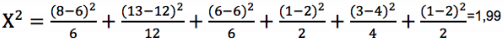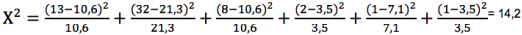Introducción
El género Heliconius es uno de los grupos de mariposas más estudiados a nivel de sistemática, genética, biología, coevolución, especiación, mimetismo y ecología de poblaciones (Brown, 1981; Mallet y Gilbert, 1995; Jiggins, Naisbit, Coe y Mallet, 2001; Rosser, Kozak, Phillimore y Mallet, 2015). Los análisis filogenéticos del género Heliconius basados solo en ADN son contradictorios en cuanto al número de especies y relaciones filogenéticas. Por ejemplo, Lamas (2004) indica que hay 40 especies, Rosser et al., (2015) registran 42 sp., y Kozak et al. (2015) reportan 45 sp., ya que incluyen a Neruda godmani, N. aoede, N. metharme y Laparus doris dentro del género Heliconius, a pesar de que estas presentan características morfológicas y venación alar diferentes (Figura 1). Sobre este aspecto, los biólogos moleculares y taxónomos siempre se ven enfrentados al dilema de cómo definir, interpretar o reconocer una buena especie, la cual varía o depende de los diferentes puntos de vista o corriente filosófica y científica.
De acuerdo a Dobzhansky (1937) y Mayr (1942) la especie biológica es un grupo o población natural de individuos que pueden cruzarse entre sí, pero que están aislados reproductivamente de otros grupos afines. El asumir una especie como biológica, implica evolutivamente asumir que es una población reproductivamente aislada, por lo que constituye un linaje evolutivo separado y que es reforzado por una serie de barreras que pueden ser de carácter geográfico o biológico. Sin embargo cuando las barreras geográficas son débiles y permiten el encuentro y la hibridación entre dos poblaciones para que individuos viables y fértiles puedan surgir por segregación en la F2 y las generaciones subsecuentes, entonces nuevos sistemas adaptativos que sean capaces de colonizar nuevos nichos podrían surgir rápidamente en este escenario (Mallet, 1993; Naisbit, Jiggins, Linares y Mallet, 2002).
De acuerdo con el origen de las especies o especiación, la evolución simpátrica de las especies o poblaciones que viven en la misma región geográfica, al igual que la evolución alopátrica en poblaciones que están físicamente separadas, requiere de un flujo limitado de genes, lo que se conoce como introgresión o movimiento de genes de una especie al pool de genes de otra especie mediante retrocruces repetitivos.
Si por el contrario, las poblaciones están fuertemente aisladas tanto por barreras precigóticas como postcigóticas, los híbridos serán en su mayoría infértiles lo cual puede dar lugar a dos escenarios distintos: (1) los híbridos pueden llegar a ser fértiles y estabilizarse genéticamente a través de alopoliploidía y habitar en ambientes intermedios entre las poblaciones parentales, (2) o bien pueden cruzarse con algunos de los parentales e ir modificando las poblaciones a través de introgresión o flujo genético en zonas de hibridación. Por lo tanto, se espera que ocurran los resultados de la hibridación natural con rapidez, debido al efecto de la combinación de genomas de diferentes linajes lo cual puede asemejarse a si ocurriese una mutación a gran escala en la cual muchos genomas únicos son producidos simultáneamente (Mallet, 2007; Shapiro, Leducq y Mallet, 2016). Quizás la mejor forma de entender la genética y ecología de la especiación es estudiando los casos intermedios. La mayoría de los estudios con mariposas del género Heliconius se han realizado en zonas de hibridación natural donde los híbridos son abundantes (Jiggins, Mcmillan, Neukirchen y Mallet, 1996). Las especies de mariposas del género Heliconius han sido estudiadas como excelentes modelos para el estudio del origen de especies o especiación, debido a que estos insectos presentan una alta diversificación de patrones de coloración alar de una misma especie y presentan subespecies geográficas aisladas con patrones de color bien definidos que forman anillos miméticos mullerianos entre grupos taxonómicos distintos (Brower, 1996; Turner, 1977; Brown, 1981; Mallet y Gilbert, 1995; Muñoz-Ortiz, 2004). En años recientes varios estudios han documentado la formación de híbridos naturales entre diferentes razas geográficas y especies incipientes de Heliconius en zonas de hibridación que ocurren con el encuentro entre dos poblaciones geográficas, y que se da frecuentemente en los pasajes bajos y cañones hidrográficos presentes en las cordilleras andinas que permiten el flujo genético y encuentro entre dos o más poblaciones (Brown y Benson, 1975, Hendry 2009; Mallet y Barton, 1989, Mallet y Gilbert, 1995; Linares, 1996; Jiggins et al., 1996; Jiggins y Mcmillan, 1997; Constantino y Salazar, 1998; Mallet 2007; Jiggins y Mallet, 2000; Jiggins et al., 2001; Salazar et al., 2005; Mavárez et al., 2006; Arias et al., 2008; Jiggins, Salazar, Linares y Mavárez, 2008), siendo la especiación un tema “misterioso”, controvertido y refutado por algunos autores (Hendry 2009; Brower, 2011).
Estas zonas de hibridación natural son probablemente mantenidas por la selección mimética, dependiente de la frecuencia contra patrones de coloración raros o poco frecuentes (Sheppard, Turner, Brown, Benson y Singer, 1985; Mallet y Barton, 1989). La extraordinaria diversidad de razas geográficas miméticas de Heliconius, y el hecho de que están estrechamente relacionadas, los pares de especies casi siempre muestran patrones de color alar divergentes que indican que la introgresión fue un factor importante en su radiación, y la variación genética que imparte en las especies es variable en todo el genoma (Turner, 1977; Gilbert, 2003; Edelman et al., 2019).
Igualmente, la especiación en mariposas también se puede dar por divergencia ecológica y geográfica entre dos especies crípticas simpátricas que cohabitan la misma región pero que se reproducen y alimentan de plantas hospederas diferentes (Rosser et al., 2019); por la estratificación vertical a nivel de dosel y sotobosque que permiten el aislamiento reproductivo entre dos poblaciones para evitar la competencia intraespecífica por la misma planta hospedera (Willmott, Constantino y Hall, 2001) y por diferencias en el número de cromosomas en especies crípticas o hermanas que pueden causar el aislamiento reproductivo de una población, siendo las especies del género Philaethria el mejor ejemplo de variación en el número de cromosomas (Brown, Emmel, Eliazar y Suomalainen, 1992; Constantino y Salazar, 2010). Por consiguiente, el estudio de la biología y genética de las poblaciones es una herramienta fundamental para entender estos procesos de especiación en los seres vivos.
En contraste, las relaciones filogenéticas de las mariposas y polillas entre los diferentes clados (grupo de organismos que se cree que han evolucionado a partir de un ancestro común, de acuerdo con los principios de la cladística) han sido controversiales aun en los días de hoy sin ningún consenso. Sin embargo, todavía para muchos grupos de organismos, aún no es factible generar grandes cantidades de datos de secuencia de ADN a partir de una variedad de regiones de genes. En Lepidoptera, por ejemplo, ha sido un reto para descubrir marcadores moleculares que sean lo suficientemente universales para amplificar regiones de genes que son de amplia utilidad filogenética en la resolución de todos los niveles taxonómicos jerárquicos, de especie a superfamilias (Wahlberg et al., 2005). La utilización del fragmento “barcode” para la identificación molecular de especies es un tema de discusión y controversia (Ebach y Holdrege, 2005; Constantino, 2016). Sus detractores afirman que es un método simplista y reduccionista que no refleja la diversidad innata de las entidades biológicas, como lo hace la morfología y además que no podría identificar especies en poblaciones genéticas complejas (Elias et al., 2007; Dasmahapatra, Elías, Hill, Hoffman y Mallet, 2010; Giraldo, 2015).
El análisis taxonómico de un pequeño fragmento de secuencia de ADN basado en un solo gen puede ser riesgoso y poco informativo en particular con especies estrechamente relacionadas (Mallet y Willmott, 2003). Esto plantea dificultades por dos razones. En primer lugar, los polimorfismos ancestrales pueden persistir durante millones de generaciones después de la especiación. En segundo lugar, los genes pueden introgresar entre especies estrechamente relacionadas. En la actualidad hay excelentes ejemplos de secuencias idénticas o casi idénticas en especies relacionadas de animales y plantas bien estudiadas (Mallet y Willmott, 2003).
Por lo anterior, es importante realizar estudios biológicos y genéticos que son más informativos y confiables en poblaciones taxonómicas complejas. En este trabajo se documenta un nuevo caso de especiación en mariposas del género Heliconius con la especie Heliconius hecalesia Hewitson, 1854. H. hecalesia presenta seis subespecies biogeográficamente bien diferenciadas y aisladas en Centro América y el norte de Suramérica (Brown y Benson, 1975; Lamas, 2004) (Fig. 3) a saber: H. hecalesia hecalesia Hewitson, 1854 se distribuye en el valle del río Magdalena en Colombia, H. hecalesia longarena Hewitson, 1875, en el occidente de Colombia (Chocó biogeográfico), H. hecalesia formosus H. W. Bates, 1866 en Panamá, y Costa Rica, H. hecalesia octavia H. W. Bates, 1866 en el sur de México hasta Nicaragua, H. hecalesia romeroi K. S. Brown & F. Fernández, 1985 en Venezuela, H. hecalesia gynaesia Hewitson, 1875 de origen desconocido, y H. hecalesia eximius Stichel, 1923 del occidente de Colombia y Ecuador. Otra subespecie, H. hecalesia ernestus K. S. Brown & Benson, 1975 del Occidente de Colombia fue recientemente sinonimizada con H. hecalesia longarena por tratarse de una forma de híbrido natural (Lamas, 2004).
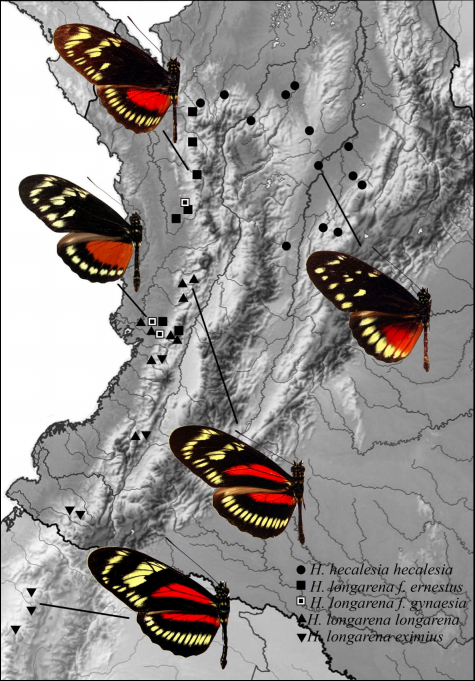
Figura 2 Poblaciones de Heliconius hecalesia y H. longarena mostrando la distribución de las diferentes subespecies en Colombia y Ecuador.
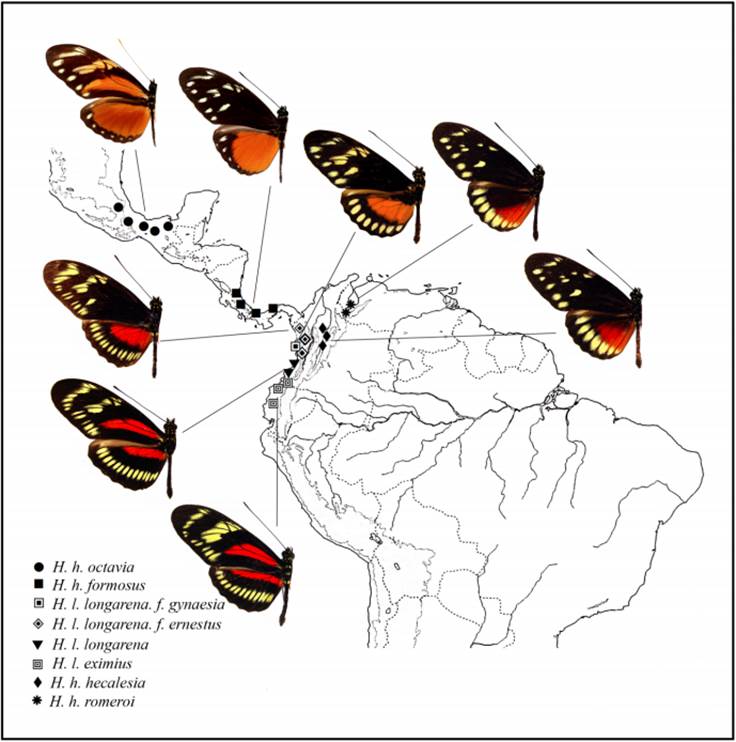
Figura 3 Mapa de distribución de las subespecies de Heliconius hecalesia y Heliconius longarena en la región neotropical, mostrando los sitios de colecta.
De todas las subespecies de H. hecalesia, la menos conocida y más rara es H. hecalesia gynaesia, que se creía extinta, y no había vuelto a ser reportada desde su descripción original en 1875, cuando el naturalista inglés William Chapman Hewitson la describió por primera vez como una nueva especie (Heliconia gynaesia) a partir de un solo ejemplar tipo sin datos de localidad, el cual se encuentra depositado en el Museo de Historia Natural en Londres (Fig. 4). Este taxón aparece ilustrado en Brown y Benson (1975) y Ackery y Smiles (1976) como una subespecie válida geográficamente aislada, la cual presenta un fenotipo de coloración y patrón muy peculiar y único similar al de su co-modelo mimético mulleriano, la mariposa Tithorea tarricina y Neruda godmani (Fig. 7). Igualmente figura en la lista de Lamas (2004) como una subespecie válida de H. hecalesia sin especificación de su origen biogeográfico ni localidad tipo. Con relación a su origen biogeográfico desconocido, Brown y Benson (1975) plantearon la hipótesis de que H. hecalesia gynaesia podría provenir del norte del Chocó al occidente de Colombia ya que su co-modelo mimético, Neruda godmani, también ocurre en esta región; sin embargo no pudieron probar la hipótesis, porque nunca se pudo colectar un ejemplar en estado silvestre de H. hecalesia gynaesia. Recientemente, Neukirchen (1991) encontró por primera vez una zona de hibridación natural de H. hecalesia longarena en el bajo río Calima y Bajo San Juan, en el sur del Chocó, en donde pudo colectar varios morfotipos de H. hecalesia gynaesia. Con base en este hallazgo, Neukirchen (1991) propuso la creación de la especie H. longarena, separándola de H. hecalesia y reclasificó a H. hecalesia gynaesia como subespecie de H. longarena, sin ninguna sustentación científica.

Figura 4 Holotipo de Heliconius hecalesia gynaesia, con su etiqueta, que se encuentra depositado en el Museo de Historia Natural de Londres y que corresponde por su patrón y coloración con los ejemplares de las figuras 5E y 5G reproducidos en condiciones de invernadero en Colombia. Foto cortesía del Museo de Historia Natural, Londres.
Por tal razón y con el fin de comprobar el estatus taxonómico de H. hecalesia gynaesia, se realizaron cruces artificiales entre H. hecalesia hecalesia y H. hecalesia longarena bajo condiciones de invernadero en el presente trabajo, lográndose obtener varios morfotipos en la segunda generación del retrocruce parental, entre los cuales se obtuvieron las formas gynaesia y ernestus que concuerdan por su patrón de coloración con los ejemplares tipo depositados en el Museo de Historia Natural en Londres.
Materiales y métodos
Zona de estudio
En la tabla 1 y en la Fig. 2 se relacionan las poblaciones de Heliconius hecalesia y H. longarena estudiadas en el presente trabajo.
Cruces interespecíficos entre las poblaciones de Heliconius hecalesia
Para determinar las frecuencias alélicas de los diferentes fenotipos, se realizaron cruces interespecíficos y retrocruces del material de H. hecalesia hecalesia, H. hecalesia longarena y H. hecalesia eximius obtenidos de las localidades de Mutatá y Anorí Antioquia; Bajo Calima, Valle y río Ñambí, Nariño respectivamente. Los cruces entre las diferentes poblaciones se realizaron bajo condiciones de invernadero en jaulas entomológicas de 4 m de largo x 3 m de ancho x 2 m de alto, construidas con tubos de PVC y forradas con tela muselina blanca, provistas con plántulas de Passiflora gracillima (Passifloraceae) como planta huésped para la oviposición y alimentación de las larvas y plántulas de Lantana camara (Verbenaceae) como planta nectarífera para los adultos. Adicionalmente, se dispusieron bebederos en platos plásticos de color rojo con una esponja amarilla impregnada con una solución azucarada del 10%. Los experimentos se realizaron en la localidad de Chinchiná, Caldas, ubicada a 1380 msnm, con una temperatura promedio de 21,8°C y una precipitación de 2556 mm al año.
Análisis de Chi-Cuadrado para las frecuencias fenotípicas de los cruces genéticos
Para determinar si los datos de las frecuencias fenotípicas de los diferentes cruces genéticos están de acuerdo con las proporciones mendelianas, se realizó una prueba de hipótesis de Chi-cuadrado, utilizando la siguiente fórmula:
Grados de libertad (gl): n-1 donde n es el número de clases fenotípicas. Los datos se analizaron mediante una prueba t con un nivel de significancia de 0,05.
Para esto se estimaron las frecuencias alélicas y fenotípicas de los genes que probablemente codifican para los seis patrones de coloración alar que presentan las poblaciones de H. hecalesia (banda naranja/ausencia de banda naranja en las alas posteriores, banda roja/ausencia de banda roja en las alas anteriores, mancha amarilla del ala anterior ubicada en el área postmedial entre las venas Cu1 y Cu2 / ausencia de la mancha amarilla, manchas o rayas submarginales amarillas / ausencia de manchas o rayas submarginales amarillas, forma negra / forma normal, rojo parcial sin mancha postmedial / rojo completo en ambas alas. Los cruces parentales entre las poblaciones de Mutatá, Calima y Ñambí se mantuvieron durante 35 días, durante el cual se obtuvieron posturas y larvas criadas en recipientes plásticos provistos de hojas de Passiflora gracillima hasta obtener los adultos vírgenes híbridos heterocigotos de primera generación F1 (forma ernestus). Luego, se hizo un retrocruce de un parental híbrido heterocigoto (forma ernestus) macho virgen con los genotipos paternos vírgenes de hecalesia (Mutatá), longarena (río Calima) y eximius (río Ñambi) de forma separada en jaulas independientes hasta obtener la generación F2, donde hubo segregación de la banda naranja del ala posterior, la banda roja del ala anterior, la mancha amarilla del ala anterior ubicada en el área media entre las venas Cu1 y Cu2 , y las manchas submarginales amarillas en las alas posteriores y anteriores. Los adultos obtenidos de la generación F2 se preservaron como material voucher, extendidos y fotografiados.
Estudio del complejo mimético Tithorea tarricina
Para el análisis de las frecuencias de los diferentes fenotipos estudiados y los complejos miméticos involucrados en cada sitio (Mutatá, Bajo Calima y río Ñambí) se seleccionaron estaciones de muestreos, ubicadas en transectos de 1 km de longitud, dentro de los bosques, donde se hicieron avistamientos visuales y recolección de especímenes voucher, a paso normal, con jama entomológica. Para que los datos entre cada sitio pudieran ser comparables entre sí, se hicieron censos de avistamiento entre las 8:00 y 14:00 horas, en días soleados, durante los meses de junio, julio y agosto de 2016. Se invirtieron un total de 30 horas/hombre/día de esfuerzo de trabajo en cada sitio para un total de 90 horas de avistamiento y censos de mariposas, en unidades paisajísticas similares (bosque muy húmedo premontano bajo, en buen estado de conservación). Se utilizó el índice F para determinar las frecuencias de los diferentes fenotipos involucrados en los anillos miméticos según la metodología propuesta por Mallet y Gilbert (1995).
Para la consulta y comparación de material museológico de Heliconius hecalesia de Colombia y Ecuador, se examinaron varias colecciones y los acrónimos citados en el texto se listan a continuación:
CMD: Colección Massimo Demaio, Bolonia, Italia http://www.heliconius.net.
NHM: Museo de Historia Natural, Londres, Inglaterra.
IiAVH: Instituto de investigaciones Alexander von Humboldt (col. E. W. Schmidt-Mumm), Villa de Leiva, Boyacá.
ICN-MHN: Instituto de Ciencias Naturales, Museo de Historia Natural, Universidad Nacional de Colombia, Bogotá.
ME-FLG: Museo Entomológico “Francisco Luis Gallego”, Universidad Nacional sede Medellín.
MEMB: Museo Entomológico “Marcial Benavides”, Cenicafé, Chinchiná, Caldas.
MHN-UC: Museo de Historia Natural-Universidad de Caldas, Manizales.
MPUJ: Museo Entomológico Pontificia Universidad Javeriana, Bogotá.
CEUN: Colección Entomológica, Universidad de Nariño, Pasto.
MUSENUV: Colección del Museo de Entomología de la Universidad del Valle, Cali. CUA: Colección Universidad de Antioquia, Medellín.
CCP: Colección Carlos Prieto, Cali.
CFC: Colección Familia Constantino, Cali, Valle.
CJS: Colección Julián Salazar, Manizales, Caldas.
CGR: Colección Gabriel Rodríguez, Mitú, Vaupés.
CDA: Colección David Acosta, Bogotá.
Resultados y Discusión
El análisis del patrón de coloración alar de los diferentes morfotipos obtenidos del cruce parental, indican que la mancha del ala anterior ubicada en el área postmedial entre las venas Cu1 y Cu2 es un carácter diagnostico heredado de H. hecalesia hecalesia y no de H. hecalesia longarena, por lo tanto se desvirtúa el planteamiento propuesto por Neukirchen (1991) de que H. hecalesia gynaesia es una subespecie de H. longarena. Igualmente se lograron obtener varios fenotipos idénticos a H. hecalesia gynaesia que concuerdan con el patrón alar del holotipo depositado en el Museo de Historia Natural de Londres (Figs. 4 y 5E-G) y por comparación con material de H. hecalesia gynaesia colectados recientemente en el occidente de Colombia que reposan en la colección personal de Massimo Demaio en Italia (Fig. 6). A continuación se describen los cruces artificiales entre H. hecalesia hecalesia, H. hecalesia longarena y H. hecalesia eximius y los diferentes fenotipos obtenidos de una misma camada de cría.
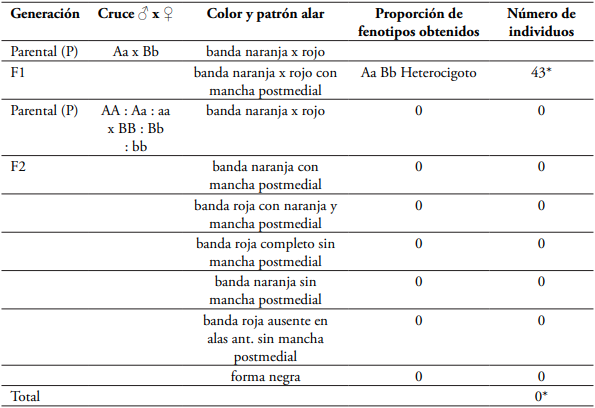
a.- Evidencia de polimorfismo y frecuencia de los fenotipos obtenidos de Mutatá
El cruce de H. hecalesia hecalesia (Aa= alelo para color naranja) con H. hecalesia longarena (Bb= alelo para color rojo) en la zona de hibridación en Rio Sucio, Mutatá produjo una progenie de 20 individuos constituida genéticamente de individuos heterocigotos (AaBb) conteniendo ambos alelomorfos del padre y la madre (forma ernestusFig. 5C) en la primera generación filial F1. En la segunda generación filial F2, producto del retrocruce de individuos heterocigotos hecalesia x longarena produjo 32 individuos constituidos genéticamente por una relación fenotípica de 8 individuos portadores del carácter genitor ABB F1, 13 individuos portadores del carácter genitor ABb F1, 6 individuos portadores del carácter genitor Abb F1, 1 individuo portador del carácter genitor aBB, 3 individuos portadores del carácter genitor aBb F1 y 1 individuo portador del carácter genitor abb F1 (Tabla 2, Fig. 5).
Tabla 2 Frecuencia de los diferentes fenotipos obtenidos del cruce H. hecalesia hecalesia x H. hecalesia longarena de Mutatá, Antioquia, bajo condiciones de invernadero (24°C, 80 % HR)n= 52 individuos.
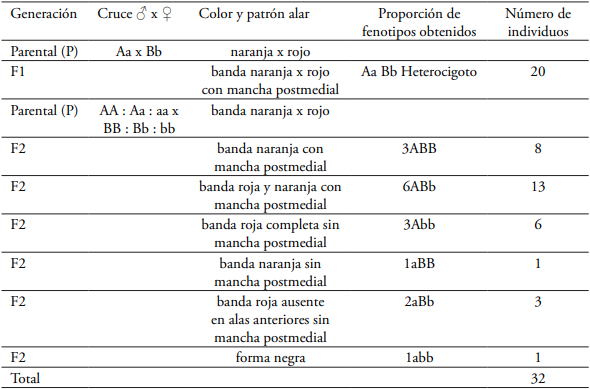
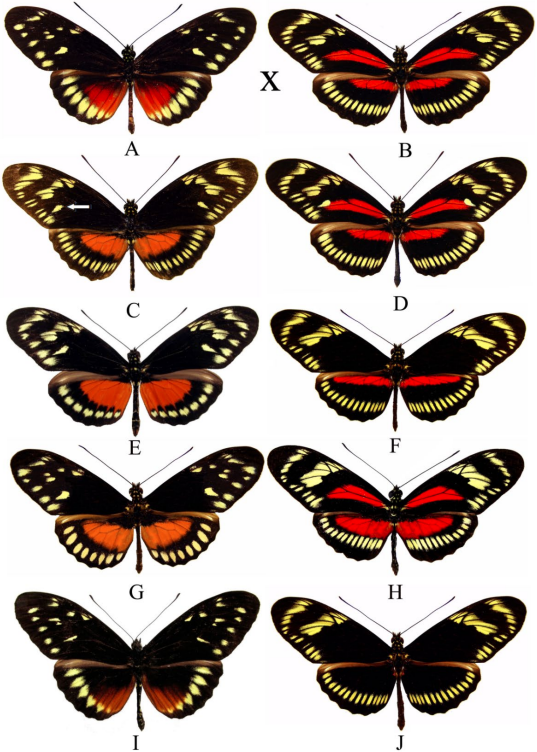
Figura 5 Cruce parental de H. hecalesia hecalesia x H. longarena. A. H. hecalesia hecalesia. B. H. longarena longarena. C-J. Fenotipos del retrocruce F2 obtenidos C. H. longarena f. ernestus (la flecha señala la mancha postmedial entre las venas Cu1 y Cu2, carácter heredado de H. H. hecalesia) D. H. longarena f. hyb. E. H. longarena f. gynaesia hyb F. H. longarena f. hyb. G. H. longarena f. hyb. H. H. longarena f. hyb. I. H. H. hecalesia hecalesia f. hyb. J. H. longarena f. negra hyb.

Figura 6 Formas puras e híbridos naturales de Heliconius hecalesia de Colombia. A. Heliconius hecalesia hecalesia (Otanche, Boyacá), B. H. hecalesia hecalesia (Otanche, Boyacá). C. H. hecalesia gynaesia hyb. (Río San Juan, Chocó), D. H. longarena hyb. E. H. longarena f. ernestus hyb. F. H. longarena f. ernestus x gynaesia hyb (Chocó) G. H. longarena hyb. H. H. longarena longarena. I. H. longarena eximius J. H. longarena hyb f. blanca. Colección de Massimo Demaio, Bolonia (Italia). http://www.heliconius.net.
Las frecuencias génicas y genotípicas se mantienen constantes de una generación a otra, debido al flujo genético (introgresión) por hibridación que existe entre las poblaciones del Magdalena Medio y el norte del Chocó, a través del corredor biológico en zonas boscosas entre los ríos Nechí, Anorí, Parque Nacional Natural Paramillo y el Urabá antioqueño, en Rio Sucio, Mutatá donde se encuentran ambas poblaciones y se cruzan produciendo híbridos naturales en el punto de encuentro (Fig. 2). En la tabla 2 se relaciona la descendencia donde se obtuvieron seis fenotipos, dependiendo de que exista dominancia completa en ambos loci o sólo en uno de ellos. La segregación fenotípica de la descendencia y su correspondencia con la segregación genotípica, en cada caso, son las que se indican en la tabla 2 con una proporción de 3:6:3:1:2:1 individuos.
b.- Evidencia de polimorfismo y frecuencia de los fenotipos obtenidos del Bajo río Calima
El cruce de H. hecalesia longarena f. ernestus (Aa= alelo para color naranja) con H. hecalesia longarena (Bb= alelo para color rojo) en la zona de hibridación del Bajo río Calima (Palestina) produjo una progenie de 32 individuos constituida genéticamente de individuos heterocigotos (AaBb) conteniendo ambos alelomorfos del padre y la madre (forma ernestusFig. 5C) en la primera generación filial F1. En la segunda generación filial F2, producto del retrocruce de individuos heterocigotos hecalesia x longarena produjo 57 individuos constituidos genéticamente por una relación fenotípica de 13 individuos portadores del carácter genitor ABB F1, 32 individuos portadores del carácter genitor ABb F1, 8 individuos portadores del carácter genitor Abb F1, 2 individuos portadores del carácter genitor aBB, 1 individuo portador del carácter genitor aBb F1 y 1 individuo portador del carácter genitor abb F1 (Tabla 3, Fig. 5).
Tabla 3 Frecuencia de los diferentes fenotipos obtenidos del cruce H. hecalesia longarena f. ernestus x H. H. longarena (Bajo Calima) bajo condiciones de invernadero (24°C, 80 % HR) n= 89 individuos.
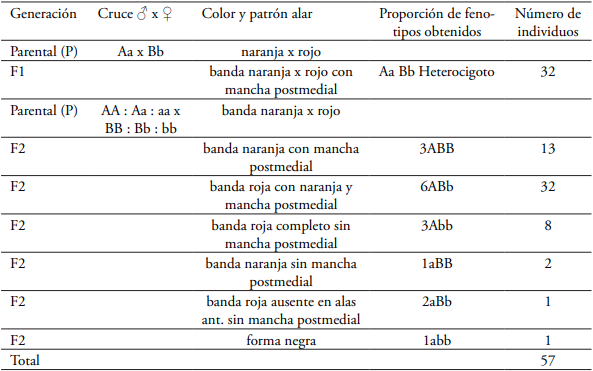
Las frecuencias génicas y genotípicas en el bajo río Calima se mantienen constantes de una generación a otra, debido al flujo genético por hibridación (introgresión) que existe entre las poblaciones del norte del Chocó con las poblaciones del bajo río Calima y San Juan a través del corredor río Atrato donde ocurre otra zona de hibridación natural, en este caso con las formas ernestus y gynaesia conteniendo la mancha amarilla en el ala anterior entre las venas Cu1 y Cu2, un carácter diagnóstico heredado de H. hecalesia hecalesia. En la tabla 3 se relaciona la descendencia donde se obtuvieron seis fenotipos dependiendo de que exista dominancia completa en ambos loci o sólo en uno de ellos. La segregación fenotípica de la descendencia y su correspondencia con la segregación genotípica, en cada caso, son las que se indican en la tabla 3 con una proporción de 3:6:3:1:2:1 individuos.
c.- Evidencia de esterilidad híbrida e inviabilidad en los cruces artificiales de Mutatá x río Ñambí
El cruce de H. hecalesia hecalesia de Mutatá (Aa= alelo para color naranja) con H. hecalesia eximius del río Ñambí (Bb= alelo para color rojo) produjo una progenie de 43 individuos constituida genéticamente de individuos heterocigotos (AaBb) conteniendo ambos alelomorfos del padre y la madre (forma ernestusFig. 5C) en la primera generación filial F1. En la segunda generación filial F2, producto del retrocruce de individuos heterocigotos hecalesia x longarena eximius produjo posturas infértiles. La esterilidad híbrida e inviabilidad en los cruces artificiales, proporciona una fuerte evidencia y soporte para el reconocimiento de H. longarena como una buena especie como parte de este estudio (Tabla 4).
Tabla 4 Frecuencia de los diferentes fenotipos obtenidos del cruce H. hecalesia hecalesia x H. hecalesia eximius (río Ñambí) bajo condiciones de invernadero (24°C, 80 % HR) n= 43 individuos en F1 y 0 individuos en F2.
* Híbridos estériles
Estos resultados de esterilidad hibrida de las poblaciones de H. longarena longarena y H. longarena eximius del sur y norte del Ecuador corroboran la hipótesis planteada por Neukirchen (1991) de que H. longarena es una buena especie, sin embargo se desvirtúa el planteamiento propuesto por este mismo autor de que H. hecalesia gynaesia es una subespecie de H. longarena, ya que se trata de un híbrido natural de H. longarena, que imita el patrón de coloración de la mariposa Neruda godmani (Figura 7D). Por consiguiente, se coloca a H. gynaesia en sinonimia (nuevo sinónimo) con H. longarena, ya que de acuerdo con las normas del Código Internacional de Nomenclatura Zoológica (ICZN), los híbridos no son taxones válidos (Art 45.1), pues los niveles por debajo de subespecie no son contemplados por el código, dado que proporcionar nombres científicos a cualquier variación fenotípica, práctica frecuente en algunos grupos (lepidóptera, coleópteros), se considera de nula utilidad científica. Por otra parte, se logró aclarar en este trabajo el origen biogeográfico de H. longarena gynaesia, como proveniente del refugio del Chocó, Colombia, el cual era desconocido para este taxón (Lamas, 2004). Los patrones de color de los diferentes fenotipos obtenidos en los cruces parentales fueron independientemente del sexo (no hubo dimorfismo sexual entre los diferentes fenotipos estudiados en la generación F1) y la proporción de sexos obtenidos macho: hembra se mantuvo 1:1 durante todo el ciclo biológico de las progenies, pero en la generación F2 no se presentaron progenies debido a la esterilidad híbrida (tabla 5).
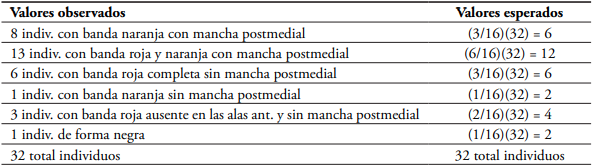
Tabla 5 Prueba de Chi-cuadrado para la proporción de fenotipos (3:6:3:1:2:1) obtenidos en el cruce H. hecalesia hecalesia x H. hecalesia longarena de Mutatá, Antioquia, bajo condiciones de invernadero (24°C, 80 % HR) n= 32 individuos.
Aplicando la ecuación:
El valor calculado de Chi-cuadrado para Mutatá no es mayor a 2, por lo tanto no se rechaza la hipótesis nula H0 y se concluye con un α = 0,05 que los resultados son los mismos que los esperados, por lo que se acepta la hipótesis de que los datos se ajustan a una distribución fenotípica de 3:6:3:1:2:1 (g.l= 5; P< 0,001) (tabla 6).
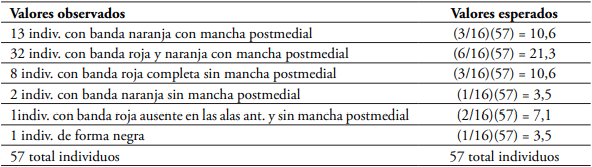
Tabla 6 Prueba de Chi-cuadrado para la proporción de fenotipos (3:6:3:1:2:1) obtenidos en del cruce H. hecalesia longarena f. ernestus x H. H. longarena (Bajo Calima) bajo condiciones de invernadero (24°C, 80 % HR) n= 57 individuos.
Aplicando la ecuación:
El valor calculado de Chi-cuadrado para la población del Bajo Calima es mayor de 3,56, por lo tanto se rechaza la hipótesis nula H0 y se concluye con un a = 0.05 que los resultados de las frecuencias observadas difieren significativamente de las esperadas, por lo que no se acepta la hipótesis de que los datos se ajustan a una distribución fenotípica de 3:6:3:1:2:1 (g.l= 5; P= 0,082).
Descripción del complejo mimético Tithorea tarricina
La mayoría de mariposas de la subfamilia Heliconinae exhiben coloración aposemática o de advertencia, con manchas de color amarillo, rojo o anaranjado sobre fondo negro. Su toxicidad se debe a la capacidad de las larvas de incorporar en sus tejidos glucósidos cianogénicos y otros metabolítos obtenidos de las plantas de las que se alimentan (familia Passifloraceae), los cuales traspasan a los adultos cuando empupan (Brown, 1981). En los cruces obtenidos se encontraron varias formas miméticas relacionadas con otras especies y subfamilias diferentes como es el caso de la mariposa Tithorea tarricina hecalesina (Ithomiinae) que es una especie que se encuentra volando junto con H. hecalesia hecalesia y Neruda godmani en el río Magdalena y adoptan un mismo patrón de coloración alar. Igual acontece con los ithomiinos Napeogenes peridia peridia y Callithomia hezia tridactyla. En el Chocó Tithorea tarricina parola vuela simpatricamente con Neruda godmani (Heliconiinae), Napeogenes stella opacella (Ithomiinae), Eresia ithomioides quintilla (Melitaeinae), Chetone ithomia (Arctiidae, Pericopinae) y Zegara personata (Castnidae) (Fig. 7).

Figura 7 Anillo mimético mulleriano y batesiano de Heliconius hecalesia con el patrón de coloración Tithorea tarricina. A. H. hecalesia hecalesia. B. Tithorea tarricina. C. H. hecalesia longarena f. gynaesia. D. Neruda godmani. E. Napeogenes peridia peridia. F. Chetone ithomia (Arctiidae: Pericopinae). G. Napeogenes stella opacella. H. Eresia ithomioides quintilla. I. Callithomia hezia tridactyla. J. Zegara personata (Castniidae).
El patrón Tithorea tarricina descrito en este estudio por primera vez se considera como otro ejemplo de mimetismo de tipo mulleriano y batesiano en el cual las especies involucradas en el complejo mimético adoptan un mismo patrón de coloración aposemática o de advertencia hacia sus depredadores, tal como sucede con otras especies de mariposas en las subfamilias Heliconiinae e Ithomiinae (Mallet, 1999). En este estudio se pudo observar que las diferencias en la frecuencia de expresión de los fenotipos de color naranja en las alas posteriores estuvieron correlacionadas con la presencia o ausencia de sus co-modelos miméticos en las zonas de origen de los pies parentales (Tabla 7, Fig. 7).
Tabla 7 Relación y frecuencia fenotípica de los complejos miméticos mullerianos observados en tres sitios diferentes de Colombia mediante censos y muestreos de campo.
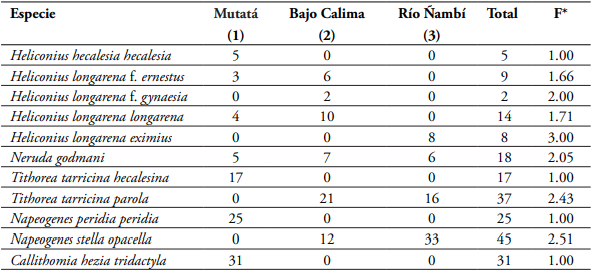
Indice F* (especies) = 1 x (proporción en 1) + 2 x (proporción en 2) + 3 x (proporción en 3) según Mallet & Gilbert, 1995.
Estos resultados concuerdan con otros estudios similares realizados con otras especies de Heliconius en el occidente de Colombia (Constantino y Salazar, 1998; Muñoz-Ortiz, 2004; Constantino, Gil y Corredor 2005; Merchán, Jiggins y Linares 2005; Constantino, 2006).
Conclusiones
La esterilidad híbrida e inviabilidad en los cruces artificiales entre H. hecalesia hecalesia y H. hecalesia longarena, proporciona una fuerte evidencia y soporte para el reconocimiento de H. longarena n. comb. como una buena especie como parte de este estudio, ya que se cumple la regla de Haldane que afirma que cuando en la descendencia de dos especies animales diferentes, uno de los dos sexos no aparece, es raro o es estéril, este siempre es el sexo heterocigótico (Naisbit, Jiggins, Linares y Mallet., 2002). Este fenómeno de especiación por hibridación ha sido documentado en la naturaleza para varios animales. Los híbridos interespecíficos se producen regularmente en las mariposas del género Eueides y Heliconius de forma natural para un 26-29% de las especies (ej. H. erato, H. himera, H. cydno, H. melpomene) (Mallet et al., 2007). Cuando se presenta un aislamiento reproductivo posterior al apareamiento, los híbridos resultan estériles. Una forma de probarlo es haciendo retrocruces (cruzamientos recíprocos), en este caso tomando un híbrido macho de la generación F1 y cruzándolo con la especie parental hembra tal como se hizo en este estudio con H. hecalesia y H. longarena. Estos casos de esterilidad híbrida son un buen ejemplo de especiación por hibridación en zonas de contacto de dos poblaciones interespecíficas el cual ha sido bien documentado para otras especies de Heliconius (Barton y Hewitt, 1989; Mallet, 1993; Jiggins et al., 1996; Jiggins y Mallet, 2000; Jiggins et al., 2001; Naisbit et al., 2002; Gilbert, 2003; Mavárez et al., 2006; Kronforst, Young, Blume y Gilbert 2006; Mallet et al., 2007; Martin et al., 2013, The Heliconius Genome, 2012 y Edelman et al., 2019) y en otros grupos de animales (Stebbins, 1958).
Igualmente, en este estudio se sinonimiza a H. hecalesia gynaesia n. syn. con H. longarena, ya que se trata de un híbrido natural y no una subespecie válida, sustentado a partir de los estudios de hibridación artificial realizados entre las poblaciones de H. hecalesia hecalesia del Magdalena medio con las poblaciones de H. longarena longarena y H. longarena eximius del occidente de Colombia y Ecuador (Chocó Biogeográfico). También se rechaza el planteamiento propuesto por Neukirchen (1991) de clasificar a H. hecalesia gynaesia como subespecie de H. longarena ya que en este estudio se pudo demostrar que la mancha amarilla del ala anterior ubicada en el área postmedial entre las venas Cu1 y Cu2 expresada en los fenotipos gynaesia y ernestus son un carácter diagnóstico heredado de H. hecalesia hecalesia y no de H. hecalesia longarena, mientras que el fenotipo eximius es un carácter heredado de H. longarena.
En este estudio se pudo aclarar el estatus taxonómico y el origen biogeográfico de H. hecalesia gynaesia, proveniente del Chocó biogeográfico en Colombia donde se corrobora la hipótesis propuesta por Brown y Benson (1975). Los resultados de este estudio sugieren que en la costa pacífica colombiana existen al menos cuatro zonas de hibridación entre H. hecalesia hecalesia y H. hecalesia longarena, ya que se han podido recolectar híbridos naturales iguales a los obtenidos en los cruces artificiales en el presente trabajo (Fig. 6). Una de estas zonas de hibridación en el occidente de Colombia fue documentada recientemente por Neukirchen (1991) en el bajo río Calima, Valle en la desembocadura al río San Juan en los límites con el departamento del Chocó, cerca de la localidad de Palestina. Las otras zonas de hibridación en el occidente de Colombia se encuentran en Mutatá, Antioquia, río Bravo, Valle y río Cabí, afluente del río Atrato cerca de Quibdó, Chocó.
Se describe y se documenta por primera vez el nuevo patrón mimético Tithorea tarricina en el cual están involucradas varias especies pertenecientes a diferentes familias de mariposas diurnas que adoptan el patrón de color de T. tarricina y Neruda godmani que vuelan en la misma región en las zonas de hibridación de H. hecalesia.
Se demuestra una vez más que los estudios de hibridación artificial son una herramienta útil de la genética de poblaciones para esclarecer el origen biogeográfico y el estatus taxonómico de taxas raros o poco conocidos. Estos estudios de genética de poblaciones realizados en campo con poblaciones silvestres sustentan la hipótesis de la especiación y origen de nuevas especies en zonas de hibridación entre dos poblaciones simpátricas, donde no existe aislamiento geográfico y se presenta un continuo flujo de genes. Sin embargo en las poblaciones de H. longarena longarena y H. longarena eximius del sur de Colombia y norte de Ecuador (aisladas geográficamente) de las poblaciones del Magdalena medio donde existe un aislamiento reproductivo, hay mayor probabilidad que se presenten eventos de especiación y esterilidad híbrida producto del aislamiento reproductivo de las poblaciones interespecíficas.