Introducción
Muchas especies de aves que viven en grupos establecen jerarquías sociales en las cuales algunos individuos, los dominantes o de alta jerarquía dominan a los demás (subordinados o de baja jerarquía) (Pulliam y Caraco, 1984; Alcock, 1989; Krause y Ruxton, 2002). El grado de dominancia o de subordinación de un individuo dentro de un grupo se manifiesta, respectivamente, en la proporción de interacciones en que el individuo gana o tiene que ceder el acceso a un recurso (alimento, sitio de reposo, sitio de anidamiento, etc.) ante otro individuo (Renton, 2004; Hahn y Bauer, 2008; Poisbleau et al., 2009). Los individuos dominantes logran un acceso preferencial a los recursos utilizados por el grupo, en tanto los subordinados, siempre que se comporten como tales, pueden utilizar dichos recursos en forma marginal, aunque suficiente (Davies et al., 2012). Los individuos subordinados pueden de esta manera continuar beneficiándose de las ventajas de vivir dentro de un grupo según Gill (2007).
En varias especies de psitácidos del Nuevo Mundo se ha reconocido la existencia de jerarquías sociales como la descrita en Aratinga canicularis según Hardy (1965), Brotogeris jugularis por Power (1966) y Amazona albifrons según Levinson (1980). De Forpus conspicillatus se conoce, de investigaciones en cautiverio, que vive en un complejo sistema de relaciones sociales (Wanker, 1990; Wanker et al., 1998; Wanker, 1999; Wanker y Fischer, 2001). Los adultos forman parejas exclusivas, dedicando al compañero todos los patrones de conducta sexual y amistosa; macho y hembra cooperan entre sí en interacciones agresivas que se presentan con otras parejas y eso les permite mantener una posición jerárquica estable. Las parejas exclusivas tienen mayores probabilidades de ocupar cavidades de anidamiento según Garnetzke-Stollmann y Franck (1991). En el campo se observan frecuentes interacciones agresivas entre parejas durante la escogencia de cavidades nido vacantes (observación personal).
Los juveniles, durante el primer mes después del éxodo, desarrollan las más relevantes interacciones sociales con los compañeros de cría, llegando a formar asociaciones temporales parecidas a parejas (Wanker et al., 1998). Cuando se forma un lazo de pareja exclusivo con un individuo no emparentado las relaciones con los compañeros de cría pueden disminuirse, pero pueden reactivarse en el momento en que este lazo se rompa por algún motivo (Wanker et al., 1998). Los volantones que no han convivido con hermanos tienen problemas para establecer un lazo de pareja exclusivo y estable, condición previa a la ocupación de una cavidad de cría según Garnetzke-Stollmann y Franck (1988) sin embargo, parece que los hijos únicos compensan dicha carencia al establecer vínculos sociales con otros individuos (Wanker, 1999).
Se conoce que la calidad de sitio de anidamiento puede estar afectada por el microclima, disponibilidad de alimento, altura sobre el suelo y depredadores (Nilsson, 1986; Martin y Roper, 1992; Marsden y Jones, 1997; Brightsmith, 2005; Rodríguez-Castillo y Eberhard, 2006; Sánchez-Martínez y Renton, 2009). En el caso de F. conspicillatus se presume que la altura y la cercanía a árboles pueden ser aspectos que influencian la calidad de su sitio de anidamiento. En condiciones naturales las cavidades suelen estar en árboles de altura considerable y próximos a otros árboles (observación personal); sin embargo, se encuentran constantemente nidos bajos en cercos de guadua de fácil acceso a depredadores. Además, según Wanker (1990) la cercanía de árboles al nido es importante ya que los adultos los utilizan como sitios de parada al alejarse o aproximarse al mismo, lo cual supuestamente permite tener una visión clara del nido y facilita el primer vuelo de los volantones hasta un lugar seguro. Igualmente puede ser importante por la cercanía a las “guarderías” en las cuales se reúnen las crías e inician su socialización (Wanker et al., 1996).
Aunque se han realizado trabajos para examinar la influencia de las características del sitio de anidamiento en el éxito reproductivo en algunas especies (Stauffer y Best, 1982; Peterson y Gauthier, 1985; Belles-lsles y Picman, 1986a; Nilsson, 1986; Finch, 1989), falta investigación acerca de la selección de sitios para anidamiento y éxito reproductivo en F. conspicillatus en Colombia.
La fácil aceptación de cavidades artificiales para anidamiento por F. conspicillatus ha facilitado la realización de estudios de campo sobre termorregulación de las crías (Kattán y Gómez, 1992), socialización de juveniles (Wanker et al., 1996), historia natural (Gómez, 1991) y aspectos sobre su ecología (Wanker, 1990). Los objetivos del estudio fueron: 1) verificar si F. conspicillatus, en condiciones naturales presenta preferencia al escoger sitios particulares de anidamiento, según las variables altura sobre el suelo y distancia al árbol más próximo; 2) Conocer si la posición jerárquica de las parejas influye en la elección de los sitios preferidos de anidamiento; 3) Constatar si la ubicación de los sitios preferidos de anidamiento propicia las condiciones necesarias para obtener mayor éxito reproductivo que en los demás; y 4) determinar si los beneficios de una alta posición en la jerarquía se traducen en un mayor éxito reproductivo debido a la selección de los sitios preferidos por la población.
Métodos
Áreas de estudio
El trabajo se desarrolló entre agosto de 1993 y marzo de 1995 en el campus universitario de la Universidad del Valle (Univalle), Cali y en la Reserva Natural Pozo Verde (RNPV), Jamundí, Valle del Cauca.
Universidad del Valle
El campus de la universidad está situado en el municipio de Cali, departamento del Valle del Cauca (3° 22’ N, 76° 32’ W, 970 m). El promedio anual de las temperaturas mensuales fue de 24,6°C y la humedad relativa promedio fue del 73%. La precipitación anual promedio fue 1880 mm, distribuidos en dos períodos de lluvia con máximos en marzo-mayo y octubre-noviembre. De acuerdo con sus características climáticas, corresponde a la Zona Natural de Vida Bosque seco Tropical (bs-T), según el sistema de clasificación de Holdridge (Espinal, 1967). El campus tiene un área de aproximadamente 100 ha, de las cuales actualmente 8,5 ha están ocupadas por edificaciones, 44 ha por árboles, 45,5 ha por prados y pastizales y 1 ha por dos lagos.
Reserva natural Pozo Verde
Situada en el municipio de Jamundí, departamento del Valle del Cauca (3° 15’ N, 77° 32’ W, 998 m). La precipitación promedio anual fue de 1777 mm, con dos períodos de lluvias con sus máximos en abril y noviembre y una época seca con un mínimo en junio. El promedio anual de las temperaturas mensuales fue de 23,7°C sin presencia de diferencias acusadas entre sus meses (Estación Meteorológica La independencia, CVC). De acuerdo con sus características climáticas, esta región corresponde a la zona natural de vida Bosque húmedo Tropical (bh-T), según el sistema de clasificación de Holdridge (Espinal, 1967).
Métodos de campo
Se capturaron y marcaron un total de 77 individuos, 38 de los cuales correspondieron a individuos adultos y 39 a los polluelos de los nidos obtenidos. Para la captura de los adultos se instalaron 31 cajas nido en árboles a una altura entre 1-2 m sobre el suelo, en la RNPV. Nueve adultos fueron capturados en la vecindad inmediata de dichos nidos y 29 con redes colocadas entre los árboles. A cada individuo capturado se le marcó en el plumaje y se le colocaron anillos de celuloide, para su reconocimiento individual (Fig. 1a).

Fuente: fotografías propias.
Figura 1 Individuo juvenil de Forpus conspicillatus con marcaje en plumaje y tibiotarso para reconocimiento individual (a). Caja nidadera de guadua: profundidad 20 cm, diámetro 9 cm y entrada 4x5 cm (b). Cali, Colombia.
Elección de cavidades
Se instalaron 138 cajas nido de guadua (Fig. 1b) (90 en Univalle y 48 en RNPV) distribuidas en números iguales a distancias de 0 m, 15 m y 50 m de los árboles más próximos. A cada una de estas distancias se dispusieron dos cajas, a 1 m y 4 m de altura respectivamente. Para las distancias 15 m y 50 m, las cajas se instalaron en postes de guadua y para la distancia de 0 m, las cajas se instalaron directamente en los árboles.
Todas las cajas fueron observadas a través de las diferentes horas del día para determinar el número y duración de cada una de las inspecciones realizadas por F. conspicillatus. También fueron revisadas semanalmente para determinar la proporción de cajas elegidas y no elegidas en las diferentes ubicaciones. Una caja se consideró como elegida, con la postura del primer huevo. Se determinó la fecha de postura, el número de huevos y la identidad de la pareja ocupante de cada uno de los nidos.
Dominancia y éxito reproductivo
La posición jerárquica fue calculada mediante la sustracción del número de derrotas al número de victorias de cada pareja. La posición más alta en la jerarquía fue la numerada como 1, la siguiente en dominancia fue la número 2 y así, hasta alcanzar la décima posición. Se registraron interacciones agresivas solo durante el proceso de inspección de las cavidades nidaderas, ya que cuando ocurre la elección de la cavidad, las parejas propietarias en la vecindad de sus nidos se convierten en dominantes sobre las otras (Rogers y McCulloch, 1981; Skeate, 1984; Wanker, 1990; Garnetzke-Stollmann y Franck, 1991; Gómez, 1991). Se determinó el número total de huevos, mortalidad, causas y el éxito reproductivo, medido este último como el número absoluto de polluelos que alcanzaron la edad del éxodo.
Análisis estadísticos
Se generaron modelos estadísticos, según el caso, con y sin interacción de los factores fijos; se evaluó la equidispersión y se seleccionó el mejor modelo mediante los criterios de verosimilitud penalizada (criterio de información de Akaike-AIC y criterio de información Bayesiana-BIC) y la prueba de razón de verosimilitudes. También se efectuó la prueba post-anova de Fisher para los factores, con corrección de Bonferroni (Agresti, 2015).
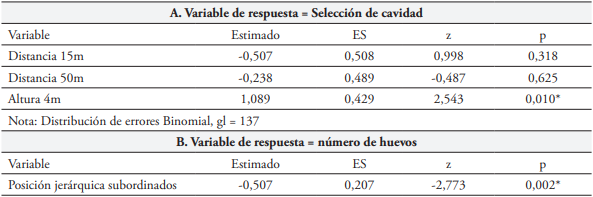
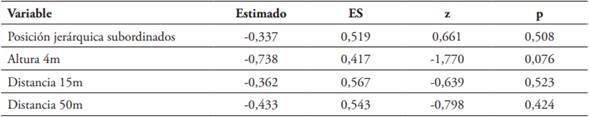
Se analizó si existía preferencia de elección de cavidades nidaderas (variable de respuesta) según la altura sobre el suelo y la distancia al árbol más cercano (factores fijos) con un Modelo Lineal Generalizado (MLG) con distribución de errores Binomial (objetivo 1). Se examinó si las cajas más inspeccionadas fueron aquellas elegidas por las parejas para su reproducción por medio de la prueba de Mann-Whitney. Para evaluar si la posición jerárquica de las parejas (factor fijo) influyó en la elección de los sitios preferidos de anidamiento (variable de respuesta), se empleó un Modelo Lineal Generalizado Mixto (MLGM), con distribución de errores Binomial. Se incluyó la identidad de la pareja como efecto aleatorio debido a que cada una de ellas se evaluó en varias temporadas reproductivas. También se constató la relación entre la posición jerárquica ocupada por las parejas y la prioridad de acceso de cavidad de anidamiento por medio del índice de correlación de Spearman (objetivo 2). Se evaluó si el potencial reproductivo, medido como el número de huevos puestos, varió con la posición jerárquica por medio de un MLG con distribución de errores Poisson (objetivo 3). Por último, para determinar si el éxito reproductivo medido como número de polluelos que alcanzaron el éxodo (variable de respuesta) varió con la ubicación del sitio de anidamiento según la altura y distancia (factores fijos 1 y 2), y con la posición jerárquica (factor fijo 3) se empleó un MLGM con distribución de errores Poisson (objetivo 3 y 4).
Resultados
Selección de Cavidades
Inspección de cavidades nidaderas
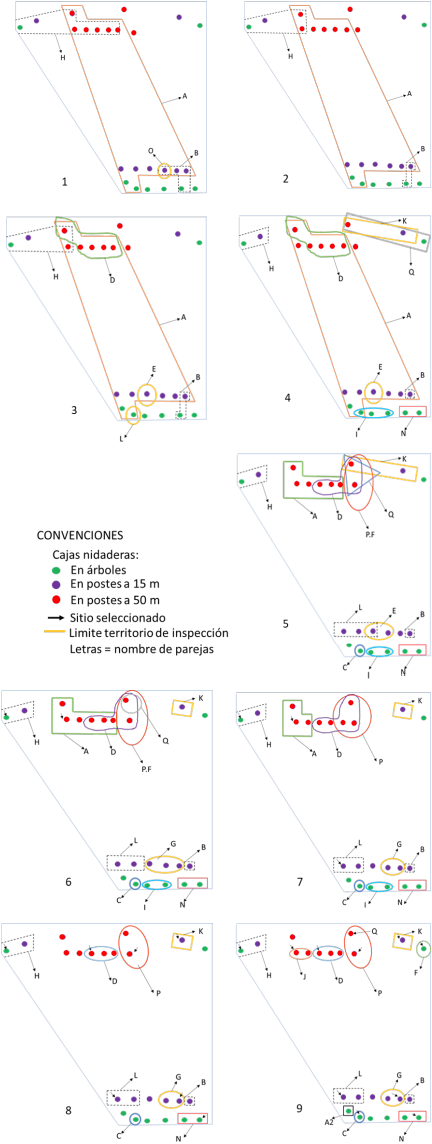
Se registró un total de 815 inspecciones por F. conspicillatus con una duración promedia de 11,73 min (DS = 20,36 minutos; máx. = 233,22 mín.; mín. = 0,02 min). El número de inspecciones promedio que las parejas realizaron a la caja nidadera seleccionada antes de iniciar su postura fue de 6,33 inspecciones (máx. = 15, mín. = 1, n = 12). Las cajas nido que más inspecciones recibieron durante el período previo al pico reproductivo fueron las que efectivamente eligieron las parejas al iniciar el momento de la postura (U = -5,6419, P = 0,0001, Prueba U de Mann-Whitney). Durante el período de selección de cavidades se advirtió la presencia de áreas específicas de inspección que fueron defendidas por ambos miembros de la pareja hasta elegir su sitio de anidamiento. En el momento en que las cajas nido se instalaron, las parejas empezaron la exploración y la pareja de más alta posición en la jerarquía (A), defendió durante dos meses consecutivos 28 cajas nido de 48 que estaban disponibles. A medida que se acercó el momento de la postura, ésta redujo su territorio de inspección de 24 a seis cajas y el número de parejas presente en la zona aumentó gradualmente pudiendo establecer sus áreas de inspección y anidación (Fig. 2).
Fuente: elaboración propia.
Figura 2 Territorios de inspección de las parejas de Forpus conspicillatus al momento de acercarse la temporada reproductiva. Nota: Números representan, 1) Condición de los territorios durante el primer mes después de la instalación de las cajas nido; 2, 3 y 4 etapas del segundo mes de permanencia de las cajas; 5, 6, 7 y 8 tercer mes (cada una con duración de una semana); 9 etapa de los 15 días siguientes, donde las parejas seleccionaron la caja para reproducirse. Note cambio del tamaño del territorio de inspección de la pareja A (dominante).
Sitios de anidamiento
La prueba de razón de verosimilitud entre los dos MLG explorados indica que no hubo diferencia entre ellos (Devianza = -3,644, gl = 2, p = 0,1617) y el criterio de AIC sugiere el modelo sin interacción como el de mejor ajuste (151,94 vs. 152,29 modelo sin vs modelo con interacción; respectivamente) (Tabla 1A). Las parejas de F. conspicillatus prefirieron cajas para anidamiento ubicadas a 4 m vs. 1 m de altura sobre el suelo (MLG: Altura X2 = 6,925, gl = 1, p = 0,008) y la variable distancia al árbol más cercano parece no influir en dicha escogencia (MLG: Distancia X2 = 1,009, gl = 2, p = 0,603).
Dominancia
Durante la fase de inspección se registraron 82 encuentros agresivos entre parejas marcadas. Dichas interacciones fueron tipificadas por Garnetzke-Stollmann y Franck (1991). Los tipos de encuentros agresivos fueron: Vuelo de suplante con apoyo (72,62 %), Pelea entre parejas (13,10 %), Amenaza (7,14 %) y Picotear (7,14 %).
Prioridad de elección y sitios preferidos de anidamiento
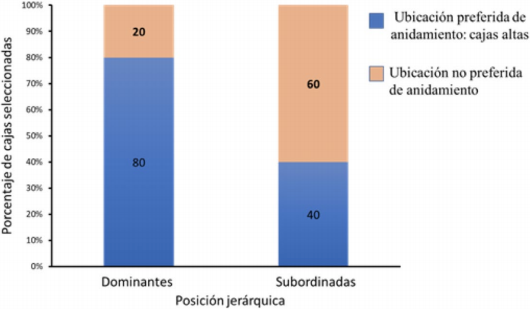
Aunque la pareja dominante (A) tuvo el mayor territorio de inspección y fue de las primeras en eleccionar su cavidad de anidamiento, no hubo correlación significativa entre posición jerárquica de las parejas y prioridad de elección de cavidad (Spearman, 1er pico reprod. Z = - 0,053, p = 0,957; 2do pico reprod. Z = 1,101, p = 0,270). Se encontró que posición jerárquica sí afecta la escogencia de los sitios de anidación, es decir, las parejas dominantes eligen sitios de anidamiento clasificados como preferidos en una proporción significativamente mayor que aquellas parejas subordinadas (MLGM Estimado = -1,7918, ES = 0,9129, Z = -1,963, p = 0,0497) (Fig. 3).
Potencial reproductivo, éxito reproductivo y posición Jerárquica
En 33 nidos observados, fueron puestos 111 huevos (media = 3,36 huevos/nido, D.S = 1,29), de los cuales eclosionaron 51 (45.95 %). Llegaron a la edad del éxodo 39 polluelos y todos sobrevivieron por lo menos hasta su independencia, esto es, cinco semanas después. El GLM con distribución Poison evidencia que el potencial reproductivo varió con la posición jerárquica (Tabla 1B), es decir que las parejas dominantes produjeron mayor número de huevos que aquellas subordinadas (X2 = 7,631, gl = 1, p = 0,0057). En la evaluación de los efectos de la posición jerárquica y la ubicación del nido, en relación con el éxito reproductivo, la prueba de verosimilitud entre los dos MLGM explorados, indicó que no hay diferencia entre ellos (X2 = 8,206, gl = 5, p = 0,145) y los criterios de verosimilitud sugieren que el modelo sin interacción (Tabla 2) es el de mejor ajuste (AIC = 95,012 vs 96,806 y BIC = 102,56 vs 110,64, modelo sin y con interacción; respectivamente). Esto significa que, el número de polluelos que logran criar las parejas hasta la edad del éxodo, no se ve afectado por la posición jerárquica. La altura (1 vs 4 m) y la distancia al árbol más cercano no afectaron el éxito reproductivo de las parejas, número de polluelos que llegaron a la edad del éxodo (Altura: X2 = 3,132, gl = 1, p = 0.076; Distancia al árbol más cercano: X2 = 0,808, gl = 2, p = 0.667).
Depredación
La depredación afectó a 45.45 % del total de nidos observados, incluyendo 10 (30.30 %) depredados por Troglodytes aëdon. Los ataques atribuidos a T. aëdon, con pérdida total o parcial de la nidada se caracterizan por la perforación de huevos que dejan en el nido o fuera de éste. Además de producir heridas a los polluelos en el cuerpo hasta ocasionar su muerte (Gómez, 1991). No se presentó depredación diferencial según la ubicación de los nidos (Distancia: X2 = 0,341, gl = 2, p = 0,842; Altura: X2 = 0,667, gl = 1, p = 0,413).
Discusión
Selección de cavidades
Debido a la presión de depredación, la adecuada elección de sitios de anidamiento es fundamental para el éxito reproductivo. Algunas veces, por la escasez de sitios óptimos se presenta competencia intra e interespecífica que origina el uso de sitios menos apropiados, en los cuales se obtiene menor productividad anual. Así, por ejemplo, sitios de anidamiento con poca altura sobre el suelo y denso follaje en su entorno entre otros, tienen alta probabilidad de sufrir depredación (Belles-Isles y Picman, 1986b; Nilsson, 1986; Brawn, 1988; Brawn y Balda, 1988; Martin y Roper, 1988; Li y Martin, 1991; Albano, 1992; Martin et al., 1992).
F. conspicillatus dedica tiempo considerable al proceso de inspección y elección de sitios de anidamiento, al igual que Rhynchopsitta pachyrhyncha (Lanning y Shieflett, 1983), Amazona vittata y Cacatúa roseicapilla (Snyder et al., 1987), y Forpus passerinus (Waltman y Beissinger, 1992). Las parejas de F. conspicillatus pueden llegar a dedicar hasta 1289,48 min al proceso de selección, e invierten energía considerable en los encuentros agresivos que se suscitan entre las parejas que están por asegurar su sitio de anidamiento. En F. conspicillatus existe una marcada preferencia por cavidades de anidamiento “altas”, así como en Brotogeris jugularis (Power, 1966), Rhynchopsitta pachyrhyncha (Lanning y Shiflett, 1983) y Deroptyus accipitrinus (Strahl et al., 1991).
El área rural de estudio (RNPV), aunque tuvo menor número de cajas disponibles que en Univalle, presentó un mayor número de cajas nido elegidas (33 nidos en 48 cajas). La gran proporción de cavidades artificiales elegidas para reproducción podría sugerir baja disponibilidad relativa de árboles caducos con cavidades y cercos de guadua con sitios potenciales para anidamiento.
Dominancia
Prioridad de elección y sitio de anidamiento
El resultado de la competencia en F. conspicillatus por la inspección de los sitios de anidamiento se vio influenciada en algunos casos por la posición jerárquica de las parejas. La pareja dominante tuvo un territorio de inspección más grande que cualquier otra pareja en la jerarquía. Aparentemente sólo en la medida en que esta pareja redujo su área de inspección, otras parejas tuvieron acceso a las cajas correspondientes. Sin embargo, la correlación entre la posición jerárquica y su prioridad de selección no fue evidente. La condición física y social de la pareja puede influir en la prioridad de elección de cavidad. Aquellas que aún conserven vínculos estrechos con sus crías más recientes al inicio de la nueva temporada reproductiva no podrán anidar tempranamente, independientemente de su posición jerárquica, como ocurrió con una de las parejas (pareja C). Por el contrario, un fracaso repetido en el pico reproductivo anterior, podrá traer consigo una iniciación temprana del nuevo ciclo y, por ende, una elección temprana del sitio de anidamiento (ejemplo, pareja H).
Potencial reproductivo productividad anual
Los dominantes en las jerarquías tienen ventajas sobre los otros miembros del grupo con respecto a la cantidad y calidad de alimento obtenido, posición más protegida dentro del grupo (Davies et al., 2012; Alonso et al., 1997; Hahn y Bauer, 2008) y, como resultado, mayor éxito reproductivo (Alcock, 1989). En F. conspicillatus las parejas con una posición jerárquica alta exhibieron un mayor potencial reproductivo medido por el número de huevos puestos. Sin embargo, aquellas parejas no presentaron mayor productividad anual en términos del número absoluto de polluelos que alcanzaron la edad del éxodo, que las de posición más baja. La dominancia de la pareja probablemente puede influir en el acceso preferencial a las fuentes de alimento que contribuyen a un mejor estado nutricional reflejado en el potencial reproductivo de la pareja. Sin embargo, la productividad anual puede ser afectada por factores como inundación de las cajas y depredación.
Éxito reproductivo
La producción anual de las especies anidadoras en cavidades está asociada según Martin et al. (1992) a los atributos del sitio de anidamiento. En este estudio no hubo diferencia significativa en la productividad anual de las parejas, atribuibles a las variables altura y distancia al árbol más cercano. La frecuencia con que se manifestó la depredación en las diferentes situaciones de anidamiento probablemente influyó en la falta de correlación entre sitio de anidamiento y productividad anual.
La depredación en los nidos varía en frecuencia dependiendo de algunas características del sitio de anidamiento (Nilsson, 1984; Dobkin et al., 1995; Joy, 2000); por ejemplo, la depredación es menor en cavidades artificiales que en cavidades naturales (Nilsson, 1986; Moller, 1989; Beissinger y Waltman, 1991). Además, si la cavidad se encuentra cubierta por follaje, éste puede permitir que un depredador se acerque sin ser detectado (Best y Stauffer, 1980; Belles-Isles y Picman, 1986a; Finch, 1989; Martin, 1992; Lindsey, 1992). Estudios realizados por Best y Stauffer (1980), Rendell y Robertson (1989), Li y Martin (1991) y Albano (1992), muestran que la altura está inversamente correlacionada con la intensidad de la depredación, ya que los pequeños mamíferos y serpientes trepadoras son capaces de alcanzar más fácilmente nidos bajos y dar menos tiempo para ser detectados y atacados hasta su desalojo por los dueños. En esta investigación el fracaso de los nidos por depredación, incluido el ataque por T. aëdon, no mostró ninguna relación con la situación de los nidos, probablemente porque las variables altura y distancia no fueron limitantes para el acceso a los nidos por parte de los depredadores, en especial para T. aedon, el mayor responsable del fracaso de nidos de F. conspicillatus. Se sabe que T. aedon destruye nidos tanto de co-específicos (Belles-Isles y Picman, 1986b; Freed, 1986; Pribil y Picman, 1991) como de otras especies incluyendo a F. conspicillatus (Gómez, 1991). Lo anterior indica que T. aëdon puede interferir a otras especies tanto en la selección de sus sitios de anidamiento, como en su éxito reproductivo (Rendell y Robertson, 1989) y se sugiere la existencia de relaciones competitivas alrededor de cavidades.