Introducción
En Colombia, el cultivo de la papa es la principal actividad agrícola en el altiplano Cundiboyacense, la cual integra especialmente a pequeños productores quienes derivan de esta su principal fuente de ingresos, bienestar y calidad de vida (Alarcón et al., 2011). El gusano blanco Premnotrypes vorax es considerado una de las principales plagas que afectan el cultivo de papa, los mayores daños son causados por las larvas, las cuales penetran y se alimentan de la pulpa de los tubérculos, ocasionando pérdidas de hasta un 90% (Yanggen et al., 2003; Niño et al., 2004; Bastidas, 2005; Parsa et al., 2006; Andrade & Bonilla, 2010; Gallegos & Hernández, 2013). Las larvas de P. vorax son difíciles de controlar, ya que prácticamente todo su ciclo biológico se desarrolla a nivel del suelo y rizosfera (Espitia, 2010).
Para el control de P. vorax, los productores generalmente recurren, sin justificación técnica, al control químico del grupo de los organofosforados, piretroides y carbamatos (Torres & López, 1996; Niño et al., 2000; Espitia, 2010). El uso de estos productos ocasiona efectos indeseables como son: resurgencia de plagas secundarias, selección de organismos resistentes a los pesticidas, contaminación ambiental y de los alimentos, daños a la vida silvestre, intoxicaciones al hombre y animales domésticos y perturbación del equilibrio natural de los ecosistemas (Yanggen et al., 2003; Cruz & Pickering, 2006; Sierra-Ariza et al., 2017).
Una de las posibilidades para contrarrestar los efectos negativos de control químico es el desarrollo de agentes biológicos, los cuales han empezado a asumir un papel importante en el campo de la agricultura sostenible. Los insectos pueden ser atacados por virus, bacterias, hongos, protozoarios y nematodos entomopatógenos (NEP’s). Los NEP’s son considerados enemigos naturales y son muy promisorios en el manejo integrado de plagas (Pérez, 2004; Molina-Acevedo et al., 2006; Argotti et al., 2010; Jiménez et al., 2012).
Los NEP’s se encuentran ampliamente distribuidos en todos los suelos de los continentes, representan uno de los grupos más grandes del reino animal, tanto en términos de diversidad genética como de abundancia. Tienen gran plasticidad fenotípica, lo que les permite ocupar una amplia gama de hábitats (Porazinska et al., 2009; Ferris et al., 2012). Son organismos habitantes del suelo que parasitan artrópodos, principalmente insectos en estados inmaduros, gracias a que poseen una relación simbiótica con bacterias gram-negativas de los géneros Xenorhabdus (Thomas & Poinar, 1979) y Photorhabdus (Boemare et al., 1993). Las bacterias son transportadas en el intestino del nematodo y posteriormente liberadas en el hemocele del hospedero, ocasionando septicemia al insecto y su muerte entre 24 y 72 h después del ingreso del nematodo en estado infectivo (J3 o JI) a la cavidad hemocélica, principalmente a través de las aberturas naturales (Woodring & Kaya, 1998; Burnell & Stock, 2000; Lacey et al., 2001; Badii & Abreu, 2006; Urtubia et al., 2016).
Los NEP’s del género Steinernema y Heterorhabditis son considerados como una de las alternativas con más futuro para el control biológico, son habitantes naturales del suelo, lo que los hace muy eficientes para el control de insectos que pasan alguna parte de su ciclo de vida en contacto con el suelo (Klein, 1990). Estos organismos son capaces de localizar activamente al hospedero, son muy virulentos y provocan la muerte. Tienen un alto potencial reproductivo, pueden criarse masivamente in vitro. Además, son compatibles con la mayoría de los químicos utilizados en la agricultura, son fáciles de aplicar, presentan seguridad para el medio ambiente y los organismos que no son su objetivo, razón por la cual son considerados excelentes insecticidas biológicos (Leite et al., 2005; Sepúlveda et al., 2008; Neher, 2010; Jiménez et al., 2012).
El potencial reproductivo, capacidad de desplazamiento, supervivencia y rango de hospederos, son características que dependen de la especie e incluso de la población, las cuales están influenciadas por las condiciones ambientales; por ello, el aislamiento e identificación de poblaciones nativas de NEP’s adaptadas a las condiciones locales, es considerado una parte esencial de los estudios encaminados a su utilización como agentes de control biológico, a fin de evitar un desequilibrio ecológico al introducir especies exóticas que podrían afectar a otros organismos.
Cuando una especie de nematodo es capaz de infectar naturalmente a insectos de una región, estos nematodos pueden ser clasificados como población adaptada localmente con probabilidad de actuar como un regulador eficaz de plagas. Generalmente, especies de cinco órdenes de insectos (Coleoptera, Hymenoptera, Diptera, Lepidoptera y Orthoptera) se han encontrado naturalmente infectados por NEP’s (Touray, et al., 2020).
El interés por los nematodos ha aumentado en las dos últimas décadas, mostrando resultados positivos en múltiples investigaciones realizadas en el mundo, colocándolos como agentes promisorios para el control de insectos (Kaya & Gaugler, 1993; Georgis et al., 1995; Caicedo, 2003; Aranda & Bustillo, 2007; Andaló et al., 2011, Rodríguez et al., 2019).
El objetivo del presente trabajo fue aislar NEP’s nativos en suelos provenientes de la granja Tesorito de la Universidad de Caldas, Colombia, y evaluar la patogenicidad que presentan dichos organismos a larvas de P. vorax.
Materiales y métodos
El estudio se realizó en el Centro de Investigación y Cría de Enemigos Naturales (CICEN) de la Universidad de Caldas, ubicado en el municipio de Manizales (Coordenadas 5° 05’N y 75° 40’ W). Para la realización del estudio se siguió el protocolo descrito por López y Soto (2016), el cual se dividió en dos etapas:
1. Etapa de búsqueda y aislamiento: se seleccionaron 10 sitios de la Granja Tesorito de la Universidad de Caldas (Coordenadas 5° 01’47” N, 75° 26’ 03” W), ubicada a 2280 msnm. En cada sitio, se tomaron cinco muestras de suelo de 500 g y se depositaron en bolsas plásticas previamente rotuladas. Posteriormente, se llevaron al Laboratorio de Control Biológico de la Universidad de Caldas para su análisis.
Para determinar la presencia de NEP’s nativos, se utilizó la técnica conocida como “insecto trampa” descrita por Bedding y Akhurst (1975), la cual consistió en depositar 500 g de suelo en un recipiente plástico (capacidad de 30 oz) y ocho larvas de último instar de Galleria mellonella (Lepidoptera: Pyralidae), conocida por su alta susceptibilidad a los nematodos (Shapiro et al., 2002; Aranda & Bustillo, 2007). Las muestras se sometieron a oscuridad y a temperatura ambiente durante nueve días; a partir del quinto día se inició la extracción de los NEP’s, para lo cual se tomaron las larvas de Galleria que presentaran síntomas por ataque de nematodos (Poinar, 1979), se ubicaron en cajas Petri -previamente esterilizadas y rotuladas- y se colocaron en incubadora a 25 °C durante dos días. Posteriormente, se realizó el aislamiento de los nematodos por el método de trampa “White” modificado por Kaya & Stock (1997), que consiste en una caja de Petri de 9,0 cm a la cual se le agregaron 20 mL de agua lluvia y en cuyo interior se dispuso de otra caja de Petri de 6,0 cm conteniendo un disco de papel filtro humedecido. Sobre dicho papel, se colocaron las larvas de G. mellonella que presentaban sintomatología de ataque por nematodos. Las larvas infectadas permanecieron durante nueve días en las respectivas trampas mientras se realizaba cosecha de NEP’s a los cinco, siete y nueve días después de la infestación.
Finalmente, se observó la actividad de los NEP’s al contar el número de juveniles infectivos observados en 10 alícuotas (10 µl) con ayuda de un estereomicroscopio marca Olympus. Después de decantar tres veces cada muestra de NEP’s, se almacenaron en tubos Falcon® con concentraciones de NEP’s /mL no superiores a 5.000 individuos y se ubicaron en incubadora a temperatura promedio de 16°C durante 15 días, esto con el fin de analizar la supervivencia y garantizar la virulencia de los juveniles infectivos al momento de realizar las inoculaciones (Molina et al., 2006; Andaló et al., 2011).
2. Pruebas de patogenicidad sobre P. vorax: se seleccionaron los aislamientos de NEP’s que presentaron mayor virulencia sobre G. mellonella, basados en los criterios de mortalidad de larvas, reproducción y supervivencia.
Las inoculaciones se realizaron por el método de inmersión, para lo cual se utilizaron dosis de 10, 100 y 1000 NEP’s en 25 µl, de acuerdo con la metodología propuesta por Shapiro et al., (2002). Se realizaron diez repeticiones por tratamiento, cada unidad experimental fue conformada por una caja Petri de 9,0 cm de diámetro y ocho larvas de último instar de P. vorax, en ausencia de luz y a temperatura ambiente. Se realizaron evaluaciones de mortalidad a las 24, 48 y 72 h después de la infestación, sometiendo las larvas muertas al mismo proceso de aislamiento de NEP’s descrito para G. mellonella. El tratamiento testigo consistió en larvas de P. vorax inmersas en agua lluvia.
Se utilizó el diseño completamente al azar; para determinar diferencias entre tratamientos se realizó la prueba de Tukey al 5%. Los análisis se realizaron mediante el programa SAS Versión 9.1 (Statistical Analisis System).
Resultados y discusión
Los resultados muestran una alta presencia de NEP’s en la zona de estudio, ya que el 100% de los aislamientos fueron positivos a dichos organismos, posiblemente debido al bajo uso de agroquímicos convencionales que se utilizan para el control de plagas (Campos et al., 2008) en dicha zona. Las investigaciones con este tipo de microorganismos podrían contribuir con la disminución en la aplicación de agroquímicos en este cultivo, en donde los agricultores aplican en forma calendario insecticidas altamente tóxicos, sin tener en cuenta los umbrales económicos para la plaga (Niño et al., 2000; Espitia, 2010). Su amplia distribución, ciclo de vida corto, capacidad de búsqueda y elevada tasa reproductiva hace que los NEP’s sean altamente eficientes para el control de las plagas.
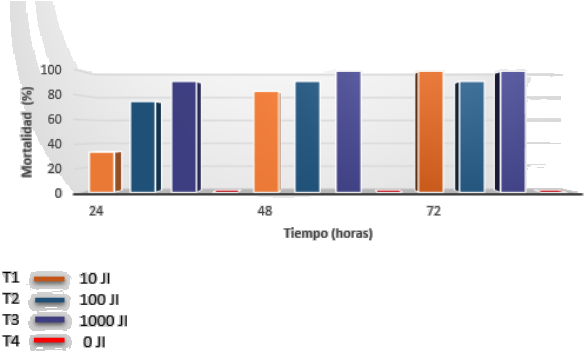
Los diez aislamientos nativos de NEP’s que presentaron mayor virulencia sobre G. mellonella pertenecieron al género Steinernema, lo cual se pudo evidenciar por el cambio de color blanco a amarillo crema que presentaron las larvas (Poinar, 1979). Estos aislamientos fueron seleccionados para realizar las respectivas inoculaciones sobre larvas de último instar de P. vorax, obteniéndose a las 24 h después de infestación y en las dosis de 10, 100 y 1000 JI, una mortalidad de 33,3%, 75% y 96,7%, respectivamente; a las 48 h después de la infestación, la mortalidad osciló entre el 83,3 y el 100%, y a las 96 h la mortalidad osciló entre el 91,7 y el 100% (Tabla 1). Las larvas de P. vorax afectadas por los nematodos cambiaron de color blanco a amarillo crema (Figura 1), con lo que se confirma que el género de dicho organismo es Steinernema (Poinar, 1979).
Tabla 1 Porcentaje de mortalidad promedio de larvas de P. vorax con respecto a las horas de infestación con Steinernema.
| Horas DDI* | Dosis (JI)** | Mortalidad (%) |
|---|---|---|
| 10 | 33.3b*** | |
| 24 horas | 100 | 75a |
| 1000 | 91.7a | |
| 10 | 83.3a | |
| 48 horas | 100 | 91.7a |
| 1000 | 100a | |
| 10 | 100a | |
| 72 horas | 100 | 91.7a |
| 1000 | 100a |
* DDI: Horas después de infestación
** JI: Juveniles infectivos
*** Valores promedios seguidos por letras distintas denotan diferencias significativas según la prueba de Tukey al 5%.
Fuente: elaboración propia.
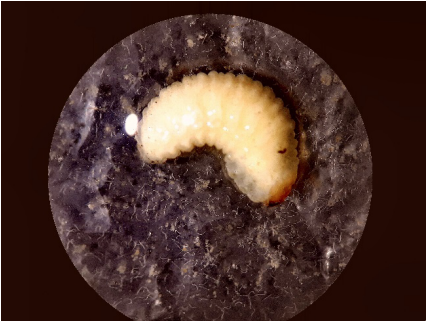
Fuente: elaboración propia.
Figura 1 Larva de P. vorax con cuadro típico de infección por Steinernema.
La alta mortalidad que presentó P. vorax deja en evidencia la capacidad de los NEP’s nativos, en este caso Steinernema, de ingresar al cuerpo de las larvas y cumplir su cometido como parásito (Figura 2), tal como lo mencionan Poinar, (1979), Gaugler et al. (1992), los NEP’s de la familia Steinernematidae son potentes patógenos de una amplia gama de especies de insectos plaga, tal como se confirma en esta investigación. En Ecuador y Perú obtuvieron efectividad y virulencia en larvas de P. vorax con cepas tanto de Steinernema como de Heterorhabditis (Chacón-Chausá, 2011; Centro Internacional de la Papa, 2011; Alcázar et al., 2011).
Parada-Santamaria (2002) encontró NEP’s del género Steinernema atacando estados inmaduros de P. vorax que se hallaban dentro de tubérculos de Solanum phureja y Solanum tuberosum, variedades Capiro y Parda Pastusa, en los departamentos de Boyacá y Cundinamarca, Colombia. Garzón et al. (1996) reportó la presencia de nematodos del género Steinernema ocasionando gran patogenicidad a larvas de P. vorax en el departamento de Cundinamarca. En otras investigaciones, Sepúlveda et al. (2008), encontró alta mortalidad de larvas de Cosmopolites sordidus (Coleoptera: Dryophthoridae) en plátano ocasionada por una cepa nativa de Steinernema en dosis de 1.000 JI/25µl.
Al comparar los tratamientos en donde se aplicaron 10, 100 y 1000 JI de nematodos del género Steinernema/larva de P. vorax a las 48 y 72 h después de la infestación, no se encontraron diferencias significativas, obteniéndose un promedio de mortalidad de 95,8% (Tabla 1), lo que indica que esta especie nativa a bajas dosis (10JI/larva) controla eficientemente la plaga. Estos resultados fueron diferentes a los obtenidos por Hernández et al. (2006), en donde encontró un 48% de mortalidad de larvas de P. vorax con nematodos del género Steinernema solo hasta las 72 h después de la infestación. En la Figura 3 se puede apreciar la mortalidad de P. vorax ocasionada por nemátodos del género Steinernema de acuerdo con diferentes horas de evaluación (24, 48 y 72 h), en donde se observa además que en el tratamiento testigo (sin aplicación de NEP’s) no se presentó mortalidad de las larvas de P. vorax.