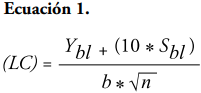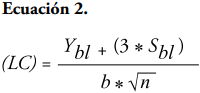Introducción
Al proceso de mantener el calor cerca de la superficie de la tierra, se le conoce como efecto invernadero. El metano (CH4), forma parte de los gases que provocan tal efecto, junto con el bióxido de carbono (CO2), que constituye la mayor proporción, el óxido nitroso (N2O), los hidrofluorocarbonados (HFC), los perfluorocarbonados (PFC) y el hexafluoruro de azufre (SF6). Estos gases son moléculas con dos o más átomos que se mantienen unidos con suficiente espacio entre sí para poder vibrar cuando absorben calor y de esta manera liberar radiación, la cual puede ser absorbida por otra molécula y generar el efecto invernadero. Aunque el CH4 se encuentra en menor concentración con respecto al CO2, su capacidad de producir dicho efecto es de 21 a 30 veces mayor (Benaouda et al., 2017).
La agricultura y la producción pecuaria contribuyen ampliamente a las emisiones antropogénicas de CH4, CO2 y N2O a la atmósfera, destacándose la explotación bovina como la de mayor impacto. Según Steinfeld et al. (2009), estos animales son responsables del 18% de las emisiones de los gases de efecto invernadero (GEI) que emite el 9% del total del CO2 y el 37% de las emisiones de CH4; este último, equivalente a 104 millones de toneladas por año, provenientes de la fermentación entérica y del estiércol. Como alternativa de solución a esta problemática, se vislumbra el establecimiento de sistemas de producción sostenible, con raciones balanceadas y compuestas por ingredientes que reduzcan la producción de GEI, principalmente, que aumenten la digestibilidad de los carbohidratos en el rumen y, por ende, que disminuyan la metanogénesis (Bonilla-Cárdenas & Lemus, 2012; Carmona et al., 2005; Apráez-Guerrero et al., 2016).
El desarrollo de estrategias que mitiguen las emisiones de CH4 generadas por el Bos taurus, requiere que tales emisiones sean cuantificadas bajo un amplio rango de circunstancias. Esto implica diseñar estrategias experimentales basadas en el análisis cuantitativo de dichas emisiones con la ayuda de técnicas de medición como la espectrometría infrarroja, la cromatografía de gases, la espectroscopia de masa y la técnica de diodo laser. Para medir la cantidad de GEI, el animal debe permanecer en una cámara respiratoria, la cual es una gran caja transparente, prácticamente sellada excepto por un flujo de aire fresco, en la cual se muestrea el contenido de CH4 en el aire que sale de ella. Los investigadores han propuesto otras mediciones, como los modelos matemáticos; sin embargo, los resultados de estos son inexactos debido a que durante el desarrollo experimental se ignoran variables tan importantes como la producción de ácidos grasos volátiles y el balance de carbono en cada una de las ecuaciones planteadas (Carmona et al., 2005); ante este problema surgen como alternativa las técnicas de producción de gases in vitro, usando como modelo el rumen artificial.
Las técnicas de producción de gases in vitro, usando como modelo el rumen artificial, son una opción para el estudio de la cinética de fermentación y producción de GEI en el rumen de Bos taurus, de una manera rápida, precisa y económica. Estas simulan, a escala mínima y de manera acertada bajo condiciones controladas, los procesos naturales de la digestión ruminal y de la producción de gases (Rymer et al., 2005). Además, permiten determinar la extensión y la cinética de degradación del alimento a través del volumen de gas producido durante el proceso fermentativo (Theodorou et al., 1994). Su principal ventaja radica en que el curso de la fermentación y el papel de los componentes solubles del sustrato pueden ser cuantificados a través de un método analítico, aun desde las primeras horas de incubación (Pell et al., 1997; Posada & Noguera, 2005; Posada et al., 2006).
Un método analítico, antes de ser puesto en práctica, debe ser estandarizado. Esto implica alcanzar buenos resultados al analizar el objeto de estudio mediante el procedimiento de una técnica, con características de confiabilidad y efectividad a la hora de utilizarlo. Además, debe permitir su validación con otros métodos. La estandarización puede variar en cuanto al analito a ser estudiado, a los parámetros a manejar y al grado de experimentación que se pueda tener para variar las condiciones en el momento indicado, dependiendo de los resultados esperados (Aguirre et al., 2001). Para estandarizar un método se deben tener en cuenta los parámetros de precisión, exactitud, linealidad, rango de trabajo, límite de detección y límite de cuantificación.
La precisión se expresa en términos de concordancia, o sea, que el análisis de la muestra presente los aspectos de repetitividad y reproducibilidad; entendida la primera como los resultados obtenidos a partir de los factores experimentales que los modifican; mientras que la segunda hace referencia a la efectividad de la técnica. La exactitud es la proximidad de concordancia entre el resultado de una medición y el valor de referencia aceptado. La linealidad es la habilidad del procedimiento analítico de obtener resultados de prueba que sean directamente proporcionales a la concentración de analito en la muestra. El rango es el intervalo entre la concentración superior e inferior de analito, para el cual se ha demostrado la correcta precisión, exactitud y linealidad del método descrito (Eurachem, 1998). El límite de detección, es la cantidad más pequeña de analito en una muestra que puede ser detectada por una única medición, con un nivel de confianza determinado, pero no necesariamente cuantificada con un valor exacto. Y finalmente, el límite de cuantificación, se entiende como la cantidad más pequeña de analito en una muestra que puede ser cuantitativamente determinada con exactitud aceptable (International Union of Pure and Applied Chemistry, 2014).
Teniendo en cuenta que el éxito de la medición del metano liberado durante la fermentación ruminal depende de la disponibilidad de técnicas de medición confiables y precisas, la presente investigación tiene como objetivo utilizar la cromatografía de gases con detector de ionización de llama (GC FID) para establecer un protocolo de cuantificación de la producción in vitro de metano presente en el fluido ruminal de Bos taurus.
Materiales y Métodos
La investigación se desarrolló en los laboratorios de Nutrición Animal y de Cromatografía de la Universidad de Caldas, Colombia. Para establecer el protocolo de cuantificación de la producción in vitro de metano presente en el fluido ruminal de Bos taurus, se procedió con la estandarización del método de análisis cromatográfico para la cuantificación del CH4, siguiendo los siguientes pasos: a) creación de las condiciones del método, b) preparación de las concentraciones del estándar, c) creación de la curva de calibración d) reconocimiento del tiempo de retención y e) aplicación del método.
Creación de las condiciones del método. Se realizaron los cambios de volumen de inyección de la dilución entre el soluto y el solvente, en este caso el CH4 y el CO2, respectivamente, hasta establecerlo en 200μl, con un flujo constante de 1mL/min y programación del horno con isoterma a 80°C durante 5 min, seguido de una temperatura post-corrida de 100°C durante un minuto.
Preparación de las diferentes concentraciones de estándar. Se utilizó CH4 al 99% de pureza, se tomó un volumen de 250 mL y se depositó en un recipiente plástico hermético con vacío. De este volumen, se tomaron diferentes volúmenes para nuevas diluciones con CO2 que conformaron los puntos de la curva.
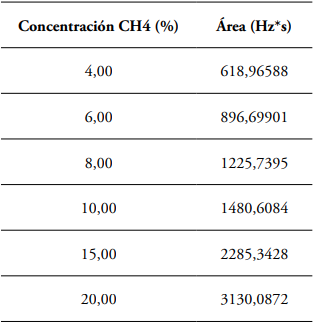
Creación de la curva de calibración. En sendos recipientes plásticos herméticos con vacío, se inyectó el mismo día y por triplicado, los volúmenes establecidos de la dilución CH4 y CO2 en la fase anterior, correspondientes a concentraciones de 2, 4, 6, 8, 10, 15, y 20%, los cuales entraron a conformar los puntos de la curva de calibración.
Reconocimiento del tiempo de retención. Del cilindro que contenía el CH4 a una pureza de 99,999% de 1 m3 de volumen se tomó la muestra en tubo vacutainer para diluirlo con CO2. De esta dilución se tomaron 100µl los cuales se inyectaron, con una jeringa Pressure-Lok® serie A2 de 1 mL, en un cromatógrafo Hewlett Packard 6890 Serie II equipado con detector de ionización de llama y una columna empacada, modelo GS-AL/KCl marca Agilet, de 50m de largo 0,53 mm de diámetro, con fase móvil de nitrógeno al 99,995% de pureza para hacer el reconocimiento del estándar y, posteriormente, establecer el tiempo de retención, considerando para esto la mejor resolución en el menor tiempo posible (Makkar y Vercoe, 2007).
Aplicación del método
Preparación de las muestras. Las muestras de CH4 que se analizaron se produjeron por simulación de la fermentación ruminal utilizando fermentadores in vitro. Estos fermentadores o botellas contenían el medio de cultivo, el inoculo y el sustrato.
Medio de cultivo. Todos los medios en uso tuvieron en común: tampón de bicarbonato y fosfato, un agente reductor, una fuente de nitrógeno, varios minerales y un indicador de potencial redox. La solución de minerales que contenía el medio de cultivo estuvo compuesta por 9,53 g/L de Na2HPO4.12H2O 2,2 g/L KH2PO4 y 0,6 g/L MgSO4. 7H2O, 132 g/L CaCl2.2H2O, 100g/L MnCl2.4H2O, 10g/L CoCl2.6H2O y 80 g/L FeCl3.6H2O). Como solución tampón se utilizó una mezcla de 4g/L NH4HCO3 y 35g/L de NaHCO3. El indicador de potencial redox usado fue la rezasurina 0,01g/L y como agente reductor se usaron 625mg de HCl cisteína, 95ml de agua destilada, 4 mL de NaOH 1M y 625mg de Na2S.9H2O). Estas soluciones se diluyeron de la siguiente manera: los macrominerales en 500mL de agua destilada, los microminerales en 200mL de agua destilada, la solución tampón en 200mL de agua destilada, la solución indicadora en 1 mL de agua destilada. Las soluciones anteriormente citadas se mezclaron, seguidamente se aforaron al volumen de un litro, y finalmente se agitó la mezcla para ser saturada con CO2 durante 2 horas (Mauricio et al., 2001).
Inóculo. Este inóculo, rico en bacterias, consistió en líquido ruminal obtenido de bovinos Bos primigenius taurus con ruminotomía, pertenecientes a la Granja Tesorito de la Universidad de Caldas. Este líquido se recolectó antes de la alimentación de los animales, para garantizar una mayor consistencia en su composición. El inóculo fue transportado al laboratorio en el menor tiempo posible y en termos para mantener la temperatura.
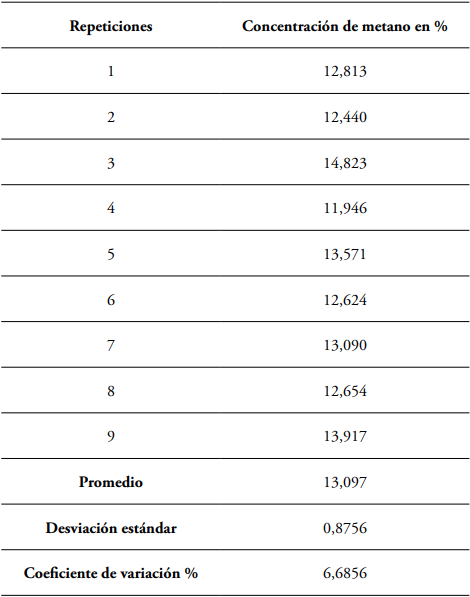
Sustrato. Es el alimento al cual se le desea cuantificar el CH4 de la fermentación. Para el presente caso se utilizó muestras de pasto Rye grass (Lolium perenne), gramínea procedente de la granja Tesorito de la Universidad de Caldas, la cual fue secada y molida en partículas finas previo a ser llevada a las botellas de fermentación. Las botellas con el medio de cultivo y el sustrato se inocularon, según corresponde, con 5 ml de líquido ruminal, usando una jeringa graduada. Posteriormente fueron selladas, agitadas rápidamente y transferidas a una estufa que se mantuvo a 39°C. Para analizar la reproducibilidad de las muestras, se prepararon diez fermentadores artificiales bajo las mismas condiciones de: medio de cultivo, inóculo y sustrato; y se prepararon tres fermentadores adicionales con estándar al 10% como blanco. En estos se efectuó la fermentación durante 18 horas, para enseguida obtener las muestras de cada fermentador por triplicado en tubos vacutainer®. Todas las muestras se analizaron por duplicado, con el mismo método, por la misma persona y en el mismo día (Tabla 1).
Resultados y Discusión
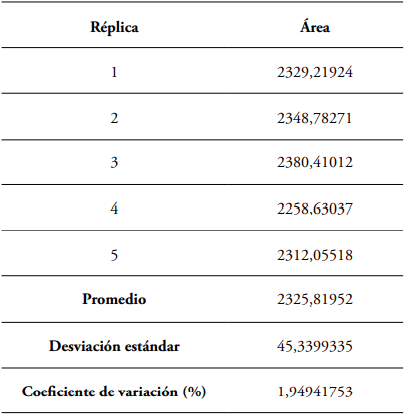
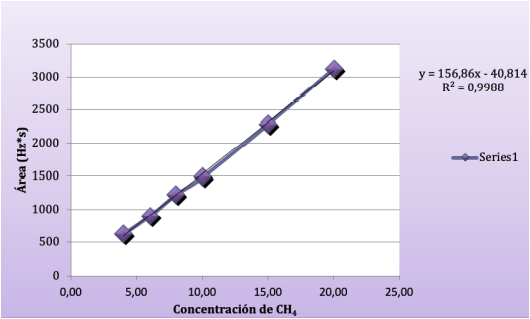
Curva de calibración. Para la estandarización de la técnica se consideró que las muestras del líquido ruminal a analizar contenían concentraciones de metano entre el 10 y 17% (Bonilla-Cárdenas et al., 2012). En la determinación de los parámetros de los límites de detección (LD) y de cuantificación (LC) se utilizó el método basado en la extrapolación de la recta calibrado a concentración cero (Arias y Gil, 2012). El intercepto en “Y” permitió obtener un valor de YLD tomado del intercepto más tres veces el valor de la desviación estándar del blanco (SB) como se presenta en la Ecuación 1; mientras que el LC se determinó con los mismos parámetros, pero con el intercepto en “Y” más diez veces el valor del SB, como descrito en la Ecuación 2 (Tabla 2).
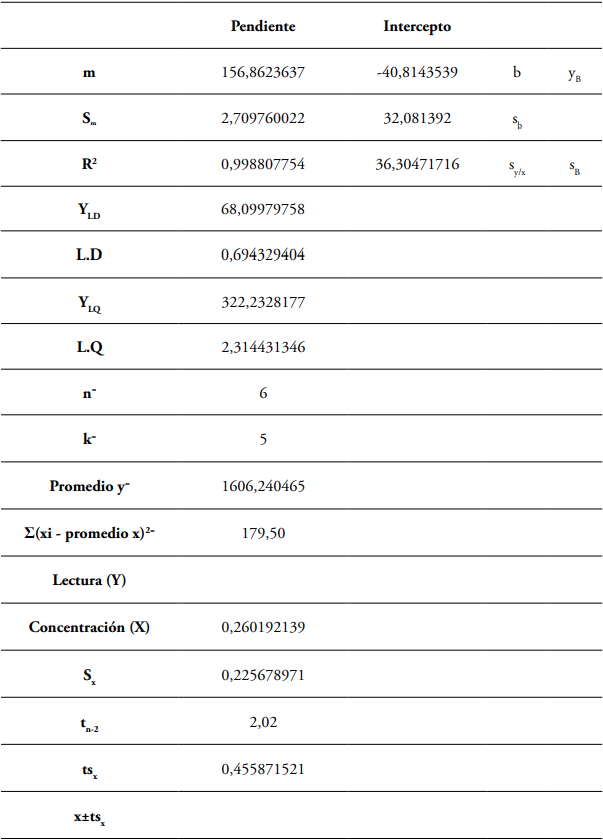
El coeficiente de correlación de 0,9988 indica alta correlación entre la concentración de metano y el área obtenida (Figura 1). La precisión del método se evaluó con la desviación estándar y el coeficiente de variación de las lecturas realizadas al estándar del 15% de metano, punto de la curva tomado por ser el valor más cercano a las concentraciones referenciadas en las muestras.
Fuente: Esta investigación.
Figura 1 Curva de calibración de metano en líquido rumial desde 2 al 20% in vitro.
Como se aprecia en la Tabla 2, la cantidad mínima de analito detectable (LD) es de 0,69% de metano y el LC es de 2,3%. Valores adecuados para el nivel de concentración de las muestras analizadas debido a que presentan cantidades altas de CH4 (10% a 17%).
El coeficiente de variación de 1,94% del estándar al 15% de metano, demuestra baja dispersión en las lecturas de los valores de área (Tabla 3). En los análisis cromatográficos de inyección manual, se aceptan como normales los coeficientes de variación que no superen el 5% (Coy, 2006); por lo tanto, el valor del coeficiente de variación obtenido, indica que el grado de concordancia obtenido a partir de las réplicas de la muestra es alto y los análisis son repetibles (Arias y Gil, 2012).
Tabla 3 Modelo utilizado para la extrapolación de la recta de calibrado a concentración cero.
Fuente: Esta investigación.
En cuanto a los resultados de la aplicación del método se tiene que el coeficiente de variación fue inferior al 15%, establecido por normas internacionales y descrito como límite para la adecuada validación de un procedimiento analítico (DeSilva et al., 2003). El coeficiente de variación del 1,9% se logró por medio de la preparación de estándares al 2, 4, 6, 8, 10, 15 y 20% de metano (Tabla 4). Los resultados revelaron homogeneidad entre las repeticiones y un valor de la desviación estándar aceptable, lo cual es indicativo de una buena preparación de los estándares y de la calibración del equipo. No obstante estos indicadores estadísticos, la heterogeneidad de los resultados de las mediciones en las muestras fue mayor y presentó un coeficiente de variabilidad de 6,7%, sugiriendo la existencia de una fuente de variabilidad no controlada. Para el caso específico, es posible que esa fuente de variabilidad haya estado direccionada al error biológico generado en la toma de la muestra del líquido ruminal y en la cantidad de microorganismos inoculados en las botellas (Rymer et al., 2005).
Conclusión
La optimización del método de cuantificación de la concentración de metano en líquido ruminal, adelantada en esta investigación, permite disponer de una técnica para cuantificar de forma efectiva, confiable y reproducible la cantidad de gas metano producido de forma in vitro, siempre y cuando se sigan de manera correcta los protocolos.