Introducción
Durante las últimas cinco décadas los bosques de galería, pertenecientes a la región de la Orinoquía Colombiana, han sufrido un proceso de deforestación acelerada generando una marcada disminución de su área y la consecuente pérdida de su conectividad (Romero et al., 2008). El establecimiento de grandes zonas de cultivo, minería y ganadería extensiva son las principales causas de su creciente fragmentación (Fajardo et al., 1999; Viña y Cavalier, 1999). Tal problemática ha comprometido los bienes y servicios ecosistémicos y el papel que cumplen estos bosques como refugio y corredores faunísticos entre diferentes regiones biogeográficas como los Andes y la Amazonía (Lasso et al., 2010). Esta situación ha generado como resultado la conformación de un mosaico de fragmentos de diferentes tamaños, inmersos en una matriz de potreros y cultivos de palma de aceite. El estudio y conservación de los fragmentos existentes es una estrategia fundamental para mantener la biodiversidad de estos bosques, permitiendo entender las interacciones ecológicas entre diferentes grupos faunísticos y generando herramientas que contrarresten el efecto negativo de la fragmentación (Ferraz et al., 2014).
Uno de los grupos faunísticos más importantes en estos relictos de bosque son los mamíferos y, entre estos, los primates, ya que desempeñan un rol funcional imprescindible (Stevenson y Aldana, 2008). Algunos de estos roles son la dispersión de semillas, la polinización, el flujo de nutrientes y la estructuración de redes tróficas (Estrada et al., 2017). En paisajes fragmentados, muchas de estas funciones se ven afectadas negativamente, especialmente aquellas asociadas con el tamaño y la calidad del hábitat, presentándose cambios importantes en la composición, riqueza y abundancia de las comunidades de primates (Estrada et al., 2017). En este contexto, los primates constituyen entre el 25% y el 40% de la biomasa de frugívoros en los bosques tropicales (Chapman, 1995), siendo elementos fundamentales para la dispersión de semillas (Stevenson y Aldana, 2008). Los procesos de fragmentación y transformación del hábitat han venido afectando la estabilidad y supervivencia de las poblaciones de primates. La fragmentación puede llegar a causar extinciones a nivel local de muchas de las especies, afectando los patrones de regeneración del bosque (Chapman, 1995). Algunas especies son más sensibles que otras, como el caso de Alouatta seniculus (Linnaeus, 1766) (monos aulladores), una de las pocas especies de primates que se han mantenido en estos hábitats fragmentados, debido a su flexibilidad y adaptabilidad (Stevenson y Aldana, 2008). En contraste, existen otras especies como Aotus brumbacki Hershkovitz, 1983 (mono nocturno llanero) o Saimiri cassiquiarensis (Lesson, 1840) (mono ardilla) que son muy sensibles al tamaño del fragmento (Carretero-Pinzón, 2013; Carretero-Pinzón et al., 2017).
Para la región neotropical, existen varios estudios que han evaluado -a diferentes escalas- el efecto negativo que tienen los procesos de perturbación, reducción y fragmentación de los hábitats sobre la estructura y diversidad de primates (Carretero-Pinzón et al., 2015; Da Silva et al., 2015; Galán-Acedo et al., 2019). En el caso de grandes primates, el efecto es más evidente, ya que son especies que requieren grandes áreas de alimentación, tienen tasas de reproducción muy bajas y su movilidad entre parches es muy limitada (Link et al., 2010). Incluso, algunas especies que son conocidas por su alta adaptabilidad a eventos de disturbio, como lo es el género Alouatta, se ven afectadas por la fragmentación y, especialmente, por el reducido tamaño de los parches (Arroyo-Rodríguez y Américo, 2010). Sin embargo, para algunos grupos faunísticos la información existente es aún muy limitada, siendo este el caso de los insectos. Para el neotrópico, existen muy pocos estudios que analicen el efecto de la fragmentación y el cómo la interacción con otros grupos taxonómicos puede ser un elemento mediador sobre la estructura y diversidad de las comunidades (Basset et al., 1998; Losey y Vaugham, 2006; Grimbacher et al., 2007).
Uno de los grupos de insectos que presenta una de las relaciones más estrechas con el estado de conservación de los ecosistemas y con la salud de las poblaciones de mamíferos, son los escarabajos coprófagos (Coleoptera: Scarabaeinae) (Favila y Halffter, 1997; McGeoch et al., 2002; Barlow et al., 2007) ya que dependen de la producción de excremento para su alimentación y nidificación (Halffter y Matthews, 1966). Los escarabajos coprófagos son los responsables de una larga lista de servicios ecosistémicos (e.g., ciclaje de nutrientes, aireación y remoción del suelo, dispersión de semillas, control de las poblaciones de moscas y parásitos, etc.) que son fundamentales para el funcionamiento de los hábitats (Nichols et al., 2008). Adicionalmente, los escarabajos coprófagos, aportan una valiosa información acerca de la estructura y los cambios en la comunidad de mamíferos -y especialmente de las poblaciones de primates- (Nichols et al., 2009), siendo potenciales indicadores de eventos de perturbación y fragmentación.
La subfamilia Scarabaeinae es un grupo bien estudiado en la región neotropical (Gill, 1991), documentándose a profundidad el efecto negativo que sobre su diversidad pueden tener diferentes eventos de perturbación (Estrada et al., 1999; Andresen y Laurance, 2007; Noriega et al., 2007; Larsen et al., 2008; Otavo et al., 2013). A nivel mundial existen unas 6000 especies de escarabajos coprófagos y aproximadamente unas 300 registradas para Colombia (Noriega et al., 2015). Según el patrón de relocalización del recurso alimenticio, los escarabajos se han clasificado en tres principales gremios (Doube, 1990): paracópridos (o cavadores), los cuales hacen túneles trasladando el excremento verticalmente; los telecópridos (o rodadores), que forman una bola con el excremento y lo trasladan horizontalmente a una cierta distancia para luego si enterrarlo; y los endocópridos (o residentes), que construyen su nido dentro del excremento o en la interface suelo-excremento y no trasladan el recurso.
Teniendo en cuenta todo lo anterior, este estudio busca contestar la siguiente pregunta: ¿Cómo el tamaño de los fragmentos de bosque de galería y la riqueza y abundancia de los primates asociados afectan la diversidad y estructura (riqueza, abundancia, composición y grupos funcionales) del ensamblaje de escarabajos coprófagos? Nuestra hipótesis de trabajo es que los fragmentos más pequeños y con una menor diversidad de primates albergan una menor diversidad y una estructura funcional más pobre de escarabajos coprófagos, en comparación con fragmentos grandes. Buscando evaluar esta hipótesis, realizamos un estudio en fragmentos de bosque de galería de diferente tamaño en San Martín, Meta (Orinoquía Colombiana), estudiando la diversidad y estructura del ensamblaje de escarabajos coprófagos y su relación con el tamaño de los fragmentos y las poblaciones de primates.
Materiales y métodos
Área de estudio
El municipio de San Martín, se encuentra ubicado en el departamento del Meta, a 65 kilómetros de Villavicencio en la región de la Orinoquía Colombiana (Fig. 1A). Esta región se caracteriza por la presencia de sabanas naturales y bosques de galería, con una altitud promedio de 400 msnm, una temperatura promedio de 29º C y un régimen de precipitaciones monomodal con lluvias de abril a noviembre y una época seca entre diciembre y marzo (Minorta-Cely y Rangel-Ch, 2014). En términos de su vegetación, la cobertura dominante en esta región son bosques de galería, los cuales presentan algunas plantas dominantes como: laurel amarillo (Aniba panurensis (Meisn.) Mez), caracaro (Enterolobium cyclocarpum (Jacq.) Griseb.), flor morado (Tabebuia rosea (Bertol.) Bertero), tablón (Duguetia lepidota (Miq.) Pulle) y platanillo (Phenakospermum guyannense (A. Rich.) Endl. Ex Miq.) (Rangel-Ch y Minorta-Cely, 2014). Este tipo de bosque se caracteriza por la presencia de un caño o quebrada en su interior a lo largo de su extensión y un dosel que varía entre los 20 y 25 m de altura. El estudio se llevó a cabo en la finca Santa Rosa (03°36’49” N y 73°38’31” O; 350 msnm), en cuatro fragmentos de bosques de galería con áreas variables (F1: 30 ha, F2: 22 ha, F3: 14 ha y F4: 4 ha), los cuales se encuentran inmersos en una matriz de potreros con pastos nativos e introducidos que tienen un uso ganadero (Fig. 1B, C).
Riqueza y abundancia de primates
En esta área, el estudio de las poblaciones de primates es muy detallado, por lo que se conocen las especies y el número de individuos en cada uno de los fragmentos (Carretero-Pinzón, 2013; Fig. 1). Para el 2016, se realizaron recorridos a lo largo de los diferentes fragmentos, efectuando conteos del número de individuos de las especies de primates (Fig. 1C, un total de 22 km de censos). Utilizando la información del tamaño de los fragmentos, de los censos (riqueza y abundancia de los primates) y de la composición de la vegetación (Carretero-Pinzón, 2013), se seleccionaron para este trabajo cuatro fragmentos de bosque con un gradiente contrastante de tamaño, de riqueza y abundancia de primates (Figs. 1B, C).
Colecta de escarabajos
Se realizó una salida de campo en abril de 2016, época de lluvias, período que corresponde al pico de abundancia y riqueza de escarabajos y a la fructificación de varias especies de plantas en la zona. Se ubicó un transecto lineal (450 m), instalando diez trampas de caída separadas 50 m entre sí (Larsen y Forsyth, 2005), en el centro (a una distancia mínima de 50 m al borde del fragmento) de cada uno de los cuatro fragmentos de bosque de galería seleccionados (Fig. 1B). Al variar significativamente el tamaño de los fragmentos, existe la posibilidad de que los fragmentos pequeños estén mejor muestreados que los grandes, pero esto no se vio reflejado en las curvas de acumulación ni en los resultados. Las trampas de caída consistieron en un vaso plástico de 1000 ml enterrado a ras de suelo con 500 ml de alcohol etílico al 70 % (Noriega y Fagua, 2009). Las trampas se cebaron con 30 g de una mezcla de excremento humano y cerdo (1:3) y permanecieron abiertas durante 48 horas.

Fuente: Foto satelital tomada en 2015 por Alberto Sánchez.
Figura 1 A) Localización del área de estudio (O), B) distribución espacial de los fragmentos de bosque de galería estudiados y C) características generales de los cuatro fragmentos escogidos con las especies de primates presentes (Alouatta seniculus, Aotus brumbacki, Saimiri cassiquiarensis, Sapajus apella y Plecturocebus ornatus) en San Martín, Orinoquía Colombiana.
Trabajo de laboratorio
Las muestras se llevaron al laboratorio de biología de la Universidad Pedagógica Nacional, donde los especímenes se identificaron -hasta especie- utilizando diferentes claves taxonómicas (Edmonds, 1994; Génier, 1996; Edmonds y Zidek, 2004; González et al., 2009; Camero, 2010; Edmonds y Zidek, 2010; Vaz-de-Mello et al., 2011; González-Alvarado y Vaz-de-Mello, 2014; Cupello y Vaz-de-Mello, 2018), la comparación con material en colecciones y la ayuda de expertos en el grupo.
Los especímenes colectados se depositaron en las colecciones UPN, E-ANDES y CJAN. Adicionalmente, se tomó la medida de la longitud del cuerpo (mm) (desde el borde anterior del clípeo hasta el borde posterior del pigidio, usando un calibrador - o pie de rey - digital Powerfix con una precisión de 0.01 mm) para cada una de las especies encontradas, seleccionando 10 individuos al azar (cuando el número de individuos por especie fue menor se midieron todos los especímenes colectados). Utilizando el largo total promedio por especie se construyeron tres categorías de tamaño: pequeños (p; 18 mm) que combinadas con los tres gremios de relocalización del recurso alimenticio (P, paracópridos; T, telecópridos y E, endocópridos) generaron nueve grupos funcionales.
Análisis estadístico
Se realizó un análisis de la eficiencia del muestreo para cada fragmento mediante curvas de acumulación, a través de los índices de Chao1, ACE, singletons y doubletons, lo que permitió conocer el número estimado de especies utilizando el programa EstimateS v. 9.1 (Colwell, 2013). Se evaluó la diversidad beta, en términos de la similitud y equitatividad entre fragmentos, utilizando los índices de Shannon-Wiener, Simpson y Pielou. Para determinar la variación espacial de la estructura del ensamblaje, se utilizó el índice de similaridad de Bray-Curtis con el software PAST y BioDiversity Pro. Se realizó́ una prueba de normalidad usando el test de ShapiroWilk y una prueba de Bartlett para evaluar la homogeneidad de las varianzas. Para analizar y determinar diferencias entre los fragmentos se realizó un análisis de varianza (ANOVA) y en el caso de detectar diferencias se aplicó una prueba de Tukey HSD post-hoc para encontrar variaciones significativas.
Resultados
En relación a la riqueza y abundancia de primates, la mayor riqueza y abundancia se presenta en el fragmento 1 (5 spp., N = 60), seguido por el fragmento 2 (3 spp., N = 21), fragmento 3 (2 spp., N = 10) y el 4 (1 sp., N = 4). Se evidencia un patrón de disminución de la riqueza y abundancia de los primates, concordante con la respuesta encontrada para los escarabajos y el tamaño del fragmento. En los fragmentos con mayor riqueza y abundancia de primates, se encontró la mayor riqueza y abundancia de escarabajos. Según nuestros resultados, A. seniculus es la especie dominante y más tolerante a la fragmentación, encontrándose en los cuatro fragmentos, mientras que A. brumbacki es la especie que presenta la mayor sensibilidad y solo se encontró en el fragmento más grande (Fig. 1C).
Las curvas de acumulación de especies de escarabajos coprófagos, demostraron que el muestreo fue eficiente para los cuatro fragmentos con un rango que osciló entre 84.67% y 92.87%. Se colectaron 1172 individuos pertenecientes a 12 géneros y 18 especies (Tabla 1, Fig. 2). Los géneros con mayor número de especies fueron Deltochilum con tres especies; seguido por Canthidium, Dichotomius, Eurysternus y Onthophagus con dos especies cada uno; el resto de géneros presentó una sola especie (Tabla 1). La especie más abundante fue Onthophagus buculus (N = 370, 31.6 %), seguida por Dichotomius mamillatus (N = 331, 28.2 %), Dichotomius tristis (N = 171, 14.6 %) y Eurysternus caribaeus (N = 157, 13.4 %) (Tabla 1, Figs. 2D, G). Cinco especies fueron exclusivas para el fragmento 1 (Ateuchus cf. pygidialis, Canthon luteicollis, Deltochilum guildingii, Deltochilum aff. parile y Canthidium funebre; Figs. 2A, B, F), mientras que ningún otro fragmento presento especies exclusivas. En cuanto a la riqueza de los escarabajos, se presentó un patrón decreciente según el tamaño del fragmento, siendo mayor en el fragmento 1 (17 spp.), seguido por el fragmento 2 (11 spp.), fragmento 3 (8 spp.) y el 4 (7 spp.) (Tabla 1). Un patrón muy semejante se presentó con la abundancia, siendo el fragmento 1 el que mayor número de individuos presento (N = 599) (Tabla 1). En cuanto al índice de diversidad de Shannon, se presentó la misma tendencia, encontrándose el mayor valor en el fragmento 1 (H = 2.118) y la mayor dominancia en el fragmento 4 (D = 0.305) (Tabla 1). El valor de equitatividad más alto se presenta en el fragmento 1 (J = 0.732). Al comparar los resultados entre los fragmentos se registraron diferencias significativas para la abundancia (F = 4.127, df = 3, p < 0.001, N = 4; Fig. 3A), riqueza (F = 3.534, df = 3, p = 0.007, N = 4; Fig. 3B), diversidad (F = 2.901, df = 3, p = 0.013, N = 4; Fig. 3C) y equitatividad (F = 2.623, df = 3, p = 0.025, N = 4; Fig. 3D). Los fragmentos 1 y 2 son los más similares entre sí, seguidos por el fragmento 3 y el fragmento 4 que son los más diferentes entre todos (Fig. 4).
Tabla 1 Listado de las especies de escarabajos coprófagos y número de individuos colectados en los fragmentos estudiados (según tamaño; F1> F2> F3> F4) en San Martín, Orinoquía Colombiana. Grupo funcional (GF): paracópridos (P), telecópridos (T), endocópridos (E) y pequeño (p; < 10 mm), mediano (m; de 10 a 18 mm) y grande (g; > 18 mm)
Fuente: elaboración propia.

Fuente: Fotografías tomadas por Jorge Ari Noriega.
Figura 2 A) Ateuchus cf. pygidialis, B) Canthidum funebre, C) Dichotomius mamillatus, D) Ontherus pubens, E) Canthon luteicollis, F) Deltochilum guildingii, G) Eurysternus caribaeus, H) Onthophagus haematopus y I) Oxysternon conspicillatum.

Fuente: elaboración propia.
Figura 3 Análisis de las diferencias entre fragmentos para: A) Abundancia, B) Riqueza, C) Diversidad y D) Equitatividad según los valores registrados de escarabajos coprófagos por trampa en los cuatro fragmentos estudiados (según tamaño; F1>F2>F3>F4) en San Martín, Orinoquía Colombiana.

Fuente: elaboración propia.
Figura 4 Dendograma basado en el índice de similaridad de Bray Curtis según la composición de escarabajos coprófagos para los cuatro fragmentos estudiados (según tamaño; F1>F2>F3>F4) en San Martín, Orinoquía Colombiana.
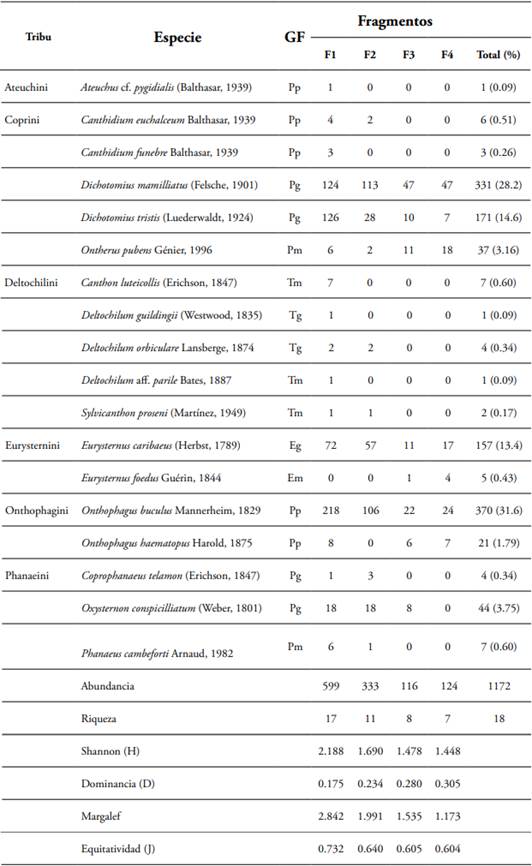
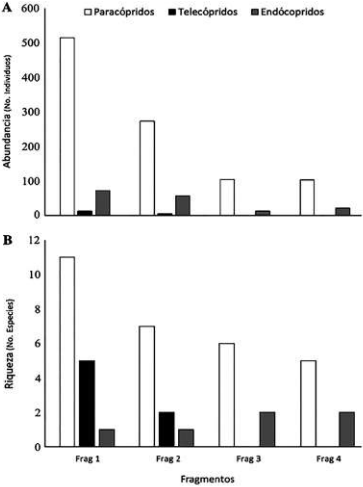
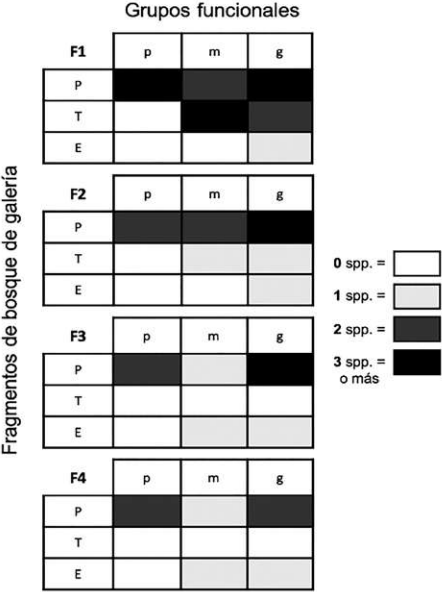
Con respecto a los gremios, once especies son paracópridas, cinco son telecópridas y dos son endocópridas (Tabla 1), evidenciándose diferencias en la estructura entre los fragmentos (Figs. 5A, B). Se registra una estructura típica decreciente (para la abundancia y la riqueza) de los tres principales gremios (paracópridos > telecópridos > endocópridos) (Tabla 1, Fig. 5). Con respecto a los grupos funcionales (gremios + tamaños), se aprecia una tendencia a perder especies y grupos funcionales completos en la medida que se pasa del fragmento grande (F1) al fragmento más pequeño (F4) (Fig. 6). La mayor pérdida de especies se da en el paso del fragmento 1 al 2, en el cual se pierden seis especies, especialmente tres paracópridos pequeños (Tabla 1, Figs. 5, 6). La mayor pérdida de grupos se da en el paso del fragmento 2 al 3, en la que se pierden dos grupos funcionales completos (telecópridos medianos y pequeños). Los telecópridos (rodadores), desaparecen por completo en los dos fragmentos pequeños (3 y 4) y los grandes paracópridos (cavadores; Coprophanaeus telamon, Phanaeus cambeforti y Oxysternon conspicillatum) disminuyen drásticamente en el fragmento 3, desapareciendo por completo en el fragmento 4 (Tabla 1, Fig. 6). La mayor redundancia en cuanto a los grupos funcionales se registró en el fragmento 1, con cinco especies pertenecientes al grupo de los Pp (paracopridos-pequeños), seguido por cuatro especies pertenecientes al grupo de los Pg (paracopridos-grandes).
Fuente: elaboración propia.
Figura 5 Estructura de los gremios funcionales (paracópridos, telecópridos y endocópridos): A) abundancia total y B) riqueza de especies en cada uno de los fragmentos estudiados (según tamaño; F1>F2>F3>F4) en San Martín, Orinoquía Colombiana.
Fuente: elaboración propia.
Figura 6 Estructura de los grupos funcionales (Gremios: P, paracópridos; T, telecópridos y E, endocópridos; y tamaños de los individuos: pequeños, p < 10 mm; medianos, m = 10 a 18 mm; y grandes, g > 18 mm) para cada uno de los fragmentos estudiados (según tamaño; F1>F2>F3>F4) en San Martín, Orinoquía Colombiana.
Discusión
En este estudio evaluamos el efecto del tamaño del fragmento y su respectiva población de primates sobre la diversidad y estructura del ensamblaje de escarabajos coprófagos en bosques de galería en la Orinoquía Colombiana, encontrando que, en los fragmentos más pequeños, con una menor diversidad de primates, la diversidad y estructura funcional de los escarabajos coprófagos se ve afectada de manera negativa. Este resultado es un indicador del estado de perturbación de los bosques y de la disminución en la riqueza y abundancia de las especies de primates, las cuales son la fuente primaria de recursos para los escarabajos coprófagos.
En este trabajo fueron registradas un total de 18 especies, que representan el 17.15% de las especies enlistadas para la Orinoquía Colombiana (N = 105 spp.). De acuerdo a lo registrado por Medina y Pulido (2009). Los valores de riqueza de especies encontrados para San Martín, son bajos, máxime si los comparamos con otros trabajos realizados en otros bosques de galería del departamento del Meta, como lo es el estudio realizado por Amézquita et al. (1999) que registró 32 especies, o el trabajo de Noriega et al. (2007) que registró 22 especies. A pesar de los bajos valores, se evidencia que los fragmentos más grandes (1 = 30 ha y 2 = 22 ha) son áreas que, a pesar de su pequeño tamaño, logran mantener una estructura funcional, incluyendo representantes de la mayoría de los diferentes grupos funcionales. La baja riqueza encontrada en los fragmentos, estaría indicando que el efecto del tamaño de los bosques es crítico y está afectando su diversidad, estructura y funcionalidad.
Fragmentos en extremo pequeños (como los fragmentos 3 y 4; < 20 ha) no logran mantener la diversidad ni estructura del ensamblaje, lo cual se evidencia con la desaparición de varios grupos funcionales importantes como los telecópridos o los grandes paracópridos. En términos de la composición del ensamblaje, el género Dichotomius se ha calificado como un grupo generalista que es capaz de ocupar bordes de bosque, con una alta capacidad de penetrar y salir de los fragmentos (Amézquita et al., 1999), siendo las especies de este grupo las de mayor abundancia en el muestreo (D. tristis y D. mamillatus; N = 502, 42.8 %). Igualmente, varias de las especies del género Onthophagus son indicadores de bosques intervenidos (Morón, 2003) y al ser capaces de utilizar las heces del ganado vacuno su distribución se ha extendido con los procesos de deforestación (Kohlmann y Solís, 2001).
En cada uno de los fragmentos muestreados, la composición y estructura de los grupos funcionales que dominan el ensamblaje es diferente, evidenciando una adaptabilidad local y una fuerte competencia espacio-temporal, donde las especies con abundancias muy bajas posiblemente estén usando fuentes alternativas de alimentación (Gill, 1991). La baja riqueza de especies endocópridas puede atribuirse a la dominancia de especies paracópridas y telecópridas las cuales son fuertes competidoras, especialmente en sitios donde los recursos son escasos y donde las oportunidades para anidar y establecerse son bajas (Hanski y Cambefort, 1991). La desaparición de ciertos grupos funcionales, en extremo importantes, en pequeños fragmentos, como es el caso de los telecópridos o de los grandes paracópridos, puede ser un claro indicador de la desaparición local de algunas especies de primates. La disminución, desaparición y extinción local de Atelinos (Ateles y Lagothrix) en algunas localidades en el neotrópico, ha generado un fuerte efecto negativo en la estructura, diversidad y funcionalidad de los bosques (Stevenson y Aldana, 2008). En este contexto, la resistencia y adaptabilidad de A. seniculus y su función de dispersor de semillas la hace una especie muy importante en la dinámica y regeneración de estos bosques, a pesar de que algunos estudios señalan que puede verse afectada si los parches de bosque son en extremo pequeños (Arroyo-Rodríguez y Américo, 2010). Los resultados estarían apuntando a que A. seniculus es una de las pocas especies de primates que logra mantenerse y perdurar en fragmentos de tamaño pequeño, como registran Gaulin y Gaulin (1982). La presencia de esta especie estaría desempeñando un papel crucial al proporcionar una mínima fuente de recursos, permitiendo mantener poblaciones de escarabajos a pesar de la alta fragmentación.
Varios trabajos han logrado identificar un efecto negativo de la fragmentación sobre la estructura, composición y aporte funcional de los ensamblajes de escarabajos coprófagos luego de un evento de disturbio antrópico (Nichols et al., 2007). Este efecto se ve reflejado en: 1. La disminución de la riqueza (Halffter et al., 2007; Navarrete y Halffter, 2008; Figuerais et al., 2011), 2. Alteración de la biomasa y tasas de remoción (Horgan, 2005; Larsen et al., 2008; Amézquita y Favila, 2010; 2011), 3. Incremento de la abundancia (Horgan y Fuentes, 2005, Louzada et al., 2007; Louzada et al., 2010) o 4. Ingreso de especies generalistas provenientes de matrices perturbadas (Louzada y Carvalho, 2009). Igualmente, diferentes estudios sobre el efecto de disturbios antrópicos en Colombia (Amézquita et al., 1999; Escobar, 2000; 2004; García y Pardo-Locarno, 2004; Noriega et al., 2007) concuerdan con nuestros resultados, evidenciando una tendencia a la disminución en la riqueza de especies desde fragmentos más conservados hacia fragmentos más intervenidos. Por ejemplo, Noriega et al. (2012), registraron -en bosques fuertemente fragmentados en Antioquia- que se presenta una fuerte homogenización (no encontrándose diferencias significativas para la riqueza, abundancia o diversidad) por pérdida de especies entre hábitats (bosque, cafetal y pastizal). El tamaño del fragmento, el tipo de matriz circundante y el aislamiento entre parches, se han reconocido como los principales factores involucrados en el efecto negativo sobre la diversidad y estructura del ensamblaje (Escobar, 1997; Amézquita et al., 1999; Noriega et al., 2007). En este trabajo, adicionalmente, registramos una clara tendencia a que la abundancia y riqueza de primates afectan potencialmente la diversidad y estructura funcional del ensamblaje de escarabajos coprófagos.
Todo lo anterior, apunta a que la riqueza y la abundancia de los escarabajos coprófagos está estrechamente relacionada con el tamaño, oferta alimenticia (i.e., poblaciones de primates) y las condiciones ambientales asociadas, ya que en cada fragmento de bosque la oferta cambia significativamente afectando la estructura del ensamblaje (Klein, 1989) y los servicios ecosistémicos relacionados como la dispersión de semillas (Estrada y Coates-Estrada, 1991). Sin embargo, es importante señalar que en la zona de estudio pueden existir especies asociadas al excremento de los primates o que están utilizando otros recursos (excremento de otros vertebrados, carroña, hongos o diplópodos) que no fueron colectadas en las trampas debido a su especificidad y que podrían estar afectando el análisis. En este contexto, los valores de riqueza y abundancia registrados en los fragmentos estudiados indican que esta área es apropiada para impulsar programas de conservación, utilizando a los escarabajos como indicadores de las poblaciones de primates (Vulinec, 2000). El papel funcional de los escarabajos coprófagos, en este tipo de sistemas fragmentados, puede contribuir a restaurar los bosques secundarios, preservando los fragmentos y proporcionando un importante complemento en la conservación de los bosques, siempre y cuando la composición de los grupos funcionales se mantenga (Vulinec et al., 2006).
En conclusión, de acuerdo con los resultados encontrados, se evidencia un fuerte efecto negativo de la fragmentación en los bosques estudiados, la cual afecta y genera una disminución en la abundancia, riqueza y composición de los grupos funcionales de escarabajos coprófagos. Fragmentos demasiado pequeños (< 20 ha) pierden importantes elementos funcionales, afectando potencialmente los servicios ecosistémicos que proveen. Sin embargo, en conjunto, se evidencia una representatividad significativa de la fauna regional de escarabajos coprófagos, lo que permite suponer que estos fragmentos funcionan como un importante refugio faunístico, especialmente para primates (Asencio et al., 2009). Es necesario continuar con este tipo de investigaciones y profundizar en el entendimiento del grado de interrelación espacial y temporal entre los elementos del paisaje. Es necesario incluir muestreos en la época seca, utilizando otros cebos (e.g., carroña y excremento de primates), otros tipos de trampas y hábitats (e.g., cercas vivas y pastizales). Igualmente, recomendamos estudiar el flujo de las especies entre los fragmentos y la utilización de las cercas vivas con el fin de entender los patrones de movilidad. Finalmente, a partir de este trabajo, se evidencia que los fragmentos de bosque de galería de la Orinoquía Colombiana son áreas con una alta sensibilidad constituyéndose en zonas que requieren de la generación de estrategias locales de conservación.














