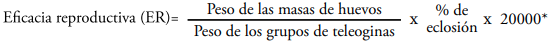Introducción
Rhipicephalus hace parte de la familia Ixodidae, conocida como garrapatas duras, por poseer un escudo protector rico en quitina (Polanco-Echeverry & Ríos-Osorio, 2016; Rivera-Páez et al., 2018). Estos especímenes pueden presentar un tamaño de 1 a 20 mm de longitud, poseen un escudo dorsal completo duro rico en quitina en el caso de los machos e incompleto o parcialmente cubierto por el escudo en la parte anterior de las hembras, larvas y ninfas, lo que les permite crecer y agrandarse lo suficiente para lograr contener hasta dos mililitros de sangre (Bendjeddou et al., 2017). Las características morfológicas más representativas de una teleogina se muestran en la figura 1.

Fuente. Original de los autores.
Figura 1 Principales características morfológicas de un espécimen hembra.
Las infestaciones por Rhipicephalus (Boophilus) microplus así como los hemoparasitos de importancia sanitaria que transmiten, Babesia spp. y Anaplasma spp. generan anemia, alteraciones neurológicas y disminución en la producción bovina; efectos negativos que afectan económicamente a los ganaderos (Araque, 2014; Corley, 2013; Lopes et al., 2013; Polanco-Echeverry & Ríos-Osorio, 2016; Villar et al., 2016). Por otro lado la garrapata del ganado R. microplus es muy fértil ya que una teleogina puede llegar a consumir hasta 3 ml de sangre diaria y ovopositar 4000 huevos aproximadamente (Busch, 2014; Maciel et al., 2015).
El tratamiento para controlar las infestaciones de esta garrapata se basa principalmente en el uso de compuestos químicos sintéticos (Cruz et al., 2014; Gomes et al., 2015). Los productos disponibles en el mercado colombiano incluyen los organofosforados, piretroides sintéticos y amidinas cuya aplicación se realiza de forma tópica mediante baños de aspersión, lactonas macrocíclicas de uso parenteral o fenilpirazolonas y benzoilfenilureas de aplicación tópica en el dorso del animal (Domingues et al., 2012; Shyma et al., 2015).
La utilización de acaricidas químicos para controlar garrapatas es un factor clave para mejorar la producción, pero los esfuerzos para combatir estas infestaciones de garrapatas en la mayoría de las fincas ganaderas colombianas son afectados por prácticas incorrectas de manejo y aplicación de los productos, caracterizadas por el uso excesivo y desordenado de los mismos lo que aumenta los costos de producción y acelera la selección de resistencia de los parásitos, representando un problema económico de importancia en la producción bovina (De Oliveira et al., 2012; Calligaris et al., 2013; Correa et al., 2015; Santana et al., 2013).
La resistencia a acaricidas en R. microplus es un problema mundial en aumento ya que el frecuente e inadecuado uso de estos productos ha seleccionado poblaciones de garrapatas capaces de resistir dosis de acaricidas que normalmente serían letales, característica que además es de tipo genético y heredable (Faza et al., 2013; Gomes et al., 2011; Rosario-Cruz et al., 2009).
En Colombia, Rodríguez-Pacheco (2017) evaluó poblaciones de R. microplus colectadas de granjas en Boyacá y encontró resistencia en el 94% de las garrapatas analizadas al amitraz, en el 94,4% a piretroides sintéticos y el 90,4% a organofosforados. Villar (2016) reportó que en siete predios ubicados en Arauca, Córdoba, Meta y Valle del Cauca se encontró resistencia en más del 80% de las fincas evaluadas a piretroides y en el 50% al amitraz. Por otro lado, Araque (2014) evaluó 71 predios distribuidos en las cinco regiones naturales de Colombia reportando que en el 89% de las fincas analizadas se registraron diferentes niveles de resistencia al amitraz con valores desde 10% al 90% y hacia el etión 28.8% de los predios tuvieron un nivel de resistencia del 20 al 59%. De esta forma, la resistencia a químicos constituye un problema general en el país incluyendo el Tolima, donde se han reportado niveles de resistencia en poblaciones de campo de R microplus del 92,1% hacia cipermetrina y 71,1% hacia organofosforados (Diaz, 2013; 2014).
Se han desarrollado pruebas biológicas de susceptibilidad acaricida como la prueba del paquete larval, prueba de inmersión de larvas, prueba tarsal y la prueba de inmersión de adultas (AIT por sus siglas en inglés), esta última ampliamente usada debido a su facilidad de ejecución así como el respaldo de la FAO (2004) (Santos et al., 2013).
En el presente estudio se buscó determinar la eficacia de los acaricidas así como la susceptibilidad de las especies de R. microplus a acaricidas mediante la AIT descrita por Drummond et al., (1973), con algunas modificaciones, mencionadas en la metodología en poblaciones de campo en la zona central del Tolima, contemplando los municipios de Ibagué, Espinal y Cajamarca.
Materiales y Métodos
Localidades
Se evaluaron 12 fincas escogidas aleatoriamente en el municipio de El Espinal (4°08′55″N 74°52′55″O) dentro del ecosistema de trópico bajo y en los municipios de Cajamarca (4°26′12″N 75°25′40″O) e Ibagué (4°26′16″N 75°12′02″O) ubicados en ecosistema de trópico medio del Tolima (Figura 1), municipios cuyo inventario bovino totaliza 58.352 cabezas de ganado distribuidas en 2.159 fincas (ICA, 2018). El tamaño de muestra fue determinado según Abad & Servín (1978), tomando un nivel de confianza del 95%, un margen de error del 10% y un valor p = 0,95 basándose en niveles de resistencia a químicos en R. microplus reportados anteriormente. Esta muestra fue estratificada de acuerdo con un índice obtenido entre la población bovina total y el número de predios por municipio, por lo cual se escogieron cinco predios en Cajamarca, cuatro predios en Ibagué y tres predios en El Espinal. Al inicio del estudio se realizó una corta encuesta en cada una de las fincas a fin de determinar características tales como tamaño de la población bovina, razas presentes, tipo de producción, condiciones ambientales, planes sanitarios de control de garrapatas, historial del uso y frecuencia de tratamiento. La ubicación geográfica de los municipios se observa en la figura 2.
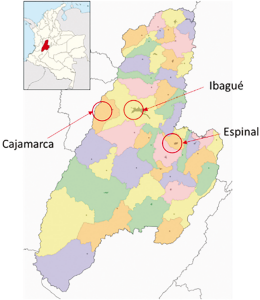
Figura 2 Ubicación geográfica de los tres municipios donde se realizó el estudio (Sociedad Geográfica de Colombia, 2015).
Colecta de especímenes
En cada finca se colectaron teleoginas (hembras repletas de sangre) de R. microplus desprendiendo cuidadosamente de forma manual los especímenes presentes en cada flanco de al menos cinco bovinos infestados (Andreotti et al., 2011). Las garrapatas se transportaron en recipientes plásticos con suficiente ventilación hasta el Laboratorio de Parasitología Veterinaria de la Universidad del Tolima donde se seleccionaron los individuos para el estudio que presentaran un tamaño mínimo de 7 mm, coloración marrón uniforme y cuerpo con todas sus estructuras, se realizó la identificación taxonómica a través de características morfológicas de la especie (USDA, 1976) y se desarrollaron los protocolos para la prueba biológica.
Prueba de Inmersión de Adultas (AIT) modificada
Para analizar la susceptibilidad de los especímenes se realizó la prueba PIA (Drummond et al., 1973) con modificaciones como: Se usaron dosis comerciales, el volumen final de solución stock de inmersión fue de 100 ml, el tiempo de inmersión fue de tres minutos, la masa de huevos se pesó a los 14 días, el porcentaje de eclosión se estimó a los 20 días y se hicieron dos réplicas. De esta manera se utilizaron hembras ingurgitadas con un peso mínimo de 150 mg. Los principios activos utilizados fueron: etión 840 ppm, cipermetrina 150 ppm, y amitraz 208 ppm, en presentaciones comerciales y diluidas de acuerdo con las recomendaciones del fabricante para su uso en campo. Es decir, se diluyó 0.1 ml de cada uno de los productos en 100 ml de agua destilada, manteniendo la recomendación de la casa comercial de dilución de 1 ml en 1 litro de agua. También se evaluó ivermectina inyectable 10 ppm, preparada según FAO (2004) diluyendo 0.1 ml del producto en 9.9 ml de etanol al 1% y Tritón X-100 al 0.02%.
Se establecieron cuatro grupos tratamiento, uno por cada acaricida, y un grupo control solo con agua destilada; al evaluar diez hembras por grupo con dos réplicas por tratamiento. Las teleoginas se sumergieron por tres minutos en 100 ml de solución acaricida diluida a la concentración respectiva en agua destilada. Las teleoginas del grupo control se sumergieron solamente en agua destilada. Luego se secaron con papel absorbente y se ubicaron en cajas de Petri en posición decúbito dorsal adhiriéndolas con cinta adhesiva doble faz para su monitoreo bajo condiciones de laboratorio en una estufa de incubación a 28°C y 80% de humedad relativa durante 14 días (Díaz & Vallejo, 2014).
Posteriormente, se pesó la masa total de huevos del grupo de 10 garrapatas que ovopositaron, en cada uno de los tratamientos acaricidas y el control, se depositó en tubos de ensayo de 10 ml con un tapón de algodón para permitir la oxigenación y se dejó en incubación a 28 °C y 80% de humedad (Díaz, 2016). Al cabo de 20 días se estimó el porcentaje de eclosión realizando tres conteos aleatorios de 200 estructuras cada uno entre huevos y cascarones por cada grupo evaluado (Furlong, 2002).
Estimación de la eficacia acaricida
La eficacia para cada acaricida se obtuvo comparando la reproducción estimada (ER) de todos los grupos de garrapatas tratadas con la ER del grupo control, tomando como parámetros de medida el peso del grupo de teleoginas, el peso de la masa de huevos y el porcentaje de eclosión, realizando el cálculo con la siguiente fórmula (Drummond, 1973):
* Constante que indica el número estimado de huevos por gramo en R. microplus.
A continuación, la ER obtenida de cada grupo tratado se comparó con la del grupo control para calcular el porcentaje de eficacia de cada acaricida, empleando la fórmula descrita por Drummond (1973):
Con base en el porcentaje de eficacia del producto, se obtuvo el factor de resistencia al dividir la eficacia esperada (100) entre la eficacia obtenida con cada uno de los productos acaricidas (Díaz, 2016).
Resultados y Discusión
Análisis de encuestas
La información de las encuestas arroja que el 91,67% de los predios evaluados tienen un tipo de producción doble propósito y el 8,33% es de cría, levante y ceba; predominando en el 83,33% de las producciones las razas mestizas, (Cruce Holstein X Gyr X Normando X Brahman) mientras en el otro 16,67% de las fincas están compuestas por animales Brahman blanco y Angus rojo.
En cuanto a la distribución geográfica, el 75% (nueve predios) se ubican en la zona de trópico medio, municipios de Cajamarca e Ibagué, entre 1240 y 1814 m.s.n.m., con temperatura media de 20 a 24°C, humedad relativa de 72 a 84% y precipitación anual máxima de 233 mm. El 25% (tres predios) se ubica en el trópico bajo, municipio de Espinal, a 600 m.s.n.m., con temperatura media de 28°C, humedad relativa de 82% y precipitación anual de 159 mm.
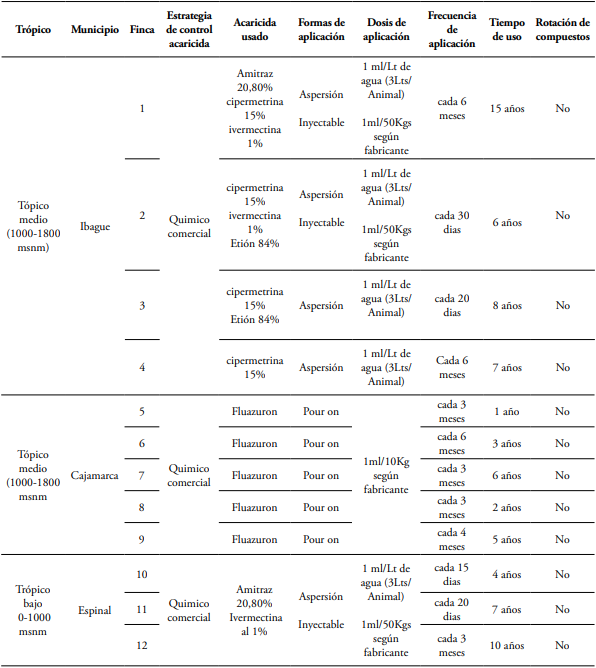
La estrategia de control acaricida desarrollada en las fincas contempla compuestos químicos como el fluazuron, usado en el 41,66% de los predios como único tratamiento de rutina (ubicados todos estos en Cajamarca); según manifiestan los ganaderos debido a la pérdida de efectividad de los otros acaricidas como el amitraz, el etión y la cipermetrina. La frecuencia con que se usa este producto de aplicación tópica va de tres a seis meses y en algunas de las fincas llevan hasta seis años utilizándolo, como se observa en la tabla 1. En el resto de las fincas, 58,34%, ubicadas en Ibagué y El Espinal, se emplean baños de aspersión con etión, cipermetrina y amitraz, aplicándolos con intervalos menores a las tres semanas, difiriendo de la recomendación técnica para el control de R. microplus de bañar cada 21 días como mínimo, y rotando los productos de un baño al otro, prácticas que conllevan a la baja eficacia expresada por los ganaderos y que se origina por la alta presión de selección de garrapatas con características genotípicas de baja susceptibilidad hacia estos compuestos.
En cuanto a la ivermectina, se utiliza en el 41,7% de las fincas, todas las evaluadas en El Espinal y dos en Ibagué, a la dosis recomendada por el fabricante. La tabla 1 sintetiza la información obtenida en cada una de las fincas, así como la frecuencia de uso de los acaricias, la rotación y el historial de uso de los cuatros compuestos evaluados.
En ninguno de los predios analizados se realiza rotación con otros productos acaricidas y se evidencia que en todas las fincas usan solo químicos como estrategia de control de garrapatas. En la tabla 1 se evidencia que tanto en las fincas de trópico bajo como las de trópico medio donde se realiza control con cipermetrina, etión y amitraz, la frecuencia de uso es alta a excepción de los predios 1 (Ibagué) y 9 (Espinal).
Tabla 1 Encuesta evaluación previa de las prácticas de manejo en los predios analizados.
Fuente: Original de los autores.
Por otro lado, cuatro de las doce fincas han usado los químicos acaricidas durante menos de cinco años en Cajamarca y El Espinal, sin embargo los predios pertenecientes a Cajamarca se usa un producto diferente a los evaluados en el presente estudio. Para un correcto uso de los baños por aspersión se recomienda rociar los animales siguiendo un orden y sosteniendo la boquilla aspersora de 15 a 30 cm de distancia del animal, el cual se debe bañar con una cantidad mínima (adultos 6 litros, terneros 4 litros, estos últimos a partir de los 3 meses de edad); con periodicidad de 30 a 60 días de intervalos entre baños según el nivel de infestación (Rodríguez-Vivas et al., 2006).
Evaluación de acaricidas
Según la tabla 2, con el organofosforado en el 25% de las fincas las poblaciones de R. microplus presentan disminución en el total de su descendencia con relación al grupo control, con reducción promedio del 98,96% en el número de larvas generadas, lo cual incidirá directamente en el nivel de infestación de los animales. Para el caso de la amidina el 16,66% de los predios presentó una disminución promedio de 92,94%. En cuanto al piretoride solo en un predio que representa el 8,33% del total de las fincas evaluadas logró una reducción del 90,41%. En contraste, la lactona macrocíclica consiguió en el 66,66% de los predios una reducción promedio de 96,83% representado el acaricida que mejor comportamiento tuvo para controlar la eficacia reproductiva de los especímenes analizados.
Tabla 2 Comparación entre la eficacia reproductiva ER de R. microplus para los cuatro tratamientos en las 12 fincas evaluadas con respecto al control.
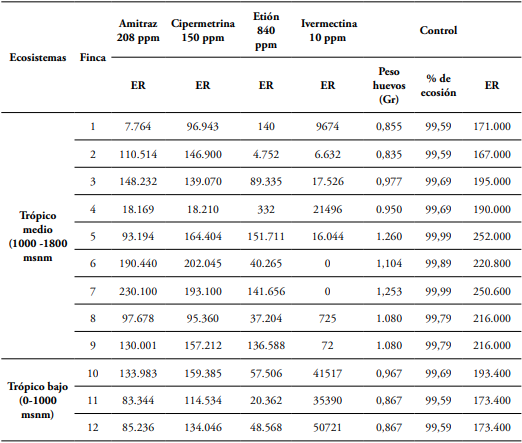
ER: Eficacia reproductiva.
Fuente: Original de los autores.
De otra forma, el amitraz reflejó una reducción de más del 90% en la eficacia reproductiva de las poblaciones de R. microplus solo en Ibagué, al igual que la cipermetrina y el etión. Mientras que la ivermectina tuvo gran incidencia en este mismo municipio y en Cajamarca con valores que superaban el 90%; siendo el acaricida más efectivo en el ecosistema de trópico medio. Para el caso de los predios ubicados en el trópico bajo el organofosforado y la lactona macrocíclica fueron los plaguicidas de mejor rendimiento con un promedio de control de 76,83% y 75,36% respectivamente.
Los cuatro acaricidas evaluados incidieron negativamente en los parámetros reproductivos de las poblaciones de R. microplus, afectando la ovoposición de las garrapatas, el porcentaje de eclosión y la estimación reproductiva, evidenciando valores más bajos que los registrados en el grupo control, reflejando el efecto de estos compuestos sobre las teleoginas. Sin embargo, cipermetrina y el amitraz fueron los acaricidas con el rendimiento más bajo para controlar la eficacia reproductiva de las poblaciones de los especímenes analizadas.
Por otro lado, durante la evaluación de la ovoposición y el pesaje de la masa de huevos, se evidenciaron diferencias morfológicas en la estructura de estos observándose deformidad de la silueta de estos, principalmente para los especímenes tratados con ivermectina.
La eficacia de los acaricidas evaluados presentó variaciones por finca y por municipio. La cipermetrina tuvo un porcentaje de eficacia bajo con relación a los demás acaricidas, aunque mostró un comportamiento aceptable en un solo predio, el cual representa al 8,33% del total de las fincas analizadas reportando un valor de 90% de eficacia, de modo que en el 91,66% de los predios el piretroide fue ineficaz, teniendo en cuenta que según la FAO (2004) la eficacia mínima aceptada internacionalmente debe ser a partir del 90% (Tabla 3).
Para el caso del amitraz se obtuvo un valor por encima del 90% de eficacia en el 16,66% de los predios, mientras que el etión reportó este comportamiento en el 25% de las fincas, contrastando con la ivermectina, el cual refleja una eficacia alta en el 66,66%.
De otra forma en el 33,33% de los predios el amitraz presentó un rango de eficacia de 20-40%, mientras que en el 25% presentó un rango de 41-60% y y el 8,33% de las fincas estuvo en un rango de 61-89%.
En cuanto a la cipermetrina el 50% de las ganaderías analizadas presentó un rango de eficacia de 20-40%, el 8,33% obtuvo una valor de 41-60% y el 25% estuvo por debajo del 20%.
Para el caso del etión el 25% de las fincas reflejó una eficacia entre 40-60%, el 16,66% tiene un rango de 61-80% mientras que el 25% obtuvo un valor de 81-89% (Tabla 3).
Tabla 3 Eficacia de control en R. microplus colectados en 12 fincas de Ibagué, Cajamarca y El Espinal.
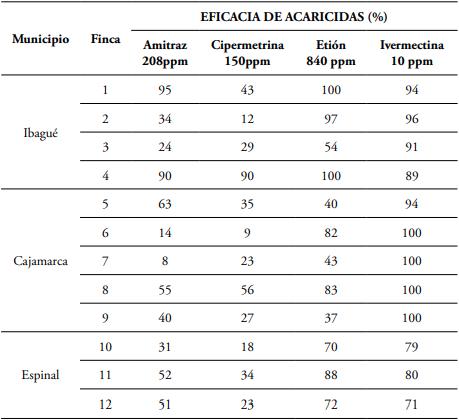
Fuente: Original de los autores.
En contraste, la ivermectina evidenció en el 33,33% de los predios un porcentaje de eficacia que va desde 71% hasta el 89%.
Por otro lado, el 77,77% de los predios ubicados en trópico medio presentaron multiresistencia y el 100% de las fincas de trópico bajo evidenció resistencia a todos los compuestos evaluados. Situación que coincide con los comentarios de los productores quienes afirman que los químicos analizados no sirven para controlar garrapatas, denotando pérdida de eficacia de estos compuestos en esas fincas.
Los resultados del presente estudio son similares a los publicados por Díaz (2016), donde la evaluación realizada en dos fincas del norte del Tolima detectó la pérdida de eficacia de amitraz con niveles de 51,95% y 76,96%, y de la cipermetrina con 87,85% y 93,5%, denotando una disminución en la población de individuos susceptibles a estos acarcicidas. Otros estudios realizados en Ibagué igualmente demuestran un nivel de resistencia a piretroides del 92,1% y a organofosforados del 71,1% (Díaz & Vallejo, 2013, 2014).
Un trabajo realizado en las regiones naturales de la Orinoquía, Pacifico, Llanura del Caribe, Amazonia y región Andina donde se analizaron poblaciones de R. microplus de 71 ganaderías, mostró niveles altos de resistencia, encontrando que el 97% de los hatos ganaderos muestreados presentó resistencia al uso de amitraz, mientras que el 52% la presentó al uso de etión, principalmente en los departamentos de Santander, Cundinamarca, Antioquia, Tolima, Quindío, Caldas, Huila y Boyacá, evidenciando la pérdida de la eficacia de este tipo de acaricidas, para el control de garrapatas (Araque, 2014). Otro estudio hecho con poblaciones de R. microplus en Arauca, Córdoba, Meta y Valle del Cauca detectó resistencia hacia cipermetrina y amitraz con niveles de eficacia inferiores al 50% y porcentajes de eficacia entre el 10% y 20%. (Villar et al., 2016) Así también evaluaron amitraz cuya eficacia no superó el 50%. Otros estudios con resultados publicados en Ibagué demuestran resistencia hacia piretroides de hasta el 92,1% y hacia organofosforados del 71,1% (Díaz & vallejo, 2013, 2014).
Estudios recientes en cuatro fincas de Antioquia han mostrado que para la cipermetrina los valores de eficacia fueron menores del 20%, e incluso del 0% en dos de ellas (Puerta et al., 2015). Pero no solo en Colombia se reporta la presencia de resistencia a acaricidas en esta especie de ectoparásito. La resistencia acaricida de R. microplus, es una problemática detectada a nivel mundial donde se ha registrado resistencia multiple en diferentes niveles, como se reporta recientemente en Brasil y México (Fernández-Salas et al; 2012; Pohl et al., 2012; Lovis et al., 2013; Miller et al., 2013).
Todos estos trabajos demuestran que en Colombia la resistencia de R. microplus hacia los acaricidas no es un fenomeno nuevo y se ha manifestado en diversas regiones del pais. La quimioresistencia puede originarse debido a la incorrecta utilización de los compuestos químicos empleados para el control de la garrapata, ya sea por el uso continuo y prolongado de un solo tipo de acaricida, por las altas frecuencias de aplicación de baños, por la inadecuada preparación de las soluciones con frecuente incremento de la dosis recomendada por el fabricante o por la deficiente aplicación impidiendo que la solución garrapaticida cubra totalmente el cuerpo del bovino (Díaz, 2012).
Como resultado del uso indiscriminado de estos cuatro acaricidas etión, cipermetrina, amitraz e ivermectina, en el control de altas infestaciones de garrapatas en bovinos, la resistencia a químicos de R. microplus se ha convertido en uno de los más grandes retos y una causa de preocupación por la producción ganadera donde este ácaro es endémico o en áreas propensas a la invasión por estas especies de ectoparásitos perjudiciales (Reck et al., 2014; Raynal, 2013; López-Arias et al., 2015).
Conclusiones
Se demostró la presencia de poblaciones de R. microplus con baja susceptibilidad a cipermetrina (66,75%), amitraz (53,58%), etión (27,83%) e ivermectina (8,83%), acaricidas más frecuentemente usados en tres municipios de la zona central del Tolima. Así mismo se observó en varios de los predios evaluados el desarrollo de multirresistencia a dos, tres o los cuatro acaricidas evaluados, siendo de especial relevancia la situación encontrada en El Espinal, donde los tres predios del estudio mostraron ineficacia en los cuatro compuestos.
Con esta información sobre el estado de resistencia a acaricidas en el centro del Tolima se dispone de las bases necesarias para rediseñar estrategias de control que integren no solo métodos de tipo químico, sino también de tipo biológico, y prácticas de manejo que permitan disminuir las infestaciones de R. microplus en la región o al menos limitar la velocidad de aparición o propagación de resistencia adoptando medidas alternativas que respondan a las necesidades particulares de cada predio según la situación encontrada.
El control de las infestaciones de R. microplus se debe realizar en el marco de un programa de manejo integrado que permita abarcar varios frentes, teniendo en cuenta la bioecología de la garrapata, así como las condiciones ambientales en que se encuentra la ganadería para determinar las prácticas a implementar.
Para la implementación de las medidas de control se debe estudiar el historial de la finca y realizar la caracterización de la misma teniendo en cuenta las metodologías adoptadas para contrarrestar la infestación por garrapatas, así como la información completa y detallada de los productos ixodicidas usados (principio activo, frecuencia, rotación, dosis, etc.).
Es importante realizar un diagnóstico previo que identifique las necesidades específicas de cada finca según el tipo de producción ganadera, para recoger información relevante que sirva de apoyo al desarrollo de programas sanitarios efectivos y de esta manera brinden herramientas valiosas para la construcción de alternativas de control ya sea de tipo biológico, químico, inmunológico o ambiental. Por otro lado, se debe conocer el estado de resistencia de las poblaciones de campo de R. microplus para evaluar estrategias de control útiles que puedan minimizar los daños sanitarios y económicos causados por las infestaciones de este ectoparásito. La divulgación de los resultados encontrados en el presente estudio permite a las instituciones y profesionales del sector velar por la salud animal en el país, y que de esta manera recomienden el uso de técnicas de diagnóstico en campo e in vitro y así determinar el estado de resistencia de las garrapatas para elegir el modelo de control pertinente o los productos a aplicar, así como el uso adecuado de los mismos. Este estudio aporta información útil para el conocimiento de uno de los mecanismos de resistencia usados por las garrapatas para sobrevivir a la presión de selección ejercida por los químicos, las malas prácticas de control y manejo. No obstante es perentorio continuar con en el proceso de investigación sobre el comportamiento biológico de R. microplus para analizar la evolución de la resistencia, por predio y por región específica a través del tiempo.