Introducción
La familia Curculionidae cuenta con cerca de 62.000 especies registradas en diferentes zonas agrícolas del mundo (Oberprieler et al., 2007); entre éstas se encuentra el género neotropical Heilipus, que fue descrito originalmente por Germar (1824) y cuya especie tipo es Heilipus lactarius (Schönherr, 1825; Morrone, 1999). Blackwelder (1947), enlista 327 especies distribuidas en México, Centro y Suramérica (Cesavem, 2010); Kuschel (1955), lo fragmenta y agrega a Haplogenus, Heilipodus, Heilus, Marshallius, Neseilipus, Parabyzes, Placeilipus y Rhineilipus como nuevos géneros. En 1986, el género Heilipus registró 39 especies para Norte y Centro América y 52 especies para América del Sur (O’brien & Wibmer, 1982; Wibmer & O’brien, 1986); no obstante, siete especies se repetían en ambos listados, de manera que el número real de especies para 1986 era de 84. Vanin & Gaiger (2005) determinan a Heilipus odoratus como una nueva especie, con lo cual el número de especies del género ascendió a 85 para ese año.
Las principales características diagnósticas de Heilipus (sensu Kuschel, 1955: 291) son las siguientes: “Prementon glabro. Tibias posteriores recurvadas y terminadas en el ángulo interno en un fuerte mucrón unciforme, premucrón ausente. Proceso mesosternal tuberculiforme”.
En 1986 Wibmer & O’brien registran 15 especies del género Heilipus para Colombia, sin considerar que dos años antes, Cárdenas (1984a, 1984b) ya había mencionado en notas y noticias entomológicas a H. trifasciatus (Díaz et al., 2021), con esto el número de especies de Heilipus en Colombia ascendía a 16: Heilipus annuliger (Latreille, 1811); Heilipus areolatus (Champion, 1902); Heilipus aulicus (Pascoe, 1881); Heilipus bipunctatus Boheman,1843; Heilipus chevrolatii Guérin, 1844; Heilipus designatus (Pascoe, 1889); Heilipus elegans Guérin, 1844; Heilipus fassli (Voss, 1953); Heilipus lauri Boheman,1845; Heilipus leopardus Boheman,1836; Heilipus mirus (Pascoe, 1881); Heilipus nisseri Boheman, 1836; Heilipus norrisii Guérin, 1844; Heilipus semivittatus Boheman, 1843; Heilipus spectator (Pascoe, 1881); (Blackwelder 1947; Wibmer & O’brien, 1986).
Recientemente, Diaz et al., (2021) al revisar las colecciones nacionales y validar la literatura, logran agregar siete nuevos registros: Heilipus discoides (Fabricius), Heilipus draco (Fabricius), Heilipus empiricus (Pascoe), Heilipus guttiger (Champion), Heilipus longirostris (Champion), Heilipus osculatii Guérin y Heilipus tetanicus (Pascoe), con estos nuevos registros, el número de especies de Heilipus presentes en Colombia asciende a 23, cifra que posiciona al país como el segundo con mayor diversidad del género después de Brasil, donde hasta el momento se enlistan 25 especies del grupo.
H. elegans (Guérin, 1844) se identificó por primera vez en el municipio de Fresno en el departamento del Tolima, asociado a ramas y tallos de las variedades de aguacate presentes en esta zona (Rubio et al., 2009); la coloración roja y los exudados depositados por las larvas en los orificios de penetración sobre la corteza son los primeros signos observados, estos precipitan síntomas como la defoliación y marchitez de las plantas afectadas. Al comienzo, los ataques se presentan generalmente, en las áreas sombreadas del tallo y de las ramas. En ataques severos, se encuentran perforaciones en las ramas terciarias (ramas jóvenes), en las cuales, se interrumpe la conducción por el xilema y ocurre la defoliación y muerte. El manejo cultural realizado para el control de la plaga consiste en el descortezado del sector afectado, la extracción de las larvas y el cubrimiento de las heridas con una pasta cicatrizante (Rubio et al., 2009).
La cadena productiva del aguacate se afecta directamente por estos insectos que disminuyen de manera considerable la producción, por ello es indispensable enfocar los esfuerzos en el conocimiento biológico de las especies involucradas y así mismo orientarlos en un manejo más eficiente. El valor de esta fruta tropical cada vez toma más impulso e importancia en la economía nacional; con 73.986 has sembradas y una producción de 403.184 ton que ubican a Colombia como el cuarto país productor y el tercero en términos de área cosechada que corresponde al 6% de participación mundial (Ministerio de Agricultura y Desarrollo Rural, Septiembre 2018). Estas cifras evidencian el enorme potencial para los 21 departamentos productores entre estos, el auge del cultivo en Antioquia y el eje cafetero, pero especialmente en el departamento del Tolima, liderando las estadísticas con una participación del 19% del total nacional (Red de Información y Comunicación del Sector Agropecuario del Ministerio de Agricultura y Desarrollo Rural de Colombia-Agronet, 2017).
Aunque originalmente se aportaron fotografías y descripciones sobre los estados de desarrollo de H. elegans (Rubio et al., 2009), en este documento se detalla con mayor claridad la morfología de la larva madura, la pupa y el adulto de H. elegans. Por lo mismo, el objetivo de este artículo se fundamenta en la descripción de tres estados biológicos de la especie lo cual constituye un avance para el conocimiento general del grupo y una referencia para Colombia y otras latitudes, contando con esto, se estarían orientando estrategias más adecuadas para su manejo.
Materiales y Métodos
Las muestras de los diferentes estados de desarrollo de H. elegans se recolectaron entre marzo y junio de 2015 en cinco veredas de diferentes municipios de los departamentos de Tolima, Risaralda y Caldas (Tabla 1). En cada vereda visitada se muestrearon 30 árboles en etapa productiva, se revisaron secciones del tallo donde se visualizaron perforaciones y exudados. Con ayuda de la hoja de una navaja, se realizaron cortes laterales en la dirección de la galería con el fin de buscar y extraer larvas de diferentes estadios y pupas del insecto. Adicionalmente, se revisaron grietas y agujeros de la corteza, donde se localizaron grupos de adultos.
Gran parte del material recolectado se almacenó en bolsas plásticas de polietileno (tipo ziploc), rotulado con los siguientes datos: localidad, zona de vida, fecha, planta hospedante, estructura de la planta hospedante y nombre del colector. Otra parte del material como larvas y pupas vivas contenidas en cortes de ramas afectadas, se almacenó en cajas compactas de poliestireno (ICOPOR) adecuadas previamente con restos vegetales y suelo. El conjunto se transportó al Laboratorio de Entomología de la Universidad de Caldas LEUC, donde el material se separó y clasificó para preservarlo en una pecera de cristal. Diariamente las ramas dentro de la pecera se monitorearon para asegurar la humedad y la temperatura hasta que las larvas y las pupas culminaron su etapa de desarrollo. Finalmente, 21 ejemplares que llegaron a la fase adulta se compararon con las muestras originales e igualmente con ejemplares catalogados anteriormente para la Colección LEUC que se obtuvieron a partir de una investigación llevada a cabo en el año 2009 (Rubio et al., 2009) en la misma zona de vida.
Para la descripción morfológica se revisaron 17 adultos, diez larvas y ocho pupas colectados en los municipios de Fresno (departamento del Tolima), Santa Rosa de Cabal (departamento de Risaralda), Manzanares y Palestina (departamento de Caldas).
Las fotografías en plano lateral y ventral se tomaron con una cámara fotográfica SONY® Alfa 350, lente de 55-80 mm. Las diferentes estructuras morfológicas de la larva, pupa y adulto de la especie estudiada se dibujaron con la ayuda de un estereomicroscopio NIKON® SMZ 1000 al cual se le adaptó una cámara de luz fría y tubo de dibujo (cámara lúcida). Las ilustraciones se aumentaron a un rango de escalas entre 0.1 X hasta 6.3X (entre 10 y 63 aumentos). Los dibujos resultantes fueron trazados inicialmente a mano alzada en papel bond de 70 g, y entintados sobre papel pergamino de 150 g, donde se elaboraron las respectivas planchas.
Por otro lado, una muestra de cinco larvas maduras de H. elegans se llevó al laboratorio de microscopía electrónica de la Universidad de Caldas. Previamente las muestras se fijaron, se prepararon en las respectivas placas y se fotografiaron en un microscopio electrónico de barrido ambiental ESEM, 200 FEI-QUANTA®. Se obtuvieron imágenes de los espiráculos torácicos y abdominales, las mandíbulas y la epifaringe. Finalmente, las fotografías se procesaron en lenguaje Word (Microsoft Office 2010®).
Los términos morfológicos utilizados en las descripciones de los adultos se basan en trabajos originales de Costa-Lima (1956); Craw (1999); Sousa et al. (2004); Marvaldi & Lanteri (2005); Vallejo et al. (2007) y Vanin & Gaiger (2005). Igualmente, los términos morfológicos utilizados en las descripciones de la larva madura y de la pupa se basan en trabajos originales de May (1993); Marvaldi (2003); Peterson (1951); Pierce (1939); García (1962) y Vallejo et al. (2007).
Resultados
Morfología externa de Heilipus elegans Guérin
Adulto macho. (Figs. 1 a 5). Longitud del cuerpo tomada desde la margen anterior del protórax hasta el ápice de los élitros 14,93 ± 0,54 mm, (n=17; rango 14,12 - 14,86 mm); color negro brillante. Sobre el dorso y en los bordes del pronoto y de los élitros se observan manchas amarillas con márgenes un poco más claras, casi blancas. Élitros negros, exhiben estrías longitudinales originadas por pequeñas perforaciones dispuestas en secuencia regular, en el interior de estas se proyectan desde la base una o dos setas diminutas.
Cabeza: (Figs. 1A-2A). Pequeña en comparación con el resto del cuerpo, se destacan los ojos compuestos, obscuros, ocupan la mayor parte de ésta y sobresalen del contorno del rostro; demarcados por la base del pico lo cual les da un aspecto característico recurvado. Pico fuerte, largo y curvo especialmente en su margen interna, base amplia, cubierta de setas pequeñas, exhibe poros amplios, notorios, con setas diminutas en el interior. El escrobo antenal forma una ranura que se extiende un poco más allá de la mitad basal del rostro.
Antenas: (Fig. 2C). De once artejos, típicamente geniculadas, se proyectan desde un poco más allá de la mitad basal del pico. Escapo (segmento I), cilíndrico, alargado, liso, angosto en la base, amplio en la zona distal. Funículo (segmentos II-VIII) con los artejos II y III un poco más largos y amplios que los cinco restantes; se destacan tres a cinco setas largas en el extremo distal; los artejos IV-VIII de longitud y forma casi idéntica, presentan en su sección media entre dos a cuatro setas largas. Clava (segmentos IX, X y XI) amplia, más larga que ancha, segmentos IX y X el doble de largos que el segmento XI, que remata en punta un tanto aguda, de tres segmentos, con unas cuantas setas largas y abundantes setas pequeñas distribuidas de manera uniforme.
Mandíbulas: (Fig. 2C). Fuertemente esclerosadas, muy pequeñas, recurvadas, negras, con cóndilo basal que permite la inserción en el extremo del pico, en la sección molar se aprecia una muela pequeña; la pieza remata con dos incisivos puntiagudos en el extremo apical.
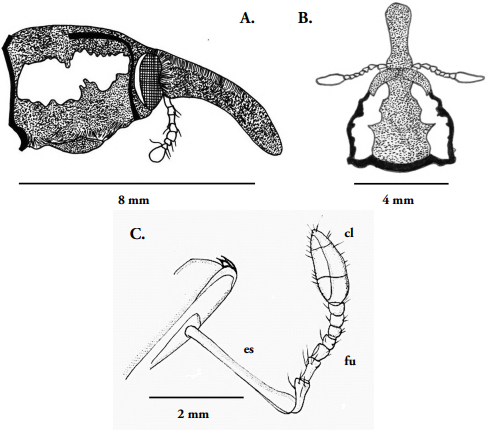
Figura 2 Heilipus elegans, adulto macho: A. Cabeza y pronoto, vista lateral; B. Cabeza y pronoto, vista dorsal; C. Antena; es = escapo; fu = funículo; cl = clava.
Tórax: Pronoto (Fig. 4C) más ancho que largo, sinuoso en la base, margen anterior convexa, exhibe un par de manchas simétricas a cada lado, constituidas por escamas diminutas, alargadas, de color amarillo, el acercamiento permite ver los bordes más claros. Prosterno (Fig. 3A) con bordes ondulados (bilobulado), cóncavo en la margen anterior y sinuoso en la base, muestra numerosas setas bien distribuidas en toda su extensión, coxas más amplias que las restantes meso y metatorácicas, ovaladas, abiertas en “V”; Meso-metatórax (Fig. 2C) presentan abundantes setas distribuidas uniformemente. Coxas anteriores (Figs. 1A, 2B, 3B) amplias-ovaladas; medias, alargadas-estrechas y posteriores (Fig. 3B), transversalmente ovaladas y más grandes que las coxas anteriores y medias. Propata (Fig. 3C) con trocánter pequeño y triangular en la base; fémur robusto, más amplio en el centro, un poco más angosto en la sección posterior, presenta un diente fuerte en su margen interna muy característico; tibia delgada, redondeada, excede la longitud del fémur, presenta poros en su superficie y el uncus tibial cerca de la inserción del tarso; tarso (Figs. 3D-E) con cinco tarsómeros, el tarsómero basal (I) es más corto que el tarsómero II, el III es bilobulado, el IV es redondeado, diminuto, normalmente queda oculto entre el tarsómero III, el tarsómero V es alargado y porta las dos uñas largas, curvas y afiladas. Élitros (Figs. 1A, 4B) rectos en vista dorsal, cubren desde el mesotórax hasta el último segmento abdominal mismo que enmarcan en un aspecto convexo, a cada lado presentan tres manchas amplias, asimétricas, una grande, se alarga desde la base hasta más allá del tercio distal, una intermedia, ancha que ocupa desde la margen hasta el centro y una relativamente pequeña hacia el final del abdomen, están constituidas por diminutas escamas, alargadas, de color amarillo claro, igualmente se diferencian diez estrías en cada uno de ellos marcadas por poros diminutos en secuencia longitudinal. Alas posteriores (Fig. 4D) amplias, membranosas, transparentes, cuatro veces más largas que anchas, terminan en punta. La venación es reducida debido a que no son buenos voladores, se observan las venas costal, subcostal, radial, medial, cubital y anal.
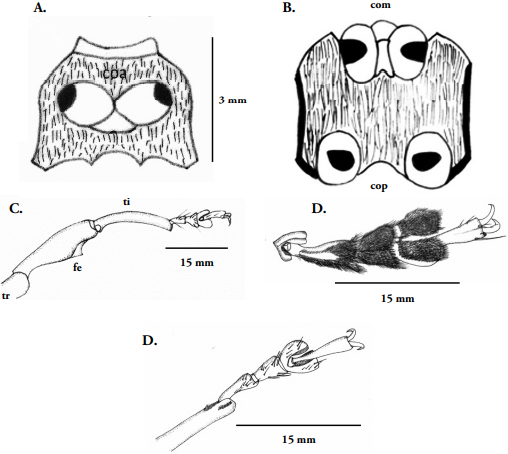
Figura 3 Heilipus elegans, adulto macho: A. Prosterno; B. Meso y metasterno. C. Propata derecha; D. Tarso, vista ventral; D. Tarso, vista dorsal. co= coxa; cocoa= coxa anterior; com= coxa media; cop= coxa posterior; fe= fémur; ti= tibia; tr= trocánter.
Abdomen: Ventralmente muestra cinco esternitos bien diferenciados (Figs. 1B, 4A), margen anterior sinuosa, presenta abundantes setas distribuidas uniformemente. Los esternitos I y II son más grandes con respecto a los demás, tan anchos como los esternitos III y IV fusionados, en ellos se observan setas en toda la superficie; esternitos III y IV de longitud menor. La margen basal de los esternitos III, IV y V está claramente diferenciada por una secuencia de setas cortas, finas y dejan un área desnuda en el centro. Esternito V de forma cónica. Dorsalmente se observan seis tergitos (Fig. 4A), el tergito VI se une con el esternito V con aspecto curvo en vista lateral; el tergito IV presenta una sutura longitudinal, que remata en una punta aguda y divide la pieza en dos, tergito V convexo en la margen posterior; apicalmente bilobulado. Edeago (Fig. 5D, E, F) muy esclerosado, de color marrón oscuro, de 2.5 mm de longitud y ancho de 0.7 mm máximo. Forma alargada, estilizada, fuertemente recurvado en vista lateral, exhibe una profunda concavidad en su cara interna, extremo distal triangular, algo romo. Saco interno membranoso, corto; apodemas alargados, más amplios en el extremo, de aproximadamente 2.5 mm de longitud. Tegmen (Fig. 5G), con parámeros que miden 1.1 mm y manubrio de 0.47 mm de largo, ápice corto, amplio, truncado y anillo relativamente estrecho, más largo que ancho. Espícula gastrale (Fig. 5H), de 3.2 mm de longitud, 0.3 mm de ancho, estrecha, más larga que el cuerpo del edeago, aspecto de ancla con la base bifurcada y zona distal con punta lanceolada.
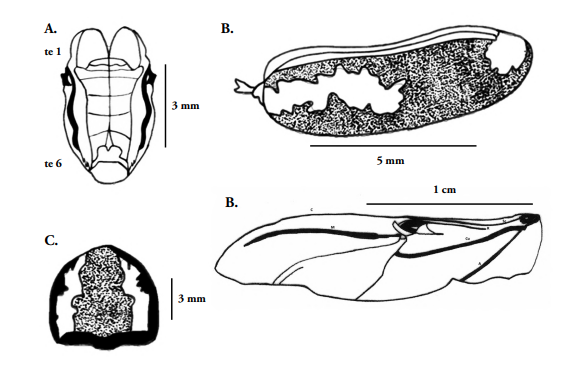
Figura 4 Heilipus elegans, adulto macho: A. Abdomen, vista dorsal; B. Élitro; C. Pronoto; D. Ala membranosa. teI= tergo abdominal I; te6= tergo abdominal VI; C=vena costal; Sc=vena subcostal; R=vena radial; M=vena medial; Cu=vena cubital; A=vena anal.
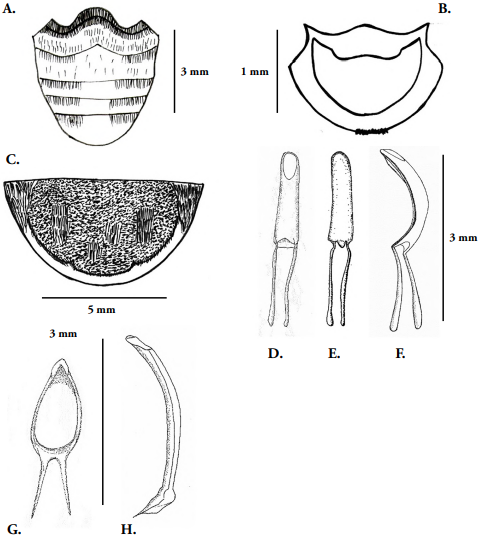
Figura 5 Heilipus elegans, adulto macho: A. Abdomen, vista ventral; B. Tergito VI; C. Esternito V; D. Edeago, vista dorsal; E. Edeago, vista ventral; F. Edeago vista lateral; G. Tegmen; H. Espícula gastrale.
Dimorfismo Sexual. En términos generales no existen diferencias morfológicas significativas entre los dos sexos, salvo por las siguientes características: la hembra es un poco más grande que el macho, las antenas del macho (Figs. 1A-B, 2C) son un poco más pronunciadas que las de la hembra, especialmente en la clava que es un poco más amplia. La forma del extremo abdominal mostrado en el tergito VI (Fig. 4A), es un poco más curvo que en la hembra. No se notan diferencias predominantes entre las patas de ambos sexos.
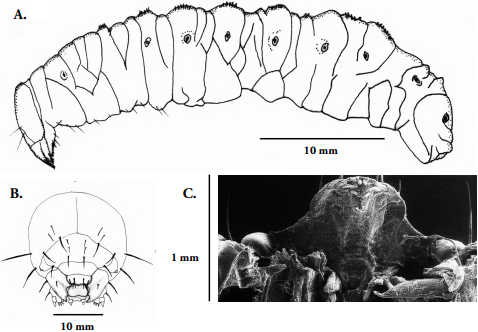
Larva madura. (Fig. 6A). Ápoda eucéfala, longitud promedio 22 mm ± 2mm (rango; n=10). De color blanco marfil. Alargada, estrecha, cilíndrica no recurvada, sin ensanchamientos. El cuerpo presenta setas cortas y escasas de color marrón oscuro que se aclaran en el ápice. Tórax y abdomen provistos de pliegues y microespinas en el dorso, probablemente para facilitar el movimiento en el interior de las galerías (Rubio et al., 2009); igualmente, exhibe nueve pares de espiráculos bicamerales: uno ubicado en el protórax y los demás en los ocho primeros segmentos abdominales, lo cual es un carácter representativo de la familia Curculionidae (Stehr, 1991).
Cápsula cefálica: (Fig. 6B) Tipo ortognata-hipognata, ovalada, fuertemente esclerosada, superficie lisa, de color marrón oscuro, amplitud de 3.1 ± 0.2 mm y 3.5 ± 0.3 mm de largo; suturas frontal y epicraneal presentes, forman una “Y” invertida, sus extremos basales coinciden con la base de las antenas. Frente amplia, triangular; en general la cápsula cefálica presenta dos pares de setas pequeñas ubicadas a la misma altura y en posición lateral (izquierda, derecha) de la región occipital, en el mismo sentido dos pares de setas más destacadas sobre el borde superior de las suturas frontal y craneal, pero igualmente en el espacio occipital; la frente muestra tres pares de setas distribuidas de manera equidistante, un par superior, un par medio y un par inferior.
Antenas: (Fig. 6B) Reducidas, de un solo segmento (característico de la familia), situadas cerca del borde ventral entre las articulaciones mandibulares. Tienen un proceso cónico sensorial en el ápice acompañado de dos sensilas diminutas.
Aparato bucal: clípeo (Fig. 6B) de forma trapezoidal, superficie glabra, brillante, no presenta sedas ni modificaciones cuticulares. Labro (Fig. 6B), suspendido directamente del clípeo a través de la sutura clípeo labral; de forma semi-ovalada, horizontalmente exhibe dos hileras de sedas, la superior constituida por dos setas largas en posición central, la segunda hilera por cuatro setas cortas que se distribuyen desde el centro hacia los extremos. El borde distal describe un pequeño lóbulo característico, los bordes laterales quedan demarcados por las caras internas de las mandíbulas. La cara ventral del labro o epifaringe (Fig. 6C), es igualmente semi-ovalada, simétrica, sinuosa y esclerosada. Desde la base de la pieza, dos procesos columnares se proyectan hacia los ángulos laterales, estos corresponden a las tormas; el espacio entre las tormas está demarcado primero por un grupo de cinco dientes pequeños y gruesos ubicados en el lóbulo superior. Seguidamente, las porciones laterales exhiben cada una, cuatro colmillos largos que demarcan una sección cóncava central que se invagina hasta la base de la estructura. Mandíbulas (Figs. 7A-B), de forma asimétrica, subtriangular, cóncavas; de color marrón en el centro, más oscuras en los bordes, fuertemente esclerosadas. La zona basal presenta tres muelas, la primera y la tercera bien definidas, la central un poco más pequeña; la zona distal incisiva exhibe tres dientes, el primero muy afilado, los siguientes con bordes afilados. Un cóndilo basal y amplio facilita la articulación con el cráneo. Maxilas (Fig. 7C), cardo, estípite, mala (gálea y lacinia fusionadas) y palpos maxilares presentes. El cardo es alargado, semi-rectangular, más largo que ancho. El estípite permite ver tres setas largas y amplias: la primera en la margen basal, la segunda muy larga y la tercera un tanto más corta pero igualmente amplia, ubicada en la sección distal desde la cual se proyecta el palpo maxilar, que en este caso es de dos segmentos; gálea (cara externa) más amplia que la lacinia, poco esclerosada; lacinia (cara interna) esclerosada, la sección distal con varias hileras de ocho a nueve pequeños colmillos amplios y afilados. Labio (Fig. 7C), pequeño en contraste con las demás piezas bucales; con cuatro colmillos pequeños pero amplios en su zona distal; los palpos labiales constituidos por dos segmentos. La hipofaringe de forma irregular, cóncava, relativamente esclerosada y característicamente glabra.
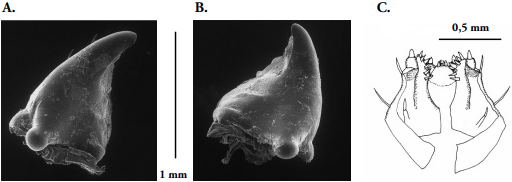
Figura 7 Heilipus elegans, larva madura. A. Mandíbula izquierda, vista dorsal; B. Mandíbula derecha, vista dorsal; C. Maxilas, labio-hipofaringe.
Tórax. Espiráculos protorácicos (Fig. 8A) con las siguientes dimensiones 0.33 ± 0.1 mm de ancho y 0.24±0.05 mm de largo (medidas tomadas a un aumento de 596X); espiráculos ausentes en el meso y metatórax. Protórax con un par de setas dorso-laterales largas, dos pares de setas pleurales largas y dos pares de setas ventro-laterales cortas. Meso y metatórax similares en longitud, mesotórax con dos pares de setas dorso-laterales, una larga y una corta, un par de setas ventro-laterales largas y un par de setas pleurales largas; metatórax con tres pares de setas dorso-laterales largas y un par de setas pleurales cortas. Secuencias de espinas diminutas esclerosadas, de color marrón oscuro, dispuestas en hileras longitudinales que abarcan la sección dorsal y ventral de los segmentos torácicos y abdominales.
Abdomen: Diez segmentos (Fig. 6A); segmentos I al VIII con hasta cuatro pliegues dorsales y un par de setas dorso-laterales largas y finas. Segmentos IX y X muy pequeños con respecto a los demás, de textura lisa, setas ventrales y pleurales escasas y diminutas; segmento X con cuatro lóbulos anales. En vista lateral, los segmentos I al VIII permiten ver los plegamientos dorsales y ventrales. En la región pleural se extiende una membrana que permite la inserción de los espiráculos, los cuales se caracterizan por la diferencia del tamaño y por su color marrón claro. Espiráculos abdominales (Fig. 8B) con dimensiones promedio de 0.34 ±0.1 mm de ancho y 0.29 ± 0.05 mm de largo (medidas tomadas a un aumento de 652X). En los espiráculos de los segmentos abdominales I-VII (Figs. 8B-E) se aprecia fácilmente el peritrema con una consistencia rugosa y la válvula en forma de “Y”. Espiráculos I y V redondeados, proporcionalmente iguales en longitud: 0.3 mm de ancho por 0.3 mm de largo, espiráculos del segmento abdominal VII de mayor dimensión con respecto a los demás: 0.4 mm de ancho por 0.2 mm de largo, ovalado y alargado. Segmento VIII con espiráculos más pequeños y característicamente en posición dorsal.
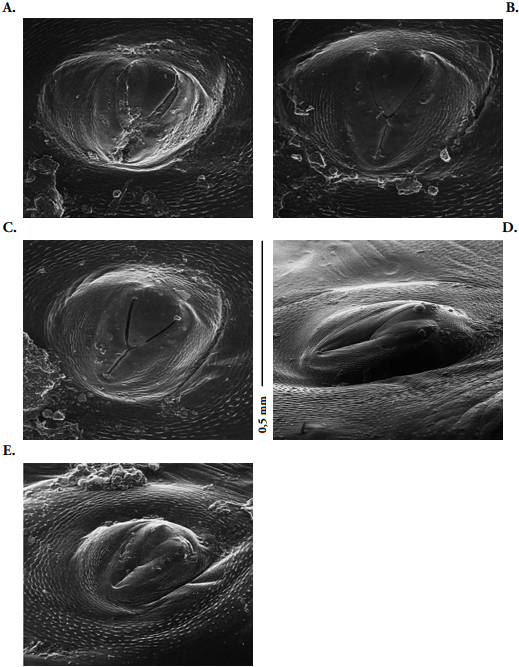
Figura 8 Heilipus elegans, larva madura: A. Espiráculo protorácico; B. Espiráculo abdominal I; C. Espiráculo abdominal III; D. Espiráculo abdominal VII, E. Espiráculo abdominal VIII.
Pupa. (Fig. 9) Longitud promedio 14 ± 0.8 mm (Rango; n=8), de color blanco marfil, tipo exarada, adéctica, forma ovalada alargada, superficie glabra. Se reconoce fácilmente el rostro, aparato bucal, pterotecas y, patas.
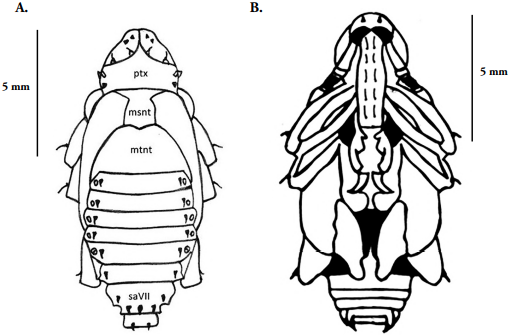
Figura 9 Heilipus elegans, Pupa: A. Vista dorsal; B. Vista ventral. msnt= mesonoto; mtnt= metanoto; ptx= protórax; saVII= segmento abdominal VII.
Cápsula cefálica: en posición ventral cubriendo el protórax; tanto el pico como las antenas se diferencian fácilmente. Antenas de once segmentos, el escapo (segmento I) alargado, ensanchado en la zona distal donde se une con el pedicelo (segmento II). Funículo (segmentos II-VIII) de forma y dimensiones más o menos iguales. Clava formada por los segmentos IX, X y XI, amplia en el centro y estrecha en la región superior; en la parte anterior del pico se observa un par de tubérculos setíferos iguales y simétricos a cada lado y hay cinco pares de setas largas dispuestas en longitudinalmente.
Tórax. Protórax ovalado, ancho, margen anterior del dorso cóncava, con dos pares de tubérculos setíferos alineados paralelamente e iguales en tamaño. Meso y metanoto glabros, diferentes en longitud, el metanoto es de mayor tamaño, trapezoidal, con la margen anterior bilobulada, la margen anterior del mesonoto recta, hacia los lados se perciben las pterotecas. En vista ventral se diferencian las tecas alares y elitrales, los tres pares de patas muestran un tubérculo setífero en el fémur. Coxas ovaladas, glabras; fémur robusto, amplio en el centro; tibia delgada, de longitud aproximada a la del fémur, revelan numerosas setas distribuidas uniformemente, se observa una espuela tibial en la inserción con los tarsos; tarso con cinco tarsómeros, aunque aparenta cuatro difíciles de apreciar, tarsómero basal más pequeño que los restantes, tarsómeros II y III bilobulados.
Abdomen: En vista dorsal se observan ocho segmentos, los segmentos I al VI son casi iguales en tamaño, el segmento VII tiene aproximadamente el doble de tamaño en relación con los otros segmentos, el segmento VIII es el de menor tamaño. Los segmentos VI y VIII cuentan con un par de tubérculos setíferos laterodorsales cortos, el segmento VII presenta un par de tubérculos setíferos anterodorsales y tres tubérculos setíferos seguidos hacia la región posterior. Segmentos I al V con un par de espiráculos laterales. En vista dorsal, se aprecian ocho segmentos completamente glabros.
Discusión
Se puede considerar que el patrón morfológico del adulto de Heilipus elegans comparte semejanzas con el de otras especies del mismo género, como H. lauri (García, 1962; Castañeda 2008; Díaz-Grisales et al., 2020), H. odoratus (Vanin & Gaiger 2005) y H. trifasciatus (Santos-Murgas et al. 2014), no obstante la franja de color amarillo que H. elegans presenta en sus élitros (Fig. 1A), puede variar entre las poblaciones, se pudo constatar que esta franja puede estar constituida por una macha grande e incluso dos muy cercanas en posición basal para extenderse hasta el final del abdomen con otras dos, todas con bordes claros e irregulares, formadas por escamas cortas, gruesas y de forma ovalada; igualmente poros notorios dispuestos en líneas longitudinales y en secuencia regular marcados por las estrías características, pico largo y curvo.
En la descripción de H. elegans de Guérin (1844), coincidimos en los siguientes aspectos: “longitud 14 a 17 mm, manchas del pronoto amarillas con bordes más claros, casi blancos”, pero difiere con nosotros cuando menciona “color rojizo del cuerpo, inserción de las antenas cerca de la mitad del rostrum”; en este caso, consideramos color negro brillante para el cuerpo del insecto que contrasta con el color de las escamas, las estrías elitrales y la inserción de las antenas un poco más allá de la mitad basal del pico.
Por otro lado, la literatura registra muy poca información sobre la larva y la pupa, en Colombia Rubio et al. (2009) destacan aspectos que relacionan el daño y la biología de esta especie, pero presentan de manera sucinta los aspectos para validar la morfología de la larva y la pupa, en este sentido este documento ofrece información más amplia al presentar ilustraciones a escala, microscopia electrónica y análisis más detallado de las piezas morfológicas clave para avanzar en el conocimiento del grupo en especial para las poblaciones de Colombia.
Castañeda-Vildózola et al. (2007) reconocen a Persea schiedeana, árbol silvestre de la familia Lauraceae con fruto muy parecido al aguacate, como nuevo hospedero de Heilipus lauri. En Colombia, Heilipus lauri es considerada la plaga predominante en aguacate, su presencia ha sido registrada en Antioquia, Caldas, Cauca, Quindío, Risaralda, Tolima, Santander y Valle del Cauca (Urueta 1976; Vergara & Varela 1980; Núñez 1983; Cárdenas 1984c; García et al., 1983; Diaz-Grisales et al., 2017), este ataca generalmente los frutos y en ocasiones las ramas. H. elegans se ha encontrado en mayor proporción en los municipios de Fresno y Santa Rosa de Cabal, departamentos de Tolima y Risaralda respectivamente, atacando el tallo de árboles de aguacate. Según Rubio et al. (2009), la mayoría de las variedades cultivadas (Lorena, Choquette, Santana, Booth 8, Trinidad) presentaron daños severos, mostrando síntomas de defoliación y marchitez; el daño causado por el insecto se evidencia por exudaciones en la base del árbol y coloraciones rojizas en el orificio de entrada de las galerías, este “anilla” el árbol, causando el deterioro de la corteza y por ende la muerte del mismo.
Aunque este documento se basa fundamentalmente en el análisis morfológico de H. elegans, no se puede pasar por alto su importancia agroecológica, nos parece muy importante abordar aspectos transversales a la biología del grupo, esto es darle cabida a la genética y la bioquímica, ir cada vez más al campo para analizar los ciclos de vida, fenología y el comportamiento; esperamos que la investigación científica alcance el valor social y económico esperado para el desarrollo de la agricultura.