Introducción
La inflamación de bajo grado es una condición subyacente a algunas enfermedades crónicas no transmisibles, como la obesidad y el síndrome metabólico, las cuales por su amplia distribución en la población se han convertido en un problema mundial de salud pública (Rani et al., 2016). Dicha relación entre la obesidad y la inflamación encuentran su punto de unión en la función endocrina del tejido adiposo, el cual tiene la capacidad de producir adipocinas que juegan un rol importante los procesos metabólicos en el animal y en el control del apetito, la regulación de la glucosa, la resistencia a la insulina y la inflamación (Faam et al., 2014).
A medida que los individuos acumulan grasa, el tejido adiposo aumenta de tamaño y es infiltrado por macrófagos que adquieren un estadio de activación conocido como M1 o “forma clásica de activación”; en este estadio, los macrófagos activados secretan citocinas proinflamatorias entre las cuales se destaca la interleucina 6 (IL-6) y el factor de necrosis tumoral alfa (TNF-α). Las citocinas proinflamatorias secretadas en el tejido adiposo mantienen en el tiempo el cuadro de inflamación dando origen a una inflamación crónica de bajo grado (Esser et al., 2014).
La inflamación crónica de bajo grado asociada a la obesidad caracterizada por la elevación de niveles circulantes de citocinas de tipo pro inflamatorias, presenta un papel importante en el desarrollo y progresión de enfermedades crónicas no infecciosas, como desordenes cardiometabólicos (Kim & Choi, 2020) y la diabetes donde se ha encontrado que la citocina pro inflamatoria que se encuentra aumentada en individuos obesos TNF-α es capaz de inducir resistencia a la insulina al inactivar el sustrato del receptor de insulina 1 (IRS-1) (Zatterale et al., 2020).
Al considerar la importancia de las enfermedades inflamatorias crónicas no trasmisibles en la salud pública mundial, se ha venido estudiando el uso de compuestos fenólicos y polifenólicos en los extractos de algunos vegetales que pueden ayudar a prevenir los efectos negativos sobre la salud de los individuos (Zhang & Tsao, 2016). Polifenoles de importancia como los flavonoides, las antocianinas y los taninos se han encontrado en frutas del género Passiflora como es el caso de la granadilla (Passiflora ligularis), que debido a su abundancia en países andinos como Colombia (DANE, 2016), puede ser una fuente potencial de polifenoles, para ser utilizados en beneficio de la salud animal y humana (Chaparro et al., 2015; Sabogal-Palma et al., 2016; Torres, 2012). En este contexto, el presente trabajo tuvo como objetivo evaluar el efecto de la suplementación con extracto de Passiflora ligularis, sobre algunos marcadores de inflamación crónica de bajo grado asociados al sobrepeso en un modelo de ratones albinos alimentados con dieta alta en grasa.
Materiales y métodos
El bioensayo fue realizado en el Bioterio de la Universidad de Caldas, ubicado en el municipio de Manizales (Colombia), a una altitud de 2100 msnm. Las condiciones ambientales se mantuvieron estables entre 18° y 25° grados centígrados de temperatura y 50% de humedad relativa ambiental, los animales contaron con 12 horas de luz al día. Todos los procedimientos se avalaron por el Comité de Ética para la Experimentación con Animales de la Facultad de Ciencias Agropecuarias de la Universidad de Caldas.
Para la obtención del extracto de Passiflora ligularis, la pulpa y la semilla de la fruta fueron homogenizados en una licuadora comercial marca Oster® Xpert Series™, a continuación, se utilizó como solvente una solución de acetona al 70%, preparándose en proporciones iguales de fruta y solvente. Para esto, la mezcla fue puesta en un agitador Dragon Lab MS-H Pro® durante 20 minutos a 500 rpm, para posteriormente realizar una sonicación por 15 minutos en un baño de ultrasonido Branson® serie MH™, mod 3800. A continuación, la mezcla de fruta y solvente se centrifugó a 3500 rpm durante 15 minutos en una centrífuga Hermle® Z 206 A. Por último, el solvente se eliminó en un rotaevaporador Scilogex® RE 100 pro, y el extracto resultante, se deshidrató a 50°C durante 96 horas en un horno Inducell® LSIS-S (Torres, 2012; Zapata et al., 2013).
Al inicio del período experimental, que tuvo una duración de 49 días, 36 ratones albinos (Mus musculus) hembras con edad superior a los 120 días y un peso inicial promedio de 27,25 ± 2,20g, fueron homogenizados respecto a su peso y se distribuyeron en un diseño experimental irrestrictamente al azar (DIA) conformado por 3 tratamientos y 12 repeticiones para cada uno, siendo cada individuo una unidad experimental (n = 12). Los tratamientos consistieron en un grupo control (CD), en el que los animales recibieron alimento balanceado para satisfacer los requerimientos de mantenimiento (Tabla 1). El segundo tratamiento (HFD) consistió en una dieta alta en grasa (45% de kcal provenientes de grasa) (Hariri & Thibault, 2010). El tercer tratamiento consistió en el suministro de dieta alta en grasa acompañada de la suplementación de 3 g/L de extracto de Passiflora ligularis en el agua de bebida (HFDP).
Tabla 1 Composición nutricional de las dietas experimentales (%).
| Nutriente | CD | HFD |
|---|---|---|
| Proteína cruda | 20 | 20 |
| Grasa | 10 | 23 |
| Carbohidratos | 45 | 32 |
| Fibra cruda | 5 | 5 |
| Cenizas | 10 | 10 |
(CD) Dieta Control, (HFD) dieta alta en grasa.
Semanalmente, se midieron el peso vivo y el consumo de agua y alimento, utilizando una balanza digital con precisión de 0,01g, el consumo de alimento fue representado como la media de kilocalorías consumidas por animal al día. Finalizado el período experimental los animales fueron eutanasiados siguiendo las recomendaciones para el cuidado y uso de animales de laboratorio de la National Research Council (2010). Para este procedimiento los animales se marcaron con líneas horizontales en la base de la cola con tinta de alcohol de diferente color para cada tratamiento. Posteriormente, cada animal fue insensibilizado con CO2, para realizar la toma de muestras y eutanasia por sangrado mediante un corte en la vena yugular.
Se tomaron muestras de sangre en tubos vacutainer tapa roja para determinar la concentración de IL-6 y TNF-α en el suero de los animales. Para esto se recolectaron dos mililitros de sangre de cada unidad experimental; seguidamente, se obtuvo el suero utilizando una centrifuga marca Hettich® EBA 200 a 4500 revoluciones por minuto, durante cinco minutos. La determinación de la concentración de IL-6 y TNF-α se realizó por medio de la técnica de ensayo por inmunoabsorción ligado a enzimas (ELISA), para lo cual, se utilizaron los kits LEGEND MAXmt MOUSE IL-6 y MOUSE TNF-α de la marca Biolegend®, según las indicaciones del fabricante. Finalmente se realizó la lectura de las placas del kit de ELISA para cada una de las citocinas en un lector Multiskan™ de la marca Thermo Fisher®.
Análisis estadístico
Los datos se expresaron como la media ± la desviación estándar. Para la comparación de medias de cada variable (ganancia de peso, consumo de agua, consumo de alimento y concentración sérica de citosinas) se utilizó la prueba de ANOVA (p≤ 0,05), y en aquellas variables en las que se encontró diferencia estadística significativa, se utilizó la prueba de Duncan. Todos los procedimientos estadísticos fueron realizados utilizando el programa estadístico licenciado STATA 12®.
Resultados
Comportamiento alimenticio y peso corporal
Respecto a los resultados de la variable ganancia de peso se observaron diferencias significativas, donde los tratamientos HFD y HFDP tuvieron una ganancia de peso superior al grupo CD, no obstante, la suplementación con extracto de Passiflora ligularis (HFDP) produjo una disminución significativa (p<0,05) del 55,5% en la ganancia de peso final en comparación al grupo de animales que consumió la dieta alta en grasa sin suplementación (HFD). Respecto a las variables de consumo de alimento y consumo de agua, no se observó efecto estadísticamente significativo (p>0,05) entre los tratamientos (Tabla 2).
Tabla 2 Efecto del extracto de Passiflora ligularis sobre el comportamiento alimenticio y peso corporal en ratones albinos.
| Tratamiento | Ganancia de peso (g) | Consumo de agua (mL/animal/día) | Consumo Alimento (Kcal/animal/día) |
|---|---|---|---|
| CD | 0,16 ± 0,57 a | 7,18 ± 1,17 | 23,02 ± 3,11 |
| HFD | 2,90 ± 0,70 c | 8,30 ± 1,21 | 24,67 ± 3,72 |
| HFDP | 1,33 ± 0,81 b | 7,84 ± 0,80 | 24,3 ± 4,24 |
| SEM | 0,24 | 0,17 | 0,79 |
| P Valor | 0,000 | 0,281 | 0,728 |
Letras a, b y c para diferencia significativa entre tratamientos determinador ANOVA y prueba de Duncan. (CD) Dieta Control, (HFD) Dieta Alta en grasa, (HFDP) Dieta Alta en grasa con extracto de P. Ligularis, (SEM) Error estándar de la media.
Citocinas proinflamatorias
Los grupos de animales que recibieron dieta alta en grasa (HFD) sin suplementación de extracto presentaron niveles superiores (p< 0,05) de TNF-α sérica en comparación con los animales que recibieron la dieta control (CD). Los ratones pertenecientes al tratamiento HFDP que recibieron el extracto de Passiflora ligularis no evidenciaron diferencias significativas con ninguno de los dos controles. La reducción en la concentración sérica de TNF-α en los animales HFDP fue del 50% en relación con el grupo HFD, reducción que no fue suficiente como para presentar diferencia significativa entre los tratamientos. Respecto a los niveles séricos de IL-6, no se obtuvieron diferencias entre ninguno de los tratamientos (Figura 1).
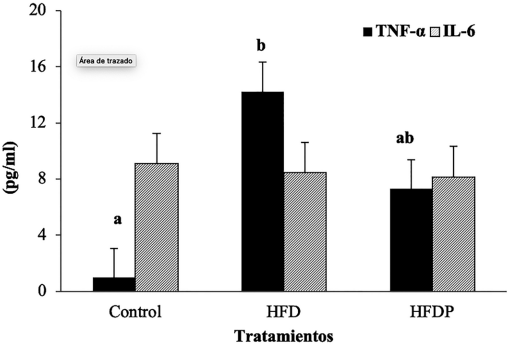
Letras a y b para diferencia significativa entre tratamientos determinados por prueba de ANOVA y prueba de Duncan.
Figura 1 Concentración (pg/ml) sérica de citocinas proinflamatorias IL-6 y TNF-α en ratones albinos. (HFD) dieta alta en grasa (HFDP) Dieta alta en grasa con suplementación de extracto de Passiflora ligularis.
Discusión
El compuesto utilizado en el presente estudio fue un extracto etanólico 70% de la Pasiflora ligularis descrito previamente por nuestro laboratorio (Carmona-Hernández et al., 2019), donde los compuestos fenólicos predominantes fueron el ácido ferúlico y catequinas del tipo: epigalocatequina, galato de epigalocatequina y (-) - epicatequina (Tabla 3).
Tabla 3 Concentraciones de fitoquímicos identificados en extractos de metanol al 70% de Passiflora ligularis (µg/mL).

LOQ: límite de cuantificación, basado en una curva de calibración que va desde 0,05 a 5,00 µg/mL.
Adaptado de: Carmona-Hernández et al. (2019).
Como compuesto predominante en el extracto utilizado en el presente estudio, el ácido ferúlico o ácido 4-hidroxi-3-metoxicinámico es un compuesto fenólico presente en los tejidos vegetales, por lo que constituye un ingrediente bioactivo de muchos alimentos (Zhao & Moghadasian, 2008). Este tipo de ácido fenólico se encuentra presente en los granos fibrosos, brebajes como el café y jugos naturales, las bayas como los arándanos y las frambuesas (Mattila et al., 2005), se ha encontrado además su presencia en muy diversos tipos de frutas como manzanas, naranjas, mandarina, bananas, peras, kiwi, melocotón y el pomelo, siendo especialmente elevado en los cítricos como la toronja, la naranja y la mandarina con concentraciones de 11,6, 9,4 y 9,2 mg/100g de fruta fresca respectivamente (Mattila et al., 2006).
Comportamiento alimenticio
Los resultados obtenidos en el presente experimento evidenciaron que la suplementación con el extracto de Passiflora ligularis durante siete semanas, disminuyó la ganancia de peso de los ratones, en comparación con los animales del tratamiento HFD. Al respecto, Pan et al. (2017) observaron resultados similares utilizando una mezcla de extractos de plantas a dosis de 5g/kg de alimento, durante 16 semanas, en ratones con dieta alta en grasa, donde los animales suplementados tuvieron una ganancia de peso inferior en 21% con relación al grupo alimentado con dieta alta en grasa sin suplementación.
En relación al ácido ferúlico como compuesto principal del extracto utilizado en el presente estudio, algunos estudios han reportado observaciones congruentes con nuestros resultados, como es el caso de Ibitoye et al. (2018), los cuales utilizaron diferentes tipos de ácidos fenólicos en ratas alimentadas con dieta alta en fructosa, hallándose que la administración de ácido cafeico, ácido ferúlico, ácido gálico y ácido protocatecuico durante cuatro semanas redujo significativamente el aumento de peso corporal, el índice de masa corporal y la circunferencia abdominal. Por su parte Wang et al. (2015) the ferulic acid (FA reportaron en un modelo de ratas alimentadas con dieta alta en grasa y fructosa, que la suplementación con ácido ferúlico atenuó la ganancia de masa corporal, además al igual que lo observado en el presente trabajo, la disminución de la ganancia de peso corporal no se acompañó de cambios en el consumo de energía de los animales.
El consumo de diferentes partes y componentes de las frutas del género Passiflora spp. se ha relacionado con la reducción de la hiperlipidemia y la modulación de lipídica en el organismo, encontrándose que el consumo continuo de Passiflora ligularis puede reducir significativamente los niveles de colesterol total, triglicéridos y lipoproteínas de baja densidad, y aumentar el nivel de colesterol en lipoproteínas de alta densidad en ratas Wistar diabéticas; por otra parte, también se ha relacionado el consumo con menor acumulación de tejido adiposo y aumento de adiponectina en estudios de obesidad inducida en ratas, acompañado de una menor ganancia de peso (He et al., 2020).
La relación entre el consumo de extractos vegetales ricos en compuesto fenólicos y polifenólicos con la disminución en la ganancia de peso corporal en los animales, ha sido motivo de investigación de diversos autores, los cuales han propuesto mecanismos fisiológicos que podrían explicar dicho efecto. Shishikura et al. (2006) y Sun et al. (2020), reportaron que los polifenoles tienen la capacidad de disminuir la absorción de carbohidratos y lípidos dietéticos a nivel intestinal, efecto corroborado, además, por otro estudio realizado en nuestro laboratorio donde el porcentaje de grasa en las heces de ratas albinas, fue superior en animales suplementados con extracto de Passiflora ligularis (datos sin publicar).
Por otra parte, existe evidencia de que los compuestos polifenólicos contenidos en algunos extractos vegetales pueden actuar sobre el metabolismo lipídico, por medio de la modulación de algunos genes relacionados con la maduración de los lípidos, impidiendo que se forme el tejido adiposo (Chen et al., 2009). Al respecto, Sae-Tan et al. (2011), sostienen que algunos polifenoles pueden intervenir en la expresión de los genes que promueven aumento en la oxidación lipídica. No obstante, los mecanismos subyacentes para estos cambios en la expresión génica no son claros, ya que podrían estar relacionados con la estimulación directa por parte de los polifenoles o ser efectos indirectos del organismo en el mantenimiento de la homeostasis energética como respuesta compensatoria a la reducción en la absorción intestinal de energía proveniente de las grasas por el efecto ya mencionado de los polifenoles (Lu et al., 2012; Sun et al., 2020; Shishikura et al., 2006).
Marcadores de inflamación
En el presente estudio, se observó una disminución del 50% de los niveles séricos de la citocina proinflamatoria TNF-α, por efecto de la suplementación con extracto de Passiflora ligularis en comparación con los animales que recibieron la dieta alta en grasa. Este resultado está en concordancia con lo reportado por Wang et al. (2009), quienes evidenciaron la disminución de TNF- α por efecto de un extracto rico en flavonoides, en un modelo murino similar al empleado en el presente estudio. Por su parte, Rivera et al. (2008), observaron que la suplementación del flavonoide quercetina por vía oral en ratas alimentadas con dieta alta en grasa, redujo el aumento de marcadores de estado proinflamatorio característico en este tipo de modelo de investigación. Este efecto se evidenció a través de la disminución de algunos marcadores donde se destaca la citocina proinflamatoria TNF-α, siendo consistente con lo encontrado en la presente investigación.
Bak et al. (2013) en su investigación, utilizando cultivos celulares estimulados con lipolisacaridos (LPS), observaron que los polifenoles extraídos de uva (Vitis amurensis), disminuyeron la producción del óxido nítrico, prostaglandinas E2 y de especies reactivas del oxígeno; adicionalmente, encontraron disminución en la expresión de citocinas proinflamatorias como TNF-α e IL-1β, atribuyendo estos resultados a la posible supresión de la actividad del factor nuclear Kappa Beta (NF-kB). En concordancia, otros reportes han evidenciado el efecto benéfico de diversos tipos de polifenoles como la crisina, el ácido elágico la genisteína y el resveratrol sobre las vías del NF-kB que contribuyen a modular el proceso inflamatorio (Romier et al., 2008; Carmona-Hernández et al., 2017).
Estudios realizados que evalúan específicamente las propiedades del ácido ferúlico, han reportado resultados congruentes respecto los niveles de TNF-α donde esta citocina se encontraba notablemente aumentada en ratas con dieta alta en grasa, mientras que en los animales con esta misma dieta suplementada con ácido ferúlico a dosis de 30 y 60 mg/kg/día se aminoró significativamente la liberación de dicha citocina por inflamatoria, siendo esto congruente con nuestros hallazgos donde la TNF-α disminuyó a niveles donde no hubo diferencias con los animales control alimentados sin una dieta alta en grasa (Senaphan et al., 2015).
Por su parte De Melo et al. (2017) observó en ratones alimentados con dieta alta en grasa la suplementación con ácido ferúlico disminuyó considerablemente los niveles plasmáticos de TNF-α en relación con los animales control con dieta alta en grasa sin suplementación. El ácido ferúlico previno eficazmente la adiposidad visceral y el aumento de peso corporal inducidos por una dieta alta en grasas a través de mecanismos que implican la modulación de las hormonas peptídicas reguladoras de los alimentos (insulina, grelina y leptina). La obesidad ha sido considerada una enfermedad en la que hay predominio de citocinas pro inflamatorias, en el estudio los niveles circulantes de TNF-α, así como de insulina, estaban muy elevados en ratones alimentados con HFD, lo que indica un estado pro inflamatorio y resistencia a la insulina, en los resultados reportados por De Melo et al. (2017) el ácido ferúlico redujo el tamaño de los adipocitos, así como los niveles circulantes de adipocinas, TNF-α y MCH-1, lo que explicaría su efecto mejorador de la adiposidad abdominal y la resistencia a la insulina.
Navarrete et al. (2015), en su estudio con extracto de tomate y ácido ferúlico, atribuyen la disminución de expresión de citocinas pro inflamatorias en macrófagos activados con LPS a la capacidad de los compuestos activos de la fruta de inhibir la activación del NF-κB, respecto a esto, autores como Cao et al. (2015), han reportado utilizando un modelo in vitro de inflamación inducido por H2O2 en las células del músculo liso vascular de rata, observaron que el ácido ferúlico redujo los niveles de IL-1β, IL-6 y TNF-α y la expresión de iNOS mediante la inhibición de la activación de NF-κB, por lo que la reducción del marcador de inflamación TNF-α encontrado en el presente estudio podría relacionarse con la acción del ácido ferúlico sobre la vía de activación del NF-κB, no obstante, se deben realizar estudios para profundizar en los mecanismos moleculares y vías de señalización que conducen la actividad antinflamatoria en este tipo de modelos de inflamación.
Por otra parte, los reportes sugieren que el estrés oxidativo juega un rol de importancia en la prevención de enfermedades relacionadas a inflamación de bajo grado como la obesidad, por lo que existe una estrecha relación entre los radicales libres y la inflamación donde los polifenoles como agentes antioxidantes pueden ser de gran relevancia. Está bien establecido que el estrés oxidativo mediado por NOX puede desencadenar una inflamación de bajo grado, donde se ha observado que polifenoles, pueden contrarrestar significativamente las enzimas prooxidantes NOX-2 y NOX-4 y concomitantemente reducir la expresión de IL-1β y COX-2 y aumentan la expresión de PPARγ. Además, estos compuestos también atenúan la activación de la vía del NF-κB. Por tanto, esta relación oxidación inflamación es una vía de interés para el enfoque terapéutico de los extractos ricos en polifenoles en la regulación de las enfermedades crónicas relacionadas a la inflamación de bajo grado (Nani et al., 2021).
Respecto a la medición de IL-6, en el presente estudio, esta citocina pro inflamatoria no fue afectada por el tratamiento con extracto de Passiflora ligularis, como reportaron otros autores como Lu et al. (2012) y Xu et al. (2015). En relación a esto, el metaanálisis realizado por Peluso et al. (2013), evidenció una alta heterogeneidad en los resultados de los estudios referentes al efecto de los flavonoides sobre los niveles circulantes de IL-6; donde posiblemente otros factores como el modelo de investigación y el tipo de polifenol presente en el extracto utilizado generen variabilidad en los hallazgos.
Conclusión
En este estudio se observó que 3g/L del extracto de Passiflora ligularis en el agua de bebida, tuvieron la capacidad de aminorar la ganancia de peso producida por el aumento de la grasa en la dieta y a su vez se redujo la concentración sérica del marcador de inflamación TNF-α indicando un efecto benéfico sobre el riesgo asociado a la inflamación de bajo grado relacionado al desbalance metabólico por sobrepeso.














