Introducción
En los cultivos de musáceas para consumo en Colombia, existen 426.905 ha sembradas en plátano con una producción de 4’271.879 t y un rendimiento de 10 t/ha, principalmente con las variedades Dominico hartón, Dominico, Hartón y Cachaco; mientras que hay 99.612 ha sembradas en banano con una producción de 2’436.424 y un rendimiento de 24 t/ha (Agronet, 2020), principalmente con las variedades gros michel, bocadillo o murrapo e indio (Aranzazu, 2002). En Colombia, el cultivo del plátano genera 340.707 empleos directos permanentes y 873.103 empleos indirectos por año, es decir, unas 65.000 familias se dedican a las labores del cultivo (Agronet, 2017).
Actualmente, las musáceas son amenazadas por enfermedades fungosas como sigatoka negra [Teleomorfo: Mycosphaerella fijiensis Morelet, anamorfo: Paracercospora fijiensis (Morelet) Deighton] y amarilla, [Teleomorfo: Mycosphaerella musicola Leach, anamorfo: Pseudocercospora musae (Zimmerman) Deighton] (Mourichon y Fullerton, 1990)] y marchitamiento por Fusarium [Fusarium oxysporum f. sp. cubense (Smith) Snyder & Hansen]; por enfermedades bacterianas como moko o maduraviche (Ralstonia solanacearum raza 2 Smith), y pudrición acuosa del pseudotallo [Dickeya (Erwinia) chrysanthemi (Burkholder et al.) Samson et al.] (Van Vaerenbergh et al., 2012), y por enfermedades virales como virus del rayado del banano [Banana streak badnavirus (BSV)] y virus del mosaico del pepino [Cucumber mosaic cucumovirus (CMV)] (Ploetz, 2004). Adicionalmente, por nematodos fitoparásitos como el nematodo barrenador [Radopholus similis (Cobb) Thorne]; lesionador [Pratylenchus coffeae (Zimmermann) Filipjev & Schuurmans Stekhoven]; espiral [Helicotylenchus multicinctus Cobb (Golden)] y [H. dihystera Cobb (Sher)], nudo radical [Meloidogyne incognita (Kofoid y White) Chitwood] y [Meloidogyne javanica (Treub) Chitwood], los cuales parasitan el sistema radical y el cormo, que afectan la producción de musáceas (Araya, 2004; Martínez et al., 2006; Sikora et al., 2018; Guzmán et al., 2020).
En Colombia, Valencia et al. (2014) y Alarcón y Castaño (2006) encontraron que R. similis es el nematodo fitoparásito de mayor prevalencia en cultivos de plátano y banano en los municipios de Manizales, Chinchiná y Palestina, del departamento de Caldas. Adicionalmente, en la zona cafetera de Colombia, el genotipo Musa AAB (sugbrupo plátano) ‘Dominico Hartón’ es parasitado por los géneros Radopholus, Pratylenchus, Helicotylenchus, Meloidogyne y Rotylenchus (Guzmán y Castaño, 2004; Guzmán et al., 2012b; Guzmán et al., 2020). Radopholus similis, nematodo barrenador, es un endoparásito migratorio que se alimenta de raíces y cormos de plantas de plátano y banano en todo el mundo, afectando la absorción de agua y traslocación de nutrientes dentro del sistema radical y a la parte aérea de la planta, que conllevan a un menor crecimiento de las plantas (Sarah et al., 1996; Guzmán, 2011; Sikora et al., 2018). Como ejemplo de esto, Moens et al. (2003) en plántulas de Musa AAA ‘Grande Naine’, Hahn et al. (1996) en Musa AAA ‘Valery’ y Fallas et al. (1995) en Musa AAA ‘Poyo’ demostraron que R. similis redujo el peso de las raíces, en condiciones de invernadero. En la parte aérea de la planta se presenta amarillamiento de hojas, disminución del tamaño y longevidad de las plantas y volcamiento por destrucción de raíces, con pérdidas en rendimiento que oscilan entre 44 y 60% en diferentes genotipos de musáceas (Loos, 1961; Fogain y Gowen, 2000).
El nivel de daño económico ocasionado por R. similis en cultivos de musáceas establecidos depende de factores tales como su densidad poblacional, la virulencia de las especies y la reacción del hospedante al ataque del nematodo (Andrews y Quezada, 1985), al igual que del material vegetal contaminado y las condiciones edafoclimáticas (Quénéhervé, 1988). En investigaciones realizadas por Cañizares (2003) en Costa Rica y Triviño (2003) en Ecuador, consideraron que los umbrales de daño económicos de R. similis que justifican la aplicación de nematicidas son de 10.000 nematodos por 100 g de raíces o de suelo. Pocasangre et al. (2007) reportan que en la mayoría de las fincas bananeras en Costa Rica que aplican dos a tres ciclos de nematicidas por año tienen poblaciones de R similis superiores a 15.000 nematodos por 100 g de raíces. Resultados similares han sido documentados por Pattison (2006), quien encontró cantidades de R. similis en fincas comerciales de Costa Rica superiores a 37.000 R. similis por 100 g de raíces. Según Suárez et al. (2002), el umbral de daño económico de R. similis se sitúa en los 10.000 nematodos por 100 g de raíces. Según Tarté y Pinochet (1981) y Chávez-Velazco et al. (2009), reportaron que 10.000 R. similis/100 g de raíces es el parámetro general para decidir las estrategias de manejo en las plantaciones de banano en países de América Central y del Sur. En Costa de Marfil se ha señalado un umbral de 1.000 nematodos/100 g de raíces, mientras que en Honduras, Costa Rica y Panamá, se considera a 20.000 nematodos/100 g de raíces (Gowen y Quénéhervé, 1995).
En Colombia no se dispone de información suficiente sobre el efecto que causan diferentes densidades de población de los principales nematodos fitoparásitos que afectan a las musáceas de importancia económica. Es por ello que el conocimiento de la reacción de diferentes materiales de musáceas al parasitismo de R. similis es esencial en la implementación de estrategias de manejo integrado, en condiciones de almácigo, que contribuyen a evitar pérdidas significativas en la producción, en condiciones de campo. Por tales motivos, el objetivo de esta investigación fue evaluar la reacción de cuatro materiales de musáceas a diferentes densidades de población de R. similis, en condiciones de almácigo.
Materiales y métodos
Localización
La investigación se realizó en la granja Montelindo de la Universidad de Caldas, ubicada en la vereda Santágueda, municipio de Palestina, departamento de Caldas, Colombia, a 5° 05’ N y 75° 40’ W, 1.010 m de altitud, 22,8°C de temperatura promedio anual, 2.200 mm de precipitación anual, 76% de humedad relativa promedio y 2.010 h de brillo solar anual. El aislamiento de los nematodos y la preparación de sus densidades poblacionales se realizaron en el Laboratorio de Nematología del Departamento de Producción Agropecuaria de la Facultad de Ciencias Agropecuarias, ubicado en la Universidad de Caldas, Manizales, Caldas.
Material vegetal
Los materiales de musáceas se obtuvieron del vivero Alaska, ubicado en la vereda Armenia del municipio de Neira, Caldas, propiedad de Agropecuaria Viscaya S.A., con resolución ICA No. 00003075 de 2015, que es productor y distribuidor de material de propagación de musáceas. Los genotipos evaluados fueron dos materiales de plátano (consumo en cocción), Musa AAB (subgrupo plátano) ‘Dominico hartón’ y Musa ABB (Subgrupo Lujugira) ‘Guineo o colicero’; y dos materiales de banano (consumo en fresco), Musa AAA (subgrupo gros michel) ‘gros michel’ y musa aa (subgrupo sucrier) ‘bananito’, ‘banano bocadillo’ o ‘baby banana’, clasificación según Robinson y Galán-Saúco (2010).
Se utilizaron cormos de similar tamaño, (300 g aprox.) y les realizó limpieza sanitaria con base en la técnica adaptada por Guzmán et al. (2012a), máximo hasta 5 cm antes de la región de Mangin. Posteriormente, a los cormos se les realizó inmersión en 10 cm3/L de carbofuran (Furadan® 3 SC) + 10 g/L de aldicarb (Temik® 15 GR) por 60 min, para garantizar que estuvieran libres de nematodos fitoparásitos.
Sustrato
Se obtuvo suelo de textura franco-arenosa derivado de cenizas volcánicas compuesto de 60% arena, 20% limo y 20% arcilla con pH de 6,5. El suelo previamente se homogenizó y desinfestó con Dazomet (Basamid®) en dosis de 60 g/m2 durante 20 días.
Establecimiento del almácigo
Se utilizaron bolsas de polietileno calibre 3, de 36 x 34 cm de ancho y alto, respectivamente, las cuales se llenaron con el sustrato esterilizado. Posteriormente, en cada bolsa se sembró un cormo cuya parte superior se ubicó a 10 cm por debajo del nivel del suelo. Las bolsas se ubicaron sobre camas de guadua a 0,6 m de alto del suelo y el almácigo se cubrió con una malla de color negro (polisombra de 60%) ubicada a una altura de 2 m.
Una vez emergieron las plántulas, se agruparon por alturas similares dentro de cada genotipo para distribuir aleatoriamente los tratamientos con las diferentes densidades de población de R. similis.
Obtención e incremento del inóculo de R. similis
Del sistema radical de plantas de musa AAB ‘Dominico hartón’ parasitadas por R. similis, ubicadas en la granja Montelindo de la Universidad de Caldas, se realizó la extracción separación de nematodos mediante la metodología de centrifugación, decantación y flotación en azúcar descrita por Taylor y Loegering (1953) y Jenkins (1964) en el Laboratorio de Nematología del Departamento de Producción Agropecuaria de la Universidad de Caldas. Finalmente, en una cámara de conteo de 36 celdas, cada una de 1 cm2, colocada en un estereoscopio marca Leica® a 30X se realizó el conteo de hembras de R. similis, para luego inocular 30.000 de estas en el sistema radical de 20 plántulas de Dominico hartón para la multiplicación masiva del nematodo.
Procedimiento para determinar las diferentes densidades de población de los nematodos
Después del incremento, se prepararon densidades de 100, 500, 1.000, 3.000, 5.000 y 10.000 hembras de R. similis en frascos de vidrio borosilicato color ámbar para su inoculación, de la siguiente manera: Con una cámara de conteo de 36 celdas, cada una de 1 cm2, colocada en un estereoscopio marca Leica® a 30X se realizó el conteo de hembras de R. similis, las cuales se depositaron en un frasco de vidrio que se aforó a 500 mL de agua destilada estéril y se obtuvo una suspensión de 500 hembras de R. similis por cada 1mL de agua.
Las densidades de población de 100, 500, 1.000, 3.000, 5.000 y 10.000 R. similis se obtuvieron mediante la extracción de 0,2; 1; 2; 6; 10 y 20 mL de la suspensión inicial de 500 hembras del nematodo por cada 1mL de agua, con ayuda de una micropipeta marca Biohit® de 1mL de capacidad. Finalmente, el volumen correspondiente a cada población de nematodos, se depositó en frascos de vidrio borosilicato color ámbar, con 100 mL de capacidad.
Aplicación y distribución de tratamientos
A los 45 días después de sembrados los cormos, de 112 plántulas de Musa AAB ‘Dominico Hartón’ se seleccionaron aleatoriamente siete grupos de 16 plántulas, a las cuales se les removió superficialmente el sustrato, con un instrumento de madera, para exponer el sistema radical. Posteriormente, cada grupo se inoculó con las densidades de población de 0, 100, 500, 1.000, 3.000, 5.000 y 10.000 hembras de R. similis por planta, las cuales estaban en 100 mL de agua destilada. Finalmente, las raíces se cubrieron nuevamente con el sustrato. A los 60 días después de la inoculación (ddi), de cada una de las densidades de población del nematodo fueron seleccionadas aleatoriamente ocho plántulas para muestreo destructivo, y al resto de las plántulas se les realizó muestreo destructivo a los 90 días. El anterior procedimiento también se realizó en los genotipos de Musa ABB ‘Guineo’, Musa AA ‘Bananito’ y Musa AAA ‘Gros Michel’. En total fueron 56 tratamientos, los cuales constaron de cuatro genotipos de musáceas con siete densidades de población del nematodo en dos tiempos de exposición de las plántulas al nematodo para un total de 448 plántulas.
El efecto de los tratamientos se evaluó bajo un diseño experimental completamente aleatorio con dos análisis factoriales; el primero con dos factores (2 x 7), así: dos tiempos de exposición de las raíces a los nematodos (60 y 90 ddi) y siete densidades de población del nematodo (0, 100, 500, 1.000, 3.000, 5.000 y 10.000), dicho análisis se utilizó para evaluar el efecto de las densidades de población de los nematodos en las variables de crecimiento en cada uno de los genotipos de musáceas. El segundo análisis con tres factores (2 x 7 x 4), así: los mismos dos tiempos de exposición y las siete densidades de población del nematodo mencionadas antes y los cuatro genotipos de musáceas (Musa AAB) ‘Dominico hartón’, Musa ABB ‘Guineo’, Musa AA ‘bananito’ y Musa AAA ‘Gros Michel’. Este arreglo factorial se utilizó para analizar el efecto de los nematodos sobre el daño en raíces y comparar los resultados entre los cuatro genotipos de musáceas.
Variables evaluadas
En cada plántula se evaluaron como variables de respuesta el peso seco total de las plántulas-PSTP (g). Como variables complementarias, se evaluó el número de hojasNH (#), la altura de plántulas-AP (cm), midiendo la distancia entre el nivel del suelo y el nivel superior de la última hoja desenrollada, diámetro del pseudotallo-DPs, tomado a 15 cm desde la base de la planta, y longitud de raíces-LR como la distancia entre el punto de crecimiento y ápice de la raíz funcional más larga. En la parte del cormo y sistema radical, se evaluó el índice de necrosis de raíces-INR, como el porcentaje de raíces funcionales-RF, necrosadas-RN y muertas-RM; el porcentaje de daño en cormos-DC y la población final de nematodos en raíces-PFNR y en suelo-PFNS como la sumatoria de estados juveniles, hembras y machos por 100 g de raíces o 100 cm3 de suelo, respectivamente. El factor de reproducción-FR se calculó mediante la relación entre la PFNS y PFNR respecto a la población inicial según Oostenbrink (1966).
Prácticas agronómicas
A los 20 días después de la siembra se realizó la primera fertilización con 400 mL/plántula de una solución de 1g del fertilizante 10-20-20 (N-P-K)/L de agua. Posteriormente, se repitió la aplicación durante cinco veces con el mismo fertilizante en diluciones de 1,5 y 2,0 g/L, cada 20 días, respectivamente. A cada plántula se le aplicó 1 L de agua de riego, cada 2 días en horas de la tarde y se realizó control manual de arvenses semanalmente.
Análisis Estadístico
Los datos obtenidos se sometieron a análisis de varianza y pruebas de comparación de Tukey a un nivel de probabilidad de 5%; también se realizó regresión lineal y análisis de correlación de Pearson entre las variables evaluadas y las densidades de población, utilizando los programas R versión 3.4.1 y XLSTAT versión 2014.3.07.
Resultados
A continuación, se presentan los efectos de R. similis en cada uno de los genotipos de musáceas evaluados en un factorial 2 x 7 así: dos tiempos de exposición (60 y 90 ddi) y siete densidades de población del nematodo.
Musa AAB ‘Dominico hartón’
La variable PSTP presentó diferencias estadísticas entre los dos tiempos de exposición y entre las siete densidades de población de R. similis, donde las plántulas testigo presentaron el mayor PSTP con 146,4 g con diferencias estadísticas (P<0,05) con la mayoría de las densidades de población del nematodo, en las cuales el PSTP disminuyó hasta 50% (Tabla 1, Figura 1A). El análisis de regresión lineal mostró que, a mayores densidades de población del nematodo, menor es el PSTP en ambos tiempos de exposición (Figura 1A).
Para la LR, las plántulas testigo presentaron el mayor valor con 83,9 cm, las cuales fueron estadísticamente similares (P>0,05) a las plántulas inoculadas con 100 y 500 R. similis (Tabla 1, Figura 1B) pero estadísticamente diferentes (P<0,05) a las plántulas inoculadas con 5.000 y 10.000 individuos, donde la LR se redujo 50%, en ambos tiempos de exposición. Adicionalmente, la regresión lineal indicó que la variable LR disminuyó con el incremento de las densidades de población de R. similis, tanto a 60 como a 90 ddi (Figura 1B).
Respecto al INR, este fue menor en las plántulas inoculadas con las densidades de población de 100, 500 y 1.000 nematodos con 48,2, 52,7 y 59,4%, respectivamente, los cuales fueron estadísticamente diferentes (P<0,05) a los valores obtenidos con las poblaciones de 3.000, 5.000 y 10.000 nematodos, que presentaron los mayores valores llegando hasta 75,5% (Tabla 2, Figura 3A). Las plántulas inoculadas con las poblaciones de 100, 500 y 1.000 R. similis presentaron el menor porcentaje de RM con 18,6, 22 y 28,2%, respectivamente, las cuales tuvieron diferencias estadísticas (P<0,05) con respecto a las mayores poblaciones de 5.000 y 10.000 nematodos con valores de 42,1 y 48,1%, respectivamente (Tabla 2; Figura 3A).
Las plántulas inoculadas con 100 individuos de R. similis presentaron el menor DC con 6,6% (grado 3), siendo estadísticamente diferentes (P<0,05) a los daños obtenidos con las mayores densidades de población (5.000 y 10.000 individuos) con valores de 24,8 y 29,9%, respectivamente, con grado 4 (Tabla 2, Figura 4A). De igual manera, respecto a la variable PFNR las plántulas inoculadas con 100 individuos presentaron la menor PFNR con 87.056 nematodos/100g de raíces, siendo estadísticamente diferentes (P<0,05) con las demás poblaciones (Tabla 2). De igual manera, para la variable PFNS en las plántulas inoculadas con 100 y 500 hembras se obtuvo el menor número con 563 y 778 nematodos/100 cm3 de suelo, respectivamente, y con diferencias estadísticas (P<0,05) respecto a las demás densidades de población del nematodo evaluadas, con valores que oscilaron entre 1.263 y 2.103 nematodos/100 cm3 de suelo (Tabla 2).
Musa ABB (subgrupo lujugira) ‘Guineo’
En la variable PSTP se encontraron diferencias estadísticas entre los dos tiempos de exposición y las densidades de población de R. similis, obteniendo el mayor PSTP en el testigo con 160,2 g y con diferencias estadísticas (P<0,05) con respecto a los demás tratamientos evaluados, donde el menor PSTP fue para el tratamiento con 10.000 individuos con 80,1 g, presentándose una reducción de 50% respecto al testigo (Tabla 1, Figuras 1C, 2B). En la regresión lineal, para ambos tiempos de exposición, se encontró que la variable PSTP disminuyó significativamente (P<0,05) desde la menor densidad de población con 100 nematodos hasta la mayor con 10.000 nematodos (Figura 1C).
De igual manera, en la variable LR, se encontró que las plántulas testigo y las inoculadas con 100 individuos obtuvieron los mayores valores con 111,6 cm y 100,3 cm, respectivamente, y con diferencias estadísticas respecto a plántulas inoculadas con 3.000, 5.000 y 10.000 individuos, cuyos valores disminuyeron significativamente (P<0,05) en 26% y 35%, respectivamente (Tabla 1, Figuras 1D, 2B). La regresión lineal mostró que la LR disminuyó en igual proporción al aumento de las poblaciones y en ambos tiempos de exposición (Figura 1D).
El INR fue de 54,7, 60,1 y 67,3% en las plántulas inoculadas con 100, 500 y 1.000 individuos, respectivamente, y con diferencias estadísticas (P<0,05) con los valores de 74,1%, 77,5% y 79,7%, obtenidos en las plántulas inoculadas con 3.000, 5.000 y 10.000 nematodos, respectivamente (Tabla 2, Figura 3B). En la variable RM, las plántulas inoculadas con 100 nematodos presentaron el valor más bajo (22,8%) respecto a las plántulas con 5.000 y 10.000 nematodos, las cuales obtuvieron los mayores valores con 61,6% y 67,1%, respectivamente (Tabla 2).
De otro lado, en las plántulas inoculadas con 100 y 500 nematodos se encontró el menor DC, con valores de 12,1 y 16,7%, respectivamente, los cuales fueron estadísticamente diferentes (P<0,05) a los valores obtenidos en las plántulas inoculadas con 1.000 y 3.000 individuos con 23,3 y 26,3%, respectivamente. Estos últimos también fueron estadísticamente diferentes (P<0,05) al daño encontrado en las plántulas inoculadas con 5.000 y 10.000 nematodos, con valores de 32,6 y 42,1%, respectivamente, correspondientes a grado 4 (Tabla 2, Figura 4B). La menor PFNR se encontró en las plántulas inoculadas con 100 nematodos, con 145.826 individuos/100g, siendo estadísticamente diferente (P<0,05) a los resultados obtenidos en las plántulas inoculadas con 500, 1.000 y 3.000 nematodos que presentaron valores de 240.640, 290.483 y 282.127 individuos/100g, respectivamente. Las plántulas inoculadas con las mayores poblaciones, 5.000 y 10.000 nematodos obtuvieron las mayores PFNR con 310.918 y 239.034 individuos/100g, respectivamente (Tabla 2). En la variable PFNS, las plántulas inoculadas con 100 nematodos obtuvieron las menores poblaciones con 1.307 individuos/100cm3 de suelo y con diferencias estadísticas (P<0,05) entre los demás tratamientos con 500, 1.000, 3.000, 5.000 y 10.000 nematodos, los cuales presentaron poblaciones finales de hasta 3.072 nematodos/100cm3 de suelo (Tabla 2).
Musa AAA (subgrupo Gros Michel) ‘Gros Michel’
En este genotipo, las plántulas testigo y las inoculadas con 100, 500 y 1.000 individuos presentaron el mayor PSTP con 151,1, 138,2, 127,8 y 119,6 g, respectivamente, siendo estadísticamente diferentes (P<0,05) a las plántulas inoculadas con 5.000 y 10.000 nematodos, que obtuvieron una reducción en el PSTP de 33,4% y 50,1%, respectivamente, comparado con las plántulas testigo (Tabla 1, Figuras 1E, 2C). La regresión lineal de la variable PSTP, en los dos tiempos de exposición al nematodo, disminuyó significativamente (P<0,05) en las poblaciones superiores a 3.000 (Figura 1E).
En la variable LR, las plántulas testigo y las inoculadas con 100 y 500 nematodos presentaron los mayores valores con 77,5, 69,5 y 65,9 cm, respectivamente, presentado diferencias estadísticas (P<0,05) con las plántulas inoculadas con 5.000 y 10.000 nematodos, las cuales tuvieron una reducción de 49% en comparación con el testigo (Tabla 1, Figuras 1F, 2C). Así mismo, en la regresión lineal se muestra reducción significativa (P<0,05 en la LR con las poblaciones mayores a 1.000 nematodos (Figura 1F).
Ahora, el INR ocasionado por R. similis fue menor en las plántulas inoculadas con 100 y 500 nematodos con valores de 35 y 42%, respectivamente, los cuales fueron estadísticamente diferentes (P<0,05) a los INR obtenidos con las mayores densidades de población del nematodo, los cuales fueron hasta de 65,6% (Tabla 2, Figura 3C). Igualmente, el mayor número de RF se observó en las plántulas con 100 y 500 nematodos con 86,1 y 80,9%, respectivamente, con diferencias estadísticas (P<0,05) con las plántulas inoculadas con las mayores densidades de población del nematodo con reducciones de 45,7% en RF (Tabla 2).
En la evaluación del DC, las plántulas testigo y las inoculadas con 100 y 500 nematodos tuvieron el menor valor con 3,6 y 6,9%, respectivamente, siendo estadísticamente diferentes (P<0,05) a los valores obtenidos en las plántulas inoculadas con 1.000, 3.000 y 5.000 individuos con 10,3%, 18,6% y 23,1%, respectivamente, mientras que las plántulas inoculadas con 10.000 individuos obtuvieron el mayor porcentaje de DC con 26,2%, correspondiente a grado 4 (Tabla 2, Figura 4C). Así mismo, las plántulas inoculadas con 100 y 500 nematodos tuvieron las menores PFNR con 37.385 y 46.103 individuos/100 g de raíces, respectivamente, siendo estadísticamente diferentes (P<0,05) a las plántulas inoculadas con las demás densidades de población del nematodo, donde la mayor PFNR se obtuvo en plántulas inoculadas con 10.000 hembras que produjeron 174.951 nematodos/100 g de raíces (Tabla 2). De igual manera, la PFNS fue menor en las plántulas inoculadas con 100 y 500 hembras, con 516 y 716 nematodos/100cm3 de suelo, respectivamente, y con diferencias estadísticas (P<0,05) en comparación con los demás tratamientos evaluados, donde la mayor PFNS, con 1.218 individuos/100 cm3 de suelo, se obtuvo en las plántulas inoculadas con 10.000 nematodos (Tabla 2).
Musa AA (subgrupo Sucrier) ‘bananito’
En la variable PSTP de este genotipo, se encontró que las plántulas testigo y las inoculadas con 100 nematodos presentaron el mayor PSTP con 107,1 y 97,9 g, respectivamente, siendo estadísticamente iguales (P>0,05). En contraste, estas fueron estadísticamente diferentes (P<0,05) a las plántulas inoculadas con las densidades de población iguales o mayores a 1.000 nematodos, que obtuvieron valores de PSTP entre 53,5 y 84,7 g. En las plántulas inoculadas con 10.000 individuos se redujo en 50% el PSTP comparado con el testigo sin inocular (Tabla 1, Figuras 1G, 2D).
En la variable LR, las plántulas testigo y las inoculadas con 100 y 500 nematodos obtuvieron el mayor valor con 116,9, 107,9 y 101,6 cm, respectivamente, siendo estadísticamente iguales (P>0,05). Los anteriores valores fueron estadísticamente diferentes (P<0,05) a las plántulas inoculadas con 3.000, 5.000 y 10.000 nematodos con reducciones de 23,78, 35,41 y 44,82%, respectivamente (Tabla 1, Figuras 1H, 2D). Así mismo, en la variable AP, las plántulas testigo e inoculadas con 100 nematodos tuvieron los mayores valores con 39,6 y 38 cm, respectivamente, las cuales fueron estadísticamente diferentes (P<0,05) a las inoculadas con las poblaciones mayores a 3.000 nematodos, presentándose una reducción de 23,98% en las inoculadas con 10.000 individuos (Tabla 1, Figura 1D).
Tabla 1 Prueba de comparación de medias de Tukey al 5% de probabilidad con arreglo bifactorial en el efecto de diferentes densidades de población de Radopholus similis en los parámetros de crecimiento de cuatro genotipos de musáceas, a los 60 y 90 días después de la inoculación del nematodo, en condiciones de almácigo.
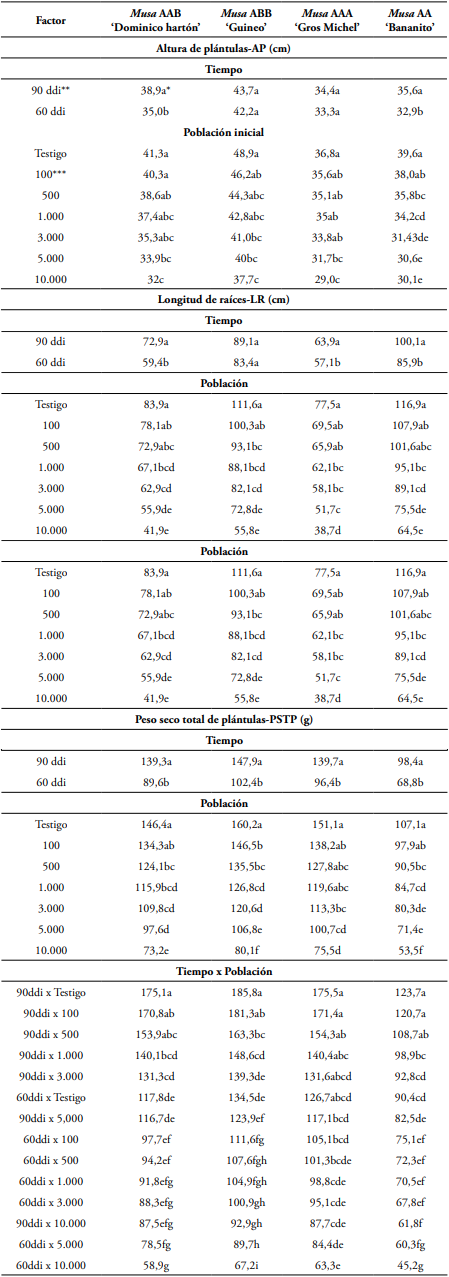
* Valores en la misma columna seguidos por letras iguales son estadísticamente similares, según la prueba de comparación de Tukey al 5% de probabilidad.
** ddi: días después de la inoculación.
*** Hembras de Radopholus similis.
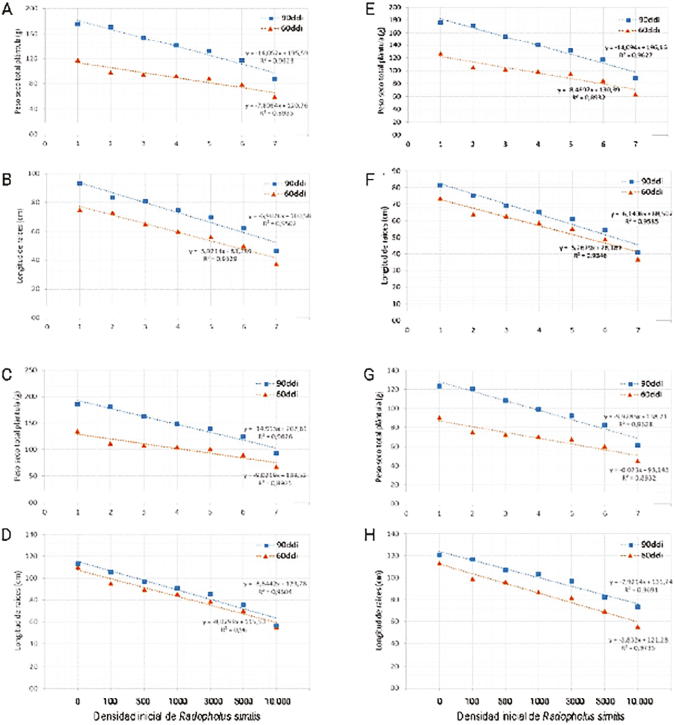
Figura 1 Regresión lineal en los parámetros de crecimiento de los cuatro materiales de musáceas evaluados. Longitud de raíces-LR (A) y peso seco total de plántulas-PSTP (B) de Musa AAB (subgrupo plátano) ‘Dominico hartón’; LR (C) y PSTP (D) de Musa ABB (subgrupo lujugira) ‘Guineo’; LR (E) y PSTP (F) de Musa AAA (subgrupo Gros Michel) ‘Gros Michel’; y LR (G) y PSTP (H) de Musa AA (subgrupo Sucrier) ‘bananito’ inoculadas con Radopholus similis.

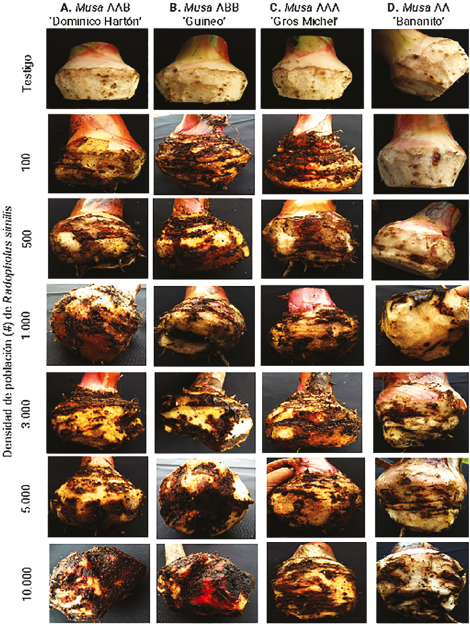
Figura 2 Seguimiento de la parte aérea y radical en plántulas de los cuatro materiales de musáceas. A. Musa AAB ‘Dominico hartón’. B. Musa ABB ‘Guineo’. C. Musa AAA ‘Gros Michel’. D. Musa AA ‘bananito’, a los 60 y 90 días después de la inoculación de Radopholus similis.
En la variable INR, las plántulas inoculadas con 100, 500, 1.000, 3.000 y 5.000 nematodos, con índices de 28,6%, 31,6%, 35,7% y 40,1%, respectivamente, presentaron los menores valores, las cuales fueron estadísticamente diferentes (P<0,05) a las plántulas inoculadas con 5.000 y 10.000 nematodos, las cuales obtuvieron los mayores INR con 45,6% y 53,2%, respectivamente (Tabla 2, Figura 3D). En la variable RF se encontró que las plántulas testigo y las inoculadas con 100 nematodos obtuvieron el mayor valor con 100 y 97,8%, respectivamente, con diferencias estadísticas (P<0,05) con respecto a los demás tratamientos (Tabla 2, Figura 3D). Así mismo, en la variable DC, las plántulas testigo e inoculadas con 100, 500 y 1.000 individuos tuvieron el menor valor con 2,6, 3 y 7,5%, respectivamente, presentando diferencias estadísticas (P<0,05) con las plántulas inoculadas con 5.000 y 10.000 nematodos con 19,8% y 21,8%, respectivamente, con grado 4 (Tabla 2, Figura 4D).
Las menores PFNR fueron obtenidas en las plántulas inoculadas con 100 y 500 nematodos con valores de 9.722 y 26.174 nematodos/100g de raíces, respectivamente, siendo estadísticamente diferentes (P<0,05) con las poblaciones obtenidas en las plántulas inoculadas con 1.000, 3.000, 5.000 y 10.000 nematodos con PFNR de 45.252, 60.564, 77.355 y 95.216 nematodos/100g de raíces, respectivamente (Tabla 2). De igual manera, la menor PFNS se obtuvo en las plántulas inoculadas con 100 y 500 hembras con valores de 97 y 284 nematodos/100cm3 de suelo, respectivamente, siendo estadísticamente diferentes (P<0,05) a las plántulas inoculadas con 5.000 y 10.000 hembras, que presentaron las mayores PFNS de 1010 y 1125 nematodos/100cm3 de suelo, respectivamente (Tabla 2).
En los cuatro genotipos evaluados, la variable AP solamente fue afectada en las densidades de población mayores a 5.000 R. similis, excepto el genotipo Musa AA ‘Bananito’ que fue afectado desde los 500 individuos (Tabla 2).
Con el propósito de conocer el genotipo de musácea que presentó el menor daño de R. similis en las raíces y el cormo; a continuación, se presentan los resultados de la interacción dos tiempos de exposición y las siete densidades de población del nematodo mencionadas antes y los cuatro genotipos de musáceas en un factorial 2 x 7 x 4.
Raíces
En las plántulas de los cuatro genotipos de musáceas inoculadas con diferentes densidades de población de R. similis, a los 60 y 90 días después de la inoculación, el análisis de varianza en arreglo multifactorial mostró diferencias estadísticas en las variables INR, RM, RF, DC, PFNR, PFNS y FR. También se presentaron diferencias estadísticas en los factores: tiempo de exposición al nematodo, genotipos de musáceas y en la interacción de genotipo X densidad de población del nematodo, incidiendo en un comportamiento diferencial en cada uno de los genotipos evaluados (Tabla 2).
El efecto de las diferentes densidades de población de R. similis en los cuatro genotipos de musáceas, según la prueba de comparación de Tukey, al 5% de probabilidad, mostró que el menor valor en las variables INR y RM se presentó en las plántulas de Musa AA ‘bananito’ con 33,5 y 17,9%, respectivamente, seguido por los valores obtenidos en las raíces de Musa AAA ‘Gros Michel’ con 43,8 y 25,1%, respectivamente, y en las raíces de Musa AAB ‘Dominico Hartón’ con 53,5 y 27,5%, respectivamente. El mayor INR y RM se obtuvo en las plántulas de Musa ABB ‘Guineo’ con 59,1 y 38,8%, respectivamente (Tabla 2).
Las variables INR y porcentaje de RM en las plántulas de los cuatro genotipos de musáceas, a los 60 ddi con R. similis, presentaron diferencias estadísticas (P<0,05) entre los valores de las plántulas inoculadas con las diferentes densidades de población del nematodo, donde los menores INR y porcentajes de RM se obtuvieron en las raíces de Musa AA ‘bananito’ inoculadas con 100 nematodos con 26 y 0%, respectivamente. Con el incremento de esta densidad de población del nematodo, se observó un mayor INR y RM, obteniendo los mayores valores en las plántulas inoculadas con 10.000 individuos con 48 y 23%, respectivamente. Resultados similares se observaron en la evaluación realizada a los 90 ddi, con un aumento de 10 en el INR y 23% en la variable RM con la mayor densidad de población del nematodo (Tabla 2, Figura 3D).
Un comportamiento similar se observó en las plántulas de Musa AAA ‘Gros Michel’ con las diferentes densidades de población del nematodo, donde a los 60 ddi, con 100 individuos se obtuvieron los menores INR y de RM con 35 y 9%, respectivamente, los cuales fueron estadísticamente diferentes (P<0,05) a los obtenidos en las plántulas inoculadas con 10.000 nematodos que obtuvieron los mayores valores con 57 y 31%, respectivamente. A los 90 días ddi no se observó aumento en el INR en las plántulas inoculadas con 100 nematodos, mientras que la variable RM aumentó en 9%. En las plántulas inoculadas con 10.000 nematodos el aumento fue de 18% en el INR y 29% en RM (Tabla 2, Figura 3C).
En las plántulas de Musa AAB ‘Dominico hartón’ inoculadas con 100 nematodos, a los 60 ddi, el INR y RM fue de 49 y 17%, respectivamente, siendo estadísticamente diferente (P<0,05) al de las plántulas inoculadas con 10.000 nematodos, con valores de 69 y 53%, respectivamente. Mientras que a los 90 ddi, las plántulas inoculadas con 100 nematodos tuvieron un incremento del 12 y 13%, respectivamente, y las plántulas inoculadas con 10.000 nematodos el incremento fue de 21% y 28%, respectivamente (Tabla 2, Figura 3A).
Los mayores INR y porcentajes de RM se obtuvieron en las raíces de las plántulas de Musa ABB ‘Guineo’ inoculadas con 10.000 nematodos con valores de 62% y 33%, respectivamente, a los 60 ddi. Así mismo, en las plántulas con la misma densidad de población del nematodo, a los 90 ddi, en las mismas variables se presentó un aumento de 19 y 30%, respectivamente (Figura 3B).
Cormos
El análisis de varianza en arreglo multifactorial realizado a la variable DC, mostró diferencias significativas (P<0,05) en el efecto de los factores: tiempo de exposición (60 y 90 días de inoculación), genotipos de musáceas (Musa AAB ‘Dominico Hartón’, Musa ABB ‘Guineo’, Musa AAA ‘Gros Michel’ y Musa AA ‘bananito’), y la interacción de genotipo X densidades de población del nematodo, donde el mayor DC se observó a los 90 ddi con R. similis, en los cuatro genotipos de musáceas. En las plántulas de los cuatro genotipos que no fueron inoculadas no se observó DC, con valores iguales a cero (0) y con diferencias estadísticas (P<0,05) con respecto a los demás tratamientos (Tabla 2, Figuras 4A, B, C, D).
El efecto de las densidades de población del nematodo en los cuatro genotipos de musáceas, mostró diferencias estadísticas entre los valores de DC obtenidos en las plántulas de banano Musa AA ‘bananito’ y Musa AAA ‘Gros Michel’ con 9,4 y 12,7%, respectivamente, seguido por los valores obtenidos en las plántulas de plátano Musa AAB ‘Dominico hartón’ con 16%; donde el mayor porcentaje de DC se obtuvo en las plántulas de Musa AA ‘bananito’ con 21,9% (Tabla 2, Figura 4).
En las plántulas de Musa AA ‘bananito’ y Musa AAA ‘Gros Michel’ que se inocularon con 100 nematodos se presentaron los menores porcentajes de DC, después de 60 ddi, con valores de cero (0), cuyos valores aumentaron en 5 y 7%, respectivamente, a los 90 días de la inoculación. Estos resultados fueron estadísticamente diferentes (P<0,05) a los obtenidos en las plántulas inoculadas con 10.000 nematodos, cuyo DC fue de 13% y 18%, respectivamente (Tabla 2, Figuras 4C, D).
Los DC de las plántulas de Musa ABB ‘Guineo’ inoculadas con las densidades de población de 5.000 y 10.000 nematodos, a los 60 ddi, fueron los más altos por el nematodo con 30 y 37%, respectivamente, y con diferencias estadísticas (P<0,05) con respecto a los valores obtenidos en las plántulas inoculadas con 100 y 500 nematodos con valores de 9 y 11%, respectivamente. Un comportamiento similar se observó en las plántulas de Musa AAB ‘Dominico hartón’, a los 60 ddi, donde con 5.000 y 10.000 nematodos se obtuvieron los mayores daños en cormos con 19 y 21%, respectivamente, mientras que los menores valores se obtuvieron en las plántulas inoculadas con 100 y 500 nematodos con 9% y 11%, respectivamente. Después de 90 días de la inoculación, el mayor DC con 29,9% se presentó en las plántulas que fueron inoculadas con 10.000 nematodos (Tabla 2, Figura 4A).
Población final del nematodo
El análisis de varianza con arreglo multifactorial mostró diferencias estadísticas (P<0,05) en el efecto de los factores: tiempo de exposición, genotipos de musáceas y en la interacción de genotipo X densidad de población del nematodo en las variables PFNR en 100 g de raíces, y PFNS en 100 cm3 de suelo y FR, en donde el mayor número de nematodos se obtuvo 90 ddi, con diferencias estadísticas (P<0,05) con las poblaciones finales obtenidas en la evaluación realizada 60 ddi. En las plántulas testigo de los cuatro genotipos de musáceas no se encontraron nematodos, ni en las raíces ni en el suelo (Tabla 2).
Los resultados demostraron el parasitismo de R. similis en los cuatro genotipos evaluados, ya que se incrementaron significativamente (P<0,05) la PFNR después de 60 ddi, observándose que los genotipos de plátano, Musa AAB ‘Dominico Hartón’ y Musa ABB ‘Guineo’ tuvieron mayores poblaciones del nematodo en comparación con las menores poblaciones encontradas en los bananos, Musa AA ‘bananito’ y Musa AAA ‘Gros Michel’ (Tabla 2, Figuras 2, 3 y 4).
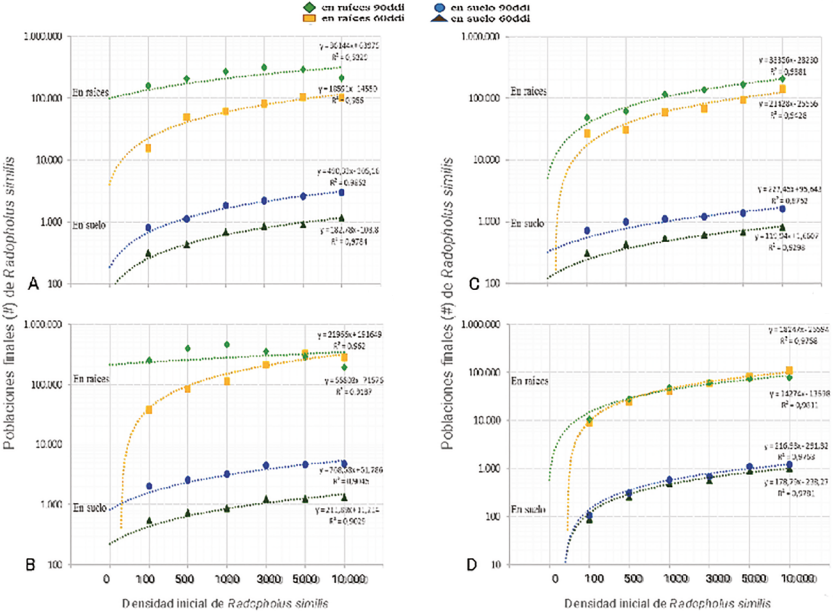
En los cuatro genotipos de musáceas, las diferentes densidades de población del nematodo en las variables PFNR y PFNS mostró diferencias estadísticas (P<0,05) entre genotipos, donde los mayores valores fueron en los genotipos de plátano, Musa ABB ‘Guineo’ con 215.575 y 1.992 nematodos, respectivamente, y Musa AAB ‘Dominico Hartón’ con 134.181 y 1.139 nematodos, respectivamente (Figura 5A, B). Por el contrario, los genotipos de banano tuvieron los menores valores, Musa AA ‘bananito’ con 44.897 y 527 nematodos, respectivamente, y Musa AAA ‘Gros Michel’ con 82.676 y 743 nematodos, respectivamente (Tabla 2; Figura 5C, D).
Tabla 2 Prueba de comparación de medias de Tukey al 5% de probabilidad en arreglo multifactorial en el efecto de diferentes densidades de población de Radopholus similis en raíces y cormos de las plántulas de los cuatro genotipos de musáceas, a los 60 y 90 días después de la inoculación con el nematodo.
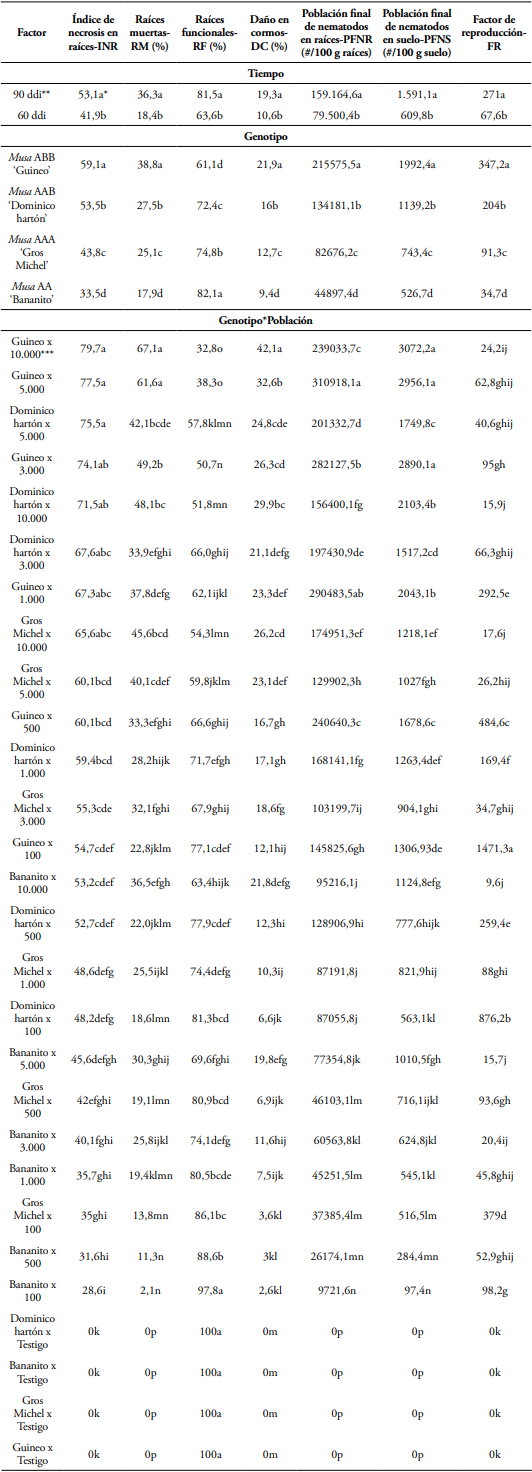
* Valores en la misma columna seguidos por letras iguales son estadísticamente similares, según la prueba de comparación de medias de Tukey al 5% de probabilidad. Los datos son el promedio de ocho repeticiones en cada tiempo de exposición al nematodo.
** ddi: días después de la inoculación.
*** Hembras de R. similis.
Análisis de correlación de Pearson
Las plántulas de Musa AAB ‘Dominico Hartón’, Musa ABB ‘Guineo’, Musa AAA ‘Gros Michel’ y Musa AA ‘bananito’, a los 60 y 90 días después de la inoculación de R. similis, mostraron una correlación negativa (P<0,05) entre las densidades de población del nematodo y las variables NH, AP, DPs, LR y PSTP, con una pendiente negativa, en donde a medida que se aumentaban las densidades de población del nematodo, se disminuían los valores de las variables de crecimiento (Tabla 3).
Tabla 3 Matriz de correlación de Pearson en la evaluación del efecto de las densidades de población de R. similis en plántulas Musa AAB ‘Dominico Hartón’, Musa ABB ‘Guineo’, Musa AAA ‘Gros Michel’ y Musa AA ‘bananito’, sobre los parámetros de crecimiento: NH, AP, DPs, LR y peso seco total de plántulas-PSTP, a los 60 y 90 días después de la inoculación del nematodo.
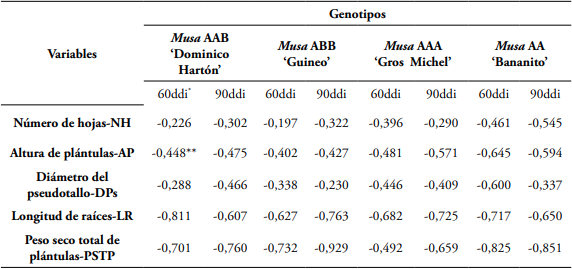
* ddi: días después de inoculación.
** Los valores en negrilla son diferentes de cero (0) con un nivel de significancia de (P<0,05).
En las variables PFNR, PFNS y daños en cormos y raíces, se encontró que hubo una correlación lineal positiva (P<0,05) entre las densidades de población del nematodo en los genotipos evaluados y el daño ocasionados en raíces y cormos, a los 60 y 90 ddi, con una pendiente positiva que mostró que a medida que aumentaba la densidad de población del nematodo, también aumentaba el daño en raíces y cormos, al igual que, la PFNR y PFNS. De otro lado, para la variable FR, se observó que cuando la densidad de población del nematodo fue de 100 y 500 individuos, el FR se incrementó en todos los genotipos evaluados; por el contrario, cuando las poblaciones estuvieron entre 1.000 y 10.000 individuos, el factor de reproducción fue significativamente menor en los cuatro genotipos de musáceas, presentando una correlación lineal negativa (P<0,05) con respecto a la población inicial del nematodo (Tabla 4).
Tabla 4 Matriz de correlación de Pearson en la evaluación del efecto de las densidades de población de R. similis y el daño ocasionado en raíces y cormos, población final de nematodos tanto en raíces-PFNR como en suelo-PFNS y factor de reproducción-FR, a los 60 y 90 días después de la inoculación del nematodo, en las plántulas de Musa AAB ‘Dominico Hartón’, Musa ABB ‘Guineo’, Musa AAA ‘Gros Michel’ y Musa AA ‘bananito’.
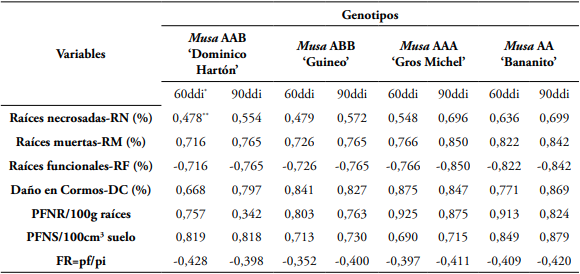
* ddi: Días después de la inoculación con densidades de población de R. similis.
** Los valores en negrilla son diferentes de cero (0) con un nivel de significancia de (P=0,05).
Discusión
En este estudio, las plántulas de los cuatro genotipos de musáceas evaluados, Musa AAB ‘Dominico Hartón’, Musa ABB ‘Guineo’, banano Musa AAA ‘Gros Michel’ y Musa AA ‘bananito’, inoculadas con las diferentes densidades de población de R. similis, a los 90 días después de la inoculación del nematodo, tuvieron disminución del PSTP como consecuencia del parasitismo del nematodo en el sistema radical y el cormo; mientras que las plántulas testigo de dichos genotipos presentaron el mayor PSTP. Resultados similares reportaron Marín et al. (2000), en Costa Rica, donde el peso fresco de las plántulas de Musa AAB ‘false horn’ disminuyó significativamente (18%), a las ocho semanas después de la inoculación con 100 R. similis. En otros estudios realizados por Plowright et al. (2013), que evaluaron la patogenicidad de poblaciones de R. similis de Uganda en Musa AAA ‘grand naine’, también obtuvieron reducciones en el peso fresco de raíces con 62,2%, a las 24 semanas después de la inoculación con 500 individuos. Daneel et al. (2015), en Sudáfrica, también reportaron porcentajes de reducción similares a las obtenidas en este estudio con valores de 27,7 y 21,7% en el PSTP de Musa AAA ‘Chinese Cavendish y Williams’, respectivamente, que fueron inoculadas con 2.000 R. similis, a las 8 semanas después de la inoculación, en condiciones de invernadero.
De igual manera, en esta investigación se obtuvieron resultados consistentes en el PSTP, a los 60 y 90 días después de la inoculación de R. similis. Estos resultados también coinciden con los tiempos utilizados por otros investigadores para experimentos de ‘screening’ con este nematodo (Mateille, 1992; Speijer y De Waele, 1997; Stoffelen et al., 1999; Marín et al., 2000; Moens et al., 2003). Autores como Sarah et al. (1993) encontraron resultados similares en estudios sobre patogenicidad de cuatro aislamientos de R. similis provenientes de Kenya, Guadalupe, Costa Rica y Costa de Marfil que fueron inoculados en Musa AAA ‘Poyo’, donde obtuvieron reducciones de 45, 48,6, 51,3 y 66% en el peso fresco de las plántulas inoculadas con 200 R. similis, a los 56 días después de la inoculación. Así mismo, Lugo et al. (2000) en un estudio sobre el manejo biológico de R. similis en banano Musa spp. obtuvieron disminuciones de 24,2% en el PSTP, a los 120 días después de la inoculación con 1.000 R. similis. Igualmente, Fallas y Marbán-Mendoza (1994), al evaluar el efecto de 100 R. similis por planta sobre el peso fresco de plantas de tres cultivares de Musa y un híbrido, obtuvieron reducciones de 16, 9 y 5,5% en el peso fresco de plántulas de Musa AAA ‘gran naine’, Musa AAB ‘currare’ y el híbrido Musa AAAB ‘Bras-9’, respectivamente, a los 60 días después de la inoculación.
Es esta investigación, los resultados obtenidos en la variable LR de los genotipos evaluados, confirman la patogenicidad de R. similis al obtener menor LR a medida que aumentaba la densidad de población del nematodo, los cuales coinciden con los reportes de Moens et al. (2003), en Costa Rica, donde observaron que el peso final de las raíces disminuyó conforme aumentó la densidad de población de R. similis inoculada, con reducciones de hasta 68% en plántulas de Musa AAA ‘grand naine’ inoculadas con 4000 nematodos, a las 12 semanas después de la inoculación. Igualmente, Fallas et al. (1995) al evaluar la patogenicidad de ocho poblaciones de R. similis en plántulas de banano Musa AAA ‘poyo’, observaron reducciones de 53,2% en el peso fresco de raíces con correlaciones negativas entre el peso y las densidades de población del nematodo, a las 12 semanas después de la inoculación con 100 individuos. Resultados similares también fueron observados por Marín et al. (1999) al evaluar el efecto de 11 poblaciones de R. similis en plántulas de Musa AAA ‘grand naine’, con reducciones de 16,2% en el peso seco de raíces, a los 56 días después de la inoculación con 200 R. similis.
En esta investigación, R. similis ocasionó mayor daño en las raíces de las plántulas de Musa ABB ‘Guineo’ y Musa AAB ‘Dominico hartón’ con más del 48% de raíces necrosadas y 14% de RM, a los 90 días después de la inoculación del nematodo. Los anteriores resultados contrastan con los menores valores obtenidos en las plántulas de Musa AAA ‘Gros Michel’ y Musa AA ‘bananito’ que tuvieron 28,6% de raíces necrosadas y 2% en RM. En otros estudios realizados por Mateille (1992), Price (1994), Speijer et al. (1999), Stoffelen et al. (1999) y Moens et al. (2001) reportaron mayor tolerancia a R. similis en los genotipos diploides y triploides de Musa AA y Musa AAA, respectivamente, con genoma de M. acuminata.
En este estudio el mayor INR fue encontrado en las plántulas de Musa ABB ‘Guineo’ y Musa AAB ‘Dominico hartón’, que tuvieron una correlación directa con las mayores densidades de población del nematodo, resultados que coinciden con los obtenidos en experimentos de susceptibilidad a R. similis en materiales de Musa AAA (subgrupo Cavendish) realizados por Moens et al. (2003), Marín et al. (1999) y Fallas et al. (1995). Así mismo, resultados similares también fueron observados por Tripathi et al. (2015), en Uganda, quienes estudiaron la relación entre el porcentaje de necrosis de raíces y varias densidades de población de R. similis en líneas transgénicas y susceptibles de musáceas, donde observaron un comportamiento con curvas asintóticas que indicaron que con 317 individuos/100g de raíces se producía hasta 61,5% de necrosis en ellas.
De igual manera, en estudios realizados por Marín et al. (2000) se obtuvieron porcentajes de necrosis mayores a 60% en raíces de plántulas de Musa AAB ‘false horn’, Musa AAA ‘grand naine y Valery’, a los 56 días después de la inoculación de 100 R. similis/planta, en condiciones de invernadero. Igualmente, Lugo et al. (2000), en un estudio sobre el manejo biológico de R. similis en banano (Musa spp.), obtuvieron daños en raíces de 53% en las plántulas sin tratamiento a los 120 después de la inoculación con 1.000 juveniles y adultos del nematodo. Fogain y Gowen (1997), Viaene et al. (2003) y Plowright et al. (2013) también reportaron índices de necrosis en raíces, similares a los obtenidos en este estudio, con valores entre 75% y 96% en plántulas de Musa AAA ‘grand naine’ inoculadas con 500 y 1.000 R. similis/planta, a las 12 semanas después de la inoculación del nematodo. Resultados similares también fueron reportados por Dochez et al. (2006), quienes obtuvieron altos porcentajes de necrosis en raíces con valores de 56,5% en bananos silvestres, a las 8 semanas después de la inoculación con 50 hembras de R. similis/ plántula. Igualmente, Blomme et al. (2001) reportaron índices de necrosis de 33,7% en las raíces de Musa AAA ‘Gros Michel’, en Nigeria, similar a lo encontrado en este estudio en el mismo genotipo con 100 hembras de R. similis, a los 60 días después de la inoculación del nematodo.
Los resultados obtenidos en este estudio mostraron que a mayor densidad de población de R. similis y tiempo de parasitismo (90 días), se presentaron mayores porcentajes de DC, principalmente en los genotipos de Musa ABB ‘Guineo’ y Musa AAB ‘Dominico Hartón’. Resultados que coinciden con los reportados por Seenivasan (2017a) quien después de evaluar el efecto de R. similis en el número de lesiones en raíces y cormos en diferentes genotipos de Musa AAA, donde obtuvo valores de hasta 47% de lesiones en raíces y 4,7 en el índice de lesiones en cormos en plántulas inoculadas con 5.000 R. similis, a los 60 después de la inoculación. Mientras que Seenivasan (2017b), en la India, reportó 37% de DC por R. similis en plántulas de Musa AAA ‘grand naine’, durante el periodo de cosecha.
En los cuatro genotipos evaluados, la AP fue afectada principalmente en las densidades mayores a 5.000 individuos de R. similis, mostrando que esta variable no es consistente para evaluar el efecto de este nematodo en los genotipos de musáceas. Fallas y Marbán-Mendoza (1994) reportaron resultados similares reportados por, quienes no observaron diferencias en la evaluación de la AP de los genotipos ‘grand naine y yangambi’, a los 60 días después de la inoculación con 100 hembras de R. similis. Sin embargo, en estudios realizados por Marín et al. (1999), en Costa Rica, obtuvieron reducciones del 4,8% en la AP de Musa AAA ‘Grand Naine’, a los 56 días después de la inoculación con 200 R. similis. Así mismo, Herradura et al. (2012) encontraron reducciones del 8,2% y 25% en la AP en dos cultivares de Musa AAA, del Sudeste Asiático en respuesta de las plantas a la infección con 1.000 R. similis, en etapa de floración y cosecha.
En este estudio se encontró que las mayores poblaciones de R. similis por 100 g de raíces y 100 cm3 de suelo se obtuvieron en Musa ABB ‘Guineo’ y Musa AAB ‘Dominico hartón’, mientras que las menores poblaciones del nematodo fueron en Musa AAA ‘Gros Michel’ y Musa AA ‘bananito’. Resultados similares fueron reportados por Elsen et al. (2002) en plantas de Musa AAA ‘grand naine’ inoculadas con 5, 10, 25, 50 y 100 hembras de R. similis/planta presentaron la mayor población final del nematodo con 79, 61, 1.882, 965 y 2.087 nematodos/1g de raíz, respectivamente, a los 56 días después de la inoculación, en condiciones de cribado in vitro. En otros estudios realizados por Stoffelen et al. (1999) también reportaron altas poblaciones de R. similis con 60.400 nematodos/100 g de raíces en Musa AAA ‘Grand Naine’ de Malasia y 63.100 nematodos/100 g de raíces en el mismo material en Vietnam, a las 8 semanas después de la inoculación con 1.000 R. similis, bajo condiciones controladas. En Sudáfrica, Daneel et al. (2015) obtuvieron poblaciones similares a las obtenidas en el presente estudio en los genotipos de Musa AAA ‘Chinese Cavendish, Grand Nain y Williams’ con poblaciones de 65.900, 50.900 y 50.500 nematodos/100g de raíces, respectivamente, a las ocho semanas después de la inoculación con 2.000 R. similis, en condiciones de invernadero. Así mismo, Sarah et al. (1993) en plantas de Musa AAA ‘Poyo’, reportaron 34.800 nematodos/100g de raíces en poblaciones de R. similis provenientes de Costa Rica, las cuales fueron inoculadas con 200 hembras de R. similis.
También, Marín et al. (2000) reportaron que los efectos del nematodo en raíces de materiales susceptibles como ‘False Horn, Grand Naine, Valery y Lacatan, reportaron 41.930, 21.950, 17.740 y 16.775 nematodos/100g de raíces, respectivamente, a las 8 semanas después de la inoculación con 100 hembras de R. similis, en condiciones de invernadero. Fallas y Marbán-Mendoza (1994) obtuvieron poblaciones finales de R. similis de 26.500, 15.900, 12.500 y 7.400 nematodos/100g de raíces en plántulas de grand naine, curraré, Bras-9 y yangambi, respectivamente, a los 60 días después de la inoculación con 100 nematodos/planta en Costa Rica. Igualmente, Marín et al. (1999) observaron poblaciones finales de 25.000 nematodos/100g de raíces en plántulas de Musa AAA, a los 56 ddi con 200 R. similis. Densidades de población inferiores a las obtenidas en este estudio reportaron Plowright et al. (2013) al evaluar la patogenicidad de R. similis de poblaciones de Uganda en materiales de Musa AAA ‘grand naine’, donde obtuvieron poblaciones finales de 1.936 nematodos/100g de raíces, a las 12 semanas después de la inoculación con 100 R. similis.
En conclusión, las plántulas de plátano Musa AAB ‘Dominico Hartón’, Musa ABB ‘Guineo’, fueron afectados por las diferentes densidades de población de R. similis a los 60 y 90 días después de la inoculación, en condiciones de almácigo, porque tuvieron menores valores en las variables PSTP y LR y mayores en las variables INR y DC, al igual que altas PFNR y PFNS, siendo altamente susceptibles. Mientras que las plántulas de banano Musa AAA ‘Gros Michel’ y Musa AA ‘bananito’ también fueron afectadas por el nematodo, pero con menor daño que las de los genotipos de plátano en los parámetros antes mencionados. Estos resultados son esenciales en las eventuales estrategias de manejo integrado de R. similis, en condiciones de campo.