Introducción
Los escarabajos Dynastini (Coleoptera: Melolonthidae: Dynastinae) registran en Colombia tres géneros y 14 especies (Apolinar-María, 1944, 1945; Blackwelder, 1944; Endrodi, 1985; Figueroa-Potes, 1977; Gasca-Álvarez et al., 2006, 2018; Hardy, 1972; Huang, 2017; Hwang, 2011; Kobayashi, 2019; Krajcik, 2005; Nagai, 2003; Pardo-Locarno, 2005; Pardo-Locarno et al., 2020; Prandi, 2018a, 2018b; Restrepo et al., 2003; Van Meenen y Schouteet, (2018); particularmente el género Megasoma K (con unas 20 especies), registra en Colombia cuatro: M. actaeon (L), de la Orinoquia y Amazonia; M. elephas Fabr., de la región Caribe y Bajo Magdalena; M. janus ramirezorum Silvestre & Arnaud, del Pacífico colombiano y M. mars Reiche, de la región amazónica (Endrödi, 1985; Pardo-Locarno et al., 2020; Ratcliffe et al., 2020; Restrepo et al., 2003); este género por sí mismo, constituye una elite entre los escarabajos, conformada por gigantes del mundo insectil, cuya morfología ha sido jalonada por la selección sexual (Eberhard, 1980; Emlen et al., 2005), lo que expone machos cornudos, lustrosos o coloreados y hembras con tórax y cabeza inerme y dorso regularmente negro unicolor (Arrow, 1951; Lachaume, 1985; Endrödi, 1976); no obstante, allí no terminan las particularidades de este grupo, que en algunos parámetros biológicos diverge de la mayoría de los patrones insectiles, al desarrollar ciclos de vida largos (Pardo-Locarno et al., 2021; Snodgrass, 1967); además, mantienen relaciones estenotípicas con formaciones vegetales húmedas, en especial selvas en buen estado de conservación (Apolinar-María, 1944, 1945; Arrow, 1951; Figueroa-Potes, 1977; Lachaume, 1985; Pardo-Locarno, 2005; Pardo-Locarno et al., 2020); no obstante algunos logros nacionales (Amat et al., 2003; Gasca-Álvarez et al., 2010, 2018; Pardo-Locarno, 1993), la biología y ecología de estas carismáticas especies han permanecido poco exploradas, nacionalmente lo que contrasta con el permanente ejercicio lúdico que inspiran en países asiáticos y europeos (Miwa, 2011); resalta la poca presencia de proyectos nacionales a largo plazo (Amat et al., 2003; Gasca-Álvarez, 2011; Pardo-Locarno, 1997, 2006b, 2011, 2020); lo que en gran parte explicaría el poco avance en la investigación, que permita desentrañar la biología y distribución de esta elite de escarabajos; ello resulta muy preocupante, en la medida en que los mapas de distribución de estos escarabajos famosos, precariamente conocidos, se achican abruptamente, dado el inmenso proceso de desmonte de selvas en Colombia, que en las últimas décadas ha alcanzado cifras récord (Grossi et al., 2008; Pardo-Locarno et al., 2020; Santos et al., 2013); atendiendo estos vacíos, esta investigación se propuso describir los inmaduros y realizar los ciclos de vida de Megasoma actaeon L, M. elephas F y M. janus ramirezorum Silvestre & Arnaud (Coleoptera: Melolonthidae: Dynastinae) en Colombia.
Materiales y métodos
A continuación, se exponen de manera sucinta los principales componentes para ciclos de vida, toma de datos biométricos, fijación de ejemplares para estudio taxonómico y artes fotográficas.
Ciclos de vida. Para profundizar sobre la biología de las especies, se tuvieron en cuenta los protocolos de cría en bioterio (Morón y Deloya, 2001; Pardo-Locarno et al., 2021); aunque existe mucha información valiosa en la web al respecto, en su mayoría como ejercicio lúdico, la investigación formal sigue siendo una actividad muy marginal (Gasca-Álvarez, 2005, 2011; Pardo-Locarno, 1997, 2006a, 2011; Pardo-Locarno et al., 2021); en este sentido, se cubrieron vacíos en lo referente a dieta y asepsia; en cada caso los adultos se confinaron en bioterios, dotados de alimento y sustrato (mixtura de sustratos orgánicos y madera descompuesta); los huevos y larvas obtenidos se individualizaron en recipientes, etiquetados con el nombre de la especie y datos de origen, fechas de revisión, etc. La toma de datos biométricos se realizó cada 15 días, e incluyó anchura de capsula cefálica (sensu Dyar 1890), idem para anchura corporal; en algunos casos se tuvieron ensayos in situ (Bajo Calima) y en la mayoría se desarrollaron ciclos ex situ (Palmira, 24 m2, 985 msnm, 24° C, humedad relativa de 70-80%); todo en parte guiado por la literatura disponible y experiencias adquiridas en ensayos previos (Morón y Deloya, 2001; Morón y Pardo-Locarno, 1994; Pardo-Locarno, 1997, 2006, 2011, Pardo-Locarno et al., 2021); en ese proceso, el primer autor compartió diálogos con Miguel Ángel Morón (1993 y 2003), en Xalapa, Veracruz, México, sobre sus experiencias en la cría de dos especies de Megasoma en México (Morón, 1977; Morón y Deloya, 2001); algunas experiencias fueron aportadas por los señores Atsumi Kawashima y Kazuo Noboru (World Insects Kingdom).
Morfología larval. Larvas saludables, de tercer instar, previamente insensibilizadas en frío, se sumergieron por 4-5 minutos en agua caliente (punto de ebullición), luego de enfriadas, se almacenaron en solución de formol, alcohol y agua destilada (20-20- 60 en volumen); el recipiente fue etiquetado con los datos de especie, fecha, origen parental, fechas de desarrollo y de fijación (Morón y Pardo-Locarno, 1994; Pardo-Locarno, 2006); en el caso de pupas, se tuvo cuidado de fijar y almacenar la exuvia respectiva; algunos pocos adultos, ya muertos, se fijaron en la misma solución, sin tratamiento térmico; las estructuras que fueron disectadas se almacenaron en viales con su respectiva larva; la descripción de inmaduros se basó en Costa et al. (1988), Morón (1984), Morón y Pardo-Locarno (1994), Pardo-Locarno et al. (2021), Ratcliffe y Morón (2005), Ritcher (1966) y Van Dam et al. (2006); las muestras de estudio han permanecido en la colección del primer autor (CFPL-COL).
Artes gráficas. Este ejercicio se realizó con equipos de estereoscopia y cámaras NikonR, OlympusR y Vision Scientific VZE-VZFR, el segundo autor realizó tomas fotográficas de ejemplares obtenidos en cría ex situ en Japón con equipos Nikon.
Marco institucional. Esta investigación ha tenido una afortunada continuidad, en diferentes proyectos, desde 1997 (Pardo-Locarno, 1997; CVC-Patrimonio Ambiental, OTGVS 038); fases siguientes de ciclos de vida fueron apoyados por el IIAP (1998-2003), CVC (2010-2012, convenio CVC-AAFP 218-2010); más recientemente, el proyecto recibió continuidad por parte de Corpoamazonia (Convenio 312 de 2020); múltiples actividades biométricas y de laboratorio se realizaron entre 2008-2010 (CFPL-COL) y desde 2017-2021 como parte de la línea de investigación agrobiodiversidad y oferta ambiental del grupo de investigación Pluviselva, Sostenibilidad y Comunidades (Unipacifico, Corpovalle).
Resultados
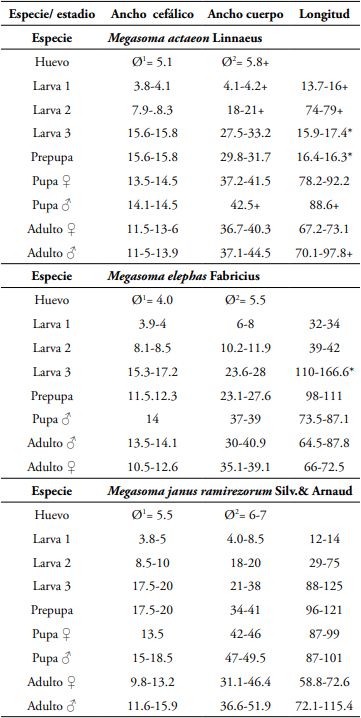
Inicialmente se expondrá la clave con los nuevos logros de descripción y redescripciones, así como la adición de Megasoma sleeperi Hardy (Van Dam et al., 2006); paso seguido, las descripciones de larva de tercer instar y pupas de M. actaeon (L), M. elephas Fabr. y M. janus ramirezorum Silvestre & Arnaud (Coleoptera: Melolonthidae: Dynastinae); Los datos de los ciclos de vida y de crecimiento, de las tres especies estudiadas, se presentan a continuación en las Tablas 1 y 2.
Tabla 1 Datos de los ciclos de vida de Megasoma actaeon L, M. elephas F y M. janus ramirezorum Silvestre & Arnaud; la duración se presenta en días (abreviaturas: L1: larva I, primer estado; L2: larva II, segundo estado; L3: larva III, tercer estado; PP prepupa; P: pupa; N: cantidad de observaciones; +: la cifra podría ser mayor; adulto obtenido en cría y/o parental; +*ver texto para más explicaciones).
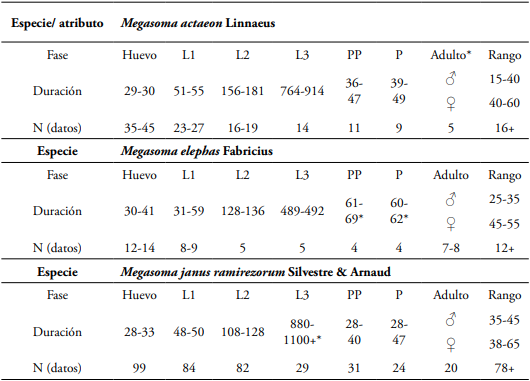
Tabla 2 Medidas corporales (mm) de los estadios de desarrollo y adultos parentales de la cría de Megasoma actaeon L, M. elephas F y M. janus ramirezorum Silvestre & Arnaud (abreviaturas: Ø1 huevo recién puesto; Ø2 huevo elongado; L1: larva I, primer estado; L2: larva II, segundo estado; L3: larva III, tercer estado; PP prepupa; P: pupa; Adulto* obtenido en cría y/o parental; N: cantidad de observaciones; +: la cifra podría ser mayor; * ver comentarios para más explicaciones).
Clave para larvas de tercer instar de Megasoma
(Adicionado y modificado desde Ratcliffe y Morón (2005), Van Dam et al., (2006)
1 Diámetro de los espiráculos abdominales progresivamente ensanchados posteriormente, especialmente, desde el segmento V a VIII. Maxila con 41 u 8 dientes estriduladores. Anchura máxima craneal de 11-18 mm. 2
1’ Diámetro de los espiráculos abdominales progresivamente reducidos posteriormente, especialmente desde el segmento V a VIII. Maxila con 5-7 dientes estriduladores. Ancho máxima craneal de 7-9 mm. 6
2 Bulla de los espiráculos transversa, elevada, con ápice agudo. Último segmento antenal con 10-14 fosetas sensoriales dorsales. Frente con una seta frontal posterior a cada lado. Dexiotorma estrecha, alargada. Anchura máxima de la cápsula cefálica 11,3 mm. M. pachecoi Cartwright.
2’ Bulla de los espiráculos vertical, ligeramente prominente, redondeada. Último segmento antenal con 8-11 fosetas sensoriales dorsales. Frente con dos a cuatro setas frontales posteriores a cada lado. Dexiotorma ancha, angulosa. Ancho máximo de la cápsula cefálica 15-18 mm. 3
3 Frente con 70-80 setas frontales. Dorso del segmento abdominal I sin setas cortas espiniformes, solo con setas largas y delgadas. Campus con 4-6 setas largas y delgadas. M. elephas (F.)
3’ Frente con 4 a 8 setas frontales. Dorso del segmento abdominal I con una mezcla de setas largas y delgadas y setas cortas espiniformes. Campus con 20-28 setas. 4
4 Cada tarsúngulo con 4 setas. Frente con cuatro setas frontales. Maxila con 8 dientes estriduladores. Último segmento antenal con 8 fosetas sensoriales dorsales M. occidentalis Bolívar y Peltain, Jiménez-Asúa, & Martínez.
4’ Cada tarsúngulo con dos setas. Frente con ocho a 16 setas frontales. Maxila con cuatro a cinco dientes estriduladores. Último segmento antenal con 10-12 fosetas sensoriales dorsales. 5
5 Frente con ocho a 10 setas frontales. Maxila con cuatro dientes estriduladores. Último segmento antenal con 10-11 fosetas sensoriales dorsales. M. actaeón (L.)
5’ Frente con 12 a 14 setas frontales. Maxila con cuatro a cinco dientes estriduladores. Último segmento antenal con 11-12 fosetas sensoriales dorsales. M. janus ramirezorum Silvestre & Arnaud.
6 Lóbulos de los espiráculos respiratorios separados. Acanthoparia con 10-14 setas. Frente con tres a cuatro setas frontales posteriores a cada lado. 7
6’ Lóbulos de los espiráculos respiratorios contiguos o casi contiguos. Acanthoparia con cinco a nueve setas. Frente con cinco a siete setas frontales posteriores a cada lado. 9
7 Último segmento antenal con siete fosetas sensoriales dorsales. Maxila con 7 dientes estriduladores. Dorso de los segmentos abdominales I-II con una mezcla de setas largas y delgadas y setas cortas espiniformes. Frente con dos setas dorsoepicraneales y 46 setas epicraneales a cada lado; faltan setas frontales anteriores. M. tersites LeConte.
7’ Último segmento antenal con 4-5 fosetas sensoriales dorsales. Acanthoparia con 10 setas. 8
8 Maxilas con cinco dientes estriduladores. Dorso de los segmentos abdominales I-II con solo setas largas y delgadas. En la mandíbula derecha2 S4 y S5 son iguales. M. cedrosa Hardy.
8’ Maxila con siete a ocho dientes estriduladores. Dorso de los segmentos abdominales I con solo setas largas y delgadas; segmento II: primer anillo con cuatro filas de setas largas y con muy pocas setas cortas espiniformes en la superficie dorsal. En la mandíbula derecha el espacio entre S4 y S5 es mayor. M. sleeperi Hardy.
9 Frente con seis a siete setas frontales anteriores. Dexiotorma ancha, truncada. Dorso del segmento abdominal I con una mezcla de setas largas delgadas y setas cortas espiniformes. Bulla de los espiráculos irregularmente redondeada, vagamente trilobulada. Campus con 18 setas. M. vogti Cartwright.
9’ Frente sin setas frontales anteriores. Dexiotorma estrecho, alargado. Dorso del segmento abdominal I con setas largas y delgadas, sin setas cortas espiniformes. Bulla espiracular ligeramente convexa, redondeada. Campus con 28-30 setas. M. punctulatus Cartwright.
Key to the Third Instar Larvae of Megasoma
(Added and modified from Ratcliffe and Morón (2005) and Van Dam et al. (2006)
1 Diameter of abdominal spiracles progressively enlarged posteriorly, mainly from segment V to segment VIII. Maxilla with 4 or 8 stridulatory teeth. Maximum width of cranium 11-18 mm 2.
1’ Diameter of abdominal spiracles progressively reduced posteriorly, mainly from segment V to segment VIII. Maxilla with 5-7 stridulatory teeth. Maximum width of cranium 7-9 mm. 6
2 Bulla of spiracles transverse, raised, with acute apex. Last antennal segment with 10-14 dorsal sensory spots. Frons with 1 posterior frontal setae on each side. Dexiotorma narrow, elongate. Maximum width of head capsule 11.3 mm. M. pachecoi Cartwright.
2’ Bulla of spiracles vertical, slightly prominent, rounded. Last antennal segment with 8-11 dorsal sensory spots. Frons with 2-4 posterior frontal setae on each side. Dexiotorma wide, angular. Maximum width of head capsule 15-18 mm. 3
3 Frons with 70-80 frontal setae. Dorsum of abdominal segment I without short, spine-like setae, only with long, slender setae. Campus with 4-6 long, slender setae. M. elephas (F.)
3’ Frons with 4 or 8 frontal setae. Dorsum of abdominal segment I with mixture of long, slender setae and short, spine-like setae. Campus with 20-28 setae. 4
4 Each tarsungulus with 4 setae. Frons with 4 frontal setae. Maxilla with 8 stridulatory teeth. Last antennal segment with 8 dorsal sensory spots M. occidentalis Bolivar and Peltain, Jimenez-Asúa, & Martinez.
4’ Each tarsungulus with 2 setae. Frons with 8-16 frontal setae. Maxilla with 4--5 stridulatory teeth. Last antennal segment with 10-12 dorsal sensory spots. 5
5 Frons with 8-10 frontal setae. Maxilla with 4 stridulatory teeth. Last antennal segment with 10-11 dorsal sensory spots. M. actaeon (L.)
5’ Frons with 12-14 frontal setae. Maxilla with 4-5 stridulatory teeth. Last antennal segment with 11-12 dorsal sensory spots. M. janus ramirezorum Silvestre & Arnaud.
6 Lobes of respiratory plates of spiracles separated. Acanthoparia with 10-14 setae. Frons with 3-4 posterior frontal setae on each side. 7
6’ Lobes of respiratory plates of spiracles contiguous or nearly so. Acanthoparia with 5-9 setae. Frons with 5-7 posterior frontal setae at each side. 9
7 Last antennal segment with 7 dorsal sensory spots. Maxilla with 7 stridulatory teeth. Dorsa of abdominal segments I-II with mixture of long, slender setae and short, spine-like setae. Frons with 2 dorsoepicranial setae and 46 epicranial setae on each side; anterior frontal setae lacking. M. thersites LeConte.
7’ Last antennal segment with 4-5 dorsal sensory spots. Acanthoparia with 10 setae. 8
8 Maxilla with 53 stridulatory teeth. Dorsa of abdominal segments I-II with only long, slender setae. On the right mandible4 S4 and S5 are equal. M. cedrosa Hardy.
8’ Maxilla with 7-8 stridulatory teeth. Dorsa of abdominal segments I with only long, slender setae; segments II: first annulet with four rows of long setae, and with very few spinelike setae on dorsal surface. On the right mandible the spacing between S4 and S5 is greater. M. sleeperi Hardy.
9 Frons with 6-7 anterior frontal setae. Dexiotorma wide, truncate. Dorsum of abdominal segment I with mixture of long, slender setae and short, spine-like setae. Bulla of spiracles irregularly rounded, vaguely trilobed. Campus with 18 setae. M. vogti Cartwright.
9’ Frons without anterior frontal setae. Dexiotorma narrow, elongate. Dorsum of abdominal segment I with long, slender setae, without spine-like setae. Bulla of spiracles slightly convex, rounded. Campus with 28-30 setae. M. punctulatus Cartwright.
Megasoma actaeon Linnaeus, 1758
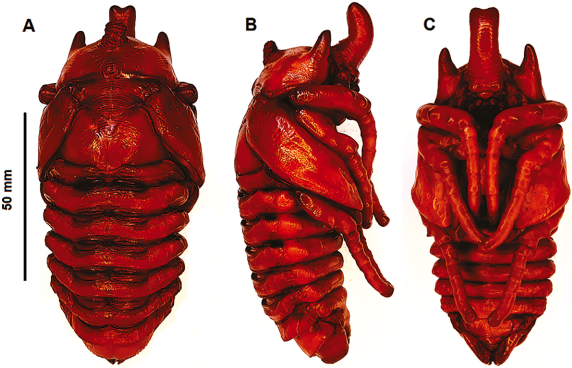
Redescripción de larva de tercer instar (Figuras 1, 2, 3, 4)
Basado en dos larvas de tercer instar y cinco exuvias de larvas de tercer instar, obtenidas desde una postura de hembras de junio de 2018 y fijada como larva de tercer instar en enero 8 de 2020 (CFPL-COL).
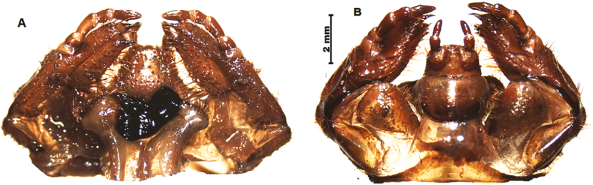
Cabeza. Ancho cefálica 17-19 mm (Figura 1, 5), superficie negra, rugosa y punturada, punturas profundas, umbilicales, en algunos casos coalescentes; frente con 4-5 setas frontales posteriores, ocho a 10 setas frontales largas, 2 setas largas en el ángulo anterior frontal, contiguas, 8-10 setas dorso-epicraneales, con entre 40-50 setas epicraneales, 4-5 setas paraocelares largas a cada lado; ojos poco visibles, pero definidos como una mácula ámbar; clípeo trapezoidal, con dos largas setas a cada lado, una seta larga a cada lado del disco, densamente punturado, punturas separadas por dos o tres diámetros, rugosidad suave en el disco y más pronunciadas en el borde posterior, seis a ocho setas posteriores clipeales; labro ligeramente asimétrico, con una seta discal a cada lado, entre 18-20 setas largas en el borde posterior y aproximadamente 8-10 setas en el borde anterior, superficie finamente chagrinada, con punturado irregular, punturas gruesas más abundantes sobre el disco, separadas aproximadamente por uno o dos diámetros.
Epifaringe. Zygum y epizygum fusionados formando un pico convexo, esclerosado (Figura 1C); heli y plegmatia ausentes; acanthoparia con 12 setas algo curvadas; gymnoparia angosta, esclerosada y ensanchada en la parte media; acroparia ensanchada, conformada una por 14-16 setas y la otra entre 18-20; corypha de 5-6 setas largas, proyectadas al disco de la epifaringe; chaetoparia izquierda con más de 50 setas robustas y algunas pocas sensilias, setas más gruesas en torno al pedium, que es amplio y oval; epitorma vagamente trazada; chaetoparia derecha similarmente conformada con las espinas más gruesas en torno al pedium; dexiotorma larga, en forma de barra, ensanchada en su ápice externo; placa esclerosada, triangular; cono sensorial largo y con el ápice ensanchado globular; laeotorma larga en forma de barra con pternotorma globular grande, color ámbar, dexiophoba y laeophoba multisetosas.
Mandíbulas. Izquierda (Figura 2A y 2B) con una gran área incisiva, la apical (S1 y S2) triangular aguzada, sigue una muesca incisiva ancha bien definida; el incisivo 3 presenta ápice redondeado, sigue una muesca ensanchada que da paso a un incisivo pequeño de ápice redondeado; área media inerme; área molar conformada, por una primera corona alta, de ápice aguzado, luego dos coronas fusionadas; calx triangular obtuso, brustia con 3-4 setas; scrobis ancho con 2 o 3 setas en el surco; mandíbula izquierda con acia corta. Mandíbula derecha (Figura 2C y 2D) con área incisiva conformada por un incisivo apical, formado por una muesca ancha separado del incisivo III que es de ápice obtuso y está separado por un área inerme corta, de otro incisivo más corto y de ápice redondeado; sigue el área media inerme, larga, que lleva al área molar conformada por dos molares, el primero con corona reducida y el segundo con la corona grande y ensanchada; calx corto; área estriduladora ventral ovalada y conformada por cerca de 20 surcos, de los cuales los primeros 10-12 son más anchos y ocupan más del 50%.
Maxila. Galea con uncus apical prominente, lacinia con tres unci apicales, contiguos, área estriduladora maxilar conformada por cuatro dientes gruesos y romos, proceso truncado, transverso y ancho (Figura 3A, 3B); labio cuadrangular con el disco poco setoso, borde y ápice multisetoso; escleroma hipofaringeo grande, esclerosado y pigmentado con un diente en su porción derecha, lóbulos laterales multisetosos.
Antena. Último segmento antenal, dorsalmente, con 10-11 áreas sensoriales dorsales, disímiles en tamaño, ventralmente con 10-12 fosetas igualmente disimiles en tamaño (Figura 4A, 4B).
Tórax. Escleroma lateral color ámbar, con ápice superior redondeado y ápice basal cóncavo en forma de media luna que rodea el estigma respiratorio (Figura 1A, 5A); borde posterior con un surco irregular de 10-12 setas largas, con poros blancos; región central con un grupo de siete a ocho setas agrupadas. Perímetro poco setoso; estigma respiratorio con la bulla poco convexa, vertical, lóbulos próximos, casi contiguos (Figura 1B); dorso de pro, meso y metanoto con decenas de setas finas, largas (100-110), no se observan setas cortas espiniformes; espiráculo torácico de 2,8-2,4 mm; bulla redondeada central algo prominente; lóbulos de la placa respiratoria contiguos y ligeramente disímiles entre sí.

Figura 2 M. actaeon: mandíbulas, A. mandíbula izquierda dorsal; B. mandíbula izquierda ventral; C. mandíbula derecha dorsal; D. mandíbula derecha lateral.
Patas. Uñas del primer par de patas con un ápice agudo y esclerosado, al final una seta gruesa pre-apical, más abajo una seta larga en posición externa; uña del segundo par de patas con apéndice esclerosado muy corto y dotado con una seta pre-apical y otra basal; uña del tercer par de patas con el apéndice esclerosado y corto, par de setas alternas de las cuales una es pre-apical y la otra basal (Figura 4C, 4D).

Figura 4 M. actaeon: A. Antena; B. último segmento antenal; C. Primer par de patas, D. tarsungulo, mostrando la uña y las setas.
Abdomen. Dorso de los segmentos I-VI con prescutum, scutum y scutellum, dotados de bandas setosas, transversales, con decenas de setas cortas espiniformes y una alineación posterior de setas largas distintivas; segmento VII con el dorso conformado por dos áreas notales cada una con decenas de setas cortas espiniformes y muy pocas setas largas; dorso del segmento VIII evidencia una sola placa tergal con decenas de setas cortas espiniformes y pocas setas largas; área superior con áreas calvas; segmento IX similar al segmento VIII con una sola placa tergal, decenas de setas cortas espiniformes y pocas setas largas; segmento X similar a los anteriores, dotado de setas cortas espiniformes.
La región ventral o área pedal de los segmentos abdominales I-VI con bandas multisetosas; segmentos V-VIII con banda de setas mucho más escasa.
El ráster carece de palidia y septulas, presenta pocas setas largas en el campus, teges poco setoso, en su mayoría setas largas; barbula densamente multisetosa, labio anal inferior multisetoso, setas largas más abundantes en el borde o proximidad de la abertura anal; labio anal superior con múltiples (decenas) de setas cortas espiniformes y algunas setas largas.
Espiráculos abdominales de los segmentos I-VI ovalados (2,5 x 1,8 mm aproximadamente), espiráculos abdominales de los segmentos VII-VIII redondeados y un poco más grandes (2,6 - 2,9 mm aprox.); lóbulos de las placas respiratorias contiguos; bulla redondeada y algo convexa o prominente.
Longitud corporal: 12,5 - 13,3 cm; máxima ancho del tórax visto dorsalmente 29 - 31 mm; máxima ancho abdominal vista dorsalmente 32-34 mm (Tabla 2).
Megasoma actaeon Linnaeus, 1758
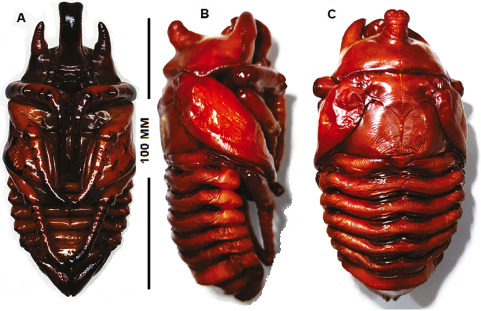
Pupa de Macho (♂): Descripción (Figura 6A, 6B y 6C)
Basado en una pupa de cría iniciada en 2017, fijada en enero de 2021; una pupa obtenida en una cría ex situ en Japón (Sr. K. Teranishi), fotografiada por el segundo autor; dos exuvias de pupa fueron compartidas en 2003 por R. Wanninger, desde cría ex situ en Alemania. ♂ cuerpo alargado, robusto exarato; color pardo oscuro y rojizo glabro.
Cabeza. Grande ubicada ventralmente en el protórax; ápice frontal con un gran cuerno que se proyecta hacia adelante y hacia arriba, el ápice es amplio y bifurcado; piezas bucales (clípeos, palpos, etc.) claramente bosquejados en su porción apical. Ojos poco visibles, estuche antenal grande, segmento apical con varios anillos claramente conformados; labrum sub ovalar; dos veces más ancho que largo; en el disco con dos ranuras transversas; ápices mandibulares y maxilares expuestos; palpo maxilar proyectado en forma cónica y con cuatro anillos; ápice labial visible semi-bifurcados.
Tórax. Protórax transverso, pronotum amplio, oblicuamente proyectado, dotado de proyecciones agudas y curvas lateralmente; al centro (disco) con una gruesa proyección de ápice ensanchado y levemente bifurcado; 8-9 franjas se observan desde el ápice a la base. El borde anterior redondeado y el posterior casi recto con un tubérculo obtuso central y dos esquinas laterales curvadas; dorso levemente lustroso con trazado de líneas transversas irregulares. Mesotórax visible dorsalmente como una pieza corta pero ancha, proyectada hacia atrás en forma triangular. Presenta oquedades en el borde lateral, líneas transversas y un fino trazado central longitudinal, ventralmente oculto por las patas.
Metatórax dorsalmente muy grande sub-trapezoidal más ancho que largo, borde anterior cóncavo, a los lados en corte oblicuo que se ensancha hacia atrás. Borde posterior con un ensanchamiento redondeado o proyección central. Estuche de patas y alas muy grandes, las patas con las piezas basales transversas y los ápices proyectados hacia atrás, estas piezas dejan ver anillos y bordes tarsales; estuches alares contiguos con la porción apical bajo los estuches del segundo par de patas; ápice de los estuches de las patas metatorácicas se proyectan hasta casi el ápice abdominal.
Abdomen. Nueve segmentos visibles, progresivamente angostados hasta llegar al ápice; espiráculos de los segmentos II-IV visibles; peritrema pigmentado y lustroso (4,1 x 1,2 mm aproximadamente), espiráculos de los segmentos V-VI vestigiales y ocultos, mientras que para el segmento VII son vestigiales pero visibles. Los segmentos II-V son similares en forma y tamaño; cinco pares de estructuras dioneiformes ubicadas entre los segmentos II-VI, cada uno profundo y ensanchado (15-16 mm de ancho y 1,8-2 mm de largo, aproximadamente); segmento VII dorsalmente plano, lustroso, con el borde posterior claramente aserrado, cada espina separada en la base y con el ápice obtuso; en el borde anterior con dos oquedades laterales (más grandes y profundas). Segmento VIII similar pero más largo (dos veces), con dos oquedades centrales (una a cada lado) y el borde posterior similarmente aserrado. Segmento IX con el ápice aguzado bifurcado, cada ápice con 7-8 surcos longitudinales contiguos a cada lado. Ámpula genital poco visible.
Longitud: 92-93 mm; ancho máximo: 48-49 mm (Tabla 2).
Megasoma actaeon Linnaeus, 1758
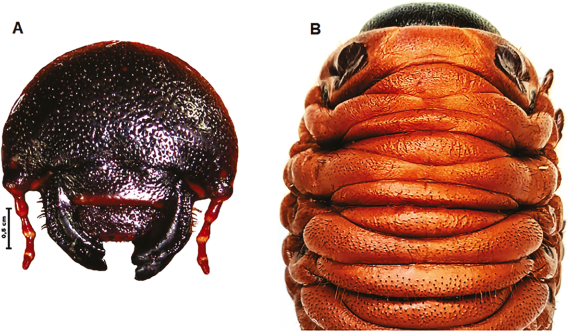
Pupa de Hembra ♀ Descripción (Figura 5B, 5C y 5D)
Basado en dos pupas ♀ de cría iniciada en 2017, fijada en enero de 2021; dos exuvias de pupa de la cría obtenidas en 2021; una exuvia de pupa enviada en 2003 por Ruppert Wanninger desde cría ex situ en Alemania.
Muy similar al macho, se diferencia por la cabeza inerme, región frontal con surco transversal irregular y múltiples pliegues o arrugas irregulares; pronoto inerme, integumento con trazos transversos irregulares; disco convexo con un tubérculo muy pequeño; bordes laterales anteriores, con cuernos cortos (Figura 5B, 5C), sus ápices cortos y dirigidos hacia la cabeza; ámpula genital hundida, al final levemente cóncava con diseño de líneas transversales. Longitud: 96 mm; ancho máximo: 45-46 mm (Tabla 2).

Figura 5 M. actaeon: A. larva de tercer instar, vista lateral; B, C, y D. pupa: B frontal; C. lateral; D. ventral.
Biología. Los ensayos permitieron observar dos ciclos de vida (Tablas 1 y 2); la media de duración por ciclo para de vida para M. actaeon fue 3, 2-3, 3 años (aprox. 1150-1170 días), con una cola del grupo que osciló entre 3,5 a 3,6 años (1270- 1310 días); en ambos casos se obtuvieron machos y hembras (Pardo-Locarno, in litt); en ese contexto la larva de tercer instar rondó los 2, 3 años (764-914 días), con el grupo más demorado que abarcó 2,8-2,9 años (994-1154 días); el estadio III fue la fase que marcó la duración del ciclo de vida; los estadios de prepupa y pupa promediaron los 30-40 días cada uno; el de huevo 29-30 días y el de larva de primer instar (LI) 29-30 días; los datos aquí expuestos se alejan un poco de lo logrado por Radnai (1994): 2,8 años (893-983 días); esta diferencia podría, quizás, explicarse por el rango de temperatura permanente del zoocriadero empleado por el autor (23-27°C), el cual difiere del usado en este ensayo, que fluctuó, de manera natural, a menor temperatura (rangos de 19-28°C) entre día y noche; respecto a los adultos también se obtuvieron datos preliminares que a continuación se mencionan basados en 49-52 adultos examinados (en su mayoría reunidos alrededor de plataformas petroleras), aproximadamente un 30% de los adultos duró entre 35-40 días (este fue el caso para la mayoría de los machos); un 50% de los adultos alcanzó una longevidad de 40-60 días, algo especialmente notable en hembras; finalmente, menos del 10% logró vivir poco más de 120 días, algo que solo se observó en unas pocas hembras, obtenidas en laboratorio, estos ejemplares evidenciaron pérdida de tarsos y muy poca actividad reproductiva al final de su ciclo.
Los datos de M. actaeon evidenciaron crecimientos a nivel de huevo: elongación de corión desde 5,1-5,8 mm, con cambio en la coloración de blanco muy nítido a blanco grisáceo y una leve transparencia del corión que dejaba ver vagamente la larva al interior, todas las medidas corporales de los estados larvales variaron de acuerdo al crecimiento, observándose datos más discretos en las medidas de la cápsula cefálica (que varió desde 3,8-4,1 mm en L1, 7,9-8,3 en L2 a 15,6-15,8 en L3); de otro lado, los datos de ancho y longitud corporal variaron en forma continua en todos los casos.
No obstante, los ciclos de vida fueron exitosos, en parte debido, a que los protocolos aplicados lidiaron exitosamente con las amenazas conocidas (Radnai, 1994), entre ellos ácaros depredadores de huevos y de larvas (H, LI), microbios entomopatógenos como bacterias y hongos (Metarhizium sp., por ejemplo); estas cifras constituyen buenas noticias para un programa de cría artificial de este escarabajo para repoblación (conservación) o biocomercio (Pardo-Locarno, 1997, 2006, 2020).
Megasoma elephas Fabricius, 1775
Larva de tercer instar, redescripción (Figuras 7, 8, 9, 10)
Basado en una larva de tercer instar criada desde agosto 19 de 2003 y fijada en febrero de 2004; dos exuvias larvales obtenidas de larvas criadas desde marzo 15 de 2003 y obtenidas como adultos entre febrero-marzo de 2005.
Cuerpo robusto, cabeza negra con un ligero lustre, tórax y abdomen cubiertos de una pubescencia densa (Figura 11A).
Cabeza. Ancho máxima de la cápsula cefálica de 19-20 mm (Figura 7A), superficie negra, gruesamente punturada, punturas profundas separadas por aproximadamente un diámetro, a veces coalescentes; frente densamente punturada, punturas basales un poco más pequeñas, disco o parte posterior con punturación más densa y gruesa, a veces coalescente, a cada lado con cuatro setas frontales posteriores, con 70-80 setas frontales anteriores, dos-tres setas frontales exteriores, seis-siete setas en el ángulo frontal, cuatro-cinco setas dorso-epicraneales, entre 40-50 setas cortas epicraneales, cinco a ocho setas paraocelares; clípeo trapezoidal, con dos setas largas a cada lado, cuatro a seis setas basales, punturado grueso e irregular, disco rugoso, suavemente chagrinado; labro ligeramente asimétrico, con los lados redondeados, chagrinado, con seis a ocho setas a cada lado; disco irregularmente punturado, punturas notables más grandes, con el doble de diámetro que las otras; en la mitad posterior punturado más grueso y separado por uno o más diámetros.
Epifaringe. Haptomerum prominente, convexo, zygun y epizygun fusionados, pigmentados, en forma de carina triangular; heli y plegmatia ausentes. Chaetoparia derecha con 80-100 espinas cortas y unas 20-25 sencillas; chaetoparia izquierda con 70-80 setas cortas en forma de, y muy cortas sencillas, cuatro a cinco acroparia con entre seis a 10 setas gruesas rectas sobre cada lado, corypha de siete a ocho setas robustas; acanthoparia sin setas; gymnoparia anchas, más ensanchadas en la parte media; pedium ancho sub-ovalar, epitorma visible suavemente en forma de surco; dexiotorma larga y en forma de barra, se observa un ensanchamiento basal esclerotizado; laeotorma larga, con pternotorma ligeramente globular; dexiophoba con siete a ocho setas, laeophoba con 10-12 setas; placa esclerosada, triángular y prominente, cono sensorial en forma de barra larga esclerotizada, pigmentada con el ápice redondeado; crepis suavemente delineado (Figura 8A).
Mandíbulas. Derecha (Figura 9C y 9D) con tres dientes incisivos, D1 + D2 fusionados, separados de D3 por una angosta abertura incisiva, sigue un diente basal redondeado; área molar con tres coronas poco definidas, calx largo y brustia esparcida; mandíbula izquierda (Figura 9A, 9B) con área incisiva triangular, conformada por tres incisivos vagamente separados por pequeños surcos y un diente basal redondeado, área molar con dos coronas, brustia esparcida, acia corta con ápice redondeado; área estriduladora ovalada, conformada por 40-50 estrías, de la cuales las primeras 18 son más anchas, mientras que las restantes son más angostas.
Maxila. Galea con uncus apical bien definido, lacinia con tres unci alineados y fusionados en la base; área estriduladora maxilar conformada por un surco de ocho dientes redondeados al final seguidos de un diente truncado; labium multisetoso, en el disco y en el borde; hipofaringe con el escleroma hipofaringeo visible y esclerotizado, lóbulo lateral izquierdo con ocho a 10 setas cortas, el escleroma hipofaringeo presenta un diente aguzado y levantado en el lado derecho (Figura 8B, 8C).
Antena. Último segmento antenal en su fase dorsal con ocho a 10 fosetas sensoriales, poco notables; antenas muy robustas, antenómeros con ápices claros (Figura 10A, 10B).
Tórax. Escleroma lateral pigmentado, sub ovalar al ápice y con forma de media luna en la parte inferior, donde rodea al estigma respiratorio; ocho a 10 largas setas; múltiples setas largas bordeando el escleroma; pro, meso y metanoto con pocas setas largas, en surcos vagamente trazados de dos a tres setas de ancho; espiráculo torácico de 2,20 x 2,00 mm (aproximadamente), lóbulos de la placa respiratoria contiguos y dirigidos hacia atrás, bulla globular poco prominente.
Patas. Uñas tarsales con ápice aguzado multisetoso, con dos setas pre apicales y otras dos setas basales largas y robustas; las tres uñas tarsales similares (Figuras 10C, 10D).
Abdomen. Dorso de los segmentos abdominales I-VII con decenas de setas alineadas en surcos transversos, conformados por múltiples setas cortas espiniformes y pocas setas largas (Figura 7B); dorso del segmento VII, con una banda transversa de múltiples setas cortas espiniformes (decenas); dorso del segmento VIII muy similar, con muchas setas, en su mayoría, setas cortas espiniformes; dorso IX similar, con una oquedad que muestra el estigma respiratorio vestigial; los segmentos VIII, IX y X presentan pocas setas cortas espiniformes laterales y pocas setas largas; área ventral abdominal de todos los segmentos presentan bandas multisetosas, conformadas por decenas de setas largas; los espiráculos de los segmentos I-VII alargados, ovalados (1,7 x 2,5 mm); los segmentos VII-VIII perfectamente ovalados, redondeados y ligeramente más grandes que los precedentes (2,4 x 2,5 mm); en todos los casos los lóbulos de las placas respiratorias contiguos, bulla central, globular y poco prominente.
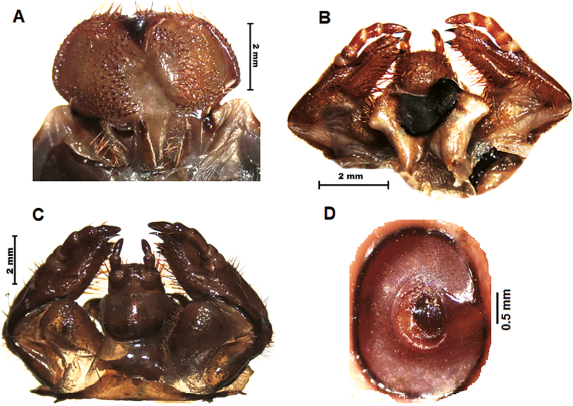
Figura 8 M. elephas: A. Epifaringe; B. Maxilas, labium dorsal e hipofaringe; C. Maxilas, labium ventralmente y D. Estigma respiratorio.
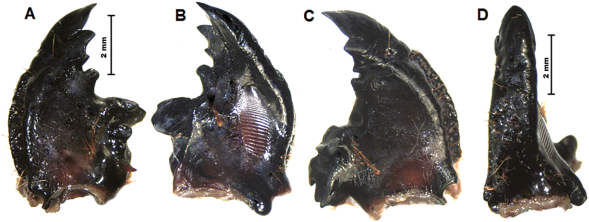
Figura 9 M. elephas: Mandíbulas, A. izquierda dorsal; B. izquierda ventral; C. derecha dorsal; D. derecha lateral.

Figura 10 M. elephas: A. Antena; B. último segmento antenal; C. Primer par de patas, D. tarsungulo, mostrando la uña y las setas.
Figura 11 M. elephas: A. larva de tercer instar, vista lateral; B, C, y D pupa: B. frontal; C. lateral; D. ventral.
Ráster sin palidia o septula, área tegular conformada por pocas setas cortas espiniformes, con barbula de 10-16 setas largas; labio anal inferior con pocas decenas de setas cortas espiniformes; labio anal inferior con varias decenas de setas cortas espiniformes; longitud corporal (medida por el perímetro externo) 12,5-13,2 cm; ancho torácica: 34-35 mm, ancho abdominal máxima 38-40 mm (Tabla 2).
Megasoma elephas Fabricius
Pupa macho, redescripción (Figuras 12A, 12B, 12C)
Basado en una pupa macho obtenida desde una cría iniciada en febrero de 2003 que mudó a pupa en mayo de 2006 y fue fijada en mayo 31 de 2006; otra pupa macho obtenida desde larvas criadas desde 2003 y fijadas como pupa en mayo de 2005.
Cuerpo robusto, elongado-cuadrangular, exarato, color pardo oscuro rojizo.
Cabeza. Transversa, ubicada ventralmente, con antenas, ápices mandibulares, palpos y demás piezas bucales visibles y delineados; antenas apicalmente ensanchadas y suavemente anilladas; ojos hundidos, parcialmente visibles; región frontoclipeal dotada de un gran cuerno, el cual está dirigido hacia adelante y en el tercio distal se curva perpendicularmente a su plano hacía arriba, terminando en un ápice orquillado; región media dorsal del cuerno presenta un abultamiento; clipeo transverso, abultado, redondeado y ligeramente ensanchado a sus extremos (Figuras 12B, 12C).
Tórax. Pronotum convexo, transverso, con un tubérculo prominente en el disco, con ápice ancho, truncado y rugoso (Figuras 12A); en el borde anterolateral presenta sendos cuernos, robustos, largos y agudos, dirigidos hacia adelante y afuera. Dentro de cada proyección un pequeño hueco se observa a cada lado; el pronotum registra un trazado trasverso de líneas suaves, irregularmente sinuosas, en el centro del borde posterior presenta una formación redondeada poco convexa.
Mesotórax. Transverso, trapezoidal, corto en su porción dorsal, con el borde anterior recto y el posterior anguloso y proyectado hacia atrás; a los lados emergen los estuches alares que se dirigen hacia afuera y rodean el tórax, se proyectan largamente más allá del ápice del segundo par de patas y sobre los segmentos abdominales II y III (Figuras 12A, 12B).
Patas. Protibias con tres dientes en el borde externo, el primero en la región central, los otros dos contiguos al ápice; mesotobias con dos tubérculos contiguos en la región central del borde externo y otros dos dientes al ápice; metatibia muy similar, las espinas tibiales poco notables; protarsómero ligeramente más largo que los meso y meta tarsómeros; cada tarsómero suavemente delineado (Figura 12C).
Abdomen. Con nueve segmentos; espiráculo del segmento I oculto bajo el estuche de las alas metatorácicas; espiráculos de los segmentos II-IV alargados, esclerosados, anulares, pigmentados, dirigidos hacia adelante; espiráculos de los segmentos V-VII ocluidos, vestigiales, en forma de roseta; espiráculo del segmento VIII ausente; área tergal de los segmentos I-VII con seis pares de órganos dioneiformes, los de los segmentos I-VI completos, transversos, pigmentados, esclerosados, los del segmento VII no apareados, conformados solo por el borde del segmento VII; el segmento VII se proyecta centralmente en forma obtusa hacia el VIII; tergo VIII con dos hoyuelos, uno a cada lado (posiblemente un espiráculo vestigial); borde posterior de los segmentos VII y VIII con una línea de espinitas, separadas entre sí; segmento IX triangular, aguzado, con el ápice bifurcado, cada punta estriada y multisetosa, setas cortas doradas (Figuras 12A, 12C). Ámpula genital hundida, poco convexa, con delineado que culmina en un círculo atravesado por un surco. Longitud 89 mm, ancho máxima 41-42 mm (Tabla 2).
Megasoma elephas Fabricius
Pupa hembra, observaciones
Se obtuvo una pupa hembra, esta se observó muy similar al macho, pero con la cabeza y pronoto inermes, algo que también presentó gran similitud fue el ápice abdominal, fotos u otros datos no pudieron ser anotados, ya que el adulto emergió antes de la siguiente revisión y daño notablemente la exuvia; ello ocurrió debido al plan de dejarlas culminar su ciclo y medir la longevidad; la pupa hembra ocupaba una cámara amplia construida con sustrato aglomerado por la larva.
Biología. En M. elephas se logró culminar dos ciclos de vida (2003 y 2004); los datos del ciclo fluctuaron de 2,4-2,6 años (864-936 días); la larva de tercer instar (L3) rondó los 489-492 días (1,3-1,5 años), los estadios de prepupa y pupa promediaron los 60 días (aprox. 2 meses); los estadios de huevo y L1 duraron entre 30-40 días y el de L2 entre 128-136 días; a su vez los datos observados en adultos fueron heterogéneos pues los parentales (7-8 ejemplares) duraron menos de 30 días, mientras que los pocos ejemplares obtenidos una hembra alcanzó los 90 días de duración (Tabla 1 y 2); las hembras ponen de 14-18 huevos en cada ocasión, esto lo alternan con dos o tres semanas alimentándose; la cópula en ejemplares obtenidos de cría tarda hasta tres semanas en darse, en ese momento puede durar entre 20 y 30 minutos; luego de algunos días la hembra se profundiza por alrededor de tres a cuatro semanas, al emerger se alimenta y podría estar receptiva nuevamente; el sustrato en que los huevos son puestos constituyen pequeñas cámaras varias veces más grandes que el huevo; el huevo inicialmente ovalado luego de 10-15 días se torna más grande y redondo, exponiéndose al final a través del corión, los anillos de la pequeña larva no emergida y el lado ambarino o amarillo oscuro de la cabeza; la larva recién emergida se observa “cabezona” y se estira rápidamente, quizás por la respiración, dos veces más, luego consume el trozo de corión como primer alimento; los datos obtenidos son ligeramente más breves que los expuestos por Morón y Deloya (2001) que obtuvieron un ciclo promedio de 2,5 años, siendo de dos años para la hembra y de tres años para el macho; algo similar ocurrió con los datos obtenidos para L2 y L3, que fueron mucho más demorados, lo cual determinó el ciclo de vida más largo; sin embargo, los estadios de prepupa y pupa fueron mucho más cortos; el primer autor tuvo la oportunidad de comentar personalmente la experiencia con M. A. Morón en 2003 y conocer de su voz algunas anécdotas del ciclo; en ese caso el ciclo de vida fue ex situ y en un clima mucho más frío que el medio natural de los ejemplares obtenidos, algo que podría explicar la mayor demora; sin embargo, los datos aquí logrados en cuanto a prepupa y pupa se alejan de lo registrado por el maestro Morón (Morón y Deloya, 2001) y con lo observado en otras especies; quizás errores de transcripción de datos del cuaderno de laboratorio respectivo o datos mal escritos, podrían explicar tal diferencia; sin embargo, teniendo en cuenta que los datos parciales y globales del estudio sí se consolidaron, se podría por ahora afirmar que el ciclo de machos y hembras podría rondar los 2,4-2,6 años, por supuesto, nuevos estudios serán necesarios para emitir datos que consoliden programas de conservación o de biocomercio de esta especie tan diezmada en su medio natural en el Caribe colombiano y a la vez tan demandada por los criaderos de escarabajos.
Los estadios de crecimiento de M. elephas evidenciaron variaciones interesantes, por ejemplo, la fase de huevo expresó una elongación de corion de 4,0-5,5, observándose al final una suave definición de los segmentos abdominales y sobre todo el color algo pigmentado de la cápsula cefálica; la ancho de cápsulas cefálicas varió sucesivamente así: L1 3,9-4,0; L2 8,1-8,5 y L3 desde 15,3 a 17,2 mm, lográndose casi doblar el tamaño anterior en cada caso, o un poco más; las prepupas evidenciaron las mismas medidas cefálicas pero menores tallas en ancho y longitud corporal, algo explicado en parte por el gasto metabólico de la construcción de la cámara pupal y el vaciado intestinal, lo que expone un cuerpo algo reducido y el integumento algo arrugado (Tabla 2).
Megasoma janus ramirezorum (Silvestre & Arnaud, 2002)
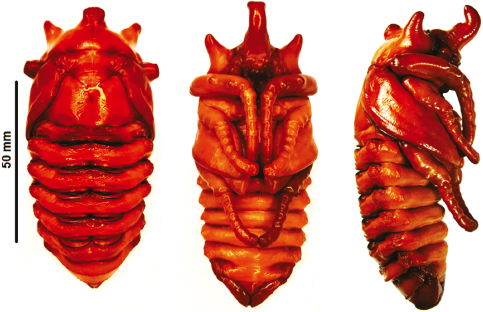
Larva de tercer instar, descripción (Figuras 13, 14, 15, 16A)
Basado en 6 larvas obtenidas en las crías de 1998-1999, fijadas en varias fechas entre 2000 y 2001; dos larvas obtenidas de cría de 2011 fijadas en 2014.
Cabeza. Ancho cefálico entre 18-19,5 mm, color negro densamente punturado, punturas profundas, superficie densamente rugosa, con un suave chagrinado (Figura 16A).
Frente. Con cuatro a cinco setas frontales posteriores, entre 14-16 setas frontales anteriores cortas, dos setas largas en el ángulo frontal anterior, ocho a 10 setas dorsoepicraneales, entre 40-50 setas epicraneales cortas y medianas, cuatro a cinco setas paraocelares a cada lado: clípeo trapezoidal, con dos setas largas a cada lado y una seta larga a cada lado del disco, entre cuatro a seis setas clipeales posteriores, punturado leve sobre el disco, punturas profundas, pero de diámetro angosto, rugosidad visible pero suave, punturado más grueso y denso sobre la parte posterior separados aproximadamente por un diámetro (Figura 17A).
Labro. Ligeramente asimétrico, punturado más regular, una seta a cada lado del disco, entre tres a cuatro setas laterales a cada lado y 18-20 setas en el borde posterior, borde anterior multisetoso, con disco rugoso y punturado, región posterior densamente punturada, punturas pequeñas (Figura 17A).
Epifaringe. Proceso haptomeral proyectado, pigmentado triangular; acanthoparia conformada por 16-17 setas curvadas; heli y plegmatia ausente; gymnoparia angosta de color ámbar; chaetoparia conformada por más de 40 setas que se tornan más robustas alrededor del pedium, que es cuadrangular, corypha de seis a siete setas, acroparia ensanchada de 14-16 setas, dexiotorma larga con el ápice externo engrosado; laeotorma en forma de barra; cono sensorial esclerosado, largo en forma de barra y pigmentado, cono sensorial en forma de barra con ápice pigmentado y engrosado, crepis ámbar (Figura 13A).
Mandíbula izquierda. Con área incisiva aguda (S1 y S2) una muesca estrecha que separa al incisivo tres que es obtuso, un área curvada separa al incisivo cuatro que es obtuso, seguido de un área media inerme, contigua del área molar, cuya primer corona es prominente y las otras dos son fundidas y bajas (Figuras 14A, 14B). Mandíbula derecha: con primer incisivo triangular proyectado, sigue una muesca angosta el incisivo tres de ápice agudo y después una cuarta muesca para un incisivo redondeado corto, un área inerme y después sigue un área molar con la primera corona corta y la segunda corona larga y proyectada, las mandíbulas tienen el scrobis ensanchado con varias setas (Figuras 14C, 14D).
Maxila. Galea con uncus aguzado, lacinia con tres unci unidos en su base, en posición sub-apical y oblicua; dientes estriduladores maxilares conformado por hilera de seis a siete dientes seguidos de uno al final grande y trasverso (Figuras 13B, 13C).
Labium. Tiene el dorso cuadrangular y los ápices laterales multisetosos; el escleroma hipofaringeo tiene una placa esclerosada grande y pigmentada con el borde derecho dentado, ambos lados con el borde pigmentado ámbar y multisetoso (Figura 13B).
Antenas. Robustas, último segmento antenal con 11-12 fosetas sensoriales dorsales (Figuras 15C, 15D).
Tórax. Escleroma color ámbar oscuro con ápice superior algo redondeado (truncado) y ápice inferior en forma de media luna, bordeando al estigma respiratorio, presenta 16-18 setas alineadas largas en el borde posterior; meso y metanoto con bandas transversales de setas largas y algunas pocas setas cortas espiniformes; espiráculo torácico (2,9 x 2,4 mm) ovalado, placas respiratorias con los ápices agudos casi contiguos (no se tocan), bulla pobremente proyectada en forma obtusa; protorsungulo con la uña aguzada, pigmentada y esclerosada, presenta una seta subapical y otra basal alternadas. Mesotarsungulo con ápice algo diferente, las uñas no tan aguzadas, más cortas, e igualmente dotadas de una seta sub-apical y otra basal alterna; metatarsungulo muy similar al mesotorsungulo falciforme (Figura 13D).
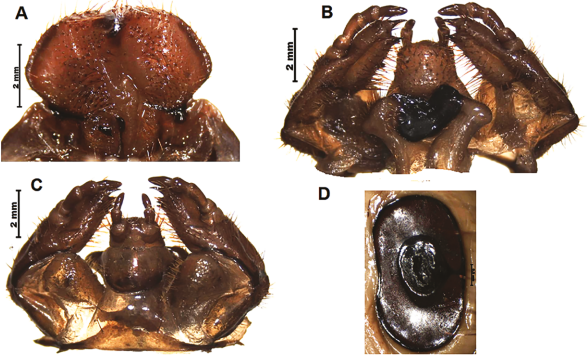
Figura 13 M. j. ramirezorum A. Epifaringe; B. Maxilas, Labium dorsal e hipofaringe; C. Maxilas, labium ventralmente y D. estigma respiratorio.
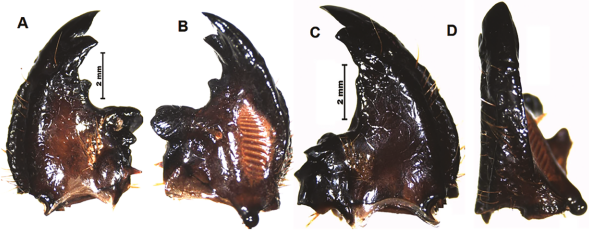
Figura 14 M. j. ramirezorum: mandíbulas, A. izquierda dorsal; B. izquierda ventral; C. derecha dorsal; D. derecha lateral.

Figura 15 M. j. ramirezorum: A. Primer par de patas; D. tarsúngulo, mostrando la uña y las setas; C. Antena; D. último segmento antenal.
Abdomen. Segmentos abdominales I-VI con el dorso (prescutum, scutum y scutellum) con franjas transversales, con decenas de setas cortas espiniformes y unas pocas setas largas en el borde posterior; segmento VII con dos placas dorsales definidas (prescutum corto fundido o fusionado con el scutellum) con bandas transversales con decenas de setas cortas espiniformes y una banda sencilla de setas largas posteriores. Segmento VIII con dorsa poco definida, conformando una sola placa con una banda transversal ancha, de decenas de setas cortas espiniformes y una hilera de setas largas posteriores; el segmento IX muy similar al segmento VIII; segmento X con decenas de setas cortas espiniformes y unas pocas setas largas. Región ventral de los segmentos I-VIII con una banda transversa de pocas setas largas y muy pocas setas cortas espiniformes (Figura 16A).
Ráster sin palidia, ni septula (Figura 17A), campus con muy pocas setas largas, teges con una banda multisetosa de setas largas y unas pocas setas cortas espiniformes: labio anal inferior, totalmente dotado de setas (principalmente setas cortas espiniformes) y una banda de setas largas, cerca de la abertura anal; labio anal superior densamente dotado de setas cortas espiniformes; barbula poco agrupada y dotada de múltiples setas largas; espiráculo abdominal progresivamente más grande, I-VI (2,2 x 2,0 mm) ovalados; lóbulos de las placas respiratorias contiguos. Bulla poco prominente e irregularmente conformada. Espiráculos abdominales VII-VIII 82,5 x 2,6 mm casi ovales con las placas respiratorias contiguas (ápice un poco aguzados).
Longitud (vista dorsalmente): 13,2 - 13,5 cm, ancho máximo del tórax, visto dorsalmente: 35-36 mm, ancho máximo del abdomen (visto dorsalmente): 42-44 mm (Tabla 2).
Megasoma janus ramirezorum Silvestre & Arnaud
Pupa macho, descripción (Figuras 17A, 17B, 17C)
Basado en dos pupas macho, obtenidas desde larvas criadas desde 2011 y fijadas en agosto de 2014; varias exuvias pupales de la misma cría y obtenidas posteriormente a la muda imaginal.
Cuerpo robusto, ovalado-cuadrangular, exarato, color amarillo oscuro rojizo (Figura 17A).
Cabeza. Grande, transversa, ubicada ventralmente en el protórax, aparato bucal visible ventralmente, en sus ápices: mandíbulas, palpos, labium; palpo labial exhibe unos cuatro anillos; estuche antenal engrosado apicalmente, mostrando cuatro a cinco anillos; ojos hundidos, poco visibles; clípeo transverso, ensanchado y suavemente redondeado en sus extremos; labro algo trapezoidal, túmido; ápice del labium cordiforme; región frontal anterior ocupada por un gran cuerno, que se proyecta hacia adelante y ligeramente hacia arriba, al extremo se bifurca, dorsalmente y en la base el cuerno se observa una convexidad pequeña (Figuras 18A, 18B, 18C).
Tórax. Pronoto transverso, amarillo oscuro, con trazado de líneas delgadas sinuosas; en el disco exhibe un cuerno grueso corto, con ápice truncado y rugoso; en la porción anterolateral emergen un par de cuernos, angulosos, obtusos, proyectados hacia adelante; en medio de tales cuernos hay sendos hoyuelos; en la porción posterior del pronoto se observa una pequeña placa redondeada, túmida, poco convexa. Mesotórax corto, transverso, borde anterior recto, el posterior angulosamente proyectado hacia atrás invadiendo el metatórax; a los lados emergen los estuches alares que se proyectan hacia la región ventral, entre el segundo y tercer par de patas y alcanzan a la altura de los segmentos abdominales II-III; Metatórax largo, trapezoidal, borde anterior anguloso, cóncavo, borde posterior ligeramente proyectado en su porción media hacia el abdomen; ventralmente expone una superficie ancha con los laterales ocupados por los estuches de las patas (Figuras 18A, 18B, 18C).
Patas. Grandes, en ubicación ventral (Figura 18C); protibias con tres dientes en el borde anterior, el primero en la porción media y los otros se disponen contiguos al ápice; mesotibias con dos dientes pequeños en el borde externo y otros cuatro apicalmente; metatibia similar a la mesotibia; tarsomeros delineados, de similar longitud los tres (22-23 mm).
Abdomen. Nueve segmentos visibles (Figura 18A); espiráculo del segmento I oculto por el forro de las alas metatorácicas; espiráculos de los segmentos II-IV visibles, anulares, pigmentados, esclerosados, dirigidos hacia adelante; espiráculos de los segmentos V-VII ocluidos, vestigiales; áreas tergales de los segmentos I-VI con cinco pares de órganos dioneiformes; cada uno transverso, con ambos bordes esclerosados, pigmentados, (10-11 mm ancho y tres a cuatro de largo); tergum VII con órgano dioneiforme incompleto, más vestigial, con la porción anterior (segmento VI) exiguamente desarrollada y la posterior (segmento VII) bien definida; borde posterior del segmento VII se proyecta en su porción media hacia el segmento VIII; tergo VIII con una oquedad a cada lado; bordes posteriores de los segmentos VII y VIII con una hilera de pequeños dientes, contiguos, desunidos, que ocupan casi todo el borde; segmento abdominal final obtuso, bifurcado, cada punta con trazado de surcos o carinas y densamente setosos, setas doradas; el surco divisorio del ápice es oscuro y esclerosado; ámpula genital hundida, muy poco convexa, con diseño de líneas sinuosas que en su porción posterior definen una figura circular y surcada.
Longitud 97-111 mm; ancho máxima 52-55 mm (Tabla 2).
Megasoma janus ramirezorum Silvestre & Arnaud
Pupa hembra, descripción (Figuras 16B, 16C, 16D)
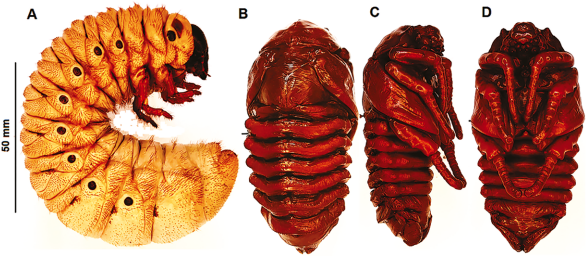
Figura 16 M. j. ramirezorum: A. larva de tercer instar, vista lateral; B, C y D pupa hembra: B. dorsal; C. lateral; D. ventral.
Basado en dos pupas hembra, obtenidas desde larvas criadas desde 2011 y fijadas en agosto de 2014; varias exuvias pupales de la misma cría y obtenidas posteriormente a la muda imaginal.
Cuerpo robusto, ovalado, amarillo pardo oscuro, exarata; muy similar al macho, difiere en varios aspectos: cabeza inerme, carece de cuernos, solo una estructura túmida; pronoto inerme, con un suave trazo o delineado en la porción media, este trazo semeja una flecha, cuya punta se dirige hacia atrás; bordes antero laterales del pronoto con sendos cuernitos o proyecciones obtusas y rugosas. Abdomen con borde anterior del VIII tergito con un par de hoyos lateralmente ubicados (espiráculos vestigiales); ámpula genital hundida, triangular, no convexa, con un trazado linear simétrico, que define una figura circular al final. Longitud 85-95 mm (Tabla 2).
Biología. Esta fue la primer especie de Megasoma disponible para investigación y en ella fue que se iniciaron los estudios de zoocría; en ese orden de ideas, desde 1997-1998 a 2012 se lograron ensayos ex situ completos y uno in situ casi completo (Pardo-Locarno, 2006); y se cimentó gran parte de los protocolos de cría; el ciclo completo de Megasoma janus ramirezorum duró aproximadamente 3,1-3,3 años (38-42 meses o 980-1250 días) (Tabla 1); como se puede observar en la tabla 1, los primeros estadios son los más rápidos, lográndose una media de 24-25 días para la fase de huevo, de 48-50 días para L1 y de 108-128 para L2; a partir de allí el ciclo se hace muy largo y los monitoreos se hicieron cada mes; la larva de tercer instar (L3) tuvo una media de 970 días, con ejemplares más avanzados que culminaron cerca de los 880 días y otros muy demorados que rondaron los 1100 días; el estado de prepupa duró aproximadamente 32 días y el de pupa 30 días; así mismo los adultos parentales variaron en longevidad de 7 a 55 días, con una media de 25-35 días; los adultos emergidos tuvieron un rango de 28-98 días, con una media de 35-55 días, siendo más longevas las hembras.
En cuanto a las tallas observadas durante los estados de crecimiento, el estadío de huevo varió de 5,5 a 6,7 mm durante la fase de elongación de corion, mientras que las larvas tuvieron dimensiones cefálicas de 3,8-5, 8,5-10 y 17,5-20 mm sucesivamente desde L1 a L3 (Tabla 2), lo que equivale a un crecimiento de 2-2,1 en cada estadio, siguiéndose aproximadamente, la ley de Dyar en el crecimiento cefálico entre estadios; la medida de ancho corporal y longitud corporal sí presentó mucha variación de datos; las pupas tuvieron su mayor expresión de diversidad de tamaños en la longitud, siendo en promedio más grande en los machos (Tabla 2).
Tanto en machos como en hembras, los individuos obtenidos fueron de la talla promedio de sus padres, lográndose un espectro de tallas (major, médium y minor) en ambos sexos; no obstante, muchos de ellos fueron exitosamente liberados al medio natural, en una localidad llamada La Delfina, río Dagua, en un ambiente ahora muy intervenido y en el que la especie es muy escasa, con fines de repoblación; un nuevo informe con muchos otros detalles se encuentra en preparación, dado lo útil de estos datos para la conservación de la especie (Pardo-Locarno, in litt.); la información obtenida no ha sido confrontada con otras fuentes, debido a que corresponden a datos parciales de páginas web; sin embargo, es importante anotar que la cría in situ en el Bajo Calima, Buenaventura (40-50 msnm, datos observados en tres ejemplares solamente), evidenció un desarrollo más rápido, lo que indicaría que este ciclo podría abreviarse al menos entre un 20-25% si se tuviera la oportunidad de culminarlo en tierras bajas; el experimento emprendido en 1998 en campamento de CVC en el Bajo Calima, tuvo que ser suspendido, dada la compleja situación de orden público que se desencadenó en ese momento; posteriores esfuerzos de reanudarlo no han sido efectivos dada la intermitencia de dichos fenómenos sociales, los cuales están seriamente agravados al momento de escribir esta nota.