Introducción
Tradicionalmente se ha planteado que las lagartijas se reparten los recursos ambientales de tres maneras principales: temporal, espacial y trófica; es decir, que las especies pueden diferir en sus horarios de actividad, en los microhábitats donde habitan o en los alimentos que consumen (Pianka, 1973). Esa repartición de los recursos permite separar los diferentes nichos entre las especies, reduciendo la competencia entre ellas y permitiendo la coexistencia de varias especies en un mismo lugar (Pianka, 1973; 1974), y hace evidente que los recursos se reparten porque no son ilimitados en el ambiente (Griffin y Silliman, 2011).
Un grupo de lagartijas en el que se ejemplifica bien la repartición de los recursos como resultado de competencia pasada o actual son las especies del género Anolis (Squamata: Dactyloidae) (Losos, 2009). Estas lagartijas se encuentran en varias coberturas como interior y bordes de bosques y vegetación abierta, donde utilizan múltiples microhábitats (arbóreos, terrestres y semiacuáticos) y exhiben formas morfológicas correlacionadas con el tipo de microhábitats particulares. Estas formas morfológicas fueron producto de una radiación adaptativa, la cual es un fenómeno caracterizado por la diversificación de un clado, asociada con la aparición de una gran variedad de rasgos con características adaptativas (Futuyma, 1998). Losos (2009, 2010) sugiere que la radiación de los Anolis se dio gracias a una oportunidad ecológica representada en la aparición de unas estructuras llamadas lamelas subdigitales expandidas, que les permitieron explotar de manera eficaz y diferencial el recurso arborícola. El resultado de este fenómeno ha sido la diversificación de 336 especies de anolinos y 28 morfotipos que evolucionaron de manera convergente entre los ambientes continentales e insulares (Poe & Anderson, 2019).
Específicamente, en el bosque seco tropical (BST) del Caribe colombiano se ha encontrado que en los bosques de ribera o de tierra firme, la familia Dactyloidae presenta los valores más altos de abundancia y diversidad comparado con otros tipos de vegetación (Medina-Rangel y Cárdenas-Arévalo, 2015); no obstante, las comunidades más diversas de anolinos se asocian a bosques húmedos tropicales (Rengifo-M. et al., 2015; Moreno-Arias et al., 2020). En estos tipos de hábitat, la oferta y utilización de recursos pueden jugar un papel importante en las estrategias de coexistencia que permiten el establecimiento de varias especies de Anolis. La mayoría de los estudios en la región han descrito la estructura del ensamblaje basados en términos de su riqueza de especies y su abundancia (p. ej. Medina-Rangel y Cárdenas-Arévalo, 2015; Rojas-Murcia et al., 2015) y los que han abordado tópicos sobre la estructuración ecológica o la coexistencia de estas especies se ha centrado en bosques húmedos (p. ej. Castro-Herrera, 1988; Pinilla-Rentería et al., 2015; Moreno-Arias et al., 2020).
Teniendo en cuenta lo anterior, se analizó la variación de los patrones de uso de los recursos espaciales y alimenticios, desde una aproximación morfológica, para determinar el grado de repartición de recursos que permiten la coexistencia de cinco especies de Anolis en hábitats de BST de los Montes de María en el Caribe colombiano.
Materiales y métodos
Área de estudio: El trabajo de campo se realizó en un área dominada por bosque seco tropical (BST) en los Montes de María (vereda La Flecha), municipio de San Jacinto, departamento de Bolívar (Figura 1), localizada a 9°51’12.4’’ N y 75°10’41.4’’ O y una altitud entre 350 y 512 m. El área presenta una topografía montañosa, ondulada, con abundantes serranías y colinas bajas que se caracterizan por ser suelos fértiles óptimos para la agricultura y la ganadería; lo que ha llevado a la disminución del área boscosa y una alta fragmentación del bosque para poder realizar este tipo de actividades antropogénicas. El área se encuentra en una formación higrotropofítica según la clasificación de Holdridge (1978), correspondiente a un bioma de BST y pertenece a la subunidad climática D2 (Rangel-C. y Carvajal-Cogollo, 2012), caracterizada por una temperatura anual promedio de 25°C y un promedio de precipitación de 1972 mm, distribuido de forma bimodal tetraestacional con dos períodos secos en diciembre-abril y julio-agosto y dos periodos lluviosos entre septiembre-noviembre y mayo-junio. La vegetación predominante es de tipo boscoso (Pizano y García, 2014), con un dosel entre 20 y 25 m y elementos emergentes de hasta 35 m.
El trabajo de campo se realizó entre enero y noviembre de 2017 y abarcó una temporada seca y una lluviosa. En total se realizaron cuatro salidas de campo (dos en temporada seca y dos en lluviosa) con una duración de cinco días cada una. Para el muestreo se utilizó la metodología de búsqueda por encuentros visuales (Crump & Scott, 1994) durante el periodo de actividad de las lagartijas (9:00 am a 4:00 pm). El muestreo se realizó con dos personas buscando intensivamente por 7 horas diarias, lo que representó un esfuerzo de 14h/hombre por día y un total de 280h/hombre en todo el estudio.
Para caracterizar los distintos usos del microhábitat para las especies, se aplicó la técnica de censos de Rand (1964), consistente en registrar los diferentes atributos de hábitat estructural y del microhábitat de cada lagartija observada. Los atributos de hábitat estructural se categorizaron de la siguiente manera: 1) Tipo de cobertura: interior de bosque (IB) (Figura 1): una cobertura constituida por una comunidad vegetal dominada por elementos típicamente arbóreos regularmente distribuidos que forman un estrato de copas (dosel) discontinuo de alturas superiores a 20 m y ubicada en zonas alejadas (>100m) de cuerpos de agua; borde de ribera (BR) (Figura 1): una cobertura constituida por vegetación arbórea ubicada en los márgenes de cursos de aguas permanentes y que se extiende perpendicularmente del cuerpo de agua a una distancia aproximada de 50 m; vegetación abierta (VA) (Figura 1): es una cobertura dominada por pastos con árboles dispersos de altura menor a 5 m. 2) Estrato de la vegetación: Rasante: vegetación con alturas menores a 0,3 m; Herbáceo: vegetación con alturas entre 0,3-1,5 m; Arbustivo: árboles y arbustos entre 1,5-5 m; Arbóreo: arboles con alturas mayores a 5 m. 3) Tipo de percha: troncos caídos, hojarasca, roca, ramas y tronco de árboles. Los atributos del microhábitat correspondieron a la altura de la percha y a la intensidad lumínica, esta última variable fue medida con un luxómetro marca Extech. Para todas las variables, se discriminó entre machos, hembras y juveniles. Para las características alimenticias de las especies se hizo una aproximación morfológica (Moreno-Arias et al., 2020) usando el tamaño corporal y el tamaño de la cabeza como medidas indirectas del tamaño de las presas consumidas (Duellman, 1978; Castro-Herrera, 1988; Vitt et al., 2002), para ello a cada individuo se le midieron su longitud rostro-cloaca (LRC), el ancho (AC) y el largo de su cabeza (LC).
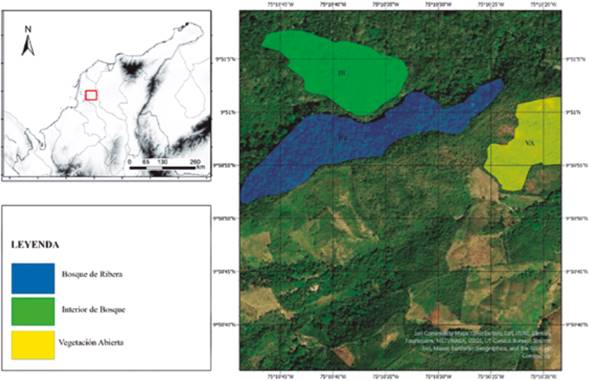
Figura 1 Localización de la vereda la Flecha, San Jacinto Bolívar, Colombia y tipos de hábitats en el área de estudio.
Análisis de datos: el uso del hábitat estructural por especie fue descrito a partir de la frecuencia de observaciones de individuos en las categorías de cada atributo, mientras que los atributos del microhábitat correspondieron al promedio de las mediciones en cada atributo. Tanto los atributos de hábitat estructural y como los de microhábitat en conjunto definieron el uso de los recursos espaciales. Las medidas morfológicas del AC, LC y LRC se usaron para describir la estructura morfológica (como aproximación al tamaño de las presas de las que se alimentan) de las especies en el área de estudio. Como el tamaño del cuerpo y de la cabeza están correlacionados con los límites de abertura de la boca y el tamaño de la presa de los Anolis (Schoener, 1968, 1974; Herrel et al., 2006), el uso del recurso alimentario fue descrito a partir del tamaño promedio de cada especie y el promedio de los residuales de AC y LC, obtenidos a partir de regresiones lineales de cada una de estas variables contra LRC.
Para determinar diferencias en el uso de recursos espaciales y alimentarios entre las especies del ensamblaje, se hizo un análisis unificado de traslape de nicho (Geange et al., 2011), que permite calcular el grado de traslape de nicho incluyendo en un solo análisis diferentes tipos de datos (p. ej. continuos, frecuencias o discretos) y comparando los resultados obtenidos contra patrones de traslape de nicho obtenidos al azar con una aproximación de modelos nulos (Gotelli, 2000), para determinar si dicho traslape puede atribuirse a mecanismos ecológicos (en nuestro caso competencia) o son producto del azar (Vilchis, 2000).
Para visualizar gráficamente las diferencias de traslape de nicho entre las especies que se obtuvieron del análisis anterior, se hizo un análisis de escalamiento multidimensional no métrico, utilizando como matriz de semejanza los valores de traslape de nicho entre las especies. Para determinar el desempeño del nMDS para representar la estructura de la matriz de semejanza se utilizó como referencia un valor de estrés ˂ 0,01 que indican un buen ajuste entre el espacio multidimensional y la matriz de distancia. Los análisis de nicho y de escalamiento se realizaron en los programas R Studio (Oksanen et al., 2013) y PRIMER 6.0 respectivamente.
Resultados
Se registraron 102 individuos de cinco especies (Anolis gaigei, A. gr. fuscoauratus, A. auratus, A. vittigerus, A. biporcatus) (Figura 2). Todas las especies se registraron tanto en la época seca como en lluvias, con excepción de A. biporcatus que no se observó en esta última (Tabla 1). La especie A. gaigei fue la más abundante en ambas épocas climáticas, mientras A. biporcatus (3 individuos) en la época seca y A. vittigerus (10 individuos) en la época lluviosa fueron las menos frecuentes (Tabla 1).
La abundancia de machos en todas las especies fue mayor que las hembras en ambas épocas climáticas, con excepción de A. gaigei en la que las hembras y los juveniles fueron más abundantes que los machos en la temporada de lluvias (Tabla 1).

Figura 2 Especies comunes de Anolis en diferentes hábitats en la vereda la Flecha, San Jacinto Bolívar, Colombia. A. A. gaigei, B. A. biporcatus, C. A. auratus, D. A. vitigerus, E. A. aff fuscoauratus.
Uso de los recursos espaciales durante la época seca: En el bosque de ribera se registró la mayor abundancia (43 individuos) y riqueza (4 especies), seguidas por interior de bosque (13 individuos y tres especies) y por último vegetación abierta (nueve individuos y dos especies) (Tabla 1). En el BR y el IB, A. gaigei fue la más frecuente con 22 y 9 individuos respectivamente y A. auratus en las áreas abiertas. Las menos frecuentes fueron A. biporcatus y A. vittigerus con 3 y 1 individuo en el BR y el IB, respectivamente (Tabla 1).
La abundancia de lagartijas fue mayor en los estratos rasante y herbáceo con 18 individuos cada uno, seguida por la del estrato arbóreo con 17 y el arbustivo con 12. El estrato rasante se usó más frecuentemente por A. auratus; mientras el herbáceo y arbustivo se usaron con mayor frecuencia por A. gaigei (12 individuos) y A. gr. fuscoauratus (cinco individuos). Solamente se observaron dos especies en los estratos arbustivo y arbóreo: A. biporcatus y A. vittigerus. La primera especie presentó una abundancia de dos individuos, mientras que la segunda presentó valores de tres y cuatro individuos para cada estrato respectivamente.
Los troncos de los árboles fueron las perchas más usadas por los anolinos (30 individuos) seguidas por la hojarasca (13) y las ramas (11) (Tabla 1). En los troncos y las ramas se observaron más frecuentemente a A. biporcatus, A. vittigerus y A. gr. fuscoauratus; en la hojarasca a A. gaigei, mientras que A. auratus se observó con mayor frecuencia en la hojarasca y en las ramas (Tabla 1).
Tabla 1 Número de individuos (N) por especie de Anolis, frecuencia por tipo de hábitat, estrato y tipo de percha registrados en la Reserva Campesina La Flecha.
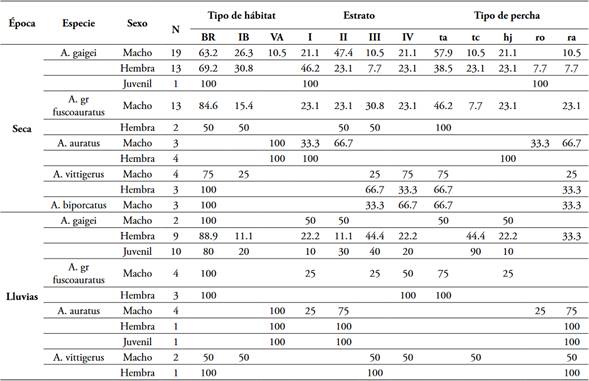
Hábitat -BR: Bosque de ribera. IB: Interior de bosque. VA: Vegetación abierta. Estrato -I: rasante. II: herbáceo. III: arbustivo- IV: arbóreo. Tipo de percha -ta: Tronco de árbol. tc: Tronco caído. hj: Hojarasca. ro: Roca. ra: Rama.
En negrita los valores más altos.
El microhábitat usado por A. auratus (♂: 26,66 ± 24,68 cm, N = 3; ♀: 0,00 ± 0,00 cm, N = 4) y A. gaigei (♂: 33,10 ± 36,28 cm, N = 19; ♀: 24 cm ± 28,26, N = 13; Juveniles: 4 cm, N = 1) se caracterizó por perchas de baja altura en sitios sometidos a una alta exposición solar para el primero (♂: 5326,66 ± 6237,40 lux, N = 3 - ♀: 3966,25 ± 2850,30 lux, N = 4) y a una exposición solar intermedia para el segundo (♂: 2317,42 ± 2794,6 lux, N = 19 - ♀: 1321,00 ± 814,50 lux, N = 13; Juveniles: 2750,00 lux, N = 1). El microhábitat de A. gr. fuscoauratus se caracterizó por perchas de altura intermedia (♂: 56,46 ± 51,68 cm, N = 13 - ♀: 61 cm ± 55,15, N = 2) en sitios con baja exposición solar (♂: 1444,83 ± 950,4 lux, N = 13 - ♀: 1034 ± 800,4 lux, N = 2). El microhábitat usado por A. biporcatus (♂: 234,67 ± 56,80 cm, N =3) y A. vittigerus (♂: 126,50 ± 65,49 cm, N = 4 - ♀: 89,33 ± 61,00 cm, N = 3) se caracterizó por perchas altas en sitios sometidos a una exposición solar intermedia para el primero (♂: 1845,45 ± 57,34 lux N = 3) y a una baja exposición solar en el segundo (♂: 1438,25 ± 645,90 lux, N = 4 - ♀: 1566,70 ± 57,64 lux, N = 3).
Uso de coberturas del suelo y microhábitats durante la época de lluvias: En esta época, se registraron 37 individuos de cuatro especies. Al igual que en la época seca, en BR se registró la mayor abundancia (26 individuos) y mayor riqueza (3 especies), seguidas por la zona de VA (seis individuos y una especie). La menor abundancia se encontró en IB con cinco individuos de dos especies. La especie más frecuente en BR e IB fue A. gaigei con 18 y 4 individuos y A. auratus (6 individuos) en VA; mientras que A. vittigerus con dos y un individuo fue la menos frecuente en BR e IB respectivamente.
Las abundancias observadas entre los estratos arbustivo (11 individuos), arbóreo y herbáceo (10 individuos para cada uno), fueron similares, pero mayores a las del estrato rasante (6 individuos). Los estratos arbustivos y herbáceos se usaron con mayor frecuencia por A. gaigei y A. auratus con 8 y 5 individuos respectivamente. El estrato rasante fue usado frecuentemente por A. gaigei (4 individuos). El estrato arbóreo fue usado por tres especies, siendo la más frecuente A. gr fuscoauratus. Por otro lado, A. vittigerus se observó con mayor frecuencia en los estratos arbóreo y arbustivo.
Durante las lluvias, los troncos de los árboles fueron el tipo de percha más utilizada por los anolinos (20 individuos), seguido por las ramas (10) y la hojarasca (6). Además de los troncos de árbol, en la hojarasca se observó frecuentemente a A. gaigei. Por otro lado, A. auratus fue observado comúnmente en las ramas, mientras que A. vittigerus se observó rara vez en este tipo de percha y A. gr fuscoauratus usó frecuentemente los troncos de los árboles.
El microhábitat utilizado por A. vittigerus fue descrito por perchas de baja altura (♂:12,00 ±4,24 cm, N = 2 - ♀: 22,00 cm, N = 1) y sitios expuestos a intensidad de luz intermedia (♂:1552,50 ± 2054,10 Lux, N = 2 - ♀: 290,00 Lux, N = 1). El microhábitat usado por A. gaigei y A. auratus se caracterizó por perchas de alturas intermedias (respectivamente ♂: 28,00 ± 39,59 cm, N = 2 - ♀: 21,55 ± 25,77 cm, N = 9 - juveniles: 19,93 ± 23,84 cm, N = 9 y ♂: 12,00 ± 4,24 cm, N = 2 - ♀: 22,00 cm, N= 1) en sitios sometidos a una baja intensidad de luz para el primero (♂:199,5 ± 9,19 Lux N= 2 - ♀: 432,81 ± 427,1 Lux, N= 9) y a una exposición solar alta (♂: 3185,75 ± 1687,10 Lux, N = 4 - ♀: 1800,00 Lux, N = 1) para el segundo. El microhábitat de A. gr fuscoauratus fue descrito por perchas con las mayores alturas (♂: 63,32 ± 44,52 cm, N= 4 - ♀: 153,33 ± 98,14 cm, N= 2) expuestas a una baja intensidad de luz (♂: 472,25 ± 379,9 Lux, N = 4 - ♀ = 135,66 ± 115,43 Lux, N = 2).
Estructura morfológica de la comunidad de anolinos: Los anolinos del área se caracterizan por tres grupos morfológicos (Figura 3). El primero formado por tres especies pequeñas: A. fuscoauratus (♂: 38,18 ± 0,54 mm, N = 9 - ♀: 38,56 ± 4,53 mm, N = 2), A. gaigei (♂: 41,65 ± 6,72 cm, N = 19 - ♀: 42,27 ± 6,03 mm, N = 19 - Juveniles: 39,75 cm. N = 1) y A. auratus (♂: 43,92 ± 1,37 mm, N = 3 - ♀: 41,02 ± 2,70 mm, N = 4). El segundo por una especie de tamaño mediano, A. vittigerus (♂: 62,50 ± 2,58 mm, N = 2 - ♀: 66,11 mm, N = 1) y el tercero por una especie grande: A. biporcatus (♂: 91,93 ± 1,93 mm, N = 3). Teniendo en cuenta las relaciones entre la longitud AC y LC, los valores más grandes los presentó A. biporcatus durante la época seca, los valores intermedios los presentó A. vitigerus, registrándose el mayor valor durante las lluvias en comparación con la seca (Figura 3). En el caso de las especies A. auratus, A. gaigei y A. gr fuscoauratus fueron quienes presentaron las menores relaciones AC y LC, siendo mayores los valores en época seca con respecto a lluvias para las tres especies respectivamente (Figura 3).
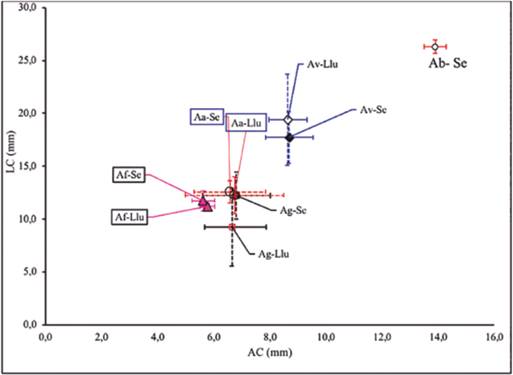
Figura 3 Relación del ancho y largo de la cabeza de los Anolis registrados en época seca y lluvias en la Reserva Campesina La Flecha. Las barras indican la desviación estándar de cada medida. Abreviaturas: Ag: A. gaigei. Af: A. fuscoauratus. Aa: A. auartus. Av: A. vittigerus. Ab: A. biporcatus. Se: Época seca. Llu: Época de lluvias.
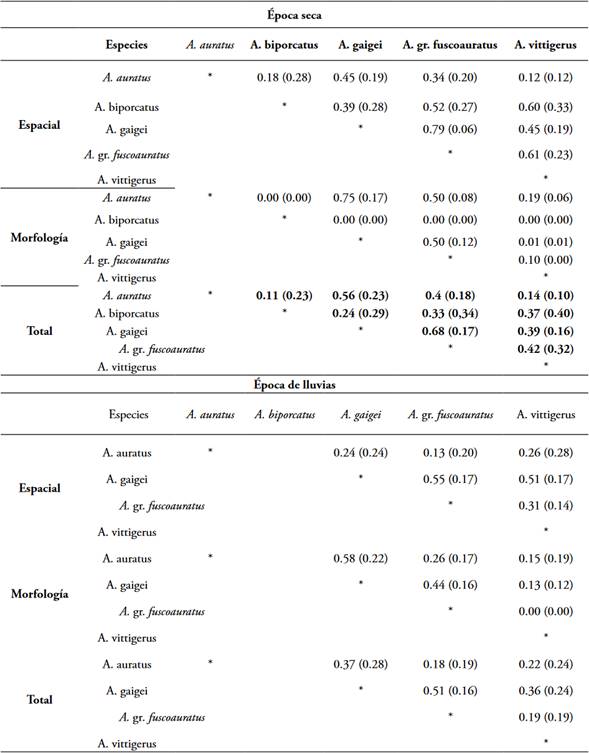
Traslape en el uso de los recursos espaciales y la morfología de la comunidad de anolinos: El valor promedio de traslape espacial (época seca: 0,44 ± 0,21, época lluviosa: 0,33 ± 0,20) fue más alto que el valor de traslape en morfología (época seca: 0,20 ± 0,04, época lluviosa: 0,26 ± 0,20). Los traslapes de nicho fueron significativamente más altos que los generados a partir de las pseudocomunidades (Espacial: época seca = 0,11, P= 0,01; época lluviosa = 0,12, P = 0,05, morfología: época seca = 0,07, P = 0,01; época lluviosa 0,09, P = 0,01).
A pesar de que todas las especies fueron ecológicamente diferentes (Tabla 2), el par de especies que presentó el valor más alto de traslape de los recursos espaciales fue A. gr fuscoauratus - A. gaigei (0,79 ± 0,06) y el de menor valor fue el par A. vittigerus - A. auratus (0,12 ± 0,12). Las especies morfológicamente más similares fueron A. gaigei - A. auratus (0,75 ± 0,17), mientras que los pares formados por A. biporcatus con el resto de las especies mostraron los menores valores de traslape (Tabla 2).
También en esta época todas las especies fueron ecológicamente diferentes (Tabla 2) y nuevamente el par A. gaigei - A. fuscoauratus, a pesar de que redujeron su magnitud en el traslape, fue el que presentó los mayores valores de traslape de nicho espacial (0,55 ± 0,17) mientras que los valores más bajos lo obtuvieron el par A. auratus - A. fuscoauratus (0,13 ± 0,20). Los valores más altos de traslape en morfología lo presentaron el par A. gaigei - A. auratus (0,58 ± 0,22) y los más bajos fueron para A. vittigerus - A. fuscoauratus (0,00 ± 0,00) (Tabla 2).
Tabla 2 Comparación por pares de especies de los valores de traslape de nicho en los ejes espacial y alimenticio (medidas morfológicas) para un ensamblaje de Anolis en dos épocas climáticas (seca y lluvias) en un fragmento de BST en San Jacinto, Bolívar, Colombia. En paréntesis la desviación estándar y en negritas los pares de especies con traslape de nicho diferente con una P ≤ 0,01.
Los análisis de escalamiento multidimensional mostraron que las especies se distribuyeron de manera diferencial en el espacio de nicho entre las épocas climáticas (Figura 4A, B). En la época seca la diferencia entre las especies se describió, en primer lugar, por las medidas morfológicas principalmente el tamaño corporal (Figura 4A, Dimensión 1), y secundariamente por los recursos espaciales representados principalmente por la intensidad lumínica (Figura 4A, Dimensión 2). En la época de lluvias la diferencia entre las especies fue descrita primeramente por el uso de los recursos espaciales definidos principalmente por altura de la percha y secundariamente por el tamaño corporal (Figura 4B). En ambas épocas, las especies más similares en el uso de los recursos fueron A. gaigei y A. gr fuscoauratus, mientras en seca las más diferentes en el uso de los recursos fueron A. auratus y A. biporcatus y en lluvias A. auratus y A. vittigerus (Figura 4A, B).

Figura 4 Ordenación espacial de las especies de Anolis de acuerdo con la semejanza en el uso total de los recursos en la época seca (A) y lluviosa (B). Los círculos rojos representan grupos ecológicos. Especies que no mostraron diferencias en la utilización de nichos basados en pruebas con el análisis de modelos nulos.
De acuerdo con los valores de significancia del traslape total de nicho cada especie representó un grupo ecológico (Tabla 2). En el primer grupo, se incluyó a A. gaigei, especie de tamaño pequeño y que habita principalmente en el BR en estratos arbóreos bajos y percha en alturas bajas en troncos de árboles, hojarasca y troncos caídos en sitios con una intensidad solar intermedia. En el segundo grupo estuvo A. gr fuscoauratus, una especie de tamaño pequeño que habita principalmente en BR en estratos arbóreos intermedios y percha en ramas y arbustos de alturas intermedias expuestos a una intensidad lumínica intermedia. El tercer grupo lo conformó A. vittigerus, especie de tamaño intermedio que puede ocurrir tanto el BR como en IB, en estratos vegetales altos y perchando en troncos a alturas intermedias en sitios con baja intensidad lumínica. En el cuarto grupo estuvo A. biporcatus que habita en BR en estratos arbóreos altos, percha en alturas altas en ramas y troncos de árboles gruesos en sitios con poca intensidad lumínica. El último grupo estuvo conformado por A. auratus, especie que ocurre en zonas de VA en estratos arbóreos bajos y perchan a alturas bajas en ramas de arbustos pequeños y rocas donde hay una alta exposición lumínica.
Discusión
Teniendo en cuenta que la información ecológica de las especies de Anolis en el BST en el Caribe colombiano es escasa, el presente estudio representa un aporte al conocimiento de estos aspectos que anteriormente se describieron para comunidades de bosque húmedo tropical (BHT) del país (Castro-Herrera, 1988; Pinilla-Rentería et al., 2015; Moreno-Arias et al., 2020). Esta investigación documenta aspectos clave para un grupo de reptiles importante en el BST, un ecosistema que ha perdido más del 90% de su cobertura original por factores antropogénicos (Pizano y García, 2014).
La riqueza encontrada en este estudio describe el 33% de las 15 especies de Anolis registradas para las tierras bajas del Caribe colombiano (Carvajal-Cogollo et al., 2012). No obstante, los valores de abundancias encontrados fueron más altos que los descritos en otros estudios realizados en el mismo ecosistema (p. ej.: Medina-Rangel y Cárdenas-Arévalo, 2015; Rojas-Murcia et al., 2015). Sin embargo, estos resultados se ajustan a la tendencia general de que los anolinos continentales presentan bajas densidades poblacionales comparadas a las descritas en islas del Caribe; lo cual se atribuye a una mayor mortalidad (producto de un mayor número de depredadores), una maduración más temprana y un bajo reclutamiento (Andrews, 1979; Losos, 2009; Moreno-Arias y Urbina-Cardona, 2013). Por otro lado, debido a limitaciones en el muestreo como la imposibilidad de muestrear el dosel del bosque, la abundancia de algunas especies como A. biporcatus se encuentra subestimada, puesto que esta es una especie caracterizada por usar perchas con altura superiores a los 5 m y estratos vegetales medios y altos como el sotobosque y el dosel. Este hábito le permite tener bajas probabilidades de captura con la técnica de búsqueda implementada; razón por la cual se sugiere realizar monitoreos más detallados (por ejemplo, con el uso de binoculares) en estratos altos y con un mayor esfuerzo muestreal para determinar el estatus de rareza, ya sea poblacional o de hábitat de esta especie.
Los valores más altos de abundancia y riqueza de Anolis en el bosque de quebrada coincidieron con lo descrito por Medina-Rangel y Cárdenas-Arévalo (2015) y Moreno-Arias y Quintero-Corzo (2015), quienes encontraron que los lagartos presentaron los valores más altos de detección y mayor solapamiento en el uso de los recursos en este tipo de hábitats. Estos resultados pueden deberse a una mayor variedad de especies y una fisionomía vegetales, que provee más microhábitats en este lugar (Rangel-C. et al., 2008), lo cual estaría ofreciendo una amplia gama de recursos como sitios para refugios tanto para especies de reptiles como para sus potenciales presas; así como una mayor estabilidad térmica en ecosistemas que sufren estrés hídrico como el BST (Medina-Rangel, 2011). Además, a pesar de la plasticidad térmica y la variación del uso de hábitats de algunos reptiles, los BR son uno de los hábitats importantes para la conservación de esta fauna en ecosistemas secos. En estos ambientes, debido a la variabilidad estructural de los hábitats que son dependientes del agua (presencia de plantas no caducifolias, hojarasca y mayor disponibilidad de recursos alimenticios); los ensamblajes de Anolis pueden ser más complejos y presentar comportamientos hogareños donde posiblemente encuentran los recursos necesarios para realizar sus actividades más básicas (Zhao et al., 2006).
El menor número de especies y abundancia registrado en las zonas de vegetación abierta, donde la altura, la complejidad vegetal y el manejo de la tierra para agricultura reducen la oferta de recursos y generan un mayor estrés térmico (Fleishman, 1988). Esas condiciones son restrictivas para la mayoría de las especies estudiadas, pero no para A. auratus, la cual posee unas características fisiológicas que les permiten soportar altas temperaturas y evitar la pérdida de agua en exceso en ambientes secos (Hertz, 1979). También es posible que la vegetación abierta juegue un papel importante en temas de estructura social como territorialidad para A auratus; ya que raramente la vegetación supera los 2 m de altura, lo cual representa disponibilidad de microhábitats adecuados a su morfología y desempeño locomotor para realizar actividades de cortejo y defensa de territorio (Fleishman, 1988). Esto coincide con las tendencias documentadas para ensambles de reptiles de ecosistemas secos o subhúmedos que han sido transformados por el hombre (Carvajal-Cogollo et al., 2007; Carvajal-Cogollo y Urbina-Cardona, 2008; Medina-Rangel, 2011).
El uso de los diferentes estratos vegetales por Anolis en el área de estudio fue variado, lo cual se puede atribuir a la alta disponibilidad del estrato arbustivo en la zona (Herazo et al., 2017); lo que refuerza la importancia de mantener las coberturas originales para sostener comunidades de lagartijas más diversas en este ecosistema tan amenazado como el BST. Esta importancia también se reflejó en el tipo de percha más utilizado (los troncos de árboles); esta relación entre hábitat y morfología muestra la vulnerabilidad de estas especies a la pérdida y transformación de las coberturas vegetales originales.
La presencia de tres grupos morfológicos de Anolis podría indicar diferenciación ecológica en el uso de los recursos alimenticios según lo propuesto por Schoener (1968, 1974) y Herrel et al. (2006). Estos autores afirman que el tamaño del cuerpo y de la cabeza están correlacionados con los límites de abertura de la boca y el tamaño de la presa consumida. Esta agrupación por tamaños podría estar describiendo una potencial diferenciación en el consumo de tamaño de las presas (Castro-Herrera, 1988; Moreno-Arias et al., 2020); razón por la cual se hace importante profundizar en el papel funcional de los anolinos como especies dominantes en el nicho arborícola en los ecosistemas boscosos (Moreno-Arias et al., 2008). En este grupo, la utilización diferencial de los recursos espaciales y alimenticios ha sido ampliamente documentada y se ha demostrado que dicha diferenciación ecológica es la que permite la coexistencia de especies en un mismo hábitat estructural. Adicionalmente, estas interacciones interespecíficas son consideradas el motor que desencadenó la radiación adaptativa de los Anolis (Losos, 2009), por lo que no se descarta que esos procesos también hayan sido importantes para la estructuración de comunidades de Anolis continentales. La disimilitud ecológica (análisis indicaron diferenciación significativa en su nicho total) en el uso de los recursos espaciales y en la morfología de A. gaigei y A. gr. fuscoauratus es evidencia que dos especies simpátricas sean ecológicamente poco diferenciadas, aunque podrían ser incluida en un mismo ecomorfo continental. Sin embargo, faltaría incluir más datos en campo y experimentales sobre el desempeño locomotor de estas dos especies para corroborar esta hipótesis.
Las diferencias en la riqueza y abundancia entre temporada climáticas (seca y lluvias) en el área de estudio, pueden atribuirse a la estacionalidad bien marcada del BST y la detectabilidad de las especies, por el método de observación y conspicuidad de las especies. Por ejemplo, en la temporada seca algunas plantas del BST por su fisonomía particular de ser caducifolias pierden sus hojas (Dirzo et al., 2011); lo cual puede influir en una mayor probabilidad de observación de algunas especies asociadas a algunos sustratos (troncos, ramas, hojarasca). Estos resultados coinciden con lo descrito en BST del Cesar, donde se ha encontrado una correlación negativa entre la cobertura arbórea del estrato arbustivo y la abundancia de A. gaigei (Medina-Rangel y Cárdenas-Arévalo, 2015).
Por otro lado, las temporadas reproductivas de las especies Anolis podría explicar el hecho de que todas las especies (excepto A. gr. fuscoauartus) mostraron valores de altura de percha más altos en la época seca en comparación con lluvias. Una mayor abundancia de individuos juveniles durante la época de lluvias es un indicador de que las poblaciones de las especies de Anolis en la zona son reproductivamente más activas durante la época seca, ya que los juveniles tienden a usar perchas más bajas que los adultos (Moreno-Arias y Urbina-Cardona, 2013). Fleming y Hooker (1975) también han señalado que algunas especies de anolinos presentan alturas de percha mayores en la temporada reproductiva en comparación con la no reproductiva, pero podría ser por un efecto de la abundancia relativa de juveniles y adultos entre temporadas. Una tercera razón podría estar relacionada con la oferta del recurso alimenticio en el área de estudio, ya que en los BST durante la época seca la abundancia de insectos herbívoros en los sustratos rasantes disminuye y en las lluvias aumenta (Coley, 1993; Coley y Barone, 1996; Gerhardt, 1998; García-Atencia et al., 2015). De esta manera, es posible que en la época seca las especies de Anolis exploren perchas más alejadas del suelo en busca de potenciales presas teniendo en cuenta que estos reptiles son principalmente insectívoros. Adicionalmente, durante la época seca la pérdida del follaje en estratos altos permite una mayor radiación en el suelo, lo que incrementa la temperatura del suelo; razón por la cual la mayoría de las especies utilicen perchas más alejadas del suelo para evitar un sobrecalentamiento que afecte sus procesos fisiológicos y eventualmente la muerte.
La relación inversa de los valores de traslape espaciales y alimenticios estarían aportando más evidencia de la complementariedad de nicho para las especies continentales (Losos, 2009); lo que indicaría que la segregación de los Anolis en el área de estudio estaría mediada por un patrón de coexistencia ecológica promovida por la repartición de recursos por algún tipo de interacción ecológica entre las especies y no por procesos azarosos. Aunque los cálculos de traslape de nicho alimenticio fueron realizados con base en las medidas morfológicas de las especies como una medida indirecta del tamaño de presa consumida, estos valores podrían estar sobrestimados según lo proponen Schoener (1968) y Herrel et al. (2006), debido a una menor resolución de la que se obtendría si se utilizara también una información directa del tamaño y tipo de presa según lo sugerido Moreno-Arias et al. (2020). Lo anterior indicaría que la comunidad de Anolis estudiada, en realidad podría repartirse más específicamente los recursos alimenticios debido a una característica limitante del mismo.
En general, los análisis mostraron que las especies de Anolis interactúan compartiendo más los recursos espaciales que los alimenticios; los cuales se reflejaron en el uso diferencial de los recursos y como este patrón cambia entre épocas. Lo anterior tiene implicaciones ecológicas en las especies y básicamente se relaciona con la diferencia de oferta y disponibilidad de recursos en el BST en las dos épocas, la cual es menor en la seca debido al estrés hídrico al que se ven sometidas las especies en esta época. Se hace necesario realizar trabajos similares en otras áreas de tierras bajas del Caribe colombiano, pero complementándolos con la ecología térmica de las especies y la dinámica poblacional para el estudio de los procesos responsables de la estructuración ecológica de las comunidades de lagartijas en esta zona del país.














