Introducción
Los fitoesteroles son constituyentes importantes de las plantas que poseen propiedades biológicas como hipocolesterolémicos, hipoglucemiantes y antioxidantes (Da Silva et al., 2015, Velásquez-Méndez, 2013), cuyas estructuras se encuentran conformadas por un sistema de cuatro anillos, dentro de los cuales, tres de ellos se encuentran conformados por seis átomos de carbono y un anillo de cinco carbonos, comúnmente enlazados a grupos metilo en las posiciones C-10 y C-13 y una cadena lateral en el C-17, así como un grupo hidroxilo en el C-3 (Da Silva et al., 2015). Las frutas y los aceites vegetales contienen gran cantidad de fitoesteroles, siendo el 95% constituidos por el β-sitosterol y el campesterol (Fernández et al., 2003). El acetato de β-sitosterilo es un esteroide formado por la condensación del grupo hidroxilo del β-sitosterolcon ácido acético y ha sido reportado en especies como Neolitsea sericea (Sharma et al., 1993, 1994), Lordhowea insularis (Bohlmann et al., 1982), Cynomorium songaricum (Yu-Bi et al., 2009) y en el hongo Cordyceps sinensis. El dihidrolanosterol es un 3β-esterol formado por la reducción del doble enlace entre C-24 y C-25 del lanosterol presente en plantas, humanos (Swainston, 2016) y en ratones. Reportes han indicado la presencia de este fitoesterol en especies como Euphorbia sapinii (TsopmoyKamnaing, 2011), Heterobasidion annosum (Munro y Musgrave, 1971), Mortierella alpina (Nes y Nichols, 2006), Capsicun annuun (Itoh et al., 1977), Solanum melongena (Farines et al., 1988), Tillandsia recurvata (Cabrera y Seldes, 1995), Chlorella vulgaris (Yasukawa et al., 1996), Wolfiporia cocos (Kaminaga et al., 1996), Euphorbia Kansui (Zheng, 1998) y Saccharomyces cerevisiae.
En Colombia, se han reportado principalmente cuatro especies silvestres de la familia Convolvulaceae relacionadas con la batata (Lu et al., 2018) como son Ipomoea hederifolia L., Ipomoea purpurea (L) Roth, Ipomoea tiliaceae (Willd) Choisy e Ipomoea trifida (H.B.K.) G. Don (Gómez y Rivera, 1987), siendo esta última una planta invasora polinizada por insectos, nativa de América Central y del Sur, que se reproduce predominantemente por semillas y artificialmente por esquejes vegetativos (Yasuo y Katsuyuki, 2000). Adicionalmente, I. trifida se encuentra distribuida en los departamentos del Atlántico, Antioquia, Bolívar, Caldas, Cauca, La Guajira, Magdalena, Nariño, Sucre y Valle del Cauca (Arias, 2011). Esta batata silvestre dispone de flores claras color crema con bordes púrpura claro, tallos oscuros con pocos tricomas, hojas sagitadas, presencia de látex y hábito trepador envolvente (Figura 1) (Arias, 2011). Un estudio sobre las resinas glicosídicas de esta especie permitió identificar los ácidos grasos que se encuentran acilando los núcleos de azúcar como son los ácidos octanoico, decanoico, dodecanoico y hexadecanoico (Osorio et al., 2018), los cuales se encuentran presentes en una gran diversidad de resinas glicosídicas que han sido aisladas del género Ipomoea (Pereda-Miranda et al., 2010; Castañeda-Gómez et al., 2019; Lira-Ricárdez et al., 2019). Se descubrió que las partes aéreas de I. carneae I. trifida encontradas en Nicaragua contenían calisteginas B1, B2, B3 y C1, que son inhibidores competitivos de β-glucosidasa y α-galactosidasa (Salinas et al., 2019).
En esta investigación se llevó a cabo el estudio fitoquímico de la especie Ipomoea trifida para el aislamiento y la identificación de los fitoesteroles mayoritarios 1 y 2 del extracto hexánico de las partes aéreas de esta planta.
Materiales y métodos
Material vegetal
Las partes aéreas de Ipomoea trifida se colectaron en la vereda La Concha, Circasia, Colombia. El material vegetal se ingresó e identificó en el herbario de la Universidad del Quindío con número de voucher (HUQ38326).
Extracción y separación
Las partes aéreas se secaron (630 g), pulverizaron y maceraron exhaustivamente a temperatura ambiente con n-Hexano. El extracto (16,3 g) se fraccionó por medio de cromatografía de columna abierta sobre gel de sílice (293,4 g), usando como fase móvil una mezcla de disolventes, iniciándose con hexano, hexano-CHCl3, CHCl3-(CH3)2CO, (CH3)2CO-MeOH hasta MeOH (100%). En total se obtuvieron 121 eluatos de 200 mL cada uno, los cuales se analizaron y revelaron por cromatografía de capa fina (cromatoplacas Merck de sílica gel 60 F254) y mediante radiación UV (254-366nm) y Ce(SO₄)₂*4H₂O. Las fracciones se combinaron en 12 subfracciones (I-XII) de acuerdo con su homogeneidad cromatográfica. El compuesto 1 fue purificado de la fracción III (25 mg) con una mezcla de Hexano: CHCl3 (1:1) y el compuesto 2 de la fracción IV (30mg) con Hexano: CHCl3 (4:6) y Hexano: CHCl3 (1:9). Los compuestos 1 y 2 se caracterizaron mediante técnicas espectroscópicas de IR, RMN 1H, 13C, DEPT, HSQC, HMBC, COSY y NOESY y espectrometría de masas (CG-MS).
Resultados
Acetato de β-sitosterilo (1): sólido amorfo, p.f 177-184 °C, Rf 0,65 (Hex/CHCl3, 80:20), CG-MS: [M]+=456 m/z (456,396182 calculado para C31H52O2), 411 [M-45]+, 396 [M-60]+, 317 [M-139]+, 290 [M-166]+, 275 [M-181]+, 231 [M-225]+, 177 [M-279]+, 147 [M-309]+, 121 [M-335]+, 95 [M-361]+; RMN 1H y 13C (Tabla 1).
Dihidrolanosterol (2): sólido amorfo, p.f 260-264°C, Rf 0,28 (Hex/CHCl3, 80:20), CG-MS: [M]+=428 m/z (428,401268 calculado para C30H52O), 413 [M-15]+, 395 [M-33]+, 275 [M-153]+, 257 [M-171]+, 206 [M-222]+, 191 [M-237]+, 165 [M-263]+, 149 [M-279]+, 135 [M-293]+, 96 [M-332]+; RMN 1H y 13C (Tabla 2).
Discusión
Las partes aéreas de Ipomoea trifida se secaron, pulverizaron y maceraron con n-hexano, luego el extracto se fraccionó por cromatografía de columna sobre gel de sílice para la purificación de los compuestos 1 y 2 (Figuras 2 y 3).
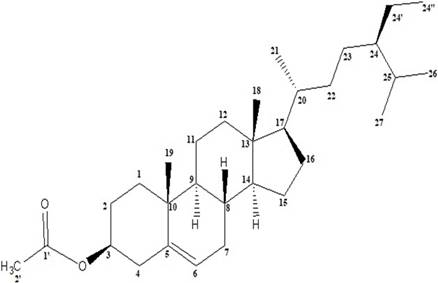
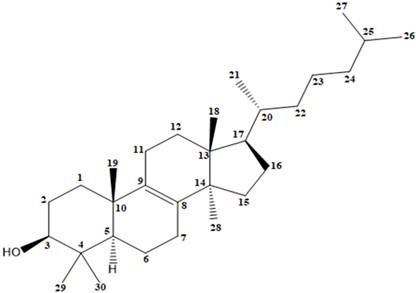
Figura 2 Estructura química del acetato de β-sitosterilo (1). Fitoesterol mayoritario de Ipomoea trifida.
El espectro IR del compuesto 1 mostró bandas características de la tensión simétrica-asimétrica y la deformación de los grupos metilo y metileno a 2919, 2851, 1455 y 1375 cm-1, una banda correspondiente al grupo carbonilo a 1731 cm-1 y una banda a 1240 cm-1 del grupo C-O-C del éster (Figura 4).
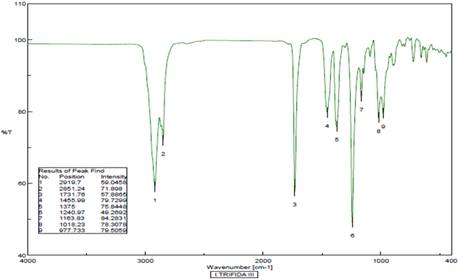
Figura 4 Espectro IR del Acetato de β-sitosterilo (1).Bandas relacionadas a los grupos funcionales CH3, CH2, C=O, R-O-R.
El espectro de masas del compuesto 1 presentó un pico de ion molecular m/z de 456 y un pico m/z a 411 [M-OHCO]+ atribuido al reordenamiento de McLafferty del grupo éster del enlace β, seguido de un pico m/z 396 [M- OHCOCH3]+ (Figura 5).
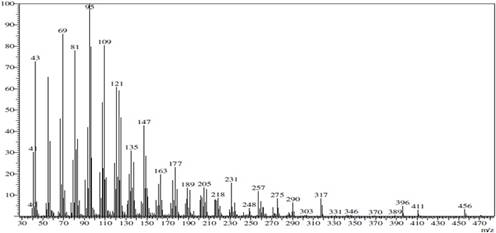
Figura 5 Espectro de masas del Acetato de β-sitosterilo (1). Se observa el pico de ion molecular a m/z 456 [M]+ (C31H52O2).
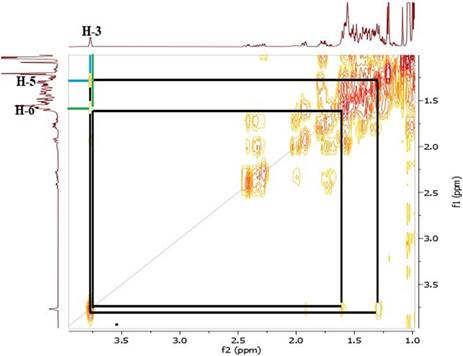
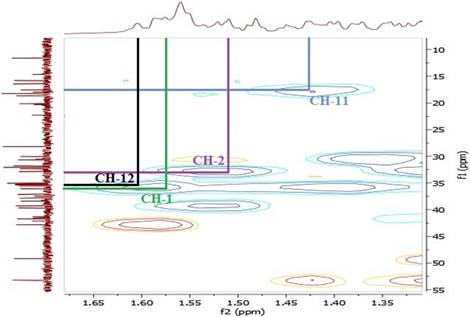
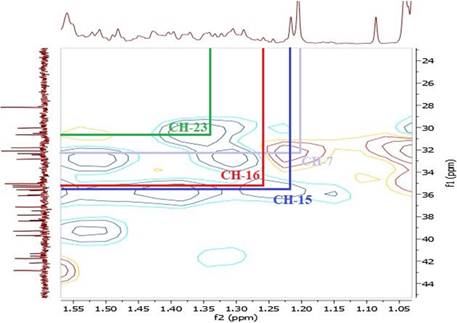
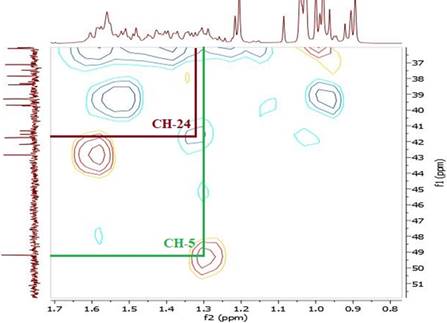
El espectro RMN-1H del compuesto 1 mostró dos singuletes que corresponden a los protones H-18 y H-19 en 0,90 y 1,03 ppm, un doblete a 0,84 ppm (d, J=7,2 Hz, 3H) perteneciente a H-21 y otro doblete a 0,97 ppm (d, J=5,8 Hz, 6H) que corresponde a los protones H-26 y H-27, también se observó un singulete a 2,07 ppm (H-2’) que corresponde a protones del metilo vecinal al carbonilo, indicando la acetilación en el esqueleto esteroidal. A campo bajo se observó una señal a 5,23 ppm (H-6) atribuido al protón vinílico y un multiplete a 4,53 ppm (m, 1H) correspondiente al protón (H-3) geminal al oxígeno del enlace β. El espectro COSY, permitió determinar las correlaciones entre H-3 (δ: 4,53 ppm) y H-4a (δ: 1,78 ppm), H-4a (δ: 1,78 ppm) y H-4b (δ: 1,00 ppm), asignadas para el ciclo A del esqueleto esteroidal y entre H-6 (δ: 5,23 ppm) y H-7a (δ: 1,93 ppm). En el espectro se observan las correlaciones H-7a (δ: 1,93 ppm) y H-7b (δ: 1,50 ppm), por el efecto del apantallamiento del anillo B y el efecto que ejerce el protón vinílico H-6 desprotegiendo al H-7a, haciendo que éste se desplace a campo bajo en comparación con su protón geminal H-7b que se encuentra a campo más alto. La correlación entre los protones: H-25 (δ: 1,31 ppm) y H-26 (δ: 0,97 ppm), H-25 (δ: 1,31 ppm) y H-27 (δ: 0,97 ppm), se atribuyó a la cadena lateral del esqueleto esteroidal (Figuras 6 y 7).
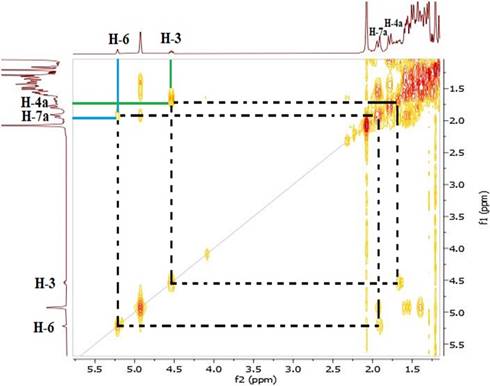
Figura 6 Espectro COSY del compuesto 1 de la región 1,0 a 6,0 ppm. Correlación homonuclear 3JH-H (400 MHz, CDCl3).
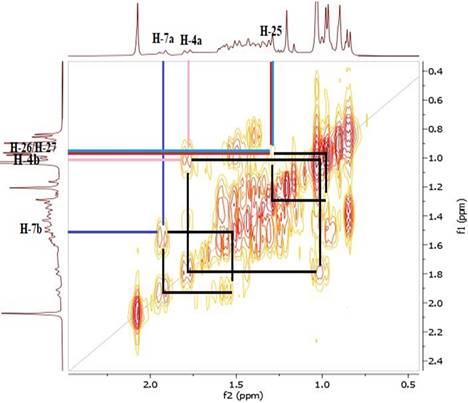
Figura 7 Espectro COSY del compuesto 1 a campo alto. Correlación homonuclear 3JH-H (400 MHz, CDCl3).
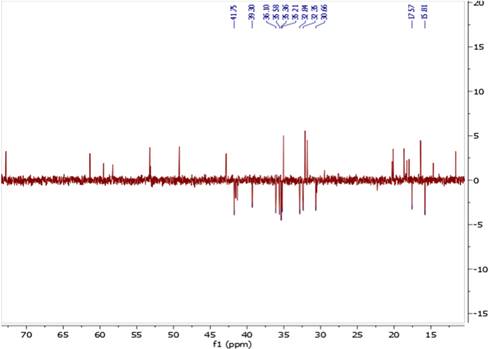
El espectro de RMN 13C junto con el DEPT 135 mostraron 31 señales correspondientes al fitoesterol 1 (Figura 8), dentro de la cuales, 14 señales correspondieron a los grupos metilo (CH3) y metino CH y 11 señales para los grupos metileno CH2, además, se observó la señal correspondiente al C del carbonilo a δC 170,93 ppm.
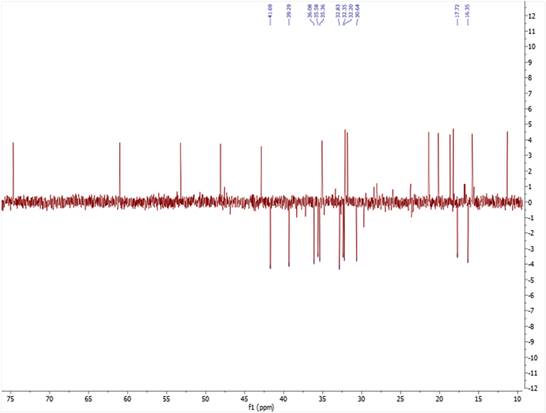
Figura 8 Espectro DEPT 135 (400 MHz, CDCl3) del compuesto 1.Señales hacia arriba (CH3, CH); Señales hacia abajo (CH2).
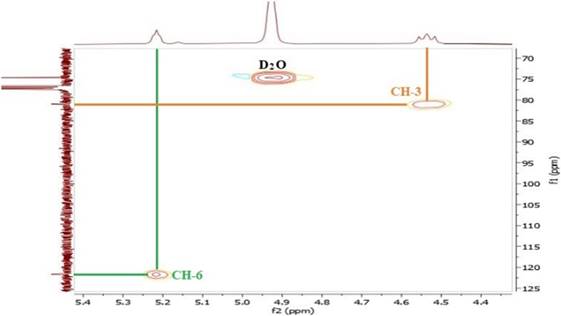
En el espectro HSQC se observó la correlación entre el protón vinílico δH 5,23 ppm con su carbono a δC 121,41 ppm (H-6/C-6) y el hidrógeno geminal al grupo acetato en δH 4,53 ppm con su carbono a δC 80,80 ppm (H-3/C-3) (Figura 9).
En la Tabla 1 se muestran los datos espectroscópicos por RMN 1H y 13C del acetato de β-sitosterilo (1) con sus respectivos desplazamientos, multiplicidad e integración.
Tabla 1 Datos espectroscópicos RMN 1H (400 MHz) y 13C (100 MHz) del compuesto 1 (CDCl3).
| Posición | 13 C | 1 H |
|---|---|---|
| 1 | 36,08 | 1,58 (m, 2H) |
| 2 | 30,64 | 1,51 (m, 2H) |
| 3 | 80,80 | 4,53 (t, 15,96, 1H) |
| 4a | 41,69 | 1,78 (d, 12,75, 1H) |
| 4b | 41,69 | 1,00 (s, 1H) |
| 6 | 121,41 | 5,23 (s, 1H) |
| 7a | 32,35 | 1,93 (d, 16,48, 1H) |
| 7b | 32,35 | 1,50 (m, 1H) |
| 11 | 16,35 | 1,43 (m, 2H) |
| 12 | 39,29 | 1,52 (m, 2H) |
| 15 | 32,82 | 1,50 (m, 2H) |
| 16 | 32,20 | 1,31 (m, 2H) |
| 18 | 18,23 | 0,90 (s, 3H) |
| 19 | 31,78 | 1,03 (s, 3H) |
| 21 | 11,26 | 0,84 (d, 7,21, 3H) |
| 22 | 35,58 | 1,20 (s, 2H) |
| 23 | 35,36 | 1,16 (s, 2H) |
| 25 | 30,02 | 1,31 (m, 1H) |
| 26 | 15,81 | 0,97 (d, 5,85, 6H) |
| 27 | 16,35 | 0,97 (d, 5,85, 6H) |
| 2’ | 21,41 | 2,07 (s, 3H) |
| 24’ | 17,72 | 0,91 (s, 2H) |
m=multiplete, t= triplete, d= doblete, s= singulete.
En el espectro IR del compuesto 2 se observaron dos bandas características de la tensión del enlace OH a 3470 cm-1, dos bandas características a la tensión simétrica-asimétrica y a la deformación de los grupos metilo y metileno a 2926, 2864 1449 y 1383 cm-1, una banda correspondiente al grupo C=C a 1704 cm-1 atribuida a la simetría de la molécula en esa región del núcleo esteroidal causada por la tetra sustitución del alqueno. El grupo hidroxilo se confirmó con la banda C-OH a 1174 cm-1 (Figura 10).
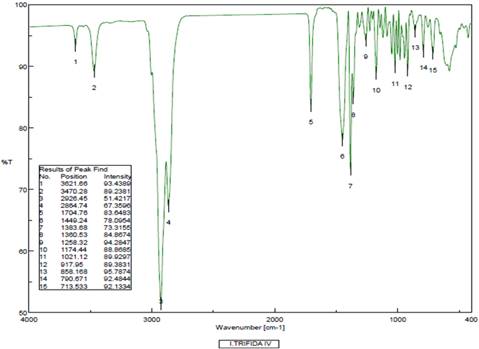
Figura 10 Espectro IR del dihidrolanosterol (2).Bandas relacionadas a los grupos funcionales OH, CH3, CH2, C=C, C-OH.
El compuesto 2 se analizó por medio de sonda directa a un equipo de espectrometría de masas acoplado a un cromatógrafo de gases mostrando un pico de ion molecular con un valor m/z de 428 correspondiente a la fórmula molecular C30H52O, con picos de fragmentación de m/z 413 [M-CH3]+, seguido de un pico m/z 395 [M- CH3H2O]+, señal que indica la pérdida de un grupo -OH, y un pico 191 [M-R1CH3]+, estas señales son características de la fragmentación de los esqueletos fitoesteroidales (Figura 11).
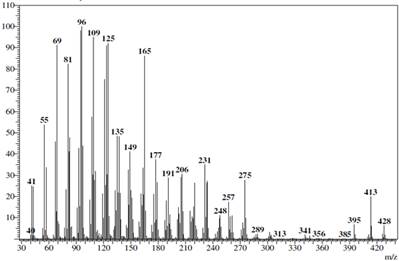
Figura 11 Espectro de masas del dihidrolanosterol (2).Se observa el pico de ion molecular a m/z 428 [M]+ (C30H52O).
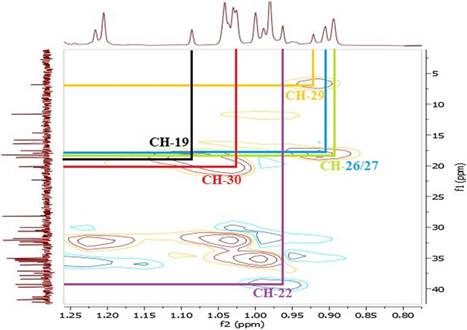
En el espectro de RMN 1H del compuesto 2 se observó el solapamiento de señales características de los grupos metilo y metileno entre 0,7 y 2,5 ppm como un multiplete. Adicionalmente, se observó un doblete correspondiente al grupo C-H geminal al OH a 3,7 ppm (H-3), un singulete a 1,03 ppm y 0,92 ppm correspondiente a los grupos metilo vecinales al grupo C-OH, cuyos protones corresponden a H-29 y H-30 y un doblete a 0,90 ppm (d, J=4.5 Hz ,6H) correspondiente a los protones H-26 y H-27. El espectro de RMN 13C junto con el DEPT 135 mostraron 30 señales de carbono entre las cuales se encuentran 8 señales correspondientes a los grupos metilo (CH3), 5 a los grupos metino (CH) y 11 señales para los grupos metileno (CH2). Adicionalmente, se observó la señal del C=C a δC 136,41 ppm (C-8 y C-9) (Figura 12).
En el espectro COSY de 2 se encontraron las correlaciones entre el H-3 (δ: 3,77 ppm) geminal al OH con el H-5 (δ: 1,29 ppm) y H-6 (δ: 1,59 ppm) del anillo B del núcleo esteroidal (Figura 13).
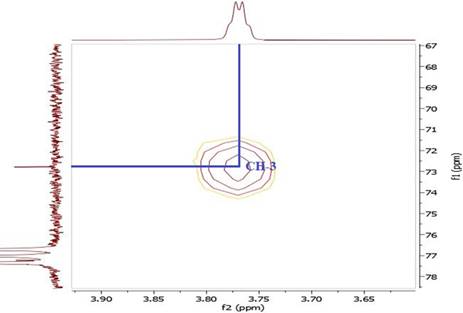
En el espectro HSQC se observó la correlación 1 J C-H del protón geminal al OH aδH 3,77 ppm y δC 72,80 ppm (Figura 14), así como otras correlaciones entre los hidrógenos y carbonos desplazados a campo alto del espectro (Figuras 15, 16, 17 y 18). En la Tabla 2 se muestran los datos espectroscópicos para el compuesto 2.
Tabla 2 Datos espectroscópicos RMN 1H (400 MHz) y 13C (100 MHz) del compuesto 2.
| Posición | 13 C | 1 H |
|---|---|---|
| 1 | 36.10 | 1.60 (m, 2H) |
| 2 | 32.84 | 1.51 (m, 2H) |
| 3 | 72.80 | 3.77 (d, J=2.62, 1H) |
| 5 | 49.21 | 1.29 (m, 1H) |
| 6 | 15.81 | 1.59 (m, 2H) |
| 7 | 32.35 | 1.20 (m, 2H) |
| 11 | 17.57 | 1.43 (m, 2H) |
| 12 | 35.36 | 1.58 (m, 2H) |
| 15 | 35.58 | 1.21 (m, 2H) |
| 16 | 35.21 | 1.25 (m, 2H) |
| 18 | - | 0.75 (s, 3H) |
| 19 | 18.67 | 1.08 (s, 3H) |
| 21 | - | 0.98 (s, 3H) |
| 22 | 39.30 | 0.96 (s, 2H) |
| 23 | 30.65 | 1.34 (m, 2H) |
| 24 | 41.75 | 1.32 (m, 2H) |
| 26 | 17.96 | 0.90 (d, J=4.54 ,6H) |
| 27 | 18.26 | 0.90 (d, J=4.54 ,6H) |
| 28 | - | 1.00 (s, 3H) |
| 29 | 6.84 | 0.92 (s, 3H) |
| 30 | 20.15 | 1.03 (s, 3H) |
m=multiplete, t= triplete, d= doblete, s= singulete.
Conclusión
En este estudio se aislaron e identificaron por primera vez dos fitoesteroles mayoritarios, el acetato de β-sitosterilo y el dihidrolanosterol en el extracto hexánico de la especie vegetal Ipomoea trifida colectada en el Quindío, como sólidos amorfos, mediante técnicas espectroscópicas que permitieron determinar la presencia del núcleo del pentanoperhidrofenantreno que identifica a los esteroides, así como los grupos enlazados a estos núcleos, el acetato y el hidroxilo en la posición 3 para cada uno de ellos y la cadena lateral en la posición 17.