Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Persona y Bioética
Print version ISSN 0123-3122
pers.bioét. vol.17 no.1 Chia Jan./June 2013
¿EN QUÉ MEDIDA ES VERDAD QUE LOS SUJETOS DE INVESTIGACIÓN COMPRENDEN SUS DERECHOS?
Amanda Cecilia Lobato-Victoria1, Luz María Guadalupe Pichardo-García2
1 Jefa de Urgencias, Hospital Español, México, D.F.
amanda_2528@hotmail.com
2 Doctora en Ciencias con especialidad en Bioética. Universidad Panamericana, México.
lpichard@up.edu.mx
Fecha de Recepción: 2012-11-09, Fecha de Envío a Pares: 2012-11-13, Fecha de Aprobación por Pares: 2013-02-19, Fecha de Aceptación: 2013-02-20
Resumen
Este artículo tiene como objetivo evaluar la comprensión de los sujetos de experimentación acerca de sus derechos, y en qué medida son capaces de hacerlos valer. Es un estudio cualitativo, con entrevistas semiestructuradas, muestreo intencional y análisis situacional, en instituciones de salud en Ciudad de México. Se encontró que los sujetos de investigación en países como México presentan una extrema vulnerabilidad y dependencia hacia el médico reflejada y agravada por su desconocimiento de lo implicado en su participación en el protocolo de investigación, tal como se manifiesta en las respuestas a las entrevistas. Se concluye que se debe involucrar al investigador en mayor grado en el proceso de obtención del consentimiento informado (CI) de manera que resuelva eficazmente las dudas del paciente sobre la naturaleza y los efectos del tratamiento al que se va a someter. Por otro lado, es necesario empoderar al sujeto para exigir lo justo en beneficios y compensación de daños en caso de efectos adversos, superando la actitud arraigada todavía en el modelo paternalista.
Palabras clave: derechos humanos, sujetos de investigación, consentimiento informado, relaciones médico-paciente, ética. (Fuente: DeCs, BIREME).
TO WHAT EXTENT IS IT TRUE THAT RESEARCH SUBJECTS UNDERSTAND THEIR RIGHTS?
Abstract
The objective of this article is to assess what the subjects of experiments know about their rights and to what extent they are able to exercise them. The study in question is qualitative and features semi-structured interviews, purposive sampling and situation analysis conducted at health institutions in Mexico City. The findings show research subjects in countries such as Mexico are extremely vulnerable and dependent on the physician. As manifest in the responses to the interviews, this situation is reflected in and compounded by their lack of knowledge about what their participation in the research protocol implies. The conclusion is that researchers should be more involved in the process of obtaining informed consent (IC), so as to effectively address the patient's concerns about the nature and effects of the treatment they will receive. It also is necessary to empower the subject to demand what is fair in terms of benefits and compensation for damages in the event of adverse effects, by overcoming attitudes still entrenched in the paternalistic model.
Key words: Human rights, research subjects, informed consent, physician-patient relations, ethics. (Source: DeCs, BIREME).
EM QUE MEDIDA É VERDADE QUE OS SUJEITOS DE PESQUISA COMPREENDEM SEUS DIREITOS?
Resumo
Este artigo tem como objetivo avaliar a compreensão dos sujeitos de experimentação sobre seus direitos, e em que medida são capazes de fazê-los valer. É um estudo qualitativo, com entrevistas semiestruturadas, amostragem intencional e análise situacional, em instituições de saúde na Cidade do México. Constatou-se que os sujeitos de pesquisa em países como o México apresentam uma extrema vulnerabilidade e dependência do médico refletida e agravada por seu desconhecimento do implicado em sua participação no protocolo de pesquisa, tal como se manifesta nas respostas às entrevistas. Conclui-se que se deve envolver o pesquisador em maior grau no processo de obtenção do consentimento informado (CI) de maneira que resolva eficazmente de dúvidas do paciente sobre a natureza e os efeitos do tratamento ao qual será submetido. Por outro lado, é necessário fortalecer o sujeito para exigir o justo em benefícios e compensação de danos em caso de efeitos adversos, superando a atitude enraizada ainda no modelo paternalista.
Palavras-chave: direitos humanos, sujeitos da pesquisa, consentimento livre e esclarecido, relações médico-paciente, ética. (Fonte: DeCs, BIREME).
INTRODUCCIÓN
Una realidad que observamos en países emergentes —como México y otros similares de América Latina—, donde se desarrolla gran parte de la investigación de nuevas moléculas de farmacéuticas y empresas multinacionales, además de la investigación en institutos de salud, es que los derechos humanos, aunque son bien conocidos, no son reconocidos y mucho menos aplicados por todas las partes involucradas, aunque hayan sido intensamente estudiados en los países desarrollados (1). Existe más de una década de publicaciones sobre el tema. Diversas conductas de mala práctica e incorrectas éticamente continúan observándose en la cotidianidad de las distintas instituciones donde se reclutan los sujetos para las pruebas de investigación (2). En Argentina se reporta que:
... los principios y reglas bioéticas son frecuentemente violados de diversas maneras, algunas veces de forma abierta, como cuando se omite el consentimiento de los sujetos de investigación; otras, de modo más solapado. Tal es el caso de consentimientos obtenidos en un idioma distinto del que habla el sujeto. El principio de justicia suele ser también vulnerado. Muchas veces las muestras no son obtenidas equitativamente de modo tal que se compartan riesgos y beneficios (3).
El sujeto de investigación proviene habitualmente de un nivel sociocultural de medio a bajo (4) (generalmente son indígenas que no hablan el español), por lo que no son capaces de entender los términos médicos, los procedimientos, los riesgos y beneficios que se plantean en el consentimiento informado (CI)3 para una "persona competente", pero que aceptan participar por los medicamentos que se le dan gratuitamente o porque el médico es para ellos el único recurso y una autoridad de la que no dudan, constituyendo una población cautiva, bajo un modelo paternalista tradicional (6).
A través de los medios de comunicación social se facilita una mayor conciencia de los derechos humanos en diversos ámbitos y más personas están en condiciones de hacerlos valer, aunque poco ha podido hacerse específicamente desde la perspectiva de los sujetos participantes en la experimentación, quienes adolecen, todavía, de una alarmante dependencia causada por el analfabetismo funcional, la pobreza, las injusticias sociales, la corrupción —incluso dentro de las instituciones de salud (4)— y otros factores muy difíciles de resolver. En la mayoría de los casos, el paciente no es capaz de discernir lo ético de lo que no lo es, en las cuestiones más simples; está a merced de la "buena voluntad" y del sentido ético de los médicos e investigadores del proyecto. No se ha desarrollado ningún estudio para conocer en qué medida los sujetos de investigación creen que entienden y exigen que se respeten sus derechos como pacientes, especialmente en lo que ellos deberían ser capaces de reivindicar. El presente estudio tiene como objetivo esclarecer estos cuestionamientos desde la perspectiva de los sujetos que aceptan participar en protocolos de investigación en los hospitales en países en desarrollo como México, y con base en los resultados plantear acciones efectivas para la prevención y solución de las carencias encontradas, tanto en la población reclutada como en el equipo médico y de investigación.
MÉTODO
Se aplicó un diseño de investigación cualitativo, descriptivo, transversal (7), por medio de entrevistas semiestructuradas a sujetos en protocolos de investigación. Los datos se estudiaron mediante análisis situacional (8, 9). Se alcanzó la saturación (9, 10) al llegar a setenta entrevistas.
La población de estudio fue seleccionada aleatoriamente con personas que acuden a los institutos de tercer nivel de atención en Ciudad de México. La investigación se realizó en septiembre, octubre y noviembre de 2011, y enero, febrero y marzo de 2012.
Tipo y tamaño de la muestra. El muestreo fue intencional.
Criterios de inclusión. Los criterios de inclusión utilizados fueron:
-
Que se encontraran dentro de un protocolo de investigación.
-
Que decidieran con completa libertad contestar por ellos mismos la información requerida.
Criterios de exclusión: Los criterios de inclusión fueron dos:
-
Que no se encontraran dentro de un protocolo de investigación.
-
Incapaces de decidir con completa libertad contestar por ellos mismos la información requerida.
Las instituciones seleccionadas y los sujetos de investigación se manejaron por medio de claves. El clima que se logró fue de confianza y apertura por el entrenamiento de los entrevistadores, quienes estuvieron completamente involucrados en los objetivos del estudio. No contamos con datos complementarios de los protocolos por parte de la institución, lo que podría enriquecer el enfoque del estudio.
RESULTADOS
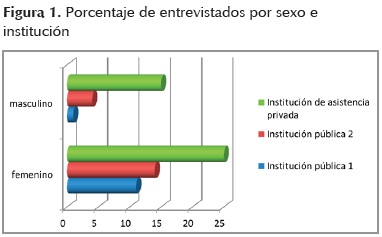
En total se entrevistaron setenta individuos participantes en protocolos de experimentación. Un 42,9 % fueron reclutados de institutos de tercer nivel de atención de la Secretaría de Salud en Ciudad de México, y el 57,1 % provienen de instituciones privadas de asistencia pública para enfermos de un estrato socioeconómico de medio-bajo a bajo, sin acceso a seguridad social. Casi todos con escasa preparación cultural o analfabetas funcionales, algunos del interior de la república mexicana. El porcentaje de mujeres fue muy superior (71%) al de hombres (29%) (figura 1).
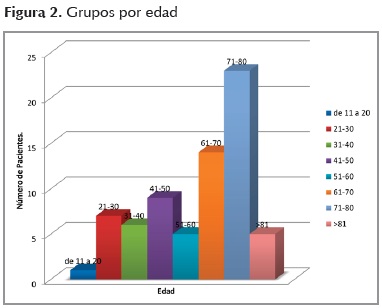
Los sujetos se dividieron por edad. Las edades de los entrevistados estuvieron entre los 18 y los 83 años, la media (M) fue de 56 años con una desviación estándar de 18 años. El 90 % de la distribución de frecuencias de la población se encontró entre los 38 y los 74 años, un rango adecuado para que quede representada la etapa de adultos mayores (Figura 2).
Los protocolos comprendieron las siguientes patologías: degeneración macular, hiperparatiroidismo, cáncer de mama, liposarcoma, fibrilación auricular, epilepsia, trombosis venosa profunda, cáncer cérvico-uterino, infarto agudo del miocardio, obstrucción tubárica bilateral y síndrome de antifosfolípidos.
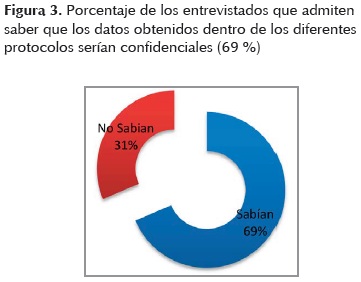
Un 31% de los participantes (figura 3) aún desconoce el derecho que tiene al manejo confidencial de toda la información personal brindada y obtenida durante la investigación. Un 75% de los varones y un 66% de las mujeres afirman saber que la información obtenida sería manejada de forma confidencial.
Un 87,1 % de la población dice estar enterada de los riesgos y un 57,1 % de los beneficios, los entrevistados aceptan que conocen en mayor proporción los riesgosque pueden llegar a sufrir al ingresar al protocolo que los beneficios que pueden obtener del mismo.
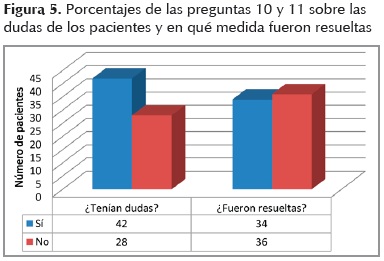
Un 95% en el caso de los hombres y un 84% en el caso de las mujeres refirieron que se les había hablado acerca del riesgo-beneficio que podrían sufrir al ser parte de la investigación. Los resultados muestran que un 60% tuvo algún tipo de duda, la cual no le fue resuelta a un 54% (Figura 4) en el orden de quedar satisfechos; los principales interrogantes fueron acerca de medicamentos y pronóstico de la enfermedad (Figura 5).
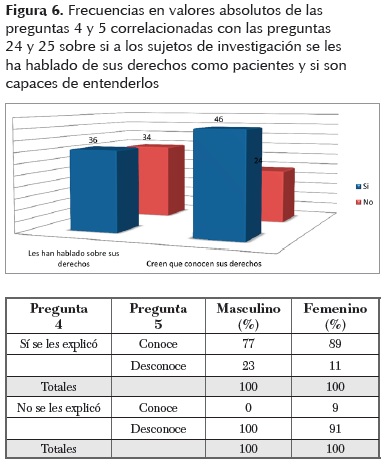
A partir de los resultados obtenidos para las preguntas 24 y 25 (Figura 6) se puede observar la proporción de la población entrevistada que tiene cierta idea de sus derechos como sujetos de investigación. Un 65,7% creen conocerlos, aunque en la realidad no es así. Muy pocos de ellos fueron capaces de enunciar algún derecho. Tampoco identificaron términos comunes en la investigación con sujetos humanos como son: consentimiento informado (preguntas de la 6 a la 11), procedimientos clínicos (preguntas 8 y 9), posibles riesgos/beneficios (preguntas 7 y 8), reacciones adversas (pregunta 12), indemnización en caso de sufrir daños (pregunta 16), dudas sobre su participación (preguntas de la 10 a la 13) y confidencialidad (pregunta 14).
DISCUSIÓN
Este es el primer estudio que comprueba que la casi totalidad de los sujetos de investigación reclutados en Ciudad de México para protocolos de investigación siguen constituyendo poblaciones que se encuentran en una condición sumamente vulnerable (11), de las que se puede abusar, y de hecho se abusa, por no conocer ni entender sus derechos como participantes y, por lo mismo, ser incapaces de exigirlos. En la mayoría de las ocasiones su asentimiento al CI no implica que comprendan la terminología médica con la que les es descrita su participación, sus deberes y derechos (12), en especial, los posibles riesgos-beneficios, sus responsabilidades, la libertad de salir del proyecto si así lo desean, los efectos secundarios y la justa indemnización en caso necesario. Esto, a pesar de que los investigadores y los médicos quedan satisfechos con cumplir con el diligenciamiento y la firma formal del CI, siendo un mero trámite que en la mayoría de los protocolos se ha demostrado que no basta (13), por más eficaz y completo que parezca su diseño. Es evidente que falta, además, un cercano y adecuado seguimiento personal al paciente por parte de los investigadores y médicos. Es indispensable que se aseguren de que los sujetos involucrados han comprendido los contenidos esenciales de su participación, motivándolos por otro lado a resolver sus dudas, haciendo que asuman la responsabilidad por su propia persona, sin descargarla en el equipo de salud, al estilo del antiguo modelo paternalista. El no cumplir con estas dos condiciones constituye una falta de conciencia ética grave de las dos partes, en distinta medida. Lo anterior deriva en el progresivo desarrollo de una nueva forma de relacionarse con el paciente.
En este estudio se encontró, además, que no se usan los métodos adecuados para aplicar el CI, explicar con suficiente claridad los tratamientos y sus implicaciones, conforme a las distintas capacidades que demuestra cada uno de los sujetos reclutados, en especial su analfabetismo funcional y sus condiciones ajenas al ámbito médico. Esto se evidenció en que no sienten la necesidad de resolver dudas y dan por entendido lo que se les ha dicho, incluyendo las implicaciones que tiene su libre participación, aunque en la realidad no sea así.
En artículos publicados en otros países de Latinoamérica (3) con características similares en experimentación con humanos, cuando intervienen empresas multinacionales de la industria farmacéutica, con intereses económicos y científicos fuertes, se observa una brecha entre el decir y el hacer de la práctica médica (2). El promotor desea un negocio rentable, el investigador está centrado en sus resultados, al médico le interesa tener un mayor número de pacientes reclutados, y al paciente le interesa la atención médica y los medicamentos. En los distintos casos el resultado es que se condiciona en gran medida la libre y voluntaria decisión del sujeto y su sí responsable al protocolo, a los intereses de los más poderosos, quedando la participación del paciente convertida en un sí impuesto en gran medida. En suma, se trata de un conflicto de intereses que debe ser mediado, pero que en la práctica no lo es.
No existen todavía legislaciones adecuadas en países como México para proteger eficazmente a los sujetos de experimentación. Y aunque en algunos casos las haya, no todo lo "legal" es legítimo. A este nivel, Lolas Stepke propone distinguir entre legalidad y legitimidad en el análisis ético de la investigación clínica:
"Legalidad se refiere al cumplimiento de procedimientos aceptados por la comunidad científica relativos a la validez, confiabilidad y solvencia del trabajo de investigación. Legitimidad alude a la propiedad con que en el contenido de la publicación se respetan los principios éticos" (14).
El hecho que el marco legal de un país permita realizar diversos procedimientos dentro de una investigación (legalidad) no es condición suficiente para que esta se pueda llevar a cabo (legitimidad), en la medida que sea injusta para los participantes. Recientemente se han realizado modificaciones a Ley General de Salud en México (31 de octubre de 2012) que señalan obligaciones a favor de los sujetos de investigación.
Numerosos reportes señalan la importancia primordial que tienen los comités de ética en la investigación (CEI) al respecto, siendo ellos los que a través de lineamientos claros y efectivos deben contribuir a que todas las investigaciones en seres humanos se desarrollen bajo principios y normas éticas, en la medida de lo posible (4), resaltando la importancia que tiene el hecho de que las instituciones interioricen los procesos de protección de los participantes en investigaciones y sus autoridades asuman la trascendencia de lo que significa dirigir ensayos clínicos en materia de salud. Conviene destacar que se debe promover entre los investigadores y profesionales de la salud en general una cultura de la ética en investigación y la necesidad de formar y capacitar comités de ética (15), los cuales deberán ocupar un espacio real en el organigrama y en la ética de los proyectos de las instituciones (16). Su papel en la vigilancia de los intereses de todas las partes involucradas es fundamental. Además de los CEI, son las instituciones mismas donde se realizan investigaciones en seres humanos quienes deben velar por que sus profesionales estén capacitados éticamente y cumplan con los principios establecidos en los diferentes tratados internacionales y legislaciones, sin esperar a que ocurra algún incidente para determinar límites y responsabilidades, pudiéndose evitar la transgresión de los derechos de los sujetos de investigación desde antes de que se lleven a cabo (17). Las instituciones deben simplificar al paciente el entendimiento de los procesos médicos.
CONCLUSIONES
Algunas estrategias posibles que se deben tener en cuenta para desarrollar un plan de concientización de derechos básicos en los sujetos de investigación en países emergentes como el nuestro, el cual servirá de marco de referencia para otros países similares, son:
Para los CEI:
-
Revisar, entre sus múltiples funciones, que para toda investigación realizada en el país con sujetos de poblaciones vulnerables los promotores e investigadores tengan en cuenta si lo que se está investigando es o no de interés específicamente para dicha población y, en caso de serlo, si tendrán acceso a los potenciales beneficios que se obtendrán a partir de ella, de una manera justa (4).
-
El intenso cambio social de las últimas décadas ha generado pacientes que claramente demandan un nuevo tipo de médicos que sepan responder adecuadamente a estos nuevos requerimientos de la sociedad, en favor del respeto a sus derechos y demandas. Lo anterior requiere un nuevo modelo médico-paciente. Este nuevo modelo se traduce primero en el respeto a los derechos más elementales de los pacientes y termina por convertirse en una meta para garantizar igualmente la libertad, la integridad y la dignidad del enfermo, lo que se traduce, para nuestros fines, en un nuevo consentimiento informado que involucre ambas partes, quedando la del investigador ligada a la del paciente: un consentimiento válidamente informado paciente-investigador (CVIPI).
-
Un tercer punto es la capacitación ética al personal de salud para que tome conciencia de que además de compartir el espacio y el tiempo con el paciente, es necesario compartir los principios éticos y humanísticos que matizan cualquier relación entre los seres humanos dentro de las instituciones. Son estos principios, llevados a la práctica, los que regulan las necesidades y expectativas del trato interpersonal que los pacientes deben recibir, y permiten al personal de salud encontrar las oportunidades de que su actividad sea una tarea eficaz, eficiente y basada en la equidad y el respeto a la dignidad humana.
-
Por último, es esencial promover la difusión de los derechos humanos elementales que se ponen en juego dentro de todas las instituciones de salud por medio de flyers o posters claros y gráficos del contenido de lo que deben saber y defender los sujetos de investigación (18), ubicados en lugares abiertos y visibles, explicados con figuras sencillas, entregados igualmente de manera personal como folletos explicados al paciente por voluntarios, trabajadores sociales y enfermeros con la finalidad de que toda persona que participe en los protocolos los conozca y, por tanto, pueda exigirlos y denunciar cualquier violación, en caso de ser transgredidos, a la instancia correspondiente (Comisión Nacional de Arbitraje Médico o similares).
Falta todavía mucho por hacer para que se logre una comprensión más amplia y cabal de los derechos del paciente como sujeto de experimentación, empezando por el mismo paciente, de manera que pueda decirse que tiene la fortaleza y la habilidad para salvaguardar su dignidad como ser humano.
3 "El consentimiento bajo información es el acto de decisión libre y voluntaria realizado por una persona competente, por el cual aceptan o rechazan las acciones diagnósticas o terapéuticas sugeridas por sus médicos, fundadas en la comprensión de la información y adecuadas a su circunstancia, respecto de las alternativas posibles, con sus correspondientes beneficios y riesgos" (5).
REFERENCIAS
1. Emanuel EJ, Grady Ch, Crouch RA, Lie RK, Miller FG. The Oxford textbook of Clinical Research Ethics. New York: Oxford University Press; 2008. [ Links ]
2. Pichardo LM, Casas ML, Reidl L, López B. Diferencias entre comités de ética en investigación públicos y privados en ciudad de México: un estudio cualitativo. Pers Bioét (Col) 2010; 14 (2): 176-186. [ Links ]
3. Outomuro D. Reflexiones sobre el estado actual de la ética en investigación en Argentina. Acta Bioethica 2004; X (1): 81-94. [ Links ]
4. Pichardo LM, Casas L, Reidl L. Hacia la construcción de una guía de auto-evaluación del desempeño de los comités de ética en investigación en una muestra de hospitales en la Ciudad de México: un análisis bioético. Tesis para obtener el grado de Doctor en ciencias. UNAM; 2011. [ Links ]
5. Tena C. Derecho de autonomía del paciente. Revista Conamed 2005; 10(2). [ Links ]
6. Casas ML. Bases Bioéticas para la toma de decisiones en la práctica médica, investigación en humanos y trasplantes. México: Trillas; 2009. [ Links ]
7. Kerlinger F, Lee HB. Investigación del comportamiento. Métodos de Investigación en Ciencias Sociales. 4 ed. México: McGraw Hill Interamericana; 2002. pp. 541-543. [ Links ]
8. Glaser B, Strauss A. The Discovery of Grounded Theory: Strategies for Qualitative Research. Chicago: Aldine; 1967. [ Links ]
9. Clarke AE. Situational analysis: Grounded Theory after the postmodern turn. USA: Sage Publications; 2005. [ Links ]
10. Charmaz K. Constructing Grounded Theory: A practical guide though Qualitative Analysis. Los Angeles; 2006. [ Links ]
11. Levine RJ. Ethics and Regulation of Clinical Research. 2 ed. New Haven: Yale University Press; 1998. [ Links ]
12. Emanuel E. ¿Qué hace que la investigación clínica sea ética? Siete requisitos éticos. En: Pellegrino A, Macklin R. Investigación en sujetos humanos: experiencia internacional. Santiago de Chile: Programa Regional de Bioética OPS/OMS; 1999. [ Links ]
13. Rothman DJ. Strangers at the bedside. New York: Basic Books; 1991. [ Links ]
14. Lolas F. Ética de la publicación médica: legalidad y legitimidad. Acta Bioethica 2000; 6 (2): 285. [ Links ]
15. Comisión Nacional de Bioética. [ Links ]
16. Instituto Nacional de Salud [en línea]. Lima. [Visitado 12 mar 2012]. Disponible en: http://ins.gob.pe/ensayosclinicos.asp [ Links ]
17. Faden RR, Beachaump TL, King NMP. A History and Theory of Informed Consent. New York: Oxford University Press; 1986. [ Links ]
18. Comisión Nacional de Arbitraje Médico [en línea]. México, DF. [Visitado 14 may 2012]. Disponible en: http://www.conamed.gob.mx [ Links ]