Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Persona y Bioética
On-line version ISSN 2027-5382
pers.bioét. vol.19 no.2 Chia July/Dec. 2015
https://doi.org/10.5294/PEBI.2015.19.2.2
UN MARCO ÉTICO AMPLIO PARA LA INVESTIGACIÓN CIENTÍFICA EN SERES HUMANOS:
MÁS ALLÁ DE LOS CÓDIGOS Y LAS DECLARACIONES.
LA PROPUESTA DE EZEKIEL J. EMANUEL
A COMPREHENSIVE ETHICAL FRAMEWORK FOR SCIENTIFIC RESEARCH ON HUMAN BEINGS:
BEYOND CODES AND STATEMENTS.
EZEKIEL J. EMANUEL'S PROPOSAL
UM REFERENCIAL AMPLO E ÉTICO PARA A PESQUISA CIENTÍFICA EM SERES HUMANOS:
MAIS ALÉM DOS CÓDICOS E DECLARAÇÕES.
A PROPOSTA DE EZEKIEL J. EMANUEL
Fernando Suárez Obando1
1 Profesor investigador de la Facultad de Medicina. Pontificia Universidad Javeriana, Bogotá, Colombia.
fernando.suarez@javeriana.edu.co
FECHA DE RECEPCION: 2015-03-04 / FECHA DE ENVÍO A PARES: 2015-03-21 / FECHA DE APROBACIÓN POR PARES: 2015-04-14 / FECHA DE ACEPTACIÓN: 2015-05-07
PARA CITAR ESTE ARTÍCULO / TO REFERENCE THIS ARTICLE / PARA CITAR ESTE ARTIGO
Suárez Obando F. Un marco ético amplio para la investigación científica en seres humanos: más allá de los códigos y las declaraciones. La propuesta de Ezekiel J. Emanuel. pers. bioét. 2015; 19(2): 182-197. DOI: 10.5294/pebi.2015.19.2.2
RESUMEN
El ejercicio de la ética de la investigación se apoya en la normatividad local vigente y en recomendaciones de carácter universal como el Código de Nüremberg o la Declaración de Helsinki. Sin embargo, estos documentos tienen una serie de falencias que no permiten la construcción de un marco ético completo para orientar la investigación en humanos, con miras hacia un mejor aprovechamiento de sus resultados y una construcción ética del conocimiento. Se propone así, un marco ético más amplio de acuerdo con la propuesta de Ezekiel J. Emanuel, en la cual, a partir de ocho principios fundamentales, se construye un espacio de evaluación, reflexión y debate alrededor de la investigación científica en seres humanos.
PALABRAS-CLAVE: ética, comité de revisión ética, poblaciones vulnerables, desarrollo de la comunidad, investigación, sujetos de investigación, investigación en sujetos humanos (Fuente: DeCS, Bireme).
ABSTRACT
Ethics in research are norms for conduct based on local regulations and universal recommendations such as the Nuremberg Code or the Declaration of Helsinki. However, these documents have a number of shortcomings that thwart the construction of a comprehensive ethical framework to guide research on humans in an effort to make better use of research results and to provide for ethical construction of knowledge. A broader ethical framework is suggested in this article, consistent with Ezekiel J. Emanuel's proposal, specifically one that allows for evaluation, reflection and debate about scientific research on humans, based on eight fundamental principles.
KEY WORDS: Ethics, ethical review committee, vulnerable populations, community development, research, research subjects, research on humans (Source: DeCS, Bireme).
RESUMO
O exercício da ética da pesquisa se apoia na normatividade local vigente e em recomendações de caráter universal, como o Código de Nuremberg ou a Declaração de Helsinki. Contudo, esses documentos têm uma série de carências que não permitem a construção de um referencial ético completo para orientar a pesquisa que envolve humanos com vistas a um melhor aproveitamento de seus resultados e a uma construção ética do conhecimento. Assim, propõe-se um referencial ético mais amplo de acordo com a proposta de Ezekiel J. Emanuel, na qual, a partir de oito princípios fundamentais, constrói-se um espaço de avaliação, reflexão e debate sobre a pesquisa científica em seres humanos.
PALAVRAS-CHAVE: ética, comitê de revisão ética, populações vulneráveis, desenvolvimento da comunidade, pesquisa, sujeitos de pesquisa, pesquisa em seres humanos (Fonte: DeCS, Bireme).
INTRODUCCIÓN
Desde principios del siglo XX, se han desarrollado alrededor del mundo múltiples guías y lineamientos relacionados con la conducción ética de la investigación con humanos; sin embargo, a pesar de la profusión de códigos y recomendaciones, el impacto de las guías vigentes parece dudoso, especialmente en países en vías de desarrollo, en donde la investigación científica tiene un escaso apoyo, lo que trae como consecuencia, no solo un rezago en el desarrollo económico del país, sino escasas y esporádicas reflexiones locales sobre el desarrollo de la ética de la investigación científica. Incluso, para suplir dicha carencia, se han adaptado diversas recomendaciones originadas en circunstancias ajenas a la investigación en el propio país, tal es el caso del principialismo expuesto en el Informe Belmont, la adhesión a la Declaración de Helsinki o el modelo administrativo-gerencial de las Guías de Buena Práctica Clínica (BPC) (1). Documentos que sin duda exponen recomendaciones adecuadas en torno a la conducción ética de la investigación, pero que son, en todo sentido, ajenas al quehacer del investigador científico, quien en la mayoría de los casos, acuña frases de cajón o párrafos preestablecidos que citan dichos documentos, esto con el propósito de llenar la sección de un formato de protocolo que debe ser presentado a un comité de ética de la investigación.
Mi experiencia con los comités de ética, indica que para los investigadores no hay diferencias entre las distintas versiones de la Declaración de Helsinki (2), ni el contexto legal que tiene en la Ley 23 de 1981 (Ley de Ética Médica) (3), como tampoco conocen la realidad del contexto originario de las BPC (Industria Farmacéutica) y, en la mayoría de los casos, se limitan a citar textualmente la norma local (resolución 8430 de 1993) (4), sin que medie alguna reflexión sobre los aspectos éticos de fondo que caracterizan cada investigación, reflexión que va mucho más allá de lo que cualquier norma pueda definir. En otras palabras, los aspectos éticos de la investigación se han convertido poco a poco en un requisito de relleno, mas no en una oportunidad de reflexión y análisis acerca de la importancia de la ciencia conducida éticamente. También es frecuente que se acuda a citar diversas fuentes documentales, como supuesto sustento y garantía de desarrollo de una investigación científica éticamente conducida, por ejemplo, se citan al mismo tiempo las normas del Council for International Organizations of Medical Sciences (CIOMS) (5), Helsinki y BPC como marco general de "garantía", cuando es sabido que entre estos documentos, que tienen pretensión de universalidad, existen profundas diferencias e incluso contradicciones que surgen de los postulados que cada documento defiende. De otra parte, la posición dominante (económica y logística) de la investigación patrocinada por la industria farmacéutica, estandarizó a través de las BPC el funcionamiento de los comités de ética, lo cual se hizo efectivo en Colombia a través de la resolución 2378 de 2008, aspecto normativo que empujó a la ética de la investigación a quedar atrapada entre una resolución desactualizada, de redacción confusa y fuera del contexto de la investigación actual (resolución 8430), y una resolución que sin duda estandariza y optimiza procesos al mejor estilo de la industria, pero que está lejos de ser un espacio de reflexión ética (resolución 2378).
Construir una reflexión ética alrededor de la investigación no puede seguir siendo, ni un requisito dentro de una lista de chequeo, ni un recordatorio sobre la historia del holocausto nazi, como tampoco un anecdotario sobre los experimentos en Tuskegee. La reflexión debe construirse sobre un análisis serio y profundo de los eventos históricos listados anteriormente (entre muchos otros) y de los eventos históricos locales sobre ética de la investigación —por ejemplo, vacunación experimental en soldados (6), vacunación en menores de edad (7) o investigación de marcadores genéticos en comunidades aisladas (7)—, sin dejar de lado el contexto social y económico del país, la necesidad apremiante de desarrollo científico y el objetivo principal de promulgar ampliamente que la investigación con seres humanos debe atender al respeto de los derechos de los participantes, respeto que debe extenderse a su comunidad y a sus necesidades de progreso.
Si bien es cierto que el análisis concienzudo y profundo de cada protocolo de investigación debe ser llevado a cabo tanto por investigadores como por patrocinadores y bioeticistas expertos en el tema, y no reducirse a una carta de aprobación que pierde sus buenas intenciones en el desarrollo de protocolo de investigación que no tiene supervisión ni seguimiento, también es cierto que las normas actuales tienen limitaciones y, como se mencionó, la implementación de dichos marcos no está libre de dificultades. Es así como la presente reflexión tiene como objetivos describir las principales razones por las cuales las recomendaciones universales de ética en investigación no han calado adecuadamente en la implementación de la investigación local, describir las principales razones por las que las normas respecto a la investigación científica en Colombia son insuficientes para generar espacios adecuados de reflexión, y proponer, siguiendo el modelo de E. J. Emanuel, una nueva manera de deliberar alrededor de la ética de la investigación científica. El presente texto sigue la argumentación del citado autor presentada en el texto introductorio al libro Ethical Issues in International Biomedical Research (8) y en el capítulo "An Ethical Framework for Biomedical Research", del libro clásico The Oxford Textbook of Clinical Research Ethics (9), y se expone junto a recomendaciones puntuales que explican los principios mencionados en el texto.
ANTECEDENTES EN LA HISTORIA: LAS CRISIS OBLIGAN A LA PROMULGACIÓN DE NORMAS
El contexto histórico a partir del cual surgieron las principales recomendaciones, normas o promulgaciones alrededor de la ética de la investigación, que han tenido una pretensión de universalidad, ha influenciado la urgencia de una declaración que resuelva los dilemas éticos de una crisis, es decir, que las recomendaciones han surgido de las crisis creadas alrededor de circunstancias históricas específicas, que en su mayoría han sido caracterizadas por el descubrimiento y posterior escándalo de conductas reprochables llevadas a cabo por autoridades científicas, académicas y profesionales que supuestamente deberían mantener una ética intachable frente al ejercicio de su profesión. Por ejemplo, la primera recomendación específica sobre aspectos éticos de la investigación, promulgada en el siglo XX, fue la Segunda Directiva Prusiana sobre investigación del año 1900 (la primera directriz fue promulgada en 1891). La Segunda Directiva, se emitió luego del escándalo suscitado por los experimentos de Albert Neisser, quien inoculó con sífilis a varias mujeres, con el fin de comprobar la eficacia de la terapia con suero (10, 11). Asimismo, el Código de Nuremberg fue la respuesta, a través del juicio a los médicos, a las atrocidades de la "experimentación" en humanos, durante la Segunda Guerra Mundial, como uno de los brazos de las políticas de limpieza racial del partido nazi (12); en el mismo sentido, el Reporte Belmont fue la respuesta al escándalo Tuskegee por el estudio de la sífilis en comunidades marginadas al sur de Estados Unidos (13). Es decir que, la promulgación de las recomendaciones emitidas luego de cada una de las crisis mencionadas, sea por la jurisprudencia internacional o por comisiones gubernamentales, fue en su momento la respuesta a una controversia concreta y, por tanto, estas tienden a enfocarse en lo que para un momento histórico es percibido como transgresión o escándalo. No significa esto que sean menos importantes o que los fundamentos de dichas recomendaciones sean menos valederos en otros contextos o escenarios de investigación; por el contrario, de estas crisis y de las respuestas a ellas, se han derivado aspectos fundamentales tales como el consentimiento informado o el derecho a retirarse de un estudio de manera voluntaria. Sin embargo, la relación crisis-norma o crisis-recomendación no puede ser el único camino por el cual se generen los espacios de reflexión sobre la ética de la investigación; si bien es cierto que el avance se da en términos de la solución de problemas, que no pocas veces son prácticamente imprevisibles y que solo surgen a medida que marcha el desarrollo, también es cierto que vale la pena observar las experiencias previas (mundiales y locales), el contexto histórico y los principios éticos con el fin de generar espacios y lineamientos que abarquen una forma de prevención de nuevas crisis. Es decir, no debemos esperar a que un nuevo conflicto encienda el escándalo y, con tal de apagar el incendio, se generen nuevas recomendaciones. Un ejemplo histórico, que no esperó a la crisis, es el consentimiento informado en los estudio de la fiebre amarilla llevados a cabo por la comisión Reed en Cuba a principios del siglo XX. Como demuestra la temprana versión del consentimiento informado de Reed, mucho tiempo antes de Nuremberg o de Belmont, fue posible pensar que la autonomía del potencial sujeto de investigación tenía cabida en el proceso (14). Así como las crisis éticas de la investigación patrocinada por las multinacionales en países en desarrollo surtieron el germen de la creación de las normas CIOMS (15) o, como en el caso colombiano, en donde la falta de rigor y organización de los comités de ética fue solventada —al menos en parte— por la adaptación de las buenas prácticas clínicas (BPC) (resolución 2378 del 2008), no deberíamos esperar a que un nuevo escándalo sacuda el establecimiento y, como reacción al mismo, nos obliguemos como científicos y bioeticistas a actualizar sobre la marcha las normas vigentes o actuar reaccionariamente creando nuevas normas que atiendan el incendio producido por una crisis.
También hay que tener en cuenta que las guías de orden normativo se deben en su mayoría a propósitos prácticos, que no necesariamente examinan el marco ético en que deberían desenvolverse las investigaciones. Esta connotación pragmática de las declaraciones relacionadas con ética de la investigación en sujetos humanos, se aprecia por ejemplo en la Conferencia Internacional de Armonización (The International Conference of Harmonization - ICH) que tiene el propósito de crear una regla común a través de los países (mercados), para el registro de la investigación de medicamentos para uso humano; el propósito principal de la ICH es incrementar la eficiencia en la aprobación del uso de medicamentos, y no específicamente proteger a los participantes en el estudio, aun cuando la estandarización sirva para detectar falencias en los procesos de investigación que pongan en peligro al sujeto participante. Dicho de otra forma, la estandarización es necesaria para optimizar procesos, es útil en la detección de casos que ameriten la protección especial de los participantes, y mejora la comunicación entre investigadores, patrocinadores y comités; sin embargo, no es su propósito ir más allá de la documentación y administración eficiente de un protocolo de investigación de la industria, el espacio de reflexión ética pertenece a otro momento y a otro ámbito que no es propiamente el de las BPC. No se debe concluir, por tanto, que se garantiza el actuar ético por el solo hecho de cumplir con los criterios de las BPC.
De otra parte, las recomendaciones tipo código, declaración o norma, existentes en la actualidad, ni son integrales, ni son sistemáticas; por el contrario, son una lista de exigencias respecto a las cuales se ha generado un acuerdo tácito que dicta que se deben atender. Por ejemplo, el código de Nüremberg consta de diez enunciados y la Declaración de Helsinki, que originalmente tenía 22, fue expandida sucesivamente a través de las décadas, sin que mediara de manera explícita, para los lectores de las declaraciones, alguna elaboración conceptual manifiesta en los textos. Nüremberg y Helsinki se constituyen, por tanto, en unas referencias que carecen de un marco conceptual amplio, aun cuando tengan un claro contexto histórico, el cual es en todos los casos el resultado de una crisis. Ambos adolecen de un marco en el que se incluyan todos los aspectos éticamente relevantes y que deberían ser contemplados para los usuarios de dichos documentos, aspecto primordial si se tiene en cuenta la magnitud de la tarea de evaluar, desde el punto de vista ético, la labor investigativa y científica desarrollada en seres humanos. Es obvio que bajo cada enunciado de las declaraciones, existe un aspecto ético que sustenta cada frase, las normas CIOMS se soportan en algún tipo de reflexión, así como Nüremberg y Helsinki, sin embargo, como se mencionó, son la reacción al escándalo y a la crisis.
La falta de un marco conceptual amplio y explícito denota que las declaraciones carecen de justificaciones claras para sus afirmaciones, como si la sola presencia de la norma implicara, con obviedad, que la guía ética que promulga es tan evidente que no merece ninguna explicación; aún más, Nüremberg, Belmont, Helsinki y CIOMS, se han posicionado como monolitos que se encuentran más allá del debate y así son citados en innumerables protocolos de investigación.
Ahora bien, es frecuente —incluso para el experto en bioética— que el análisis profundo de las normas y recomendaciones mencionadas implique que, en la mayoría de los casos, el hecho de proponer el debate acerca de cuál de los principios promulgados en las recomendaciones debe ser utilizado en el análisis y la resolución de los dilemas de la investigación científica, resulta en dejar de lado la reflexión y el debate, a favor de apelar pragmáticamente a la autoridad de las declaraciones, sin que se acuda a la contextualización tanto de la investigación, como de los sujetos implicados. No es infrecuente escuchar que una u otra conducta en una investigación se justifica éticamente, solo por que una recomendación así lo consigna, es decir, que se apela a una forma de interpretación legalista y acomodada de lo que supone promulgarse, autoritariamente, en una recomendación de pretensión universal como puede ser CIOMS, o incluso de una norma local como la resolución 2378 del 2008. En pocas palabras, la conclusión de ciertas evaluaciones hechas por comités, determina que se hace así, de una forma u otra, porque un documento así lo indica. A todas luces una conclusión mediocre.
No menos importante es el hecho de que las recomendaciones y los códigos despliegan su influencia a partir de argumentaciones que dejan de lado aspectos altamente significativos en el propio contexto e implementación de la investigación; por ejemplo, el Código de Nüremberg refiere que el consentimiento voluntario del sujeto humano es absolutamente esencial, lo que deja de lado la investigación pediátrica o la investigación en discapacidad mental. De igual forma, las aseveraciones de Helsinki, establecen que los conflictos de interés se sobrellevan por medio de la declaración e información de los mismos a todos los participantes en la investigación, y que estos deben ser declarados en las publicaciones; no obstante, la resolución de conflictos de interés con base solo en su declaración, es inadecuada frente a ciertos conflictos que deberían ser prohibidos y no simplemente reconocidos por los investigadores. Debido a estas y a otras deficiencias que tienen las diversas declaraciones, normas y códigos, es que se hace necesario el desarrollo de una guía ética de la investigación científica que se amplíe más allá de las declaraciones puntuales, que no espere la aparición de nueva crisis y que se desarrolle hasta convertirse en un marco conceptual extenso, sistemático y comprensivo, que incluya la justificación de investigar éticamente, así como el imperativo ético de investigar. A continuación se presentan los fundamentos de ese marco conceptual en razón de la necesidad que existe en el país de desarrollar investigación científica de alta calidad.
UN MARCO ÉTICO AMPLIO PARA LA INVESTIGACIÓN BIOMÉDICA
La ética de la investigación científica no se limita a la protección del sujeto que se estudia, su ejercicio e influencia se extienden a la reflexión en torno al impacto que todo el proceso investigativo tiene en diversos actores del desarrollo científico, incluyendo investigadores, patrocinadores, academia y sociedad. No se trata, entonces, de un ejercicio limitado a la protección de los derechos de sujetos vulnerables, se trata de una disciplina que en el marco de la bioética, busca mantener una mirada atenta al impacto que la biotecnología tiene en el futuro de la humanidad. De esta forma, las declaraciones, las normas y los propios fundamentos de la investigación científica deben ser vistos dentro de un marco mucho más amplio que los tradicionales principios a los que nos expuso la temprana historia de la bioética. Una visión más amplia implica que los procesos de investigación y los resultados de los mismos, no son propiedad exclusiva de los investigadores ni de los patrocinadores, ni los aspectos éticos se reducen a cumplir con un formato de formulario de consentimiento informado.
La investigación científica es parte de un patrimonio que la humanidad construye para cimentar su futuro. Lo que implica una ciencia y una investigación con la responsabilidad suficiente para que el desarrollo científico no se convierta en un medio de destrucción de la sociedad, una propuesta que se encuentra en los fundamentos expuestos por Potter en su propuesta bioética (16, 17), fundamentos que a menudo son olvidados por los mismos comités de ética de la investigación y que raramente son contemplados por los propios investigadores científicos. El propósito ético fundamental de la ciencia es brindar beneficios y solucionar problemas a la humanidad, un propósito que solo es posible alcanzar si existe una sinergia entre todos los actores involucrados; esta sinergia se puede alcanzar con un marco ético amplio para la investigación.
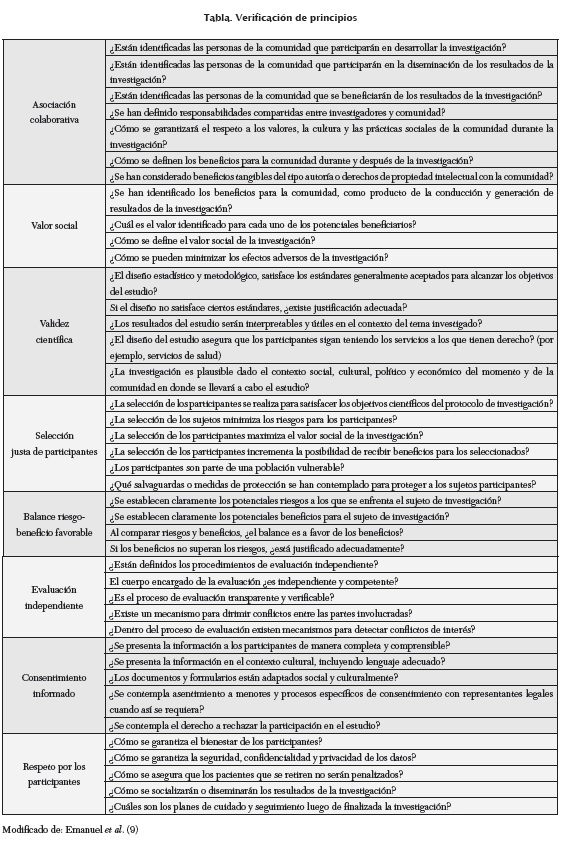
En concordancia con la propuesta de Ezekiel J. Emanuel, exponen ocho principios que definen un marco ético amplio para la investigación científica en seres humanos (18).
ASOCIACIÓN COLABORATIVA
Teniendo en cuenta que la investigación científica tiene como propósito fundamental servir a la sociedad, la colaboración entre investigadores y comunidad construyen el principio de la investigación colaborativa, el cual supone que la comunidad en donde se lleva a cabo la investigación debe favorecer y participar en el esfuerzo investigativo, lo que incluye, además, definir si la comunidad recibirá beneficios como resultado de la investigación y garantizar que la comunidad no será explotada durante el proceso, es decir que la investigación colaborativa deja de lado a una comunidad pasiva, para invitarla a ser protagonista y dar paso a las personas para que contribuyan en el proceso de desarrollo científico, a fin de que sean intérpretes del mismo y permanezcan activas en la implementación de la investigación (19). Además, la investigación colaborativa indica a la comunidad, si el esfuerzo científico ayudará a resolver sus problemas y a definir si es aceptable desarrollar la investigación en su propio entorno. Es claro que para que la investigación colaborativa se dé adecuadamente debe mantenerse el respeto mutuo entre las partes, impulsar la acción de líderes que entablen un diálogo permanente entre el equipo científico y la comunidad, y desarrollar un plan a largo plazo que, además de desplegar la propia investigación incluya, según sea el caso, la socialización de resultados, el seguimiento y el cumplimiento de compromisos entre las partes (20). Emanuel menciona el término "Investigación helicóptero", en la cual los investigadores aterrizan en una comunidad, toman muestras y despegan para nunca regresar. Esta investigación representa todo lo contrario de la investigación colaborativa, la cual aboga por que la comunidad no sea explotada, ni abandonada por un grupo de científicos que solo persiguen sus propios intereses.
VALOR SOCIAL
La investigación debe partir de la especificación de los beneficiarios de la misma, apreciando la importancia de los problemas de salud que están siendo investigados, y definiendo el valor potencial de la investigación para cada uno de los involucrados. La colaboración entre investigadores y comunidad permite identificar el valor social de la investigación. Por ejemplo, si se tiene en cuenta que esta es un medio para alcanzar el conocimiento necesario a fin de optimizar las condiciones de vida, como puede ser mejorar la salud para el caso de la investigación biomédica; la mejora en la salud es el valor social de la investigación. En otro escenario, la investigación puede identificar la fuente de un problema sanitario, aun cuando ella misma no pruebe las soluciones, la identificación de la causa permite plantear probables soluciones, lo que constituye a su vez el valor social de dicha investigación. El valor social de la investigación no es simple de identificar en todos los casos, especialmente en la investigación básica o en los casos de aquella limitada a grupos pequeños de individuos o incluso en las investigaciones de orden teórico, de tal modo que es importante, al menos, identificar que los potenciales beneficios se darán a largo plazo o que los resultados de un estudio tendrán influencia en el desarrollo del conocimiento que a la larga debe redundar en el beneficio social; de hecho, el término de moda, translational research, implica que los esfuerzos de las ciencias básicas rápidamente se traduzcan o se trasladen a una acción clínica que beneficie al paciente, es decir que no se trata de hacer esfuerzos investigativos aislados de la tendencia que lleva el conocimiento hacia el beneficio social (21). Para potenciar el valor social de la investigación, los investigadores también deben hacer esfuerzos a fin de fortalecer sus redes de conocimiento y la difusión de los resultados, con el propósito de fundamentar una estrategia colaborativa a largo plazo en la que converjan los conocimientos de diversas áreas. El valor social de la investigación también se desarrolla cuando esta es un medio para fortalecer la estructura y capacidad investigativa local, a través de entrenamiento, equipos y la implementación de programas académicos y científicos sostenibles que contribuyan a mantener el impulso generado por la investigación científica.
VALIDEZ CIENTÍFICA
La investigación debe reflejar validez desde el diseño, el cual debe tener en cuenta el valor social para los beneficiarios. El diseño científico debe dar cuenta tanto de los objetivos científicos como de las garantías que los participantes tienen para acceder a las intervenciones de atención en salud a las que tienen derecho. La validez científica es un requerimiento ético fundamental de la investigación; de hecho, cualquier investigación sin validez científica no es ética (22). De otra parte, la validez científica es la que garantiza su valor para la sociedad, y es el único garante para que se confíe en el desarrollo científico. Si no hay validez científica, no hay valor social y no existe, por tanto, ninguna justificación para que un sujeto se exponga a los riesgos que supone la investigación. La validez científica se cimienta, a su vez, en una adecuada pregunta de investigación y un diseño coherente que se destaque por la coherencia entre los objetivos y la metodología, y el correcto uso de las herramientas estadísticas empleadas, tanto para el cálculo adecuado del tamaño de muestra, como para el análisis de resultados (23, 24). Estos estándares mínimos deben conjugarse con la pertinencia de la idea investigativa y la plausibilidad del proyecto, para lo cual se debe tener en cuenta el contexto social, político y cultural en donde se llevará a cabo la investigación (25).
SELECCIÓN JUSTA DE LOS PARTICIPANTES
La investigación debe seleccionar la población de estudio de tal forma que garantice su validez científica; al mismo tiempo, debe seleccionar la población de estudio minimizando los riesgos y, en procura de fortalecer otros principios, especialmente el de asociación colaborativa y el valor social de la investigación, la selección de la población debe propender por identificar y proteger a las poblaciones vulnerables (26). La selección de los participantes en un estudio debe basarse en los objetivos de la investigación, es decir que el fundamento de la validez científica es aquel que define la elegibilidad de los sujetos que deben ser reclutados. La selección justa de los participantes fortalece la validez científica y, por tanto, vigoriza el valor social de la investigación. Cualquier otro criterio de selección de los sujetos debilita la conducción del estudio, incrementa el riesgo de sesgos de selección y aumenta las posibilidades de reclutar sujetos en poblaciones vulnerables y potencialmente explotables que no pueden defender sus intereses frente a las estrategias de reclutamiento. Si son los objetivos científicos los que definen la selección de los participantes, entonces, con base en esos criterios de selección, se minimizarán los riesgos y la vulnerabilidad para los sujetos (27). La construcción de la selección justa se basa en la validez científica y, nuevamente, ambas contribuyen al valor social de la investigación.
BALANCE RIESGO-BENEFICIO FAVORABLE
Si bien es cierto que la incertidumbre sobre la magnitud de los riesgos y beneficios asociados a un medicamento, dispositivo o procedimiento, es inherente a la investigación clínica, la propuesta de investigación debe evaluar y sopesar los riesgos y beneficios potenciales a los que la población de estudio se expone durante la ejecución del proyecto, especialmente aquellos relacionados con el contexto de la salud (28). Asimismo, debe valorar la relación riesgo-beneficio mediante la comparación de los riesgos netos del proyecto de investigación con el conjunto de beneficios potenciales derivados de los principios de asociación colaborativa, valor social y respeto por los participantes, de lo contrario no habría mucho sentido para hacer la investigación. En función de los objetivos y métodos de un estudio, los riesgos podrían menores o graves, y podrían clasificarse como riesgos físicos (muerte, incapacidad, infección), psicológicos (depresión, ansiedad), económicos (pérdida del empleo) o sociales (discriminación o el estigma de la participación en un determinado ensayo). Tanto la propuesta investigativa como la evaluación ética por parte del comité deben hacer todo lo posible por identificar los peligros potenciales y establecer claramente los mecanismos para minimizar los riesgos y las molestias a los sujetos de investigación, de tal forma que maximicen los beneficios potenciales derivados del estudio. Solo en casos excepcionales, es aceptable que el riesgo supere el beneficio, tales casos representarían el momento en el que el valor social del conocimiento, al cual solo se podría acceder por la investigación, justifica el compromiso de someter a un sujeto humano a un riesgo mayor que los beneficios que el mismo puede obtener; tal valor social se fundamenta en beneficios futuros para la sociedad y, eventualmente, para el sujeto (29). Si los riesgos exceden la combinación de beneficios potenciales a los individuos con el beneficio de conocimiento útil a la sociedad, la investigación no es justificable.
EVALUACIÓN INDEPENDIENTE
La investigación y sus procesos de implementación deben garantizar el acceso a la veeduría pública que dé cuentas del proceso de desarrollo de la propuesta investigativa, la puesta en marcha de la misma y la difusión de los resultados, teniendo en cuenta no solo las evaluaciones correspondientes a la ley y los reglamentos vigentes, sino la evaluación y el seguimiento de los comités de ética. Asimismo, se debe garantizar la responsabilidad pública a través de la transparencia del proceso evaluativo y contar con las opiniones de otras organizaciones (internacionales y organismos no gubernamentales), según sea el caso, asegurando para cada proceso de evaluación, la independencia y competencia de los aportes hechos a la evaluación de la investigación (30). La evaluación independiente no solo valora la validez científica de las propuestas, sino que vela por identificar y reducir al mínimo los conflictos de interés (31) y asegurarse de que un estudio es éticamente aceptable antes de dar inicio al mismo; un comité independiente, que no tenga interés en el estudio debe estudiar y evaluar la propuesta y formular los cuestionamientos pertinentes, tanto a investigadores como a patrocinadores del estudio.
CONSENTIMIENTO INFORMADO
El proceso de consentimiento debe entenderse como un principio fundamental que enmarque el proceso investigativo, para dejar de considerarlo solo como un requisito dentro las listas de chequeo. El consentimiento muestra respeto por la autonomía del individuo, destacando que con la información apropiada sobre la investigación, las personas deben tomar sus propias decisiones acerca de si quieren participar o continuar participando en ella (32). En este proceso, se les informa con precisión a las personas el objetivo, los métodos, los riesgos, los beneficios y las alternativas, garantizando que los sujetos entiendan dicha información y cómo se relaciona esta con la investigación, con su propia situación clínica, sus intereses, su contexto social y cultural. El consentimiento informado es un tema amplio, que supera los alcances de esta descripción, sin embargo, se debe destacar que este recoge la totalidad de los ocho principios aquí expuestos, dado que es un ejemplo de la colaboración entre las partes, la cual se fundamenta en el valor social de la investigación, en su solidez científica, en alcanzar justamente a quienes deben participar, exponiendo de manera abierta los riesgos y beneficios del proceso, y desplegando el accionar investigativo, luego de una juiciosa evaluación ética y metodológica. El proceso de consentimiento respeta a la persona, valora su capacidad de decisión (o de quien represente sus intereses) y establece un puente de comunicación entre todos los participantes: sujetos, investigadores, comités, patrocinadores y comunidad.
RESPETO POR LOS PARTICIPANTES
El cierre del marco ético alcanza su cúspide con un principio que parece obvio, el respeto. Sin embargo, es lamentable observar que su obviedad no lo hace un aspecto de cotidiana práctica en un gran número de investigaciones. Las personas deben ser tratadas con respeto desde el momento en que se define su posible participación (por ejemplo, tamizaje de sujetos), hasta el momento en que se termine el seguimiento, luego de concluido el estudio. Dicho respeto incluye acatar las decisiones de la persona si esta se niega a participar o desea retirarse. El respeto por el sujeto se construye, guardando coherencia entre lo que se le expone en el consentimiento y las acciones que se llevan a cabo en el estudio, y se fortalece al informar a tiempo a los participantes si hay cambios en el balance riesgo-beneficio; asimismo, el respeto se robustece manteniendo la privacidad y confidencialidad de los datos recolectados. El respeto es perdurable si los participantes y la comunidad presencian y viven el hecho de recibir los beneficios de la investigación, es decir el respeto se consolida cuando el valor social de la investigación se hace tangible.
CONCLUSIONES
Los principios aquí enumerados y brevemente descritos, tienen diversas dimensiones y condiciones para que puedan ser cumplidos o al menos contemplados dentro del desarrollo científico; no se trata, por tanto, de una imposición, ni de una utopía, ni es una lista de chequeo más dentro del proceso de evaluación de un protocolo, sino de dimensionar cada uno de los componentes propuestos en el contexto de la diversidad de la investigación científica, a fin de contribuir a ampliar el pensamiento y la fundamentación de la ética de la investigación, más allá de los principios de autonomía, beneficencia, no maleficencia y justicia. No es tampoco una contraposición a dichos principios, por el contrario, son sinergia y complemento y, de algún modo, una reivindicación de la comunidad en donde el sujeto ejerce sus derechos. Para que este modelo, propuesto por Emanuel, tenga una adecuada implementación, el comité de ética de la investigación debe considerar cada uno de sus aportes, en razón al tipo de estudio sometido, y ha de desarrollar un diálogo con los investigadores a través del cual se comprenda su significado y su valor social, más allá del valor meramente científico.
Emanuel también propone algunas preguntas fundamentales, que tanto los miembros de un comité de investigación, como los propios investigadores, pueden tener en cuenta para valorar si los principios del marco ético están establecidos —o al menos contemplados— dentro del proceso investigativo (ver tabla). Si bien es cierto que las normas locales vigentes (resoluciones 8430 y 2378) y las recomendaciones universales actuales (Nüremberg, Helsinki, CIOMS, BPC, entre otras) hacen parte de un marco que podría definirse como ético-legal, el cual cumple una función orientadora, son documentos que carecen de la contextualización que merece la investigación científica con sentido ético y social.
La ética de la investigación científica, no debe reducirse al apego etéreo y simplón a principios ajenos que casi siempre se encuentran documentados en declaraciones que nunca se leen ni se analizan al tenor de las características de cada protocolo de investigación (Nüremberg o Helsinki). La ética de la investigación debe acoger las declaraciones universales y las normas locales, y ubicarlas en un proceso de contextualización que le permita a investigadores, sujetos de investigación, patrocinadores y público en general, comprender la ciencia y la investigación como medios para beneficiar a la humanidad, dicho contexto debe comprenderse a partir de un diálogo (asociación colaborativa) entre las partes y orientarse hacia el respeto de todos los participantes. El modelo de Emanuel es un buen punto de partida.
REFERENCIAS
1. Conferencia Internacional de Armonización. Guía tripartita armonizada de la Conferencia Internacional de Armonización. Lineamiento para la Buena Práctica Clínica (BPC); 1996. [ Links ]
2. WMA. World Medical Association. Declaration of Helsinki. Ethical Principles for Medical Research Involving Human Subjects. Amended by the 64th WMA General Assembly, Fortaleza, Brazil, October 2013; 1964. [ Links ]
3. República de Colombia. Ley 23 de 1981. Por la cual se dictan normas en materia de ética médica; 1981. [ Links ]
4. República de Colombia. Ministerio de Salud. Resolución 8430 de 1993. Por la cual se establecen las normas científicas, técnicas y administrativas para la investigación en salud; 1993. [ Links ]
5. Bankowski Z, Levine RJ. The Council for International Organizations of Medical Sciences. Ethics and Research on Human Subjects. International Guidelines; 1992. [ Links ]
6. Thomas JA, Beck M, Clarke JT, Cox GF. Childhood onset of Scheie syndrome, the attenuated form of mucopolysaccharidosis I. J Inherit Metab Dis. 2010;33(4):421-7. [ Links ]
7. Cobos PN, Steglich C, Santer R, Lukacs Z, Gal A. Dried blood spots allow targeted screening to diagnose mucopolysaccharidosis and mucolipidosis. JIMD Rep. 2015;15:123-32. [ Links ]
8. Lavery J, Grady C, Wahl E, Emanuel E. Introduction. In: Lavery J, Grady C, Wahl E, Emanuel E, editors. Ethical Issues in International Biomedical Research. New York: Oxford University Press; 2007. p. 3-18. [ Links ]
9. Emanuel E. An Ethical Framework for Biomedical Research. In: Emanuel E, Grady C, Crouch R, Lie R, Miller F, Wendler D, editors. The Oxford Textbook of Clinical Research Ethics New York: Oxford University Press; 2008. p. 123-35. [ Links ]
10. Vollmann J, Winau R. Informed consent in human experimentation before the Nuremberg code. BMJ. 1996;313(7070):1445-9. [ Links ]
11. Sass HM. Reichsrundschreiben 1931: pre-Nuremberg German regulations concerning new therapy and human experimentation. The Journal of Medicine and Philosophy. 1983;8(2):99-111. [ Links ]
12. Annas GJ, Grodin MA. Medicine and Human Rights: Reflections on the Fiftieth Anniversary of the Doctors' Trial. Health and Human Rights. 1996;2(1):6-21. [ Links ]
13. Carroll TW, Gutmann MP. The limits of autonomy: the Belmont Report and the history of childhood. Journal of the History of Medicine and Allied Sciences. 2011;66(1):82-115. [ Links ]
14. Suárez-Obando F, Ordóñez Vásquez A. Ética de la Investigación científica: la fiebre amarilla, la Comisión Reed y el origen del consentimiento informado. Infectio. 2010;14(3):206-16. [ Links ]
15. Zion D, Gillam L, Loff B. The Declaration of Helsinki, CIOMS and the ethics of research on vulnerable populations. Nature Medicine. 2000;6(6):615-7. [ Links ]
16. Potter VR. Global bioethics: linking genes to ethical behavior. Perspectives in Biology and Medicine. 1995;39(1):118-31. [ Links ]
17. Potter VR. Getting to the Year 3000: can global bioethics overcome evolution's fatal flaw? Perspectives in biology and medicine. 1990;34(1):89-98. [ Links ]
18. Emanuel EJ, Wendler D, Grady C. What makes clinical research ethical? JAMA. 2000;283(20):2701-11. [ Links ]
19. Rosenthal MS, Barash J, Blackstock O, Ellis-West S, Filice C, Furie G, et al. Building community capacity: sustaining the effects of multiple, two-year community-based participatory research projects. Progress in community health partnerships: research, education, and action. 2014;8(3):365-74. [ Links ]
20. Tapp H, Kuhn L, Alkhazraji T, Steuerwald M, Ludden T, Wilson S, et al. Adapting community based participatory research (CBPR) methods to the implementation of an asthma shared decision making intervention in ambulatory practices. The Journal of Asthma. 2014;51(4):380-90. [ Links ]
21. Rubio DM, Schoenbaum EE, Lee LS, Schteingart DE, Marantz PR, Anderson KE, et al. Defining translational research: implications for training. Academic Medicine. 2010;85(3):470-5. [ Links ]
22. Freedman B. Scientific value and validity as ethical requirements for research: a proposed explication. IRB. 1987;9(6):7-10. [ Links ]
23. Clark T, Berger U, Mansmann U. Sample size determinations in original research protocols for randomised clinical trials submitted to UK research ethics committees: review. BMJ. 2013;346:f1135. [ Links ]
24. Altman DG. Statistics and ethics in medical research. Misuse of statistics is unethical. BMJ. 1980;281(6249):1182-4. [ Links ]
25. Harrowing JN, Mill J, Spiers J, Kulig J, Kipp W. Culture, context and community: ethical considerations for global nursing research. International Nursing Review. 2010;57(1):70-7. [ Links ]
26. Chen DT, Jones L, Gelberg L. Ethics of clinical research within a community-academic partnered participatory framework. Ethnicity & Disease. 2006;16(1 Suppl 1):S118-35. [ Links ]
27. Coughlin SS, Beauchamp TL. Ethics, scientific validity, and the design of epidemiologic studies. Epidemiology. 1992;3(4):343-7. [ Links ]
28. Bernabe RD, van Thiel GJ, Raaijmakers JA, van Delden JJ. The risk-benefit task of research ethics committees: an evaluation of current approaches and the need to incorporate decision studies methods. BMC medical ethics. 2012;13:6. [ Links ]
29. Weijer C. The ethical analysis of risk. The Journal of Law, Medicine & Ethics. 2000;28(4):344-61. [ Links ]
30. Pech C, Cob N, Cejka JT. Understanding institutional review boards: practical guidance to the IRB review process. Nutrition in Clinical Practice. 2007;22(6):618-28. [ Links ]
31. Williams-Jones B, Potvin MJ, Mathieu G, Smith E. Barriers to research on research ethics review and conflicts of interest. IRB. 2013;35(5):14-9. [ Links ]
32. Steinke EE. Research ethics, informed consent, and participant recruitment. CNS. 2004;18(2):88-95;quiz 6-7. [ Links ]