Introducción
Múltiples organizaciones señalan la importancia que tiene la investigación clínica en salud en el desarrollo económico de un país, ya que esta contribuye de manera importante al mejoramiento de la efectividad y costo-eficacia de las actuales conductas terapéuticas, a su innovación y a la producción de beneficios netos para las economías nacionales 1-4. Sin embargo, el fortalecimiento de una cultura de investigación en salud constituye un desafío pendiente en Colombia (5, 6). A pesar de ello, en las dos últimas décadas se ha incrementado en el país el número de investigaciones con fármacos en fases clínicas, así como la complejidad en los diseños de los estudios 7,8. Cabe anotar que la mayoría de estas investigaciones son patrocinadas por la industria farmacéutica 9.
En Colombia, para conducir un protocolo con un medicamento en investigación es necesario que este sea realizado en centros de investigación clínica certificados por la entidad reguladora gubernamental, el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima). Esta condición de certificación implica que las instituciones deben cumplir con una serie de requisitos que incluyen el cumplimiento de las normas de habilitación dispuestas por el Ministerio de Salud para ser instituciones prestadoras de servicios de salud (IPS), así como contar con un servicio farmacéutico, un laboratorio clínico y tener un comité de ética en investigación que evalúe los estudios que se conduzcan en el centro. Estas condiciones son esenciales para obtener la certificación en Buenas Prácticas Clínicas (BPC) otorgada por el Invima 10. Actualmente, en Colombia existen 124 centros de investigación clínica y 73 Comités de Ética certificados en BPC.
La regulación vigente ha obligado a las IPS que quieran desarrollar investigación clínica contratada a mejorar su capacidad instalada y a contar con investigadores competentes en la ejecución de cronogramas y actividades de alta complejidad, que conduzcan al adecuado desarrollo de los protocolos de investigación. Este desarrollo ha sido respaldado, al menos en parte, por lineamientos normativos emitidos por entes gubernamentales, tales como el Ministerio de Salud y el Invima 11. De otra parte, la investigación patrocinada por la industria farmacéutica, las Organizaciones de Investigación por Contrato (Contract Research Organizations CRO), los investigadores, las instituciones dedicadas a la investigación y entidades privadas como la Asociación Colombiana de Centros de Investigación (ACIC)1, le han dado un impulso importante a la ejecución de protocolos de investigación clínica, lo que ha posicionado a Colombia como un competidor importante en la región 9.
El progreso de la investigación clínica en el país supone que, además de las normas gubernamentales y del marco legal vigente, se tengan en cuenta los principios éticos que orientan el correcto desarrollo de la investigación, tarea que recae sobre los comités de ética en investigación (CEI) 12. Una labor que no se circunscribe a la revisión documental, sino que implica la aplicación de un vasto conocimiento que incluye desde la metodología de la investigación hasta los fundamentos filosóficos de los preceptos éticos que rigen la investigación biomédica en humanos 13,14. Una actividad que, además, está inmersa en un proceso multinacional, en donde convergen diversos intereses, no siempre circunscritos a la ciencia biomédica, sino que implican intereses de desarrollo comercial, mercadeo y de posicionamiento económico 15,16.
De esta descripción se desprende que un CEI ha dejado de ser un grupo de personas que se reúnen temporalmente para la revisión documental de un estudio, para convertirse en un ente fundamental y con funciones bien definidas dentro de la organización que lleva a cabo la investigación clínica y que, por tanto, necesita asegurar un adecuado funcionamiento y, asimismo, que los miembros que lo conforman cuenten con la capacitación necesaria y experticia para llevar a cabo su papel en forma eficiente 17. Ante el enorme reto que implica el constante crecimiento de la investigación en el país, sumado a la complejidad del conocimiento científico y a la necesidad de infraestructura requerida para asegurar la ejecución ética de la investigación, vale la pena preguntarse si los CEI del país están preparados para asumir adecuadamente el reto, y si cuentan con los insumos necesarios que les permitan mantenerse competentes en el desarrollo de su importante tarea.
El presente estudio tuvo como objetivo caracterizar a los CEI que operan actualmente en Colombia; esta caracterización permitió identificar, a la luz de lineamientos aceptados nacional e internacionalmente, las fortalezas y carencias de los CEI, con lo cual será posible planear, plantear y desarrollar, tanto programas de mejoramiento en áreas específicas, como programas que refuercen las fortalezas de cada uno de los CEI analizados, a fin de contribuir al mejoramiento de los comités y a la estructura general de la investigación clínica del país.
Materiales y métodos
La caracterización de los comités se hizo a través de una encuesta desplegada en formato digital y distribuida a cada uno de los comités, junto con una carta de presentación que explicaba la naturaleza del proyecto. La recolección de los datos se llevó a cabo mediante el diligenciamiento de la encuesta en línea por parte del presidente del comité o con el apoyo presencial de una encuestadora cuando fue solicitado para facilitar el proceso. Los comités fueron contactados por correo electrónico, carta y contacto telefónico. Para cada comité se realizó al menos un seguimiento telefónico. Se invitó a participar al 100 % de los comités de ética certificados por el Invima en Colombia para febrero de 2014, mediante comunicación escrita y personal donde se explicaba la confidencialidad, seguridad y privacidad de los datos de la información que se obtuviera. Los datos recolectados luego de la encuesta se anonimizaron y se mantuvieron en el computador institucional del investigador principal bajo usuario y contraseña personal, con los protocolos de seguridad informática de la Pontificia Universidad Javeriana.
El instrumento para la encuesta fue elaborado por el grupo de trabajo conformado por representantes de las distintas organizaciones involucradas en el desarrollo de la investigación clínica, tales como investigadores, comités de ética, patrocinadores y CRO; se tuvo como marco normativo de referencia lo establecido en la regulación 2378 de 2008 10.
Este formulario fue revisado y aprobado por el grupo de trabajo en varias rondas de verificación, en las cuales se incluyeron además las observaciones que realizó el Invima al instrumento de medición. Luego de alcanzar la versión definitiva, se desarrolló una versión electrónica (formulario electrónico de captura de datos) para el manejo de las bases de datos, lo cual ofreció la seguridad y confiabilidad necesarias para el manejo de la información. Los resultados recolectados se exportaron a una hoja de cálculo y se realizó un análisis estadístico descriptivo, cálculo de las frecuencias relativas y medidas de tendencia central. Para asegurar el mantenimiento de la confidencialidad, la información se presenta de manera agrupada, sin especificar datos por ciudad, ni por nombre o presidente de comité.
Resultados
De un total de 73 comités de ética certificados por el Invima en Colombia se obtuvo respuesta de 25 (34 %), 22 de los cuales (30 %) brindaron datos completos que pudieron ser analizados. Tres comités expresaron directamente que no querían participar y 48 comités (65 %) no diligenciaron la encuesta sin explicar alguna razón específica. Los porcentajes hacen referencia a la totalidad de los 22 comités encuestados de 6 ciudades del país (Bogotá, Medellín, Cali, Barranquilla, Bucaramanga y Manizales), con un total de 165 miembros caracterizados.
Carácter y composición general del comité
De acuerdo con su denominación, 12 comités (54 %) se definieron como independientes, 6 (27 %) como institucionales, 3 (13 %) institucionales e independientes, y en un solo caso (4,5 %) el comité no se identificó con ninguna de estas definiciones. El promedio de tiempo de funcionamiento de los comités fue de 9 años (rango 4-29 años). En el 100 % de los comités se evidenció en su composición un equilibrio de género con una proporción mujer-hombre de ≈1:1. El 77 % (17 comités) tenía un abogado como miembro del comité, en 13 % (3 comités) participó como miembro un sacerdote, y en el 9 % dos sacerdotes como representantes de la comunidad. En todos los comités evaluados se encontró siempre un miembro identificado como representante de la comunidad.
La totalidad de los comités contaba con la certificación en BPC: 3 comités (13 %) estaban registrados en la Office for Human Research Protection (OHRP) y cuentan con el certificado de calidad Federalwide Assurance (FWA) de la misma entidad. Quince comités (68 %) han sido visitados por el Invima, la agencia reguladora colombiana, en diligencias diferentes a la visita de certificación en BPC. Solo un comité (4,5 %) ha recibido visita por parte de la Food and Drug Administration (FDA) de los Estados Unidos.
Perfil de los miembros
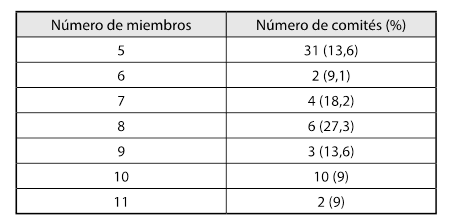
Se caracterizaron 165 miembros de los 22 comités. El promedio de miembros por comité fue de 8 (rango 5-11 miembros) (tabla 1). El promedio de edad de los miembros fue de 46,8 años (rango 24-78 años).
Del total de integrantes caracterizados, 85 fueron mujeres (51 %), de las cuales 61 (72 %) eran médicas o pertenecientes a áreas de la salud, mientras que 24 miembros eran mujeres que no eran médicas ni trabajaban en áreas de la salud (28 %); de este grupo, 11 se identificaron como representantes de la comunidad (13 %).
Se observa el número de miembros por comité; en aproximadamente el 30 % de los casos analizados se encontraron 8 miembros; 15 % de los comités tienen 9 o más miembros.
El término específico de la membresía no está definido en tres comités (13 %), en dos de ellos (9 %) el término es de un año, en 5 (22 %) es de 2 años, y en los restantes 12 comités (54 %) es mayor a dos años. Las responsabilidades de los miembros están descritas en un documento específico para tal fin, en todos los comités.
Los parámetros para la elección y las funciones dentro del comité están establecidos en un documento específico en 18 comités (81 %); los requisitos mínimos que debe tener cada miembro están definidos en 19 comités (86 %); la elección de los miembros se lleva a cabo a través del propio comité en 10 casos (45 %), por medio de convocatoria pública en 3 casos (13 %), en modalidad mixta (convocatoria y a través del propio comité) en 5 casos (22 %), y mediante un ente externo en un solo caso (4,5 %); 3 comités (13 %) no tienen definido un proceso de elección.
En 19 comités (86 %) está establecida una política específica para determinar la salida de un miembro, y en 21 comités (95 %) existe una política de sustitución del miembro. En 21 comités (95 %) está establecida la política de formación de cada miembro. Con relación a esta formación existe una política específica de entrenamiento de los miembros en metodología y ética de la investigación en 14 comités (63 %).
Perfil de presidente del comité
El presidente del comité es un médico en 12 comités (54 %); perteneciente al área de la salud, pero no médico, en 3 casos (13 %), y de un área diferente a la salud en 8 comités (36 %). El presidente tiene un promedio de edad de 55 años, es un hombre en 12 comités (54 %) y una mujer en 10 comités (45 %) (figura 2).
El presidente tiene al menos un posgrado en 21 casos (95 %), y en 13 casos (59 %) ha participado en investigación; 5 presidentes (22 %) han participado exclusivamente en investigación básica, 4 (18 %) lo han hecho de manera exclusiva en investigación clínica, y 4 (18%) han participado en investigaciones básicas y clínicas. Once presidentes (50%) indicaron ser investigadores; en un caso (4 %), el presidente participó como coordinador, y en un caso (4 %) como personal de farmacia.
Perfil del secretario del comité
El secretario es un médico en 4 comités (18 %); pertenece al área de la salud, pero no es médico, en 13 casos (59 %), y es de un área diferente a la salud en 6 comités (27 %). El secretario tiene un promedio de edad de 47 años, es una mujer en 20 comités (90 %) y un hombre en 3 comités (13 %). El secretario tiene al menos un posgrado en 19 casos (86 %) (figura 2). Solamente 3 secretarios (13 %) de comité manifestaron haber participado en investigaciones básicas y clínicas, y en todos los casos su papel fue el de investigador.
Procedimientos del comité
Las sesiones del comité suceden semanalmente en 2 de ellos (9 %), cada dos semanas en 6 casos (27 %), mensualmente en 8 comités (36 %), cada 2 meses en 4 comités (18 %); en dos comités (9 %) no está definida la regularidad de las sesiones. En 20 comités está definido el quórum para sesionar (90 %). En 20 comités (90 %) existe un documento guía (estatutos), el cual está alineado a una política de calidad en 18 casos (81 %); este documento guía se actualiza según la necesidad en 14 comités (63 %), cada 2 años en 3 comités (13 %), anualmente en 2 comités (9 %). Tres comités (13%) no tienen definido tiempo de actualización de sus estatutos.
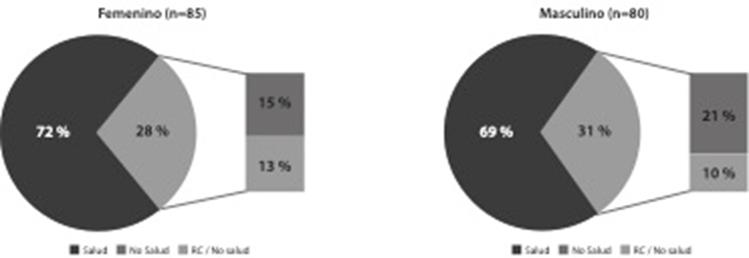
Nota: se aprecia un balance de género entre la totalidad de miembros caracterizados de los comités. En ambos sexos predominan los miembros pertenecientes a la salud. Igualmente, se aprecia un balance de género entre los representantes de la comunidad (RC).
Figura 1 Balance de género y profesión
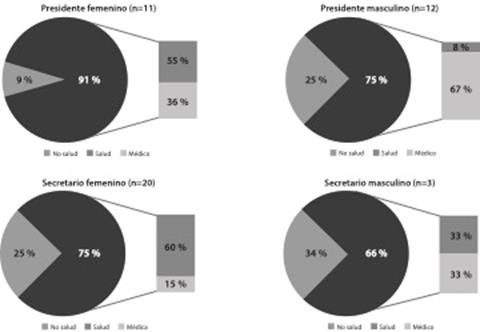
Nota: se aprecia un balance por género en el caso de los presidentes de los comités, mientras que existe una mayoría de secretarios mujeres. La mayoría de presidentes de comité son hombres, médicos. Fuente: elaboración propia basada en los datos de la investigación.
Figura 2 Perfiles de presidente y secretario del comité
Evaluación de protocolos
En 20 comités (90 %) está descrita tanto la política sobre conflictos de interés como la conducta que se debe seguir en caso de conflicto por parte de los involucrados en la evaluación de un protocolo. En 20 comités (90 %) están descritos los requisitos mínimos para la evaluación de un protocolo, en el mismo número de comités están definidos los procedimientos para evaluar un protocolo desde el punto de vista ético, mientras que en 19 comités (86 %) se describen los procedimientos para evaluar un protocolo desde el punto de vista metodológico. En 20 comités (90 %) están descritos los procedimientos y requerimientos mínimos para la aprobación expedita.
Seguimiento de protocolos y centros
En 20 comités (90 %) está establecida la política de seguimiento de los protocolos, que incluye notificaciones al investigador de las decisiones tomadas por el comité, informes del estudio, análisis de desviaciones, entre otros. El seguimiento se lleva a cabo a través de reportes periódicos por parte de los investigadores en 14 comités (63 %), por medio de visitas a los propios investigadores en 4 (18 %), y a través de una combinación de entrevistas a los investigadores, notificaciones y visitas en 2 comités (9 %). Los eventos adversos son analizados por todos los comités; se registran en una herramienta específica en 15 comités (68 %), y se hace seguimiento activo a los eventos adversos serios en 19 (86 %). En 20 comités (90 %) hay un procedimiento escrito que indica las medidas que se deben tomar si el comité encuentra anormalidades en la ejecución del protocolo.
Asesores externos
Respecto a los asesores externos, 16 comités (69 %) cuentan con ellos. En 4 comités (18 %) los asesores son permanentes, mientras que en 12 casos (54 %) son asesores para eventos puntuales. Trece comités (59 %) tienen asesores expertos en epidemiología, 8 (26 %) tienen expertos en especialidades médicas (pediatría, medicina interna, endocrinología, oftalmología, cirugía, psiquiatría), 6 comités (27 %) cuentan con expertos en ensayos clínicos, 6 (27 %) tienen expertos en bioética, 5 comités (22 %) tienen expertos en derecho, 4 (18 %) en química y farmacia, 3 (13 %) cuentan con expertos en salud pública, y un solo comité (4 %) tiene un experto en bacteriología.
Aspectos administrativos y de funcionamiento
En cuanto a los aspectos administrativos y de funcionamiento, 16 comités (69 %) cuentan con un administrador; el papel de este administrador se identifica como secretaría técnica, secretaría administrativa o secretaría coordinadora en 8 comités (36 %). Se le denomina asistente o auxiliar administrativo en 3 comités (13%) y gerente administrativo en 3 (13%). En un solo caso el administrador se identificó como contador (4%), y en un solo comité el rol de administrador lo realizaba un ingeniero de calidad (4 %).
Veintiún comités (95 %) cuentan con espacio privado para sus reuniones, el mismo número tiene archivo físico, mientras que 16 comités (72 %) cuentan con archivo magnético; 19 comités (86 %) tienen con computador e impresoras propias, 16 tienen escáner (72 %), 11 (50 %) tienen página web, 17 (77 %) tienen acceso a material bibliográfico especializado y 3 comités (13 %) cuentan con un programa especializado para la gestión de comités de ética de la investigación. En relación con los recursos económicos necesarios para el funcionamiento, estos provienen exclusivamente de sus propias actividades en 11 comités (63 %), mientras que en los demás casos los recursos provienen de una combinación de las actividades propias del comité y de las instituciones a las cuales está adscrito (centro de investigación, IPS, academia). En 15 comités los miembros reciben remuneración económica por sus actividades (68 %), y en solo 3 comités la remuneración es fija (13 %), mientras que en los demás casos la remuneración a cada miembro es por evento (revisión de protocolo). Todos los comités señalaron tener un manual tarifario de sus actividades.
Discusión
La información descrita en el presente estudio da buena cuenta del cambio que ha tenido la estructuración de los comités, a partir de la Resolución 2378, tal como se aprecia en la tabla 2. Varios aspectos negativos encontrados en los trabajos de Alterio y Miranda se han mejorado, y otros aspectos positivos se han mantenido en el tiempo.
Tabla 2 Comparación de la caracterización con estudios previos
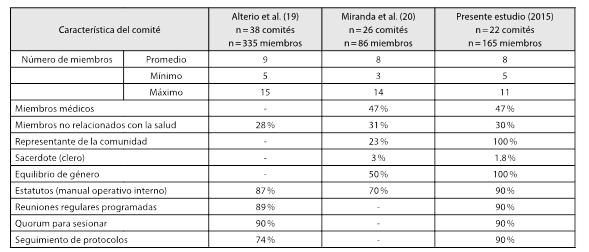
Los aspectos comunes estudiados en las tres caracterizaciones hechas en el país sobre comités mejoraron desde el estudio de Alterio et al. (2001-2002) (19) y Miranda et al. (2006) 20.
Fuente: datos del estudio.
Se aprecia que se mantiene la proporción predominante de médicos participantes. Asimismo, se destaca que la totalidad de los comités caracterizados en este estudio tienen representantes de la comunidad, y que el equilibrio de género se alcanzó en todos los casos, a excepción de la distribución por género del cargo de secretario del Comité. Además, se observa que una mayor proporción de comités manifiesta hacer seguimiento a los protocolos aprobados.
La Resolución 2378 ha representado un gran avance en la estructuración de la investigación clínica bajo parámetros internacionales, y ha permitido que tanto los CEI como los centros de investigación y patrocinadores hablen un mismo idioma en el momento de desarrollar y ejecutar una investigación. Sin embargo, a la luz de la normatividad y activa vigilancia del Invima, este estudio identifica, en la muestra de los CEI que actualmente operan en Colombia, que persisten falencias en el desarrollo de sus procesos, lo que acarrea el incumplimiento de sus objetivos y desdibuja el papel preponderante que deben tener en las actividades y el progreso científico del país.
Estas falencias ya han sido descritas en investigaciones previas a la resolución del 2008. Por ejemplo, en mencionado trabajo de Alterio et al. 18, en el cual se caracterizaron algunos de los CEI del país en el periodo 2001-2002, los autores identificaron que solo alrededor del 10 % de los comités encuestados evaluaba todos los aspectos del protocolo (“aspectos éticos, metodológicos, la idoneidad y calidad del investigador, la idoneidad y calidad del patrocinador, la validez de la pregunta de investigación, los aspectos estadísticos y facilidades locativas y equipos, los aspectos financieros incluido pago a los pacientes, el acuerdo con el investigador y la idoneidad y calidad del monitor”), mientras que las mayoría de CEI limitaban sus apreciaciones a aspectos puntuales sin que se revisaran todos los aspectos globalmente 18. Cabe también destacar en este estudio, que la mayoría de CEI -alrededor del 80 % para ese periodo- ya utilizaban como referente guía a las BPC, es decir, que además de la Resolución 8430 de 1993, las BPC ya eran reconocidas como un marco fundamental de funcionamiento.
En el estudio realizado por Miranda en el 2006 19, en el cual se caracterizaron 26 CEI del país, la autora encontró que solo en 6 casos (23 %) el CEI contaba con un representante de la comunidad; en el 50 % de los casos no existía equidad de género; en cerca del 50 % de los casos el CEI era conformado solo por médicos, y el 30 % de los CEI encuestados no tenían un manual de operaciones interno. La autora, en su momento, recomendó que se elaboraran guías de funcionamiento para los CEI basadas en normas internacionales 20,21.
En la presente caracterización la mayoría de comités cumple a cabalidad con los estándares de las BPC, lo cual constituye un progreso importante en el fortalecimiento de los comités, dado que se ha demostrado que la ausencia de estándares en el funcionamiento de los CEI entorpece los procesos administrativos y desprotege a los involucrados en la investigación, además de poner en duda la veracidad de los resultados 21-23. De otra parte, la organización de un CEI alrededor de normas que conduzcan a una acreditación o certificación le permite mejorar la calidad de sus servicios, definir indicadores e incluso convertir al CEI en una organización económicamente rentable 24,25. Aún más, la evaluación de los procesos de un CEI le permite definir un punto de base a partir del cual se desarrollen procesos fundamentales, como la implementación de tecnologías para la administración del CEI, la instauración de redes colaborativas y el desarrollo de programas completos de protección al sujeto de investigación 26-28.
Sin embargo, a pesar de las mejoras en la estandarización de los procesos, una de las limitaciones de los comités es su falta de herramientas informáticas para la gestión de la información, dado que en solo 3 casos se reportó el uso de herramientas informáticas específicas para el comité, un número muy bajo si se compara con las instituciones de investigación norteamericanas en las cuales casi el 100 % de sus comités tiene herramientas informáticas especializadas en gestión de estos órganos 29.
Aunque todos los comités mencionan tener un representante de la comunidad, es posible que las funciones de dichos miembros no sean claras y que su participación tenga una menor influencia en la toma de decisiones 30, aspecto que podría fortalecerse al definir funciones y perfiles que refuercen su accionar en las reuniones del comité 31,32.
En Latinoamérica se han realizado diversos esfuerzos para establecer un instrumento de medición que permita lograr una evaluación para obtener la acreditación de los comités a través de la preparación de guías y el establecimiento de una red latinoamericana de cooperación 28, a pesar de que puedan existir legislaciones diferentes si existe un consenso común cuando se trata de estudios de investigación 29. En un estudio realizado en Colombia se concluyó que los CEI, en su mayoría, cumplen con la normativa nacional e internacional, pero que sus miembros requieren mayor y continuada formación en bioética 30; este es un aspecto muy importante para el desarrollo futuro de estrategias educativas continuadas para fortalecer el conocimiento en bioética de los comités.
El sentido, los objetivos y los propósitos de la ética, aplicados al ámbito del quehacer científico, se reflejan en las funciones del CEI, las cuales comprenden el análisis profundo, independiente, competente y oportuno de los protocolos de la investigación biomédica, así como el acompañamiento de los procesos de ejecución de los proyectos y en asegurar la difusión de los resultados de la investigación 33.
Estas funciones tienen como objeto salvaguardar la dignidad, los derechos, la seguridad y el bienestar de los participantes en las investigaciones, a partir de la reflexión, el debate, la deliberación, y de un proceso racional para la toma de decisiones entre los miembros del CEI, con el fin de cumplir con un propósito que tiene intención de universalidad, el cual es propender por el avance científico al servicio del progreso y el desarrollo 34.
El CEI es el elemento que enlaza la generación de hipótesis investigativas, las cuales pretenden ser respondidas a través de la metodología científica, con la ejecución de la investigación que se adhiera a procedimientos éticos. De esta manera, el CEI es un grupo interdisciplinario que se reúne para analizar los posibles cuestionamientos éticos de la investigación biomédica, los cuales no se circunscriben a lo teórico, sino que se analizan en razón de los potenciales riesgos a los que se someten los sujetos durante la actividad investigativa.
El quehacer del CEI es eminentemente práctico, y su sentido se debe a la protección de la dignidad, los derechos, la seguridad y el bienestar de los sujetos de investigación; al estudio de los aspectos éticos del protocolo; al análisis de los aspectos metodológicos y científicos de la investigación; a develar los riesgos del protocolo; a establecer la pertinencia de la investigación científica, y a resaltar la importancia de la calidad en la investigación. De tal modo que el sentido del CEI es el de proteger a los sujetos y atestiguar que los resultados de la investigación sean confiables, de manera que las conclusiones del proyecto correspondan a hechos científicos de utilidad y de aplicación práctica. Aspectos que se garantizan solo sí los diferentes componentes del protocolo científico cumplen con parámetros éticos que avalen la inversión de recursos y el sometimiento de los sujetos de investigación a un riesgo razonablemente previsible.
La ley de ética médica colombiana invoca a la Declaración de Helsinki como el referente ético en lo concerniente a la investigación biomédica 35, y las funciones atribuidas al CEI se han venido formalizando en el país en la medida que la investigación clínica se ha incrementado en su número y complejidad. Es a partir de la Resolución 8430 de 1993 36 en donde se hace el requerimiento directo a los comités para que estos vigilen las actividades de investigación científica; sin embargo, con la Resolución 2378 de 2008 10 este requerimiento adquiere un contexto de estructura, funcionamiento, objetivos y actividades específicas del CEI, bajo los patrones de la norma internacional de las Buenas Prácticas Clínicas.
Una limitación importante de este estudio es el no haber podido obtener mayor participación de los comités de ética si se considera que su enfoque era precisamente conocer la situación actual y proponer medidas de mejora para todos. Un estudio en el cual se comparan las tasas de respuesta de encuestas aplicadas a la comunidad señaló que se obtuvo el 30 % de respuesta cuando la encuesta es telefónica, 10 % en encuestas por correo personalizadas y 7,5 % en encuestas genéricas por correo 37; en este estudio hubo una participación del 30 % de los comités de ética certificados en Colombia. Si bien el resultado se encuentra en un porcentaje esperado según las tasas usuales de respuesta, no es posible determinar el estado de las características de los comités que no participaron como tampoco extrapolar estos resultados.
No obstante, este ha sido un ejercicio significativo y se recomienda repetirlo periódicamente, con el objetivo de ampliar la participación de los diferentes comités en futuros estudios. También es muy importante generar la cultura de la autoevaluación dentro de los CEI como un proceso sistemático, procedimiento que se ha realizado en otros países y ha demostrado que la revisión periódica del funcionamiento del comité conlleva una mejoría en la operación y ejecución, y en la implementación de parámetros específicos como las BPC 38,39. La situación actual de los CEI en Colombia refleja la que sucede a nivel mundial, que exige una transformación continua de las acciones de los comités, la cual se orienta hacia el mejoramiento continuo, con el objetivo de optimizar la competitividad de los países en relación con su capacidad de desarrollar investigación clínica de elevados estándares científicos, y con la capacidad de evaluar los protocolos con criterios éticos definidos 40-43.
Conclusiones
Al comparar las características actuales de los comités de ética de la investigación en Colombia con estudios similares realizados en el país, se observa que hay cambios positivos en relación con la conformación y el funcionamiento de los comités, lo que se relaciona con la introducción de las BPC por medio de la Resolución 2378 de 2008.