INTRODUCCIÓN
Uno de los sucesos trascendentales en la biotecnología y la genética molecular ha sido el desarrollo de técnicas de edición genética, como: TALEN, ZFN y, recientemente, CRISPR-Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats [repeticiones palindrómicas cortas agrupadas regularmente interespaciadas] y Cas9: proteína 9 asociada a CRISPR): una herramienta que ha derribado numerosas barreras de la edición genética; especialmente por sus aplicaciones en células de la línea germinal. El complejo Cas9 permite realizar modificaciones específicas mediante la identificación de una secuencia de nucleótidos y la acción de un ARN guía sintético que impulsa la proteína Cas9 encargada de reconocer y cortar la región deseada 1.
El desarrollo de este sistema surgió de investigaciones en la inmunidad adaptativa bacteriana de Streptococcus pyogenes (Rosenbach 1884), las cuales reconocen que las bacterias tienen un sistema equivalente a la "inmunidad adquirida" en animales 1.
El alto alcance de la técnica la ha posicionado como una herramienta poderosa en la caracterización molecular y como una alternativa para el tratamiento de enfermedades humanas 2; se reportan más de 25.000 trabajos académicos y alrededor de 20.000 patentes registradas a lo largo de todo el mundo 3. CRISPR-Cas9 aún puede catalogarse como una tecnología génica reciente que, si bien promete mejorar la calidad de vida humana, al mismo tiempo despierta interrogantes éticos respecto a sus riesgos y beneficios 4.
La edición in vivo del ADN presenta inconvenientes tales como: los efectos secundarios, las alteraciones ecosistémicas, el uso en embriones humanos de manera ilegal e incluso el mejoramiento genético que es considerado por muchos como una problemática social no prevista 5-7. Es aquí donde la bioética, como multi (inter y trans) disciplina, pone en perspectiva la preocupación científica por el avance tecnológico en relación con las condiciones de vida de los seres vivos y aporta, desde su campo de conocimientos teóricos, a la consolidación de reflexiones y posiciones moralmente idóneas 8.
Además, al ser una "ciencia puente", regula el actuar humano ante los problemas sociales y del medioambiente desde múltiples campos de interés que problematizan las cuestiones éticas asociadas a la investigación, la política y el equilibrio ecosistémico 9.
Por consiguiente, el presente artículo tiene como objetivo revisar las aproximaciones bioéticas en torno a los desafíos y posibles repercusiones que suscita la edición del genoma por CRISPR-Cas9; para ello, se integran las preocupaciones, discusiones y reflexiones bioéticas en niveles que incluyen: la investigación básica, la línea somática y germinal humana, el uso en otros organismos y el impacto a nivel ecosistémico y social. De igual forma, se enfatiza en las cuestiones éticas dirigidas a dos áreas fundamentales: la seguridad y la aceptabilidad moral, analizando los cuestionamientos asociados a través de la bioética principialista.
MATERIALES Y MÉTODOS
En esta revisión sistemática cualitativa se realizó una exploración en las bases de datos: PubMed, Scopus y Scielo, con los términos de búsqueda libre: "Bioética CRISPR-Cas9", "CRISPR-cas9 bioethics", "CRISPR-Cas9 application ethics" y "CRISPR/Cas9 Reflexiones bioéticas". Además, se emplearon informes y declaraciones científicas que constituyeron la literatura gris, la cual brindó una mejor comprensión bioética de la temática. Los criterios de inclusión aplicados fueron: manuscritos originales y capítulos de libros publicados entre 2015 y 2021-exceptuando aquellos documentos que reportaron las primeras descripciones de principios bioéticos y de la tecnología CRISPR-Cas9-, material con acceso total en idioma español e inglés con título y resumen completos y acordes a esta investigación.
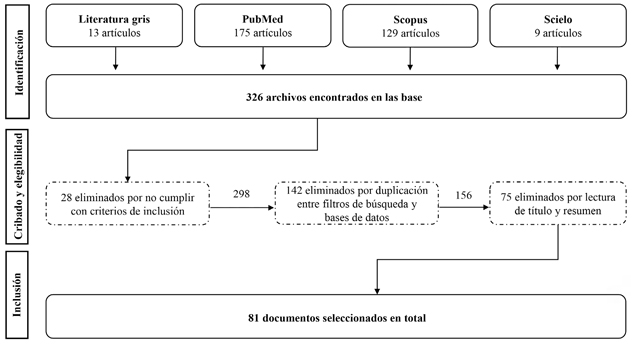
La búsqueda en las bases de datos arrojó 326 artículos, de los cuales 298 cumplieron con los criterios de inclusión. Luego de eliminar los duplicados entre bases de datos, se obtuvieron 156 documentos. Al realizar el ejercicio de lectura de título y resumen llevado a cabo por las autoras, fueron seleccionados un total de 81 documentos (figura 1).
En los siguientes apartados se presenta una descripción del sistema CRISPR-Cas9, sus aplicaciones y la sistematización de las discusiones bioéticas encontradas al aplicar la metodología descrita (tabla. 1), organizadas en una relación beneficio-riesgo/problemática, con las categorías: a) investigación básica asociada, b) aplicaciones no terapéuticas, c) línea somática, d) línea germinal y e) implicaciones sociales; estos elementos fueron seleccionados debido a que son los más recurrentes en las investigaciones que contempla esta revisión. Para su inclusión, se elaboró una matriz de datos que permitió llevar a cabo la trazabilidad en la ocurrencia de aparición de cada una de estas categorías para, finalmente, seleccionar y desarrollar las cinco más frecuentes.
RESULTADOS Y DISCUSIÓN
Sistema CRISPR-Cas9
El sistema CRISPR-Cas9, en su estado natural, se reconoce como una forma de inmunidad presente en bacterias y arqueas contra la reinfección por fagos 2 y, en su forma artificial, es una herramienta de edición genética con fácil diseño, simplicidad en su uso y alta eficacia 10. En 1987, mediante la secuenciación de nucleótidos de Escherichia coli (Escherich, 1885), se identificaron por primera vez unas secuencias homólogas repetitivas de ADN que luego serían llamadas regiones CRISPR 11. A inicios del siglo XXI fueron determinadas algunas de sus funciones biológicas 12, luego, estas regiones se asociaron a un grupo de genes Cas. En los años 2005 y 2007, se comprobó de forma experimental la acción inmunitaria que estos palíndromos presentaban contra las reinfecciones por virus 13 y, un año después, fue vinculada la participación de cadenas de ARN (crRNA) que guían la defensa antiviral en este complejo 14. Los componentes esenciales de CRISPR-Cas9 fueron descritos principalmente en Streptococcus pyogenes (Rosenbach 1884) gracias a los trabajos de Doudna y Charpentier 1 quienes, en su momento, sugirieron su aplicación como herramienta de edición genómica mediante el rediseño del complejo Cas9. Luego de estos acontecimientos, fue posible la edición de genomas bacterianos y eucariotas usando CRISPR-Cas9 en numerosas investigaciones 15.
Para comprender el mecanismo de esta herramienta de edición, es necesario entender su funcionamiento como defensa de inmunidad natural procariota caracterizada por la escisión de fragmentos del ADN invasor 16. La inmunidad a partir de CRISPR se divide, generalmente, en tres etapas: adaptación, expresión e interferencia. La adaptación ocurre cuando la infección se ha producido por primera vez; se insertan regiones de ADN vírico llamados protospacers entre las regiones de repetición CRISPR del huésped 17. En el paso dos o expresión, las regiones CRISPR, con los espaciadores adquiridos y los genes Cas, se transcriben en un CRISPR ARN precursor (pre-crARN) que, a su vez, incluye un ARN transactivador (tracrRNA), estos dos forman un complejo que finalmente se cortará en crARN cortos y maduros, para obtener el híbrido tracrARN: crARN 18. La última etapa se produce ante la invasión viral; el híbrido de ARN se une a la proteína Cas9 y corta la secuencia nucleotídica invasora en un sitio específico de reconocimiento, lo que crea una ruptura de doble cadena (DSB) 19,20.
Con estas claridades, fue posible la modificación del complejo Cas9 llevada a cabo por Doudna y Charpentier, quienes fusionaron las dos moléculas de ARN en un ARN de guía simple sintético (sgARN) suficiente para reconocer y cortar el ADN diana al direccionar la endonucleasa Cas9, para desencadenar así la maquinaria de reparación del ADN, que involucra dos posibles vías: en la primera, cuando no se posee un molde, se activa el mecanismo NHEJ (unión de extremos no homólogos) muy propenso a errores, lo que induce cambios en los extremos de unión, ya sea mediante inserciones o deleciones, lo que inactiva la función del gen (bloqueo de gen o knockout)21. En la segunda, la reparación es directa por homología o HDR, y crea la modificación al programar el sitio donde se realizará el corte de manera específica, al añadir una secuencia nucleotídica exógena homóloga a las regiones escindidas 10,22.
Aplicaciones de la tecnología CRISPR-Cas9
La utilización de CRISPR-cas9 ha impulsado la investigación en fitomejoramiento en el tratamiento de enfermedades y en ensayos en diferentes organismos, incluido el humano. A tal punto que ha logrado un gran éxito gracias a su eficiencia y fácil diseño, ya que puede ejecutarse tanto in vivo como ex vivo23,24 y con ello, ampliar las posibilidades en la ciencia y la tecnología.
Salud pública
Liao et al.25 emplearon la técnica para el tratamiento del VIH-1 inactivando permanentemente su expresión viral. Otra desactivación exitosa se realizó en los retrovirus PERV presentes en todas las cepas de cerdos; esta experimentación, realizada por Niu, et al.26, plantea los primeros avances para la posible transferencia de órganos de cerdos a humanos sin la complicación de incompatibilidades inmunológicas. Por su parte, Hammond et al.27 trabajaron en la aceleración de impulsores genéticos que inactivan o suprimen las poblaciones de Anopheles gambiae mediante una reducción en la capacidad reproductiva de la hembra para detener la transmisión de la malaria.
En el año 2013 se experimentó en ratones a fin de eliminar las cataratas al crear una mutación en el gen Cry Gc, lo que permitió una descendencia sin la enfermedad 28. En este mismo año, se reparó in vitro un gen defectuoso en células madre intestinales con fibrosis quística 29 y, trabajando con hepatocitos humanos, suprimieron la hepatitis B en cultivos in vitro30. Tres años después, Tabebordbar et al.31 utilizaron tejido muscular in vivo de ratones para insertar una mutación del gen que codifica la distrofina -deficiente en personas con distrofia muscular- y restauraron la función del músculo esquelético. Palit et al.32, a través de pantallas genéticas 33, identificaron que la inhibición del gen BRAF aumentaba la sensibilidad a la enzalutamida, la cual es utilizada para el tratamiento en las células de cáncer de próstata. Para finalizar, una de las aplicaciones más controversiales fue la realizada por He Jianhui 34 en terapia génica preventiva, quien alteró el gen CCR5 ante el virus del VIH con el propósito de que la mutación o deleción del gen generase resistencia en dos bebés ante el contacto con el virus.
Industria alimentaria
Existen problemas bióticos y abióticos (plagas, enfermedades, lluvias, sequías) que afectan un gran número de cultivos alrededor del mundo, especialmente en plantas de interés comercial como el tomate, la papa, el pepino, el arroz, el sorgo, la naranja, el maíz 35-39, por lo que son necesarios avances tecnológicos que brinden una mayor resistencia en las plantas. En este sentido, E et al.40 caracterizaron los principales enfoques que ha tenido la edición genética en plantas, dentro de los cuales se encuentra la potencialización de los rasgos agronómicos, tolerancia a herbicidas, propiedades nutricionales, una mejor calidad del producto acorde con las expectativas del consumidor y una mayor tolerancia en escenarios de cambio climático, a fin de contribuir a una soberanía alimentaria en el futuro 41. En general, la experimentación en el área vegetal ha sido amplia y ha demostrado resultados exitosos 42,43.
Bioética y CRISPR-Cas9
La necesidad de cuestionar los avances tecnológicos parte de la brecha establecida históricamente entre el conocimiento científico y las humanidades, razón por la cual han surgido numerosas opiniones y discusiones respecto a la capacidad que brinda CRISPR-Cas9 para transformar el acervo genético de cualquier organismo, incluido el hombre.
Así es como dichas perspectivas (tabla 1) fueron recuperadas en esta revisión sistemática, mediante la categorización de las temáticas más relevantes en las bases de datos consultadas, en las que destaca la preocupación por las aplicaciones mencionadas con anterioridad y los aspectos desconocidos asociados, por el corto tiempo de la investigación, la insuficiencia de mecanismos de regulación y la libertad que ha sido brindada a investigadores en numerosos países para su utilización.
Tabla 1 Panorama general de temáticas relacionadas con la bioética de CRISPR-Cas9
| Temática | Beneficio | Riesgo /problemática bioética | Referencia |
|---|---|---|---|
| Investigación básica asociada | Avances metodológicos en la técnica y la edición genética. Comprensión de mecanismos genéticos. Estudio de la función de los genes. | Inconsistencia en normativas, leyes y protocolos. Aplicaciones no reguladas o llevadas a cabo de manera ilegal. | Santaló et al. 44 Brokowski y Adli 45, The Royal Society et al. 46 |
| Aplicaciones en organismos no humanos | Fitomejoramiento. Reducción de vectores de enfermedades. Recepción de órganos xenogénicos. | Alteraciones ecológicas. Reducción de poblaciones animales. Dignidad Animal. | Ayanoglu, Elçin, Elçin 47, Shinwari, Tanveer y Khalil 48, Eissenberg 6, Zhang et al. 49, El-Mounadi 50, Lima 51 Piergentili, et al. 22 |
| Línea somática | Tratamiento de enfermedades. Cirugías plásticas y reconstructivas. | Efectos secundarios aún no determinados. Cambios fuera del objetivo. | Cathomen et al. 52 Alonso et al. 53 Cribbs y Perera 54 Eissenberg 6, Zeps et al. 55, Piergentili et al. 22 |
| Línea germinal | Corrección de enfermedades genéticas en embriones humanos. Reproducción humana asistida. Tratamiento de enfermedades. | Riesgo de mosaicismo. Cambios fuera del objetivo. Menor longevidad. Cambios del genoma sin justificación médica. Ausencia de un consentimiento informado intergeneracional. Condición de persona de un embrión. Mosaicismo y quimerismo. | Peters 56, Savulescu et al. 57, Santillan-Doherty et al. 58, Brokowski y Adli 45, Gumer 59 |
| Implicaciones sociales | Soberanía alimentaria. Mitigar el sufrimiento por enfermedades. | Eugenesia. Acceso equitativo a la tecnología en países en vía de desarrollo. Costo de la técnica. | De Lecuona et al. 60, Ayanoglu, Elçin, Elçin 47, Greenfield 61 |
Fuente: elaboración propia.
Reflexiones y recomendaciones ante la investigación básica con CRISPR-Cas9
La expansión de CRISPR-Cas9 ha llamado la atención de comités nacionales -como el Consejo Nacional de Bioética- e internacionales mencionados por Santaló et al.44, quienes problematizan los elementos éticos del uso de la técnica y realizan recomendaciones específicas dependiendo el tipo de aplicación.
Este es el caso del Observatorio de Bioética y Derecho, el cual hace una reflexión acerca de cómo la investigación básica se ha desarrollado en un escenario de contraposición entre el principio de precaución y los intereses de la industria y la economía. En ese sentido, busca brindar respuestas y velar por el control de las actividades investigativas mediante la aclaratoria de los usos admisibles en investigación con CRISPR-Cas9 en seres humanos: 1) estudios relacionados con células somáticas en cultivos y terapia genética; 2) investigaciones en embriones; 3) trabajos en células embrionarias y células germinales en calidad restrictiva y controlada, evitando restringir el avance científico y el acceso equitativo a los beneficios, sin dejar a un lado los mecanismos de precaución y acción de efectos no deseados 44. En esta misma línea, se encuentra el Informe de las Academias de Ciencias y Medicina de estados Unidos y la Royal Society (el mayor análisis reportado hasta la fecha sobre preocupaciones de edición del genoma humano) 46, el cual recomienda continuar con las investigaciones básicas sin tener como finalidad usos clínicos en embriones, lo que permite el avance en el reconocimiento del genoma y, con ello, mejorar la especificidad y efectividad de la técnica para el diseño de metodologías más seguras y efectivas. De hecho, para autores como Alonso et al.53, el continuar con la investigación ha hecho posible crear alternativas más precisas como es el caso de la "edición principal".
En contraposición, el prohibir los trabajos con embriones según otras investigaciones 57 solo limitaría toda posibilidad terapéutica relacionada con el tratamiento de células madre totipotenciales, la creación de técnicas novedosas de fertilización, e incluso, el surgimiento de tratamientos de enfermedades. Por esto, Savulescu et al.57 establecen como ilógico concebir la prohibición total al examinar que toda nueva tecnología representa efectos impredecibles y no sería coherente darle un tratamiento distinto a esta técnica comparada con sus semejantes, por el contrario, exponen que la investigación en edición genética es una verdadera necesidad moral, ya que ayudaría a reducir las enfermedades genéticas y beneficiaría a millones de personas.
De cualquier forma, se busca promover un control democrático y no mercantil o financiero en las inves tigaciones, con participación de comités de ética que implementen y simplifiquen los procedimientos, a fin de evitar la pérdida de credibilidad en la comunidad científica y la ciencia en general 44.
La dualidad entre el balance ecosistémico y la calidad de vida humana
El fitomejoramiento pone en perspectiva postulados bioéticos en una relación de contribuciones sociales e impactos ecológicos; según E§ et al.40 y Brokowski y Adli 45 se obtienen beneficios como: una mayor resistencia en las plantas y, con ello, se evita la pérdida de cosechas; son posibles los cultivos en áreas con altas condiciones de estrés, aumenta el valor nutricional de los organismos y se reducen las biomoléculas relaciona das con efectos perjudiciales en la salud humana. Esto propicia un estilo de vida más saludable, el aumento en la disponibilidad de alimentos para poblaciones humanas, contribuye con soluciones factibles al problema de la desnutrición y crea un camino para la seguridad y soberanía alimentaria 41. En contraste, hay posturas que establecen que la introducción de organismos modificados genéticamente (OGM) podría afectar el equilibrio ecosistémico; Shinwari et al.48 y Eissenberg 6 cuestionan la potencialidad de algunas especies vegetales modificadas para convertirse en malezas invasoras, teniendo en cuenta que, adquirir un carácter de resistencia no antes visto en la naturaleza aumentaría su probabilidad de éxito al colonizar otros ecosistemas, sumado al desconocimiento de la interacción de estos genes con las condiciones ambientales.
No obstante, hay estudios que catalogan la edición de cultivos como un aspecto necesario, teniendo en cuenta la demanda alimentaria mundial. Por esta razón, existe el imperativo de reestructurar las regulaciones asociadas a plantas editadas genéticamente, ya que existe una preocupación en la población sobre la bioseguridad en su consumo, muchas veces causada por la ausencia de información sobre los principios básicos propios de CRISPR-Cas9 62,50.
Algunas investigaciones 27 señalan que el equilibrio ecosistémico también puede verse alterado por acciones como la edición de mosquitos vectores de enfermedades, al modificar su autoecología; la dieta de depredadores ubicados en niveles superiores de las redes tróficas; la proliferación de especies plagas 63, e incluso, generar la extinción de una especie en laboratorio al cabo de aproximadamente 10 generaciones 64. Piergentili et al.22 exponen el dilema ético sobre la modificación permanente del genoma de las especies y sus futuras generaciones, de la misma manera que Eissenberg 6 señala los siguientes cuestionamientos asociados: ¿Quién decide si alguien puede liberar un gen? Considerando que este impulso puede traspasar las fronteras nacionales, ¿qué tan diferente es a la liberación de una especie invasora? Aun cuando es factible revertir las alteraciones fuera de objetivo mediante los denominados kill-switch: proteínas encargadas de la inhibición del complejo 65. Para algunos autores 51 queda claro que no existe una certeza sobre los efectos reales de la alteración o eliminación de ciertos caracteres que probablemente en un futuro llegasen a ser ventajosos en un contexto diferente, o bien, presenten beneficios para la especie en general, aunque no para un individuo en particular. Otras cuestiones éticas se han inclinado a discutir la edición del genoma en cerdos para el mejoramiento de su producción, su uso como modelos animales, para el estudio de enfermedades 66 o en la obtención de órganos. Zhang et al.49 señalan las ventajas de una reducción significativa en los costos de producción. Por su parte, Wang et al.67 reconocen que se requiere mejorar las metodologías y evitar las altas tasas de mortalidad de los organismos y la vulneración de la dignidad animal.
Respecto a los xenotrasplantes obtenidos con esta técnica, se pueden asociar ventajas como: acortar los tiempos de espera en la recepción de donantes compatibles y aumentar la calidad y el tiempo de vida en los pacientes, sin embargo, al ser un procedimiento en el que se obtienen órganos o tejidos a partir de organismos animales, reconocidos como organismos quimera 26, despierta debates asociados a la dignidad e identidad de nuestra especie, debido a la presencia de células humanas en otros organismos 47. Debido a lo anterior, se recomienda examinar cuidadosamente todas las alternativas,vcomo campañas de donación entre humanos y políticasvpúblicas para el diseño de programas eficientes 51 a fin de no tener que acudir a estrategias como la edición genómica para la obtención de órganos para trasplantes.
La edición de células somáticas, ¿prometedora para los pacientes o una apuesta por la mejora humana?
El tratamiento de enfermedades es una de las aplicaciones más frecuentes de CRISPR-Cas9 en la línea somática, y su uso beneficiaría la calidad de vida de los pacientes, mitigaría su sufrimiento, reduciría la medicación excesiva y ayudaría a la prevención de la muerte prematura 55.
Estas modificaciones y sus efectos mueren con el sujeto de estudio y no se transmiten a generaciones futuras 6 y, de ser desarrolladas de forma segura y con el mismo enfoque que otros tratamientos médicos bien establecidos, no habría razón para ser tratadas de forma distinta 68,53; lo anterior, sin olvidar la importancia de evaluar, validar e identificar los efectos adversos que podrían desarrollarse 52.
Aunque la edición de células somáticas sea menos problemática que la terapia transgénica 55, sus modificaciones in vivo pueden producir efectos adversos, como comprometer órganos cercanos (por edición fuera del objetivo), aumentar la probabilidad de toxicidad, de transformaciones mutagénicas y oncogénicas y el riesgo de inactividad o pérdida de funciones de genes asociados 23,52,69. En este sentido, bajo el principio de autonomía, el paciente firma un consentimiento informado en el cual acepta dichos efectos imprevistos del procedimiento 6, cuestión que no aplica en los infantes y que despierta el dilema ético asociado a la vulnerabilidad y al consentimiento que, en estos casos, es otorgado por los padres o titulares debido a la ausencia de autonomía 55.
Otros estudios, como los realizados por Zeps et al.55, reflexionan sobre la aplicación de la técnica en entornos deportivos con la búsqueda de un mejoramiento en el rendimiento físico, lo que vulnera el principio de justicia respecto a la accesibilidad, la igualdad y la representatividad, ya que las características mejoradas impiden una contienda justa y dejan en desventaja a determinadas poblaciones que no han accedido a la tecnología; además, con la posibilidad de revertir estos cambios a nivel somático, las transformaciones serán vagamente detectables y problemáticas. Aun con aplicaciones que puedan conducir a la "mejora" de ciertos rasgos, es poco probable que los riesgos involucrados con su uso superen los beneficios potenciales en el campo clínico 54.
Ante debates como el planteado por Polcz y Lewis 70 sobre el posible uso en sistemas de justicia para controlar la expresión genética de conductas moralmente indebidas, como la agresividad en los centros penitenciarios, se recomienda que la comunidad académica gestione las expectativas del público, informando sobre el alcance real de CRISPR-Cas9 para evitar expectativas de curas milagrosas y el sensacionalismo equívoco 55.
La línea germinal humana, ¿un debate bioético de extremos?
La eugenesia, la dignidad humana y el transhumanismo son algunas de las preocupaciones éticas más frecuentes de la edición genética en etapas embrionarias. Estos aspectos pueden ser aplicados a un caso en particular objeto de críticas y debates académicos 49. Se hace alusión al experimento realizado por He Jianhui 71,34, investigador que intervino a las primeras humanas con genomas editados en estado prenatal; esta situación abrió grandes controversias sobre la edición clínica del genoma de la línea germinal (GGE); el investigador informó que aun cuando su objetivo fue corregir un error genético en las gemelas, en una de ellas la modificación se produjo en un único alelo, con lo cual quedó desprotegida ante el virus y bajo la condición conocida como mosaicismo 72,73.
Este experimento es injustificado bajo la mirada principialista de la no maleficencia, ya que en la actualidad hay estrategias que evitan el contagio de VIH, como lo es el lavado seminal, una metodología segura y eficaz 58,56. También se identificaron algunas falencias con relación al consentimiento informado para este caso; al parecer, los padres no fueron comunicados con claridad sobre los riesgos y beneficios del experimento: el documento presentó en su mayoría terminología molecular poco comprensible para ajenos a esta disciplina y el incentivo monetario otorgado pudo incidir en la deliberación y el condicionamiento de su participación 74,75. Santillán et al.58 mencionan que el aval ético nunca fue realmente otorgado por el Comité de Ética Médica, ya que las firmas fueron falsificadas, situación que crea en la sociedad la percepción de que el proceso fue fraudulento y con posibles intenciones mediáticas o económicas 58. Además, no se tuvieron en cuenta algunas reglas estatales chinas que establecen directrices para el tratamiento de embriones humanos modificados genéticamente 73.
Con este referente, cabe preguntarse ¿debería o no ser aceptada la modificación de la línea germinal con CRISPR-Cas9? Al respecto, Gumer 59 plantea la completa prohibición de este tipo de modificaciones y Piergentili et al.22 lo consideran desaconsejable; posiciones que se sustentan en la comprensión superficial sobre el genoma humano que, al emplear estas prácticas, aumenta los riesgos y efectos potenciales en los pacientes, producto de la imprecisión de la técnica y el porcentaje de células afectadas negativamente. Como establece la Unesco en su Declaración Universal sobre el Genoma Humano y los Derechos Humanos 76, esto iría en contra de la dignidad humana, ya que estas alteraciones genómicas de manera predecible e intencional conducen al sufrimiento, además, como mencionan Dantas et al.77, podrían aumentar las diferencias sociales y atentar contra la diversidad biológica, con resultados nefastos e irreversibles en el genoma de toda una especie.
Por su parte, Greenfield 61 afirma que no habría razón para oponerse a una edición responsable del genoma humano ya que este no existe como carácter identitario en términos de patrimonio de la humanidad, teniendo en cuenta que nuestro ADN está expuesto a factores genéticos y ambientales que lo modifican de manera constante. En este escenario, se ubican estudios que señalan que una moratoria total en las prácticas de edición genómica, ya sea en células somáticas o germinales, sería inútil en el contexto actual, donde la premura de publicación e investigación permite que se repitan acciones no controladas como lo ocurrido en China 60.
Para otros autores 78,59, el potencial que ha demostrado la técnica podría proporcionar a progenitores ventajas biológicas en sus descendientes; incluso si se legaliza para el uso terapéutico, es difícil asegurar que no se aplicará para la mejora humana, es decir, si se pueden corregir errores ¿por qué no aumentar las capacidades físicas o mentales de la progenie? 6.
Ahora, ante un posible acceso universal a estos avances, Johnston 79 problematiza cómo el sistema de atención médica podría brindar la participación equitativa sin que se retire la financiación a otras prácticas clínicas; en el caso contrario, ante la existencia de un condicionante económico para su acceso, este autor cuestiona si los beneficios solo serían accesibles a sectores específicos de la población 58,59, lo que incrementaría la in-equidad social y, con ello, habría una transgresión del principio de justicia.
Diferentes posturas identifican que el mejoramiento de la especie humana también puede ser visto como una última consecuencia del transhumanismo 80, que busca individuos superiores a la "normalidad" humana a partir del control de la evolución de la especie mediante alternativas como la eugenesia, lo que para algunos va en contravía de los valores culturales 77,81.
Si bien las posturas pueden llegar a ser muy diversas y controversiales, el informe de la Comisión Internacional de las Academias de Ciencias sobre la edición hereditaria del genoma humano 46 establece recomendaciones para el actuar responsable en la aplicación de la línea germinal, y contempla dos condiciones que se deben cumplir para que se pueda desarrollar la GGE: 1) los datos preclínicos deberán respaldar metodologías confiables de edición que eviten cambios fuera del objetivo, y 2) esta práctica debe ser legal en el país que se piense realizar, contando con participación, consulta pública y supervisión regulatoria. Sin embargo, para esta Comisión, la evidencia actual demuestra que estos criterios no se cumplen a cabalidad, lo que hace inviable el uso de CRISPR-Cas9 en células germinales.
REFLEXIONES FINALES
Se considera el principio de precaución como uno de los ejes más relevantes en la toma de decisiones frente a la edición genética con CRISPR-cas9, teniendo en cuenta que el alcance de la técnica y su efectividad no hace posible realizar proyecciones seguras sobre sus implicaciones a largo plazo. Lo anterior se fundamenta en los siguientes elementos: las prácticas eugenésicas, los efectos no deseados en las generaciones futuras 51, las implicaciones ecosistémicas que siguen siendo desconocidas fuera de un laboratorio, y la incertidumbre de los daños que no se compensan en su totalidad por las contribuciones 61.
Así mismo, el consentimiento informado planteado bajo el principio de autonomía ha cobijado investigaciones que no han sido claras con los sujetos, ¿cómo experimentar con CRISPR-cas9 cuando no son identificables los efectos que atentan contra la integridad y la salud humana si los daños no serán reversados? Lograr prevenir los riesgos deberá ser un acto de responsabilidad de la comunidad científica con la sociedad en general que atiende a un pilar bioético: la no maleficencia, en la que se busca a toda costa no producir daño y, de la misma forma, evitarlo.
Ahora bien, en el contexto actual de inequidad y desigualdad mundial, el principio de justicia puede llegar a ser uno de los más vulnerados en lo que respecta al acceso universal y distribución de esta técnica, ya que su uso y aplicación por industrias privadas con objetivos de enriquecimiento individual aumentarían la discriminación y la brecha social entre seres humanos 80. Estas mismas preocupaciones son aplicables a contextos competitivos como la educación o el deporte 81, en los cuales la premura por ser los mejores coarta la toma de decisiones libres y, por ende, representa una transgresión al principio de autonomía.
Es evidente que existe un foco específico de preocupación sobre las aplicaciones de la terapia génica con CRISPR-Cas9 en células somáticas y germinales humanas, por esta razón, muchos de los cuestionamientos solo serán solucionados cuando se logre un mayor avance y eficacia de la técnica, aunado a protocolos y regulaciones internacionales.
Paralelo a lo anterior, en esta revisión se reconocen vacíos investigativos sobre los cuestionamientos éticos asociados a aplicaciones en organismos no humanos, lo que evidencia un desconocimiento sobre los desafíos futuros de estas modificaciones en términos ambientales; el hombre ha sido objeto central de los debates, lo que deja de lado a otros grupos biológicos que podrían ser objeto de discusión.
De cualquier forma, será crucial la consolidación de una postura ética de la comunidad científica y un trabajo multidisciplinario con otras áreas de conocimiento como la bioética, para que esta tecnología no llegue a ser utilizada con propósitos mercantiles potenciados por la sociedad del consumo y la desigualdad y que, a su vez, permita analizar un panorama más representativo de la ética de las aplicaciones de esta tecnología, que involucre a una diversidad de organismos vivos que están siendo ignorados.
CONCLUSIONES
Las posiciones bioéticas se encuentran mayoritariamente polarizadas. Por un lado, se aceptan las prácticas con fines terapéuticos en la línea somática, teniendo como pilares bioéticos la no maleficencia, el respeto a la dignidad humana, el desarrollo de un debido consentimiento informado y protocolos eficaces de supervisión de la técnica. Por otro lado, la postura bioética en la línea germinal se inclina por una desaprobación generalizada en su uso, debido al conocimiento limitado del genoma, las ediciones no controladas en células, la inexistencia de un consentimiento informado intergeneracional y el acceso inequitativo a los beneficios de su aplicación. Respecto a los usos de la técnica en organismos no humanos, la discusión ética problematiza el principio de precaución en relación con la incertidumbre que generan las afectaciones ecológicas y el desequilibrio ecosistémico producto de la edición del genoma animal y vegetal.
Reflexionar sobre intervenciones genéticas con CRISPR-cas9 posibilita entornos más seguros para el ser humano y el ecosistema, no obstante, es indispensable evitar los extremos radicales que limiten una tecnología prometedora para la solución de enfermedades y el mejoramiento de la calidad de vida humana o, por el contrario, ser permisivos con una herramienta que pueda causar daño considerable tanto ecológico como social. Entonces, será necesaria la toma de decisiones responsables que incluyan las preocupaciones de la sociedad y que, a su vez, sean coherentes con las evidencias producto de investigaciones rigurosas y transparentes.