Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol v.12 n.2 Bogotá jul./dez. 2010
ARTÍCULO DE INVESTIGACIÓN
Construcción de mutantes de Salmonella enterica por inactivación de los genes invG/invE y ssaJ/ssaK de las islas de patogenicidad 1 y 2
Construction of mutants of Salmonella enterica for inactivation of invG/invE y ssaJ/ssaK genes of pathogenicity islands 1 and 2
Judith Velasco1 , María Araque2 , Juan A. Ayala3
1Licenciada en Bioanálisis, Especialista en Microbiología, Departamento de Microbiología y Parasitología, Facultad de Farmacia y Bioanálisis, Universidad de los Andes, Mérida, Venezuela. judithvelasco2005@yahoo.es
2Médico cirujano, Doctora en Ciencias Médicas Fundamentales, Departamento de Microbiología y Parasitología, Facultad de Farmacia y Bioanálisis, Universidad de los Andes, Mérida, Venezuela. araquemc@ula.ve
3 Licenciado en Ciencias Químicas (Bioquímica), Doctor en Ciencias Químicas (Bioquímica), Centro de Biología Molecular "Severo Ochoa" CSIC-UAM, Campus de Cantoblanco, Madrid, España. jayala@cbm.uam.es
Recibido: mayo 25 de 2010 Aprobado: octubre 7 de 2010
Resumen
Para la comprensión de las bases genéticas de los mecanismos de patogenicidad de Salmonella se han descrito diversas metodologías para manipular el ADN genómico y generar mutantes con características particulares. En este estudio se reporta la construcción de mutantes a partir de varios serotipos de S. enterica, por sustitución e inactivación de los genes invG/invE en SPI-1 y de los genes ssaJ/ssaK en SPI-2 mediante la técnica de recombinasa Red del fago ? descrita por Datsenko y Wanner (2000). Los genes delecionados en las SPI-1 y SPI-2 codifican para las proteínas que participan en la formación de los sistemas de secreción tipo III, responsables de la invasión y supervivencia intracelular de S. enterica en las células hospedadoras. Los resultados de este trabajo permitirán realizar estudios futuros in vivo para evaluar la posible atenuación de la virulencia de las cepas mutantes, así como aportar nuevos conocimientos sobre los mecanismos genéticos involucrados en la fisiopatogenia de las enfermedades producidas por los serovares estudiados. Además, esta técnica se recomienda para generar de manera eficiente mutantes de diferentes serotipos de S. enterica con la finalidad de estudiar los genes cromosómicos y sus productos.
Palabras clave: recombinasa red ?, mutación, islas de patogenicidad, Salmonella enterica.
Abstract
To understand the genetic basis of Salmonella pathogenicity mechanisms, various methods have been described to manipulate and generate mutant genomic DNA with specific characteristics. In this study we report the construction of mutants from several serotypes of S. enterica, substitution and inactivation of genes invG/invE in SPI-1 gene and ssaJ/ssaK in SPI-2 by the technique of phage ? Red recombinase, as described by Datsenko and Wanner (2000). The gene deletion in SPI-1 and SPI-2 encodes proteins involved in the formation of type III secretion systems responsible for the invasion and intracellular survival of S. enterica in the host cells. The results of this work will allow in vivo studies to evaluate the possible attenuation of virulence of the mutant strains, as well as to provide new insights into the genetic mechanisms involved in the pathogenesis of diseases caused by these bacteria. Moreover, this technique is recommended to efficiently generate mutants of different serotypes of S. enterica in order to study the chromosomal genes and their products.
Key words: ? red recombinasa, mutation, pathogenicity islands, Salmonella enterica.
Introducción
Diversos factores de virulencia de Salmonella están codificados por genes que se encuentran agrupados en las islas de patogenicidad SPI (del inglés: Salmonella Pathogenicity Islands). En la actualidad se han descrito 17 SPI diferentes, de las cuales se han caracterizado 14. Sin embargo, las SPI1 y SPI2 son las que codifican los determinantes que median la invasión y la supervivencia intracelular (Darwin y Miller, 1999; Hensel, 2004; Vernikos y Parkhill, 2006; Morgan, 2007).
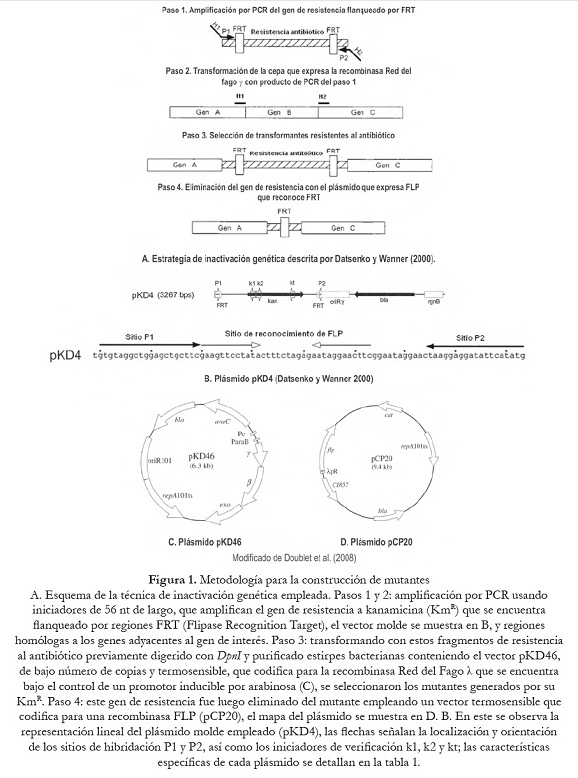
Para la comprensión de las bases genéticas de los mecanismos de patogenicidad de Salmonella se han descrito diversas metodologías para manipular el ADN genómico y generar mutantes con características particulares. Estos métodos comprenden varios procesos de recombinación, uso de enzimas de restricción y vectores suicidas (Collazo et al., 1995; Boyd et al., 1997; Beuzón et al., 2000). No obstante, el sistema de recombinasa Red del Bacteriófago ?, propuesto por Datsenko y Wanner (2000), es un método simple y altamente eficiente para inducir mutaciones o inactivar genes en el genoma de E. coli y en otras bacterias Gram- negativas, a través de recombinaciones homólogas utilizando productos de PCR. Este sistema tiene la ventaja de utilizar pequeñas regiones homólogas (< 50 pb), lo que permite generar mutaciones en cualquier zona del genoma bacteriano (figura 1). Además, comparado con las técnicas clásicas de ingeniería genética no utiliza enzimas de restricción ni ADN ligasas (Santoyo, 2008).
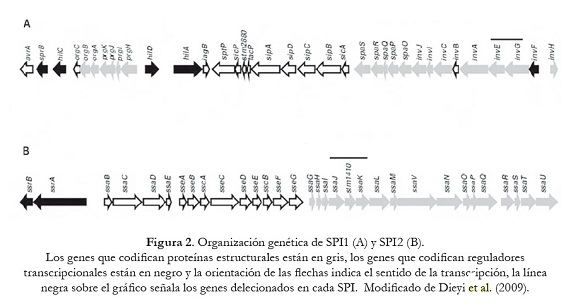
En este trabajo se reporta la construcción de mutantes a partir de varios serotipos de S. enterica, por sustitución e inactivación de los genes invG/invE en SPI-1 y de los genes ssaJ/ssaK en SPI-2 mediante la técnica de recombinasa Red del fago ? (figura 2). Los genes delecionados en las SPI-1 y SPI-2 codifican proteínas que participan en la formación de los sistemas de secreción tipo III (SSTIII), responsables de la invasión y sobrevivencia intracelular de S. enterica en las células hospedadoras. Los resultados de este trabajo permitirán estudios futuros in vivo para evaluar la posible atenuación de la virulencia de las cepas mutantes, así como aportar nuevos conocimientos sobre los mecanismos genéticos involucrados en la fisiopatogenia de las enfermedades producidas por estas bacterias.
Materiales y métodos
Cepas bacterianas, plásmidos y condiciones de cultivo
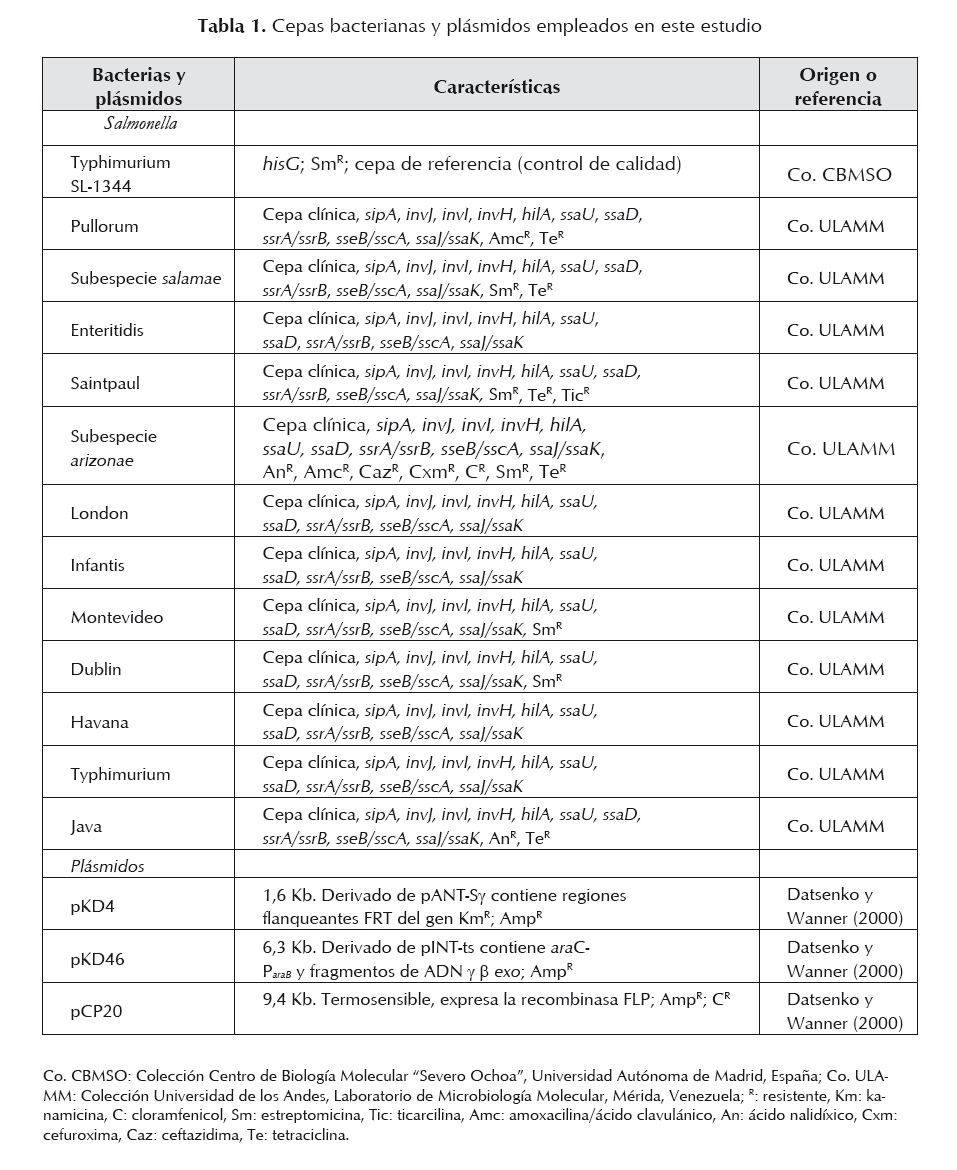
Las cepas bacterianas y plásmidos utilizados en este estudio se muestran en la tabla 1. Todas las cepas fueron cultivadas en caldo y agar Luria Bertani (LB). En algunos casos los medios de cultivo fueron suplementados con 30 µg/ml de kanamicina (Km) o 100 µg/ml de ampicilina (Amp) según corresponda al mutante ensayado. Los cultivos fueron incubados durante toda la noche a 37 oC en baño de agua con agitación.
Construcción de mutantes de Salmonella enterica por deleción de los genes invG/invE y ssaJ/ssaK en las SPI-1 y SPI-2, respectivamente
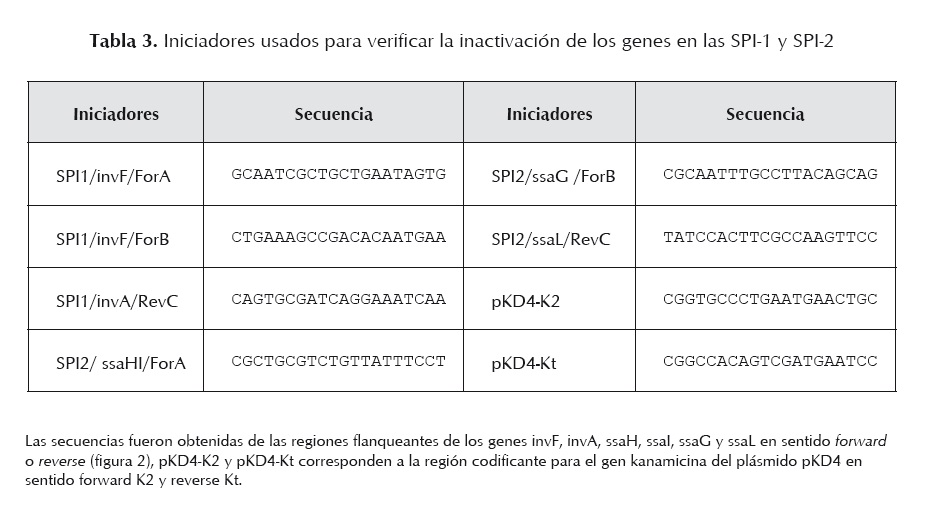
Los mutantes de S. enterica en invG/invE y ssaJ/ssaK fueron construidos utilizando el sistema Red del fago ?, de acuerdo con lo descrito por Datsenko y Wanner (2000). Los iniciadores utilizados para inducir la mutagénesis de los genes invG/invE (SPI-1) y ssaJ/ssaK (SPI-2) y amplificar el gen de resistencia a la kanamicina del plásmido pKD4, se muestran en la tabla 2; estos se diseñaron con secuencias homólogas (36 nucleótidos) a la región del cromosoma adyacente a los genes objeto de deleción [H1 (invF) y H2 (invA) de SPI1 y H1 (ssaI) y H2 (ssaL) de SPI2], de las SPI1 y SPI2 (número de acceso GenBank para SPI1 U08280 y para SPI2 ssaL Y09357, ssaI AJ224892) más la secuencia correspondiente a P1 y P2 del plásmido PKD4 (20 nucleótidos). Las mezclas para la amplificación se prepararon a un volumen final de 25 µl, conteniendo 1 ng de ADN (pKD4), 1,5 U de Taq polimerasa (Biotools®), 0,2 mM de cada dNTP (Invitrogen®), 4 mM de MgCl2 (Biotools®), 1 µM de cada oligonucléotido y 1X de buffer (Biotools®). Las condiciones de amplificación fueron: inicialmente 3 min a 96 oC y luego 30 ciclos: 1,30 min a 94 oC, 2 min 60 oC y 3 min a 72 oC, con un paso de extensión final de 10 min a 72 oC. Los productos amplificados fueron purificados (Wizard® SV Gel and Clean-Up System, Promega®), digeridos con DpnI (New England Biolabs®), nuevamente purificados y resuspendidos en agua libre de DNAsa. Estos productos fueron observados en corridas electroforéticas en geles de agarosa 0,8% (Promega®), teñidos con bromuro de etidio (Sigma®), visualizados bajo LUV y fotografiados. Como marcador de peso molecular se utilizó el fago ? digerido con HindIII (Promega®).
Electrotransformación de cepas de S. enterica
Las cepas de S. enterica fueron preparadas para los ensayos de transformación de acuerdo con lo descrito por Vega y Ayala (2006) y transformadas por electroporación con el plásmido pKD46. Las células fueron pulsadas con 2500 kV y 5 ms e incubadas en medio SOC durante 1 a 2 horas a 30 oC. Las células transformadas fueron seleccionadas en agar LB suplementado con Amp e incubadas a 30 oC. Posteriormente, estas cepas que portaban el plásmido pKD46 se cultivaron en caldo 2YT a 30 oC suplementado con Amp y L-arabinosa (1mM) hasta una DO600nm de 0,6. Estas células fueron preparadas para una transformación adicional con el producto de PCR repurificado inicialmente, bajo las mismas condiciones anteriormente señaladas. Las nuevas células transformadas fueron seleccionadas en agar LB con Km e incubadas a 37 oC. Una vez obtenidas las células mutantes, el plásmido pKD46 se eliminó mediante cultivo en agar LB sin Amp a 43 oC.
Comprobación de la obtención de cepas de S. enterica mutantes
La mutagénesis fue confirmada por PCR utilizando el ADN cromosómico de las células transformadas y los iniciadores que flanquean la secuencia invG/invE y ssaJ/ssaK (tabla 3).
Eliminación del gen KmR de las cepas ?invGE::Km y ?ssaJK::Km S. enterica
Una vez verificada la obtención de mutantes de S. enterica, estas células fueron sometidas a una nueva transformación con el plásmido pCP20, bajo las condiciones señaladas. Las células transformadas fueron seleccionadas en agar LB con Amp a 30 oC. Luego, varias colonias fueron aisladas y subcultivadas sucesivamente en medio no selectivo a 43 oC, de manera de favorecer la pérdida del plásmido. Finalmente, por ensayos de PCR se comprobó que el gen de resistencia KmR del pKD4 había sido eliminado y los genes originales estaban delecionados en las cepas mutadas. En estas pruebas se utilizó el ADN cromosómico de las células transformantes y los iniciadores descritos en la tabla 3, con las mismas características de la mezcla de amplificación antes mencionada. El programa aplicado fue el siguiente: 2 min a 93 oC y 25 ciclos: 1 min a 93 oC, 1 min a 60oC y 1 min a 72 oC, con un paso de extensión final de 10 min a 72 oC.
Resultados
Obtención de cepas de S. enterica mutantes (genes delecionados invG/invE y ssaJ/ssaK en las SPI-1 y SPI-2, respectivamente)
Como paso preliminar para la realización de la mutagénesis, los 12 serotipos de S. enterica de origen clínico y la cepa de referencia (S. Typhimurium SL-1344) fueron inicialmente transformadas con el plásmido pKD46, que porta la recombinasa Red del bacteriófago ?. Posteriormente, todas las cepas fueron sometidas a otro proceso de transformación, con los productos amplificados con los iniciadores diseñados para la mutagénesis: SPI1/invF-H1P1 y SPI1/invA-H2P2, SPI2/ssaI-H1P1 y SPI2/ssaL-H2P2, los cuales amplifican el gen de resistencia a la Km del pKD4 y reconocen las secuencias externas flanqueantes de la región génica, invF - invA y ssaH/ssaI - ssaL, de los genes invG/invE de la SPI-1 y los genes ssaJ/ssaK de la SPI-2, respectivamente. La eficiencia de transformación fue en promedio de 5-10 UFC/ml por cada serotipo de S. enterica. De estas células transformantes se seleccionaron dos clones representativos de cada serotipo de Salmonella, con el objeto de comprobar la correcta sustitución de los genes mencionados, empleando los iniciadores de la tabla 3.
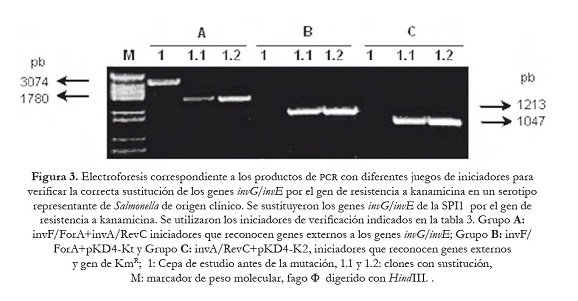
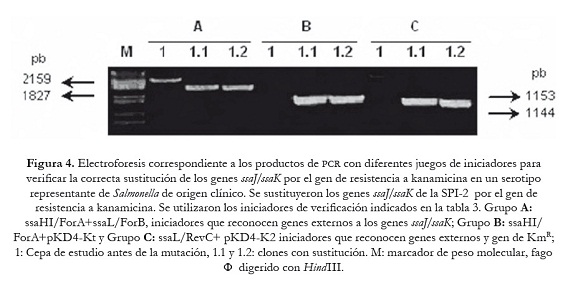
En las figuras 3 y 4, se muestran los productos amplificados que permitieron verificar la correcta sustitución de los genes objeto de mutación en las cepas estudiadas. Dependiendo del juego de iniciadores utilizados, el tamaño de los amplificados varió y coincidió con el valor esperado, en el caso de la mutación en la SPI1 fue de 1780 pb cuando se usaron los iniciadores (invF/ForA+invA/RevC) que reconocen las regiones génicas que flanquean los genes invG/invE (figura 3: A; 1.1 y 1.2). Productos de PCR más pequeños se obtuvieron cuando se emplearon los iniciadores que identifican los genes adyacentes al sitio de mutación (invA-invF) y el gen de KmR: 1213 pb (invF/ForA+pKD4-Kt) y 1047 pb (invA/RevC+pKD4-K2) (figura 3: canales B y C; 1.1 y 1.2). Resultados similares se observaron en la mutagénesis realizada en la SPI2. Se generaron amplicones de 1827 pb con los iniciadores externos (ssaHI/ForA+ssaL/ForB) que reconocen las regiones génicas que flanquean los genes ssaJ–ssaK (figura 4: A; 1.1 y 1.2), mientras que se obtuvieron productos de 1153 pb y 1144 pb con los iniciadores específicos que amplifican los genes adyacentes a ssaJ-ssaK y el gen KmR (figura 4: B y C, canales: 1.1 y 1.2).
Eliminación del gen KmR de las cepas ?invGE::Km y ?ssaJK::Km S. enterica
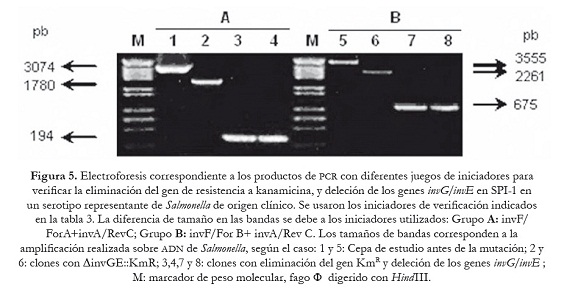
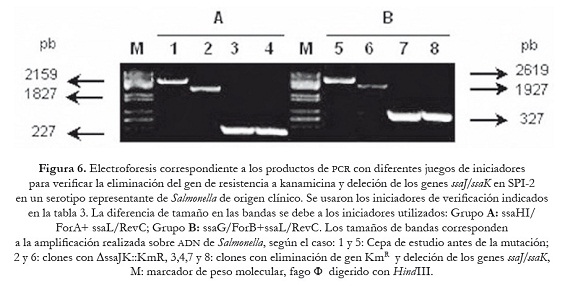
Una vez confirmada la correcta sustitución de los genes que se van a delecionar por el gen de resistencia a Km, estos transformantes fueron sometidos a un último proceso de transformación con el plásmido auxiliar pCP20, que expresa la recombinasa FLP que reconoce los sitios FRT adyacentes al gen de KmR. Para ello se seleccionó un clon por cada serotipo de Salmonella. La selección de las mutantes se realizó en agar LB suplementado con Amp a 30 oC. La eficiencia de transformación fue similar a la obtenida anteriormente (5-10 UFC/ml). Las mutantes fueron sometidas a subcultivos a 43 oC para favorecer pérdida del plásmido, y seleccionadas en agar LB —el mismo número de clones que en el ensayo de sustitución—, y se verificó la correcta pérdida del gen de resistencia que reemplazaba a los genes invG/invE de la SPI-1 y los genes ssaJ/ssaK de la SPI-2, empleando para ello los iniciadores mencionados en la tabla 3. Dependiendo de las parejas de iniciadores utilizados se generaron fragmentos de diferentes tamaños de acuerdo con lo esperado, 194 pb (invF/ForA +invA/RevC) y 675 pb (invF/For B+ invA/Rev C) en los transformantes con deleción de los genes invG/invE de la SPI-1 como se puede apreciar en la figura 5; 227 pb (ssaHI/ForA+ ssaL/RevC) y 327 pb (ssaG/ForB+ssaL/RevC), en los mutantes con eliminación de los genes ssaJ/ssaK de la SPI-2 como se observa en la figura 6.
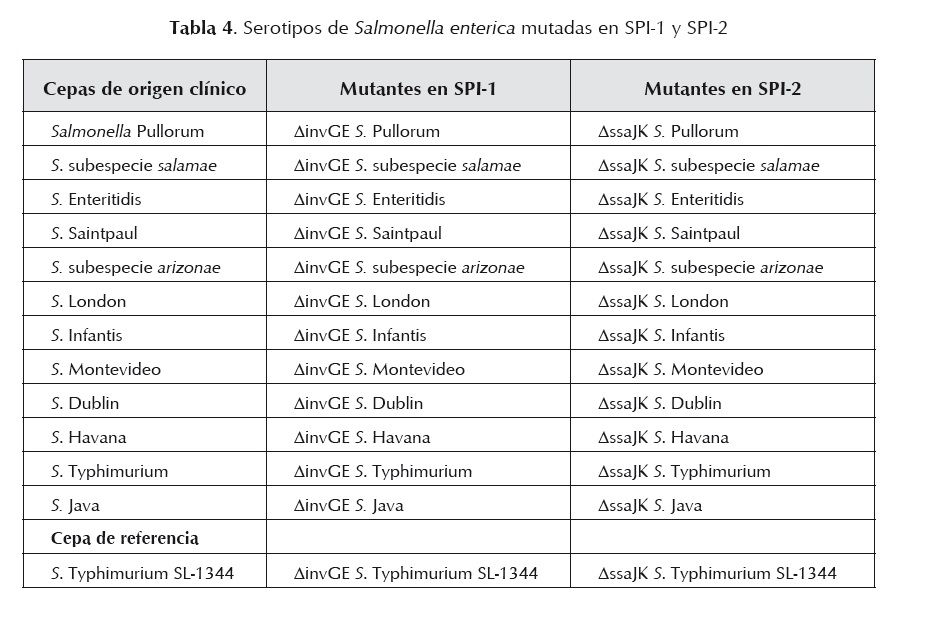
Cada serotipo o subespecie de Salmonella fue sometida en forma independiente al proceso de sustitución y deleción de los genes invG/invE en la SPI-1 y ssaJ/ssaK en la SPI-2. En la tabla 4 se muestra la distribución de las cepas de acuerdo con la mutación realizada.
Discusión
La disposición de técnicas efectivas para realizar mutaciones puntuales en el cromosoma bacteriano contribuye de manera significativa en la comprensión de las implicaciones de diversos genes en la patogenia de un microorganismo (Murphy y Campellone, 2003). Al respecto, el sistema de la recombinasa Red del bacteriófago ?, propuesto por Datsenko y Wanner (2000), ofrece una alternativa rápida y eficiente para realizar mutaciones dirigidas e inactivar genes en el genoma de bacterias Gram- negativas, por medio de recombinaciones homólogas, en un solo paso, utilizando productos de PCR. Los resultados obtenidos en este estudio así lo demuestran; 13 cepas de diversos serotipos de S. enterica fueron delecionadas en forma independiente en los genes invG/invE de SPI-1 y ssaJ/ssaK de SPI-2. Para ello se utilizaron amplicones obtenidos a partir de dos juegos de iniciadores específicamente diseñados para una mutagénesis puntual (SPI1/invF-H1P1 y SPI1/invA-H2P2, SPI2/ssaI-H1P1 y SPI2/ssaL-H2P2).
Los genes deleteados en las cepas estudiadas son considerados no esenciales, debido a que no afectan el desarrollo o la viabilidad de la bacteria. Sin embargo, son genes que se encuentran en las dos principales islas de patogenicidad (SPI1 y SPI2) de Salmonella, y son fundamentales para la virulencia de esta bacteria. Estos genes invG/invE y ssaJ/ssaK codifican para proteínas que participan en la formación de los sistemas de secreción tipo III (SSTIII) en Salmonella y median la invasión y supervivencia intracelular de la bacteria en la célula hospedera. Estudios similares fueron reportados por Murphy y Campellone (2003), quienes con una metodología similar a la descrita en este trabajo, lograron delecionar con precisión genes (eae,tir y el operón eae-cesT-tir) en islas de patogenicidad (O-islands) de Escherichia coli enterohemorrágica (ECEH) y enteropatógena (ECEP). Por otra parte, Klumpp y Fuchs (2007), utilizando el sistema de la recombinasa Red del fago ?, identificaron genes nuevos en la isla genómica SPI-6 de S. Typhimurium, la cual contribuye en la multiplicación de esta bacteria en los macrófagos.
Aunque el sistema de la recombinasa Red del fago ?, permite inactivar por lo menos un gen de interés, como el descrito en este trabajo, la eficiencia de este método ha permitido la deleción hasta de una isla de patogenicidad completa como lo reportan Dieye et al. (2009), quienes lograron obtener mutantes de S. Typhimurium en SPI1 y SPI2. Además, la versatilidad de este sistema ha sido comprobada en este estudio al producir mutaciones sitio-específicas en serotipos de Salmonella de origen clínico diferentes al Typhimurium, Enteritidis o Cholerasuis (Cox et al., 2007; Domínguez-Bernal et al., 2008; Dieye et al., 2009). En este contexto, el sistema de la recombinasa Red ha extendido su utilidad en bacterias diferentes a las de la familia Enterobacteriaceae, tal es el caso de la inactivación del gen aroA en Pasteurella multocida (Zare et al., 2008) y en la modificación y deleción de genes en Vibrio cholerae (Yamamoto et al., 2009).
Conclusiones
La metodología descrita por Datsenko y Wanner (2000), es aplicable para la realización de una mutagénesis dirigida por reemplazo y deleción de genes de virulencia en las SPI1 y SPI2 de diferentes serotipos de S. enterica de origen clínico. Este es el primer reporte del empleo exitoso de esta técnica en serotipos diferentes a S. Typhimurium, Enteritidis y Cholerasuis.
Los resultados obtenidos en este trabajo permitirán estudios futuros in vivo para evaluar la posible atenuación de la virulencia en mutantes de S. enterica, así como aportar nuevos conocimientos sobre los mecanismos genéticos involucrados en la fisiopatogenia de las enfermedades producidas por los serovares estudiados y la posible construcción de cepas para el desarrollo de vacunas.
Agradecimientos
Los autores desean expresar su agradecimiento al doctor Francisco García del Portillo del Centro Nacional de Biotecnología (CNB) Madrid, España, por facilitar parte del material biológico utilizado en este estudio, y al doctor Daniel Vega por su asesoramiento en el desarrollo de la metodología.
Este estudio fue financiado por el proyecto ALFA Bacterialnet (Contrato II-531-FC-FA-FCD-FI), Fundación para el Desarrollo de la Ciencia y la Tecnología (Fundacite) Mérida, Venezuela (Contrato CF-07-10 y CF-09-04); el Consejo de Desarrollo Científico, Humanístico y Tecnológico (CDCHT) de la Universidad de los Andes, Mérida, Venezuela (Códigos FA- 419 - 07 - 07 - B y CVI-ADG-FA-02-97) y el Ministerio de Ciencia e Innovación (Micinn), España (proyecto BFU2006-04574/BMC).
Referencias bibliográficas
1 Beuzón, C. R., Meresse, S., Unsworth, K., Ruiz-Albert, J., Garvis, S., Waterman et al. 2000. Salmonella maintains the integrity of its intracellular vacuole through the action of SifA. The EMBO Journal 19 (13): 3235- 3249. [ Links ]
2 Boyd, F., Li, J., Ochman, H., Selander, R. 1997. Comparative Genetics of the inv-spa Invasion Gene Complex of Salmonella enterica. Journal of Bacteriology 19 (6): 1985-1991. [ Links ]
3 Collazo, C., Zierier, M., Galan, J. 1995. Functional analysis of the Salmonella typhimurium invasion genes invl and invJ and identification of a target of the protein secretion apparatus encoded in the inv locus. Molecular Microbiology 15 (1): 25-38. [ Links ]
4 Cox, M., Layton, S., Jiang, T., Cole, K., Hargis, B., Berghman, L., Bottje, W., Kwon, Y. 2007. Scarless and site-directed mutagenesis in Salmonella enteritidis chromosome. BMC Biotechnology. 7: 59. Disponible en: http://www.biomedcentral.com/1472-6750/7/59 [ Links ]
5 Darwin, K., Miller, V. 1999. Molecular Basis of the Interaction of Salmonella with the Intestinal Mucosa. Clinical Microbiology Reviews 12 (3): 405-428. [ Links ]
6 Datsenko, K. A., Wanner, B. L. 2000. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proceedings of the National Academy of Sciences of the United States of America (PNAS). 97: 6640- 6645. [ Links ]
7 Dieye, Y., Ameiss, K., Mellata, M., Curtiss, R. 2009. The Salmonella Pathogenicity Island (SPI) 1 contributes more than SPI2 to the colonization of the chicken by Salmonella enterica serovar Typhimurium. BMC Microbiology. 9:3. Disponible en: http://www.biomedcentral.com/1471-2180/9/3 [ Links ]
8 Domínguez-Bernal, G., Tierrez, A., Bartolomé, A., Martínez-Pulgarín, S., Salguero, F. J., Orden, J. A., De la Fuente,, R. 2008. Salmonella enterica serovar Choleraesuis derivatives harbouring deletions in rpoS and phoP regulatory genes are attenuated in pigs, and survive and multiply in porcine intestinal macrophages and fibroblasts, respectively. Veterinary Microbiology 130 (3-4): 298-311. [ Links ]
9 Doublet, B., Douard, G., Targant, H., Meunier, D., Madec, J., Cloeckaert, A. 2008. Antibiotic marker modifications of ? Red and FLP helper plasmids, pKD46 and pCP20, for inactivation of chromosomal genes using PCR products in multidrug-resistant strains. Journal of Microbiological Methods, 75: 359-361. [ Links ]
10 Hensel, M. 2004. Evolution of pathogenicity islands of Salmonella enterica. International Journal of Medical Microbiology 294: 95-102. [ Links ]
11 Klumpp, J., Fuchs, T. 2007. Identification of novel genes in genomic islands that contribute to Salmonella typhimurium replication in macrophages. Microbiology 153, 1207-1220. Disponible en: http://mic.sgmjournals.org/cgi/reprint/153/4/1207 [ Links ]
12 Morgan, E. 2007. Salmonella pathogenicity islands. En: Rhen, M, Maskell, D, Mastroeni, P, Threlfall, J. Salmonella molecular biology and pathogenesis. Horizon Bioscience, UK. [ Links ]
13 Murphy, K. C., Campellone, K. G. 2003. Lambda Red-mediated recombinogenic engineering of enterohemorrhagic and enteropathogenic E. coli. BMC [ Links ]
14 Molecular Biology. 4: 11. Disponible en: http://www.biomedcentral.com/1471-2199/4/11. [ Links ]
15 Santoyo, G. 2008. Recombinería en bacterias: ingeniería del ADN usando recombinación homóloga. Revista Latinoamericana de Microbiología 50 (1-2): 38-47. [ Links ]
16 Vega, D., Ayala, J. 2006. The DD-carboxypeptidase activity encoded by pbp4B is not essential for the cell growth of Escherichia coli. Archives of Microbiology 185: 23-27. [ Links ]
17 Vernikos, G., Parkhill, J. 2006. Interpolated variable order motifs for identification of horizontally acquired DNA: revisiting the Salmonella pathogenicity islands. Bioinformatics 22 (18): 2196-2203. [ Links ]
18 Zare, P., Tabatabaei, M., Yousefbeygi, G., Jabbari, A. 2008. Using Red Recombinase and PCR Product for One- Step in-Frame Inactivation of aroA Gene in Pateurella multocida A: 1 and Evaluation of Pathogenicity and Immonogecity. Journal of Animal and Veterinary Advances 7 (9): 1155-1159. [ Links ]
19 Yamamoto, S., Izumiya, H., Masatomo, M., Arakawa, E., Watanabe, H. 2009. Application of ? Red recombination system to Vibrio cholerae genetics: Simple methods for inactivation and modification of chromosomal genes. Gene 438: 57-64. [ Links ]