Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.12 no.2 Bogotá July/Dec. 2010
ARTÍCULO DE INVESTIGACIÓN
Efecto de la biofertilización y los biorreguladores en la germinación y el crecimiento de Carica papaya L.
Effect of biofertilization and bioregulators on germination and growth of Carica papaya L.
M. Constantino1 , R. Gómez-Álvarez2 , J. D. Álvarez-Solís3 , J. Pat-Fernández4 , G. Espín5
1 El Colegio de la Frontera Sur, Villahermosa, Tabasco, México. aconstan1177@gmail.com
2 El Colegio de la Frontera Sur, Villahermosa, Tabasco, México. regomez@ecosur
3 El Colegio de la Frontera Sur, Villahermosa, Tabasco, México. dalvarez@ecosur.mx
4 El Colegio de la Frontera Sur, Villahermosa, Tabasco, México. jpat@ecosur.mx
5 Instituto de Biotecnología, Universidad Autónoma de México, México.
Recibido: marzo 16 de 2010 Aprobado: noviembre 3 de 2010
Resumen
Con el objetivo de incrementar y acelerar el proceso de germinación de las semillas y obtener una alta producción y homogeneidad de plántulas de Carica papaya variedad Maradol en vivero, se evaluó el efecto de tres biofertilizantes aplicados solos o en combinación (Azotobacter chroococcum, Azospirillum brasilense y Glomus intraradices), y un biorregulador del crecimiento vegetal, el ácido giberélico (AG3), en la germinación y el crecimiento vegetal. Se realizó un experimento bajo un diseño completamente al azar con ocho tratamientos y tres repeticiones. A las semillas se les aplicó un pretratamiento germinativo con alternancia de temperatura para superar la dormancia. Los tratamientos simples con A. chroococcum y A. brasilense, incrementaron el porcentaje de germinación a 90,28 y 88,89% respectivamente. Además, con la aplicación de los biofertilizantes y el AG3, la velocidad de germinación se incrementó y el tiempo medio de germinación se redujo. La doble aplicación en semillas y foliar de los biofertilizantes y el AG3 en plántulas mejoró el crecimiento vegetal. La población de A. chroococcum fue mayor cuando se inoculó en combinación con G. intraradices. La prevalencia de colonización de las plántulas inoculadas con G. intraradices varió de 18,53 a 26,67%, con el mayor valor registrado para el tratamiento combinado con A. brasilense. Finalmente, aplicando esta metodología se logró acelerar la germinación, obteniéndose una mayor homogeneidad en la emergencia de las plántulas, disminuyendo así el tiempo de permanencia en el vivero.
Palabras clave: Azospirillum brasilense, Azotobacter chroococcum, Glomus intraradices, ácido giberélico, dormancia.
Abstract
In order to increase and accelerate the process of seed germination and obtain a high yield and homogeneity of papaya seedlings cv. Maradol in nurseries, we evaluated the effect of three biofertilizers applied single or in combination (Azotobacter chroococcum, Azospirillum brasilense and Glomus intraradices) and a plant growth bioregulator, the gibberellic acid 3 (AG3), on the germination and subsequent growth of papaya seedlings. An experimental design completely random with eight treatments and three replications were used. The application of a pre-germinal treatment with alternating temperature had to be applied to seeds to overcome dormancy. Single biofertilization with A. chroococcum and A. brasilense, promoted the germination percentage 90.28 y 88.89% respectively. Germination rate could be enhanced and the mean germination time was reduced with the application of biofertilizer and AG3. Both applications on seeds and leaves of biofertilizers and AG3, had a positive effect on plant growth. The population of A. chroococcum was higher in the combined inoculation with G. intraradices. The prevalence of colonization of plants inoculated with G. intraradices ranged from 18.53 to 26.67%, with the greatest values recorded for the treatment involving combined inoculation with A. brasilense. Finally, with the application of this methodology the seed germination rate was improved, as well as the uniformity of seedlings emergence.
Key words: Azospirillum brasilense, Azotobacter chroococcum, Glomus intraradices, gibberellic acid, dormancy.
Introducción
La producción de papaya (Carica papaya L.) se encuentra entre las principales especies de frutas cultivadas comercialmente en el mundo (Faostat, 2007). En México, la variedad Maradol roja es la de mayor importancia económica, por su alta rentabilidad, y la gran demanda para su consumo en fresco e industrializada, la cual en el año 2007 fue de 7,53 kg per cápita, ocupando el quinto lugar, solo por debajo de frutas como la naranja, el plátano, el limón y la sandía (Secofi-Sniim, 2007). La propagación de esta variedad casi siempre se realiza por semilla, y aunque puede producirse vegetativamente, rara vez se hace en plantaciones comerciales debido a que el costo no se justifica por la vida económicamente corta de la plantación (Malo y Campbell, 1986).
La presencia de una cubierta mucilaginosa denominada sarcotesta, que cubre externamente a las semillas de papaya, puede ocasionar dormancia física (Tokuhisa et al., 2006). La dormancia es definida como la incapacidad de semillas viables e intactas para completar la germinación, bajo condiciones favorables (Bewley, 1997). Para superar la dormancia y promover la germinación de las semillas de papaya se han empleado diversos tratamientos, desde la remoción de la sarcotesta (Tokuhisa, 2006), el remojo en agua (Pérez et al., 1980), secado al sol (Wood et al., 2000), almacenamiento de las semillas a diferentes periodos de tiempo (Aroucha et al., 2005; Tokuhisa et al., 2006), la inmersión de semillas en promotores del crecimiento como el KNO3 (Furatani y Nagao, 1987) y el ácido giberélico (AG3) (Tokuhisa et al., 2006; Bautista-Calles et al., 2008; Andrade-Rodríguez et al., 2008). El tratamiento de semillas con inoculantes microbianos o biofertilizantes también ha sido empleado para promover y acelerar la germinación de semillas. Según Kloepper et al. (1991), ciertas bacterias dentro de las denominadas PGPR (del inglés Plant Growth Promoting Rhizobacteria), o rizobacterias promotoras del crecimiento vegetal, pueden mejorar la germinación de semillas a través de la producción y liberación de algunas sustancias reguladoras del crecimiento vegetal como auxinas, citoquininas o giberelinas en medios químicamente definidos y en asociación con las plantas (Janzen et al., 1992; Cassán et al., 2009).
Las PGPR y los hongos micorrizicos arbusculares (HMA) han sido aplicados en viveros de plantas para mejorar el vigor, la nutrición y la calidad de las plantas (Lovato et al., 1996). Los HMA son bien conocidos por estimular el crecimiento de las plantas hospederas, por el incremento en la toma de nutrientes del suelo, especialmente el fósforo (P), pero también otros elementos como el nitrógeno (N) y micronutrientes (Clark y Zeto, 2000; Ward et al., 2001). Las PGPR, además de la producción de fitohormonas, involucran otros mecanismos a través de los cuales pueden estimular el crecimiento vegetal y mejorar la salud de las plantas, como la fijación de nitrógeno (Glick, 1995), la solubilización de fosfatos (Kumar y Narula 1999), la producción de sustancias antifúngicas (Verma, 2001) y sideróforos (Tindale et al., 2000). También existe evidencia de que las interacciones combinadas entre los HMA y las PGPR pueden incrementar el crecimiento vegetal (Arturson et al., 2006).
Para obtener una alta producción y homogeneidad de plántulas de papaya en vivero es importante incrementar y acelerar el proceso de la germinación de semillas y el establecimiento de las plántulas. El objetivo de este trabajo fue determinar el efecto que tienen tres diferentes biofertilizantes (Azotobacter chroococcum, Azospirillum brasilense y Glomus intraradices), aplicados solos y en combinación, y la aplicación de un biorregulador del crecimiento vegetal (AG3) en tres parámetros de la germinación de semillas y en el crecimiento vegetal de plántulas de C. papaya L. variedad Maradol en fase de vivero.
Materiales y métodos
El trabajo se llevó a cabo en las instalaciones de El Colegio de la Frontera Sur (ECOSUR), Unidad Villahermosa, Tabasco, México. Las plantas crecieron bajo condiciones de vivero a una temperatura media mínima / máxima de 28,5 / 36,5 o.C, con una humedad relativa de 85% y una altitud de 10 msnm.
Material vegetal. Se emplearon semillas C. papaya L. variedad Maradol, colectadas en el mes de febrero, de frutos maduros provenientes de una plantación establecida en el campo experimental de ECOSUR. Las semillas recién sacadas del fruto fueron puestas en agua destilada por 24 horas, y se removió manualmente la sarcotesta (cubierta mucilaginosa que rodea a la testa). Posteriormente, se eliminaron los restos de sarcotesta y las semillas que flotaban se descartaron por considerarse no viables. Las semillas se extendieron en papel formando una sola capa y se secaron durante 3 días en condiciones de sombra a temperatura ambiente (32 o.C), después se colocaron en bolsas de plástico y se almacenaron en refrigeración a 15 ± 2 o.C durante un mes.
Material microbiológico y biorreguladores. En los experimentos se utilizaron dos rizobacterias: Azotobacter chroococcum y Azospirillum brasilense aisladas por el Instituto de Investigaciones Fundamentales en Agricultura Tropical (INIFAT) de La Habana, Cuba, y reproducidas en los laboratorios de ECOSUR. En la producción de los biofertilizantes líquidos, A. chroococcum fue cultivado en medio liquido Ashby enriquecido con NH4NO3 (3 g l-1) y extracto de levadura (0,1 g l-1), mientras que A. brasilense fue crecido en caldo nutriente (Merck) y se mantuvieron con agitación orbital (150 rpm) a 30 oC por 60 horas para A. chroococcum y 48 horas para A. brasilense, hasta obtener una concentración de 1x109 unidades formadoras de colonias por mililitro (ufc ml-1). El inóculo micorrízico empleado fue Glomus intraradices, con una concentración de 3.000 esporas por cada 100 g de sustrato (Biofábrica). La solución de AG3 empleada fue de 500 ppm y se preparó a partir del producto comercial Activol (Valent Biosciences).
Sustrato. El sustrato empleado contenía una mezcla en una proporción de 1:1:1 de arena: suelo: materia orgánica (cascarilla de cacao previamente seca y tamizada). La proporción fue hecha en base a peso (p/p). La esterilización del sustrato se realizó en autoclave a 121 oC por 1 hora por tres días consecutivos. Las características fisicoquímicas del sustrato son: textura franco-arcillo-arenoso (arcilla 25%, limo 21% y arena 54%); pH (H2O): 6,1; materia orgánica: 11,2% (Walkey y Black); N total: 0,6% (semimicro Kjeldhal); P: 66,04 mg/kg-1 (Olsen). Las bases intercambiables fueron extraídas con acetato de amonio 1N a pH 7 y determinado por espectrofotometría de absorción atómica, K+ 2,64 cmol kg-1, Ca2+ 29,44 cmol kg-1, Mg2+ 10,20 cmol kg-1, Na+ 0,46 cmol kg-1.
Tratamiento pregerminativo. Previamente, las semillas fueron desinfectadas sumergiéndolas en una solución de peróxido de hidrógeno al 10% por 3 min y posteriormente fueron lavadas tres veces con agua destilada estéril. El tratamiento de alternancia de temperatura consistió en la inmersión de las semillas en agua destilada estéril a temperatura alternada de 15-35 oC por 24 y 4 horas respectivamente.
Siembra y aplicación de los tratamientos. La siembra de la semilla se realizó en charolas de germinación, sembrándose una semilla por cavidad. Para la inoculación de las rizobacterias y la aplicación de AG3 las semillas previamente se sumergieron respectivamente en cada uno de estos tratamientos por una hora (tabla 1). La concentración de la solución de AG3 empleada fue de 500 ppm. Para la inoculación de G. intraradices se aplicaron directamente en el sustrato 3 g por cavidad antes de la siembra de la semilla (tabla 1). A los 10 días después de la emergencia de las plántulas se realizó una segunda aplicación de las rizobacterias y del AG3 en aplicación foliar, asperjando 1 ml plántula-1 de A. chroococcum a los tratamientos AC y MA+AC, y de A. brasilense a los tratamientos AZOS y MA + AZOS, y un ml plántula-1 de AG3 (250 ppm) al tratamiento AG3. Los tratamientos MA, el tratamiento control y el testigo no recibieron aplicación foliar (tabla 1).
Diseño del experimento de germinación. Se realizó un diseño completamente al azar con 8 tratamientos y 3 réplicas por tratamiento en cada experimento. Cada réplica consistió de una charola de plástico con 24 cavidades. El experimento se realizó por duplicado en dos periodos de tiempo, el primero en abril y el segundo en el mes de julio de 2009. Los tratamientos empleados están descritos en la tabla 1. El testigo recibió el tratamiento pre-germinativo con alternancia de temperatura, mientras que el control no fue sometido a la alternancia de temperatura.
La germinación se evaluó diariamente durante 18 días y se consideró como semilla germinada cuando la radícula había emergido 0,5 mm aproximadamente. Con los datos obtenidos se calculó el porcentaje de germinación (CG), la velocidad de germinación (VG) y el tiempo medio de germinación (TMG). La velocidad de germinación (VG) se obtuvo mediante la fórmula sugerida por Copeland (1976). El tiempo medio de germinación (TMG) es el tiempo promedio requerido para que las semillas germinen, y fue determinado usando la fórmula de Ellis y Roberts (1980). No se encontraron diferencias entre los dos experimentos realizados, por tanto, los datos fueron combinados para los análisis estadísticos.
Diseño del experimento del crecimiento vegetal. Al terminar el experimento de germinación (35 días después de la siembra), se seleccionaron al azar cinco plántulas por cada réplica (n=15 por cada tratamiento), excluyendo las plántulas del tratamiento control ya que solo el 20% de las semillas germinadas lograron sobrevivir. Las variables evaluadas fueron: altura (cm), diámetro del tallo (mm), número de hojas, biomasa fresca (g) y biomasa seca (g). Para determinar la población de A. chroococcum y A. brasilense en los tratamientos que recibieron estas rizobacterias, se muestrearon 5 g de una muestra compuesta de raíces más suelo rizósferico (0,5 g de raíces plántula-1). Se realizó el método de diluciones seriadas, sembrando por triplicado 100 µl de las diluciones 10-2 a 10-4 en cajas de Petri con medio de cultivo Burk libre de nitrógeno, adicionado con ácido nalidixico (20 µg ml-1 de medio de cultivo) para A. chroococcum, mientras que para A. brasilense se empleó el medio de cultivo Rojo Congo. El porcentaje de colonización micorrízica se evaluó usando el método de clareo y tinción de Phillips y Hayman (1978).
Análisis estadístico. Los resultados del porcentaje de germinación previamente fueron transformados a valores de raíz cuadrada debido a la no normalidad de los datos. Posteriormente, estos resultados y los de TMG, VG y las variables de crecimiento vegetal, fueron sometidos a un análisis de varianza (Anova) de una vía. En la figura 1 se presentan datos no transformados. La comparación de medias se realizó con la prueba de rango múltiple de Duncan (p < 0,05), usando el paquete estadístico Statistica versión 8.0.
RESULTADOS Y DISCUSIÓN
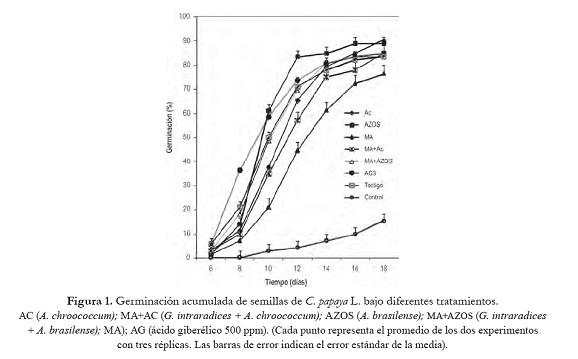
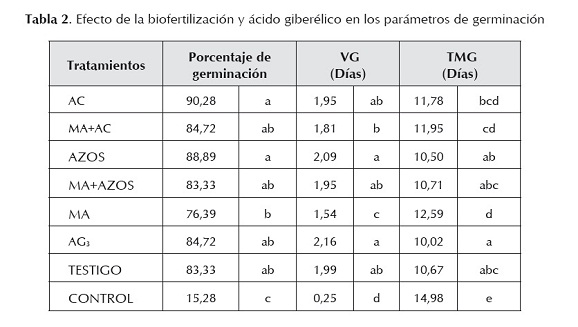
La germinación de semillas de C. papaya L. se inició al sexto día después de la siembra, en los tratamientos que se sometieron a la alternancia de temperatura. Para el tratamiento control, el día inicial de germinación se observó al décimo día (figura 1). La aplicación de la alternancia de temperatura en las semillas de C. papaya L. incrementó positivamente los valores de todos los parámetros de germinación evaluados (porcentaje de germinación, velocidad de germinación y tiempo medio de germinación), en comparación con el tratamiento control, en el cual las semillas no se sometieron a este tratamiento pre-germinativo (tabla 2). El tratamiento con AC registró el mayor porcentaje de germinación (90,28%), pero solo resultó significativamente diferente (p < 0,05) al tratamiento MA (76,39%) y al tratamiento Control (15,28%), los cuales reportaron los valores más bajos de porcentaje de germinación (tabla 2). Esto podría indicarnos que la alternancia de la temperatura fue el principal factor que influyó en la superación de la dormancia y en la promoción de la germinación, más que la aplicación de biofertilizantes y el AG3.
De acuerdo con Vleeshouwers et al. (1995), la temperatura puede inducir o romper la dormancia de las semillas. En C. papaya L. se ha observado una estrecha correlación entre los ciclos de temperatura y la pérdida de la dormancia (Tokuhisa et al., 2006). Los resultados obtenidos aquí sugieren que la germinación de semillas de C. papaya L. mejoran al someterlas a una temperatura menor a la cual germinan antes de la siembra. Resultados similares fueron encontrados por Furatani y Nagao (1989), al someter las semillas a un tratamiento de preacondicionamiento a 24 oC antes de la germinación a 32 oC. De acuerdo con Carvalho y Nacagawa (2000), la acción de bajas temperaturas, aunada a una alta humedad, está relacionada con cambios en el equilibrio entre hormonas inhibidoras (ácido absicico) y promotoras de la germinación (giberelinas).
La eliminación de la sarcotesta mejoró la germinación, ya que esta puede actuar como una barrera evitando la lixiviación de las sustancias inhibidoras de la germinación (principalmente compuestos fenólicos), durante la inmersión de las semillas en agua (Tokuhisa et al., 2006). La presencia de compuestos fenólicos en la sarcotesta y en la esclerotesta también pueden impedir la germinación (Reyes et al., 1980; Tokuhisa et al., 2007), ya que estos compuestos consumen oxígeno durante el proceso de oxidación restringiendo la entrada de oxígeno que llega al embrión (Bewley y Black, 1994). Por otra parte, en semillas de diferentes especies la dormancia es ocasionada por un balance hormonal desfavorable entre promotores de crecimiento como las giberelinas (GA) e inhibidores de la germinación, como el ácido abcísico (ABA) (Bewley, 1997).
La máxima velocidad de germinación se registró para los tratamiento AG3 y AZOS (8,99 % y 8,94% de semillas día-1 respectivamente) pero solo resultaron significativamente diferentes (p < 0,05) a los tratamientos AC+MA, AC y Control los cuales registraron la velocidad de germinación más bajas con 7,53, 6,40 y 1,05% de semillas día-1 respectivamente (tabla 2). El tiempo promedio para la germinación de las semillas (TMG), se redujo de manera significativa a 10 días en las semillas que fueron tratadas con AG3, AZOS, MA+AZOS, y Testigo en comparación con los demás tratamientos que reportaron valores desde 11 días (AC y AC+MA), 12 días (MA) y 14 días (control) (tabla 2).
El AG3 es uno de los biorreguladores más usados comercialmente, posee más de un sitio de acción en la estructura de la semilla y está directamente relacionado con la terminación de la latencia del embrión, con la velocidad de germinación de semillas y el crecimiento inicial de las plántulas (Hartmann y Kester, 1987). En los resultados de la tabla 2 se puede observar que la aplicación de 500 ppm de AG3 mejoró el porcentaje de germinación, la velocidad y el tiempo medio de germinación en comparación con el control, aunque no se encontraron diferencias significativas con el testigo. De acuerdo con Furatani y Nagao (1987) y Andrade-Rodríguez et al. (2008) la aplicación de 600 ppm de AG3 incrementó el porcentaje de germinación de semillas de papaya. En frutales como el aguacate (Persea americana Mill.) y kiwi (Actinidia deliciosa Chev.), la aplicación de AG3 también ha registrado efectos positivos en el porcentaje de germinación de semillas (Sauls y Campbell, 1980; Celik et al., 2006).
Asimismo, diversos autores han encontrado que al aplicar Azotobacter y Azosprillum a semillas antes de la siembra, se mejora la germinación y el crecimiento de plantas, debido a que estos géneros de bacterias, aparte de tener la capacidad de fijar nitrógeno atmosférico, también sintetizan sustancias biológicamente activas como aminoácidos, vitaminas, ácido indol acético (AIA) y giberelinas en cultivos puros (González-López et al., 2005; Perrig et al., 2007). De acuerdo con Nezarat y Gholami (2009), la aplicación de las rizobacterias, A. brasilense, A. lipoferum, P. putida y P. fluorescens a semillas de maíz, incrementó el porcentaje de germinación. En semillas de chile habanero, la aplicación de Azospirillum sp. aceleró el proceso de germinación en 24 horas (Canto-Martín et al., 2004). Para romper la dormancia de las semillas de C. papaya L. fue necesario someterlas al tratamiento de alternancia de temperatura, y aunque la aplicación de los biofertilizantes y el AG3 incrementaron los parámetros de germinación, estos resultados no fueron significativamente diferentes al testigo, el cual solo recibió la alternancia de temperatura.
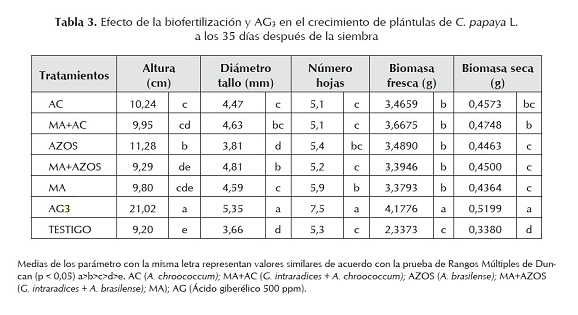
El ácido giberélico también se ha empleado para aumentar el crecimiento vegetal de plántulas y reducir el tiempo de la etapa en vivero, en diversos frutales entre ellos papaya (C. papaya L.) (Andrade-Rodríguez et al., 2008), manzana golden (Spondias dulcis Parkinson), lima o limoncillo (Melicoccus bijugatus Jacq.), tamarindo (Tamarindus indica L.), chicozapote (Manilkara zapota L.) (Morales-Payan y Santos, 1997 a, b). Los resultados obtenidos en este trabajo demostraron que las plántulas generadas a partir de semillas tratadas con AG3 y que fueron asperjadas foliarmente con 1 ml plántula-1 de AG3 (250 ppm), incrementaron de forma significativa (p < 0,05%) todos los parámetros de crecimiento evaluados, en comparación con los otros tratamientos (tabla 3). Resultados similares fueron encontrados por Andrade-Rodríguez et al. (2008), en plántulas de papaya emergidas de semillas tratadas con una solución de 1 mM (equivalente a 346,38 ppm) de AG3, obteniéndose un incremento en la altura y en el número de hojas en comparación con el tratamiento testigo que solo recibió agua destilada.
La doble inoculación (semilla y foliar) de A. chroococcum y A. brasilense, y la aplicación de G. intraradices solos o en combinación, registraron valores de biomasa fresca y seca significativamentes mayores con respecto al tratamiento testigo (tabla 3). Por otra parte, no se encontraron diferencias significativas cuando se aplicó A. chroococcum simple (AC) o en combinación con G. intraradices (MA) en ninguno de los parámetros de crecimiento, pero cuando se aplicó A. brasilense la altura de las plántulas se incrementó significativamente en comparación a cuando se aplicó en combinación con G. intraradices. Por otra parte, la aplicación simple de G. intraradices no mostró diferencias significativas en la altura ni en la biomasa fresca de las plántulas cuando se aplicó en combinación con A. chroococcum y A. brasilense. En cuanto a la biomasa seca para A. chroococcum la aplicación combinada con G. intraradices incrementó significativamente (p < 0,05) su población, en comparación con su aplicación individual. Similarmente, la aplicación combinada de A. brasilense y G. intraradices incrementó de forma positiva el diámetro de tallo de las plántulas en comparación a cuando se aplicó solamente G. intraradices. Resultados que confirman el efecto positivo de la biofertilización foliar con Azotobacter en cultivos como el arroz, han sido reportados por Kannaiyan et al. (1980), los cuales tuvieron incrementos en el rendimiento en grano en este cultivo con la aplicación de esta rizobacteria.
Los resultados obtenidos demuestran que la aplicación conjunta de las PGPR con HMA promueve algunos, pero no todos, los parámetros del crecimiento vegetal. Similarmente, en un trabajo realizado por Alarcón et al. (2002) encontraron que la aplicación combinada de A. brasilense y micorrizas en plántulas de papaya, incrementó solo los valores de biomasa seca y el área foliar en comparación con las plántulas no micorrizadas. En cultivos como el maíz (Zea mays L.) (Elgala et al., 1995) y lechuga (Lactuca sativa L.) (Brown y Carr, 1984), la aplicación combinada de A. chroococcum y micorrizas también incrementó algunos parámetros de crecimiento vegetal evaluados.
De acuerdo a Allan et al. (2000), las semillas de papaya variedad Solo, contienen una importante reserva de nutrientes, específicamente de N y P. Además, los altos contenidos de N y P determinados en el sustrato empleado, podrían haber influido en la escasa respuesta a los tratamientos evaluados. Estos factores podrían explicar por qué en esta etapa temprana de crecimiento, las semillas que no recibieron ningún tratamiento de biofertilización o de AG3 no difirieron significativamente en algunos parámetros de crecimiento evaluados (tabla 3). Por otra parte, se ha observado que las etapas iniciales después de la inoculación con HMA no afectan significativamente el crecimiento vegetal, pero después crece mucho más rápido que las plantas no micorrizadas (Manjunat y Bagyaraj, 1981), lo cual podría explicarse al tiempo que requieren las esporas e hifas para infectar y ramificarse dentro de las raíces y para establecer una relación simbiótica con las plantas (Manjunat y Bagyaraj, 1981).
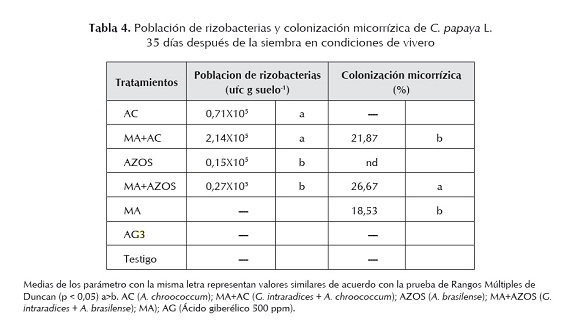
Entre las PGPR y los HMA pueden establecerse diversos tipos de relaciones, desde relaciones benéficas, neutrales o perjudiciales. Estas rizobacterias pueden influenciar la formación y función de las micorrizas. De igual forma, las micorrizas pueden afectar cuantitativa y cualitativamente las poblaciones microbianas (Azcón-Aguilera y Barea, 1992, 1995; Barea et al., 2004; Johansson et al., 2004). A los 35 días después de la siembra las poblaciones de ambas rizobacterias lograron establecerse en la rizosfera de C. papaya L. Para A. chroococcum la aplicación combinada con G. intraradices incrementó significativamente (p < 0,05) su población que cuando esta rizobacteria se aplicó de forma simple, mientras que para A. brasilense no se encontraron diferencias significativas cuando se aplicó de forma simple o en combinación con G. intraradices (tabla 4).
En diversos trabajos se ha demostrado que la papaya es una especie micotrófica, es decir, dependiente de la inoculación micorrízica (Jaizme-Vega y Azcón, 1995). En especies altamente micotróficas como la cebolla, se ha observado infección micorrízica con hifas internas y presencia de arbúsculos a los 15 días después de la siembra, con un incremento progresivo en el porcentaje de infección a los 35 días (Manjunath y Bagyaraj, 1981). La evaluación de la infección micorrízica en raíces de C. papaya L. a los 35 días después de la inoculación mostró que el tratamiento combinado de HMA con A. brasilense presentó el mayor porcentaje de infección (26,67%) y difirió significativamente (p < 0,05) con los tratamientos restantes que también recibieron HMA. La aplicación simple de HMA no difirió significativamente cuando se aplicó en combinación con A. chroococcum, pero sí en la combinación con A. brasilense (tabla 4). Se ha confirmado que la respuesta de la planta a la inoculación con HMA depende del nivel de fertilidad del suelo, de la planta hospedera y del hongo (Sharda y Rodrigues, 2008).
El bajo porcentaje de colonización micorrizíca registrado en todos los tratamientos pudo haber sido ocasionado por el alto contenido de fósforo en el sustrato (66 mg kg-1). Niveles altos o muy bajos de fósforo según Koide (1991), pueden reducir la infección y colonización de la raíz. De acuerdo con Trindade et al. (2001), altas dosis de fósforo disponible afectaron la eficiencia de los HMA para colonizar las raíces de cuatro variedades de papaya, recomendando además, que una dosis de 12 a 16 mg dm3 de fósforo es suficiente para incrementar la colonización micorrizíca. Aunque el nivel de fósforo más adecuado dependerá de la especie vegetal y el hongo (Graham et al., 1996).
Conclusiones
La dormancia presente en las semillas de C. papaya L. se eliminó con la aplicación de alternancia de temperatura de 15/36 o.C por 24 y 4 horas respectivamente. Asimismo, la inoculación de semillas con microorganismos y AG3, demostró ser un método potencial para la promoción de la germinación y emergencia de plántulas, aunque en este trabajo no lograron superar significativamente al tratamiento que solo recibió alternancia de temperatura.
El crecimiento vegetal de C. papaya L. puede ser mejorado con la doble aplicación (en semillas y foliar) de los biofertilizantes y el AG3, bajo estas condiciones experimentales. Igualmente, la aplicación combinada de las rizobacterias con G. intraradices mostró un efecto sinérgico en algunos parámetros del crecimiento vegetal, como la biomasa seca y el diámetro del tallo.
Finalmente, a través de este procedimiento sencillo se logró disminuir el tiempo de permanencia en el vivero de las plántulas de C. papaya L., lo que podrá retribuir en la disponibilidad de plántulas de calidad y un mejor establecimiento al trasplante en campo.
Referencias bibliográficas
1 Akbari, G. A., Arab, S. M., Alikhani, H. A., Allahdadi, I., Arzanesh, M. H. 2007. Isolation and Selection of Indigenous Azospirillum spp. and The IAA of Superior Strains Effects on Wheat Roots. World Journal of Agricultural Sciences. 3: 523-529. [ Links ]
2 Alarcón, A., Davies, F. Jr., Egilla, J. N., Fox, T. C., Estrada-Luna, A. A., Ferrera-Cerrato, R. 2002. Short term effects of Glomus claroideum and Azospirrillum brasilense on growth and root acid phosphatase activity of Carica papaya L. under phosphorous stress. Revista Latinoamericana de Microbiología 44: 31-37. [ Links ]
3 Allan, P., Taylor, N. J., Dicks, H. M. 2000. Fertilization of Solo papayas with nitrogen, phosphorus and potassium. Acta Horticulturae 511: 27-33. [ Links ]
4 Andrade-Rodríguez, M., Ayala-Hernández, J. J., Alia-Tejacal, I., Rodríguez-Mendoza, H., Acosta-Durán, C. M., López-Martínez, V. 2008. Efecto de promotores de la germinación y sustratos en el desarrollo de plántulas de papayo. Revista de la Facultad de Agronomía 25: 617-635. [ Links ]
5 Aroucha, E. M. M., Silva, R. F., Oliveira, J. G., Viana, A. P., Gonzaga, M. P. 2005. Época de colheita e período de repouso dos frutos de mamão (Carica papaya L.) cv. Golden na qualidade fisiológica das sementes. Ciência Rural, Santa Maria 35: 537-543. [ Links ]
6 Artursson, V., Finlay, R. D., Jansson, J. K. 2006. Interactions between arbuscular mycorrhizal fungi and bacteria and their potential for stimulating plant growth. Environmental Microbiology 8: 1-10. [ Links ]
7 Azcón-Aguilar, C., Barea, J. M. 1992. Interactions between mycorrhizal fungi and other rhizosphere micro-organisms. In: Allen MJ, ed. Mycorrhizal functioning: an integrative plant-fungal process. New York: Chapman & Hall. 163-198. [ Links ]
8 Azcón-Aguilar, C., Barea, J. M. 1995. Saprophytic growth of arbuscular-mycorrhizal fungi. In: Hock B, Varma A, eds. Mycorrhiza structure, function, molecular biology and biotechnology. Heidelberg, Germany: Springer-Verlag. pp. 391-407. [ Links ]
9 Barea, J. M. Azcón, R. Azcón-Aguilar, C. 2004. Mycorrhizal fungi and plant growth promoting rhizobacteria. In: Varma A, Abbott L, Werner D, Hampp R, eds. Plant surface microbiology. Heidelberg, Germany: Springer-Verlag. pp. 351-371. [ Links ]
10 Bautista-Calles, F., Carrillo-Castañeda, G., Villegas-Monter, A. 2008. Recuperación de la alta capacidad de germinación de la semilla de papaya mediante la tecnología de preacondicionamiento y biorreguladores. Agrociencia 42: 817-826. [ Links ]
11 Bewley, J. D., Black, M. 1994. Seeds: physiology of development and germination. 2. ed. New York: Plenum Press. pp. 445. [ Links ]
12 Bewley, J. D. 1997. Seed germination and dormancy. The Plant Cell 9: 1055-1066. [ Links ]
13 Brown, M. E., Carr, G. R. 1984. Interactions between Azotobacter chroococcum and vesicular-arbuscular mycorrhiza and their effects on plant growth. Journal of Applied Bacteriology 56: 429-437. [ Links ]
14 Canto-Martín, J. C., Medina, P. S., Morales, A. D. 2004. Efecto de la inoculación con Azospirillum sp. en plantas de chile habanero (Capsicum chinense Jaquin). Tropical and Subtropical Agroecosystems. 4: 21-27. [ Links ]
15 Carvalho, N. M., Nakagawa, J. 2000. Sementes, ciencia, tecnología e produção. 4 ed. Jabuticabal: FUNEP. pp. 588. [ Links ]
16 Cassán, F., Perrig, D., Sgroy, V., Masciarelli, O., Penna, C., Luna, V. 2009. Azospirillum brasilense Az39 and Bradyrhizobium japonicum E109, inoculated singly or in combination, promote seed germination and early seedling growth in corn (Zea mays L.) and soybean (Glycine max L.). European Journal of soil biology 45: 28-35. [ Links ]
17 Celik, H., Zenginbal, H., Ôzcan, M. 2006. Enhancing germination of kiwifruit seeds with temperature, medium and gibberellic acid. Horticultural Science 33: 39-45. [ Links ]
18 Clark, R. B., Zeto, S. K. 2000. Mineral acquisition by arbuscular mycorrhizal plants. Journal of Plant Nutrition 23: 867-902. [ Links ]
19 Copeland, L. O. 1976. Principles of seed science and technology, Burges Pub. Co. U.S.A. Pp. 55-200. [ Links ]
20 Elgala, H. M,. Ishac, Y. Z., Abdel-Monem, M., El-Ghandour, I.A.I.; Huang, P.M.; Berthelin, J. Bollag, J. M. McGill, W. B. Page, A. L. 1995. Effect of single and combined inoculation with Azotobacter and VA mycorrhizal fungi on growth and nutrient content of maize and wheat plants. Environmental Impact of Soil Component Interaction 2: 109-116. [ Links ]
21 Ellis, R. H. Hong, T. D., Roberts, E. H. 1991. Effect of storage temperature and moisture on the germination of papaya seeds. Seed Science Research 1: 69-72. [ Links ]
22 FAOSTAT, 2007. Base de datos (en línea). Disponible en: http://faostat.fao.org. Consultado en febrero de 2010. [ Links ]
23 Furatani, S. C., Nagao, M. A. 1987. Influence of temperature, KNO3, GA3 and seed drying on emergence of papaya seedlings. Scientia Horticulturae 32: 67-72, 1987. [ Links ]
24 Furatani, S. C., Nagao, M. A. 1989. Influence of preconditioning temperatures on papaya seed germination. Journal of Hawaii and Pacific Agriculture 2: 22-23. [ Links ]
25 Glick, B. R. 1995. The enhancement of plant growth by free-living bacteria. Canadian Journal of Microbiology 41: 109-117. [ Links ]
26 González-López, L., Rodelas, B., Pozo, C., Salmerón-López, V., Martínez-Toledo, M.V. Salmerón, V. 2005. Liberation of amino acids by heterotrophic nitrogen fixing bacteria. Amino Acids 28: 363-367. [ Links ]
27 Graham, J. H., Linderman, R. G., Menge, J. A. 1982. Development of external hyphae by different isolates of mycorrhizal Glomus spp. In relation to root colonization and growth of Troyer citrange. New Phvtologist. 91: 183-189. [ Links ]
28 Hartmann, H. T., Kester, E. 1987. Propagación de plantas: principios y prácticas. Ed. CECSA. México Pp. 759. [ Links ]
29 Jaizme-Vega, M. C., Azcón, R. 1995. Response of some tropical and subtropical cultures to endomycorhizal fungi. Mycorrhiza 5: 213-217. [ Links ]
30 Janzen, R. A., Rood S. B., Dormaar, J. F., McGill, W. B. 1992. Azospirillum brasilense produces gibberellin in pure culture on chemically defined medium and in co-culture on straw. Soil Biology and Biochemestry 24: 1061-1064. [ Links ]
31 Johansson, J. F., Paul L. R., Finlay R. D. 2004. Microbial interactions in the mycorrhizosphere and their significance for sustainable agriculture. FEMS Microbiology Ecology 48: 1-13. [ Links ]
32 Kannaiyan, S., Govindarajan, K., Lewin, H. D. 1980. Effect of foliar spray of Azotobacter chroococcum on rice crop. Plant and soil 6: 487-490. [ Links ]
33 Kloepper, J. W., Zablokovicz, R. M., Tipping, E. M., Lifshitz, R. 1991. Plant growth promotion mediated by bacterial rhizosphere colonizers. In D. L. Keister & P. B. Cregan (eds.). The rhizosphere and plant growth (Pp. 315-326). The Netherlands: Kluwer Academic Publishers. [ Links ]
34 Koide, R. T. 1991. Nutrient supply, nutrient demand and plant response to mycorrhizal infection. New Phytologist 117: 365-386. [ Links ]
35 Kumar, V., Narula, B. 1999. Solubilization of inorganic phosphates and growth emergence of wheat as affected by A. chroococcum mutants. Biology and Fertility of Soils 28: 301-305. [ Links ]
36 Lovato, P. E., Gianinazzi-Pearson, V., Trouvelot, A., Gianinazzi, S. 1996. The state of art of mycorrhizas and micropropagation. Advances in Horticultural Science 10: 46-52. [ Links ]
37 Malo, S. E., Campbell, C. W. 1986. The papaya. Gainesville, Fla: University of Florida. (Cooperative Extension Service Fruit Crops Fact Sheet FC - 11). [ Links ]
38 Manjunath, A., Bagyaraj, D. J. 1981. Intensity of Mycorrhizal Infection and response of onion at different stages of growth. Plant and soil 63: 295-298. [ Links ]
39 Morales-Payan, J. P., Santos, B. M. 1997a. Effect of nitrogen, gibberellic acid, triadimefon, and kinetin on the seedling growth of sapodilla (Achras sapota) and tamarind (Tamarindus indica ). HortScience 32: 437. [ Links ]
40 Morales-Payan, J. P., Santos, B. M. 1997b. Effect of gibberellic acid 3 and nitrogen on the seedlings of the tropical fruits Malpighia punicifolia, Spondias dulcis, and Melicoccus bijugatus. HortScience 32: 602-603. [ Links ]
41 Nezarat, S., Gholami, A. 2009. Screening plant growth promoting rhizobacteria for improving seed germination, seedling growth and yield of maize. Pakistan Journal of Biological Science 12: 26-32. [ Links ]
42 Pérez, A., Reyes, M. N., Cuevas, J. 1980. Germination of two papaya varieties: effect of seed aeration, K-treatment, removing of the sarcotesta, high temperature, soaking in distilled water and age of seed. Journal of Agriculture of the University of Puerto Rico 64: 173-180. [ Links ]
43 Perrig, D., Boiero, L., Masciarelli, O., Penna, C., Ruiz, O., Cassan, F., Luna, V. 2007. Plant growth promoting compounds produced by two agronomically important strains of Azospirillum brasilense, and their implications for inoculant formulation. Applied Microbiology and Biotechnology 75: 1143-1150. [ Links ]
44 Phillips, J. M., Hayman D. S. 1970. Improved procedures for clearing roots and staining parasitic and vesicular arbuscular mycorrhizal fungi for rapid assessment to infection. Transactions of the British Mycological Society 55: 158-161. [ Links ]
45 Revillas, J. J., Rodelas, B., Pozo, C., Martínez-Toledo, M. V., González-López, J. 2000. Production of B-group vitamins by two Azotobacter strains with phenolic compounds as sole carbon source under diazotrophic and adiazotrophic conditions. Journal of Applied Microbiology 89: 486-493. [ Links ]
46 Reyes, M. N., Pérez, A., Cuevas, J. 1980. Detecting endogenous growth regulators on the sarcotesta, sclerotesta, endosperm and embryo by paper chromatography on fresh and old seeds of two Papayas varieties. Journal Agriculture University of Puerto Rico 64: 167-172. [ Links ]
47 Sauls, J. W., Campbell, C. W. 1980. Avocado seed germination studies. Proceedings of the Florida State Horticultural Society 93: 153-154. [ Links ]
48 SECOFI-SNIIM, 2007. Consumo nacional aparente de productos agrícolas seleccionados. Disponible en: http://www.secofi-sniim.gob.mx. Consultado en febrero de 2010. [ Links ]
49 Sharda, W. K., Rodrigues, B. F. 2008. Ecology of arbuscular mycorrhizal fungi associated with Carica papaya L. in agro-based ecosystem of Goa, India. Tropical and Subtropical Agroecosystems 8: 265-278. [ Links ]
50 Tindale, A. E., Mehrotra, M., Ottem, D., Page, W. J. 2000. Dual regulation of catercholate siderophore biosynthesis in Azotobacter vinelandii by iron and oxidative stress. Microbiology 146: 1617-1626. [ Links ]
51 Tokuhisa, D., Días, D. C. F. S., Alvarenga, E. M., Días, L. A. S., Marin, S. L. D. 2006. Tratamientos para Superação Da Dormência Em Sementes De Mamão. Revista Brasileira de Sementes 29: 131-139. [ Links ]
52 Tokuhisa, D., Dos Santos, D. D. C. F., Mantovani, A. E., Hilst, P. C., Demuner, A. J. 2007. Compostos fenólicos inibidores da germinação em sementes de mamão (Carica papaya L.). Revista Brasileira de Sementes 29: 180-188. [ Links ]
53 Trindade, A. V., Siqueira, J. O., de Almedia, F. P. 2001. Dependência micorrízica de variedades comerciais de mamoeiro. Pesq. agropec 12: 1485-1494. [ Links ]
54 Verma, S., Kumar, V., Narula, N., Merbach, W. 2001. Studies on in vitro production of antimicrobial substances by Azotobacter chroococcum isolates/mutants. Journal of Plant Diseases and Protection 108: 152-165. [ Links ]
55 Vleeshouwers, L. M., Bouwmeester, H. J., Karssen, C. M. 1995. Redefining seed dormancy: an attempt to integrate physiology and ecology. Journal of Ecology 83: 1031-1037. [ Links ]
56 Ward, N. I., Stead, K., Reeves, J. 2001. Impact of endomycorrhizal fungi on plant trace element uptake and nutrition. The Nutrition Practitioner 32: 30-31. [ Links ]
57 Wood, C. B., Pritchard, H. W., Amritphale, D. 2000. Desiccation induced dormancy in papaya (Carica papaya L.) is alleviated by heat shock. Seed Science Research 10: 135-145. [ Links ]