Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.12 no.2 Bogotá July/Dec. 2010
ARTÍCULO CORTO
Efecto de la densidad de inoculación en la formación y morfología de los embriones somáticos de plátano (Musa spp. AAAB, cv. híbrido FHIA-21)
Effect of inoculum density on formation and morphology of plantain somatic embryos (Musa spp. AAAB, cv. Hybrid ‘FHIA-21’)
Leyanis García-Águila1 , Rafael Gómez-Kosky1 , Yelenys Alvarado-Capó1 , Zoe Sarría y Maritza Reyes1
1 Instituto de Biotecnología de las Plantas, Universidad Central "Marta Abreu" de Las Villas, Cuba. leyanis@ibp.co.cu
Recibido: febrero 4 de 2010 Aprobado: noviembre 10 de 2010
Resumen
La embriogénesis somática constituye una interesante propuesta para la propagación masiva de plantas del cultivar híbrido FHIA-21 (Musa AAAB). Sin embargo, se caracteriza por ser un proceso asincrónico, dado por la presencia de embriones somáticos en diferentes etapas de desarrollo ontogénico. La reducción de la asincronía es un aspecto importante para la utilización de este sistema de regeneración en la propagación de plantas. Esta investigación se realizó con el objetivo de determinar el efecto de la densidad de inoculación sobre la formación y el desarrollo morfológico homogéneo de los embriones somáticos del cv. FHIA-21. Con este propósito se adicionaron 0,5; 1,0; 1,5 y 2,0 g de masa fresca (gMF) de agregados celulares embriogénicos en Erlenmeyers (250 ml), que contenían 30 ml de medio de cultivo líquido. Las evaluaciones se realizaron a los 30 días de cultivo con la determinación del número y la longitud de los embriones somáticos (mm). Además de una descripción morfológica e histológica de estos. Los resultados mostraron el efecto regulatorio de la densidad de inoculación en la formación y el desarrollo morfológico de los embriones somáticos. La mayor formación de embriones con un desarrollo morfológico homogéneo se produjo en 1,5 gMF de densidad de inoculación. Esta proporcionó un 86,4% de embriones con una longitud de 0,21 a 4,0 mm, y el estudio de las secciones histológicas mostró evidencias histológicas de la etapa globular. La sincronización durante la formación y el desarrollo de los embriones somáticos del cv. FHIA-21 aumentó la eficiencia del proceso de embriogénesis somática.
Palabras clave: histología, morfología, embriogénesis somática, sincronización.
Abstract
Somatic embryogenesis is an interesting proposal for mass propagation of plants from the FHIA-21 (Musa AAAB). However, it is characterized by an asynchronous process, due to the presence of somatic embryos at different stages of ontogenetic development. Reduction of asynchrony is an important aspect to use this system of regeneration in plant propagation. Effect of inoculation density on the formation and uniform morphological development of somatic embryos of cv. ‘FHIA-21’ was determine by adding 0.5, 1.0, 1.5 and 2.0 g of fresh mass (gMF) of embryogenic cell aggregates, in Erlenmeyer flasks (250 ml) containing 30 ml liquid culture medium. Evaluations were made within 30 days of culture determining the number and length of somatic embryos (mm). Also, morphological and histological descriptions of these were analyzed. Results showed the regulatory effect of inoculation density on the formation and morphological development of somatic embryos. The biggest formation of embryos with a uniform morphological development occurred in 1.5 gMF inoculation density. This provided 86.4% of embryos with a length of 0.21 to 4.0 mm and the study of histological sections showed histological evidence of the globular stage. Synchronization during the formation and development of somatic embryos cv. FHIA-21 increased the efficiency of somatic embryogenesis.
Key words: Histology, morphology, somatic embryogenesis, synchronization.
Introducción
Los bananos y plátanos se encuentran ampliamente distribuidos en el mundo y son un componente importante en la alimentación de millones de personas. En el año 2008 la producción mundial fue de 125’049.265 toneladas métricas, y de ellas el 27,46% correspondieron a cultivares de plátano (Faostat, 2010). Este cultivo es afectado por varias enfermedades fúngicas, dentro de las cuales se destaca como la más nociva la Sigatoka negra (Mycosphaerella fijiensis Morelet). Es por ello que la introducción de genotipos resistentes y el uso del cultivo in vitro para su propagación contribuirían al aumento de los niveles de producción.
El cultivar de plátano FHIA-21 (AAAB) se introdujo en Cuba por su resistencia a la enfermedad Sigatoka negra y por presentar adecuadas características agronómicas y organolépticas (Orellana et al., 1999). Su propagación in vitro se ha efectuado a partir del cultivo de ápices meristemáticos, o sea por la vía organogénica de regeneración. Sin embargo, el bajo coeficiente de multiplicación y el crecimiento de brotes en forma de rosetas (García et al., 2002) limitaron su propagación. La utilización de la embriogénesis somática pudiera solucionar esta problemática debido al potencial ilimitado de multiplicación secundaria o recurrente de los embriones somáticos (ES). Su principal desventaja radica en la asincronía del proceso, dada la presencia de ES en diferentes etapas de desarrollo ontogénico. La sincronización del proceso evitaría las operaciones de selección de los ES con características adecuadas para su posterior multiplicación, maduración, geminación y conversión de las plantas en condiciones ex vitro (Tonon et al., 2001; Barry-Etienne et al., 2002; Celestino et al., 2005).
En el cv. FHIA-21 (AAAB), Daniels et al. (2002) desarrollaron un protocolo de transformación genética utilizando la embriogénesis somática como sistema de regeneración de plantas. Estos resultados sentaron las bases para la formación, maduración y germinación de los ES en medio de cultivo semisólido. Sin embargo, la utilización de medios de cultivo líquido aumenta la eficiencia del proceso debido a sus beneficios adicionales, como la reducción de los costos por la ausencia del agente gelificante y la posibilidad de automatización (Gómez-Kosky et al., 2002; Ducos et al., 2007). Teniendo en cuenta los aspectos anteriormente descritos, este trabajo tuvo como objetivo determinar el efecto de la densidad de inoculación sobre la formación y variabilidad morfológica de los ES del cv. FHIA-21 en medio de cultivo líquido, para su posterior utilización en la propagación masiva.
Materiales y métodos
Preparación del material vegetal
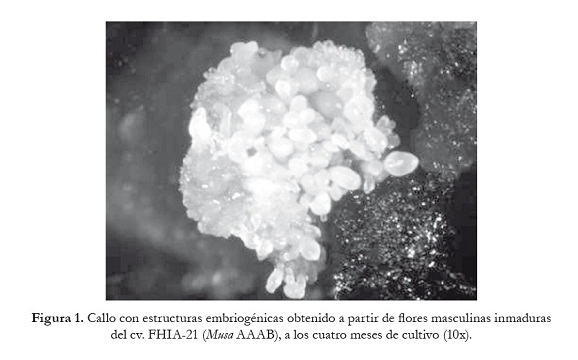
Como material vegetal se usaron inflorescencias de plantas del cv. FHIA-21 (AAAB) pertenecientes al banco de variedades de la Empresa de Cultivos Varios "La Cuba". Las inflorescencias se colectaron después de emitida la última flor femenina. Posteriormente, se extrajeron las flores masculinas inmaduras para la formación de callos con estructuras embriogénicas siguiendo el procedimiento descrito por Escalant et al. (1994) para el cv. Gran Naine (AAA). Estos callos se obtuvieron a los cuatro meses de cultivo (figura 1) y fueron utilizados para el establecimiento de suspensiones celulares embriogénicas (SCE).
Establecimiento de suspensiones celulares embriogénicas
Se inocularon 150 mg de masa fresca (mgMF) de los callos con estructuras embriogénicas en Erlenmeyers (25 ml de volumen total) que contenían 3,0 ml del medio de cultivo líquido propuesto por Daniels et al. (2002) para el cv. FHIA-21. A los 30 días de cultivo, las SCE fueron tamizadas con filtros de malla metálica de 0,5 mm de longitud de poro. La multiplicación de los agregados celulares embriogénicos menores de 0,5 mm se efectuó agregando 1,0 ml de estos en Erlenmeyer de 250 ml de capacidad con 30 ml de medio de cultivo. Después de 5 subcultivos cada 30 días, se utilizaron las SCE para la formación de los ES en medio de cultivo líquido.
Efecto de la densidad de inoculación en la formación de los embriones somáticos
Se adicionaron 0,5; 1,0; 1,5 y 2,0 g de masa fresca (gMF) de agregados celulares embriogénicos en Erlenmeyers de 250 ml de capacidad, que contenían 30 ml de medio de cultivo. Se utilizó un medio de cultivo compuesto por el 100% de las sales inorgánicas SH (Schenk e Hildebrandt, 1972) suplementado con 100% de las vitaminas MS, 1,0 mg/l-1 de biotina, 100 mg/l-1 de extracto de malta, 100 mg/l-1 de L-glutamina, 230 mg/l-1 de L-prolina, 10 mg/l-1 de lactosa, 0,23 µM de zeatina, 100 mg/l-1 de mio-inositol, 1,1 µM de ácido naftalenacético (ANA), 0,98 µM de isopenilaminopurina (2ip), 0,23 µM de Kinetina y 45 g/l-1 de sacarosa. El pH se ajustó a 5,3 previo a la esterilización con el uso de ácido clorhídrico (HCl) 0,5 M y hidróxido de sodio (NaOH) 0,5 M.
Los Erlenmeyers se colocaron en un agitador orbital (modelo INFORS HT) a 90 rpm de velocidad, en oscuridad total y 27±2,0 oC de temperatura. Se establecieron cinco repeticiones por cada tratamiento con un diseño experimental completamente aleatorizado. A los 30 días de cultivo se evaluó el número de ES formados en cada uno de los tratamientos. Para ello, se extrajeron 500 µl por Elenmeryers y se adicionaron en un vaso de precipitado (50 ml de capacidad) que contenía 30 ml de una solución de Gelrite ® (SIGMA) (2,5 g/l-1) y agua. Esta se vertió en placas de Petri de 70 mm de diámetro. El conteo de los ES se realizó con la ayuda de un microscopio estereoscópico modelo WILD M8 (LEICA).
Los datos experimentales se procesaron mediante un análisis de varianza (Anova) de clasificación simple. La comparación de los valores medios se efectuó mediante la prueba de Dunnett C, con un nivel de significación de 0,05.
Morfología e histología
Se determinó la longitud de los ES con el objetivo de utilizar esta variable como un marcador de la variabilidad morfológica. Además, se realizó la descripción morfológica e histológica de los mismos y para este propósito se extrajeron 100 µl de embriones en suspensión y se adicionaron en placas de Petri de 70 mm de diámetro siguiendo el procedimiento descrito anteriormente para evaluar el número de ES.
Para el análisis histológico, los ES se colocaron durante 24 horas en una solución de fijación que contenía 37% de formaldehído, 100% de ácido acético y 70% de etanol, en una proporción 5:5:90. Posteriormente, fueron deshidratados en un gradiente ascendente de etanol e incluidos en parafina. Se efectuaron cortes seriados de 10 µm de grosor con un microtomo de rotación (Zeiss, Alemania), se fijaron en portaobjetos y se realizó una tinción con safranina al 0,5%. Las secciones histológicas de las diferentes muestras se examinaron en microscopio óptico (Axioskop), y las imágenes fueron captadas con una cámara digital (Olympus DP70) acoplada al microscopio.
Resultados
Efecto de la densidad de inoculación en la formación de embriones somáticos
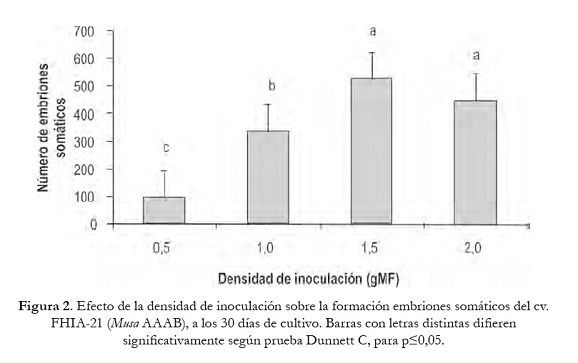
La formación de ES a partir de agregados celulares embriogénicos se produjo en las cuatro densidades iniciales de inoculación. Sin embargo, el efecto de la densidad se manifestó en la cantidad de ES formados en cada una de ellas. A los 30 días de cultivo, el mayor número se cuantificó en las densidades de 1,5 y 2,0 gMF con 523,9 y 447,5, respectivamente en 500µl de medio de cultivo. Ambas densidades no mostraron diferencias significativas entre ellas y sí con respecto a 0,5 y 1,0 gMF (figura 2).
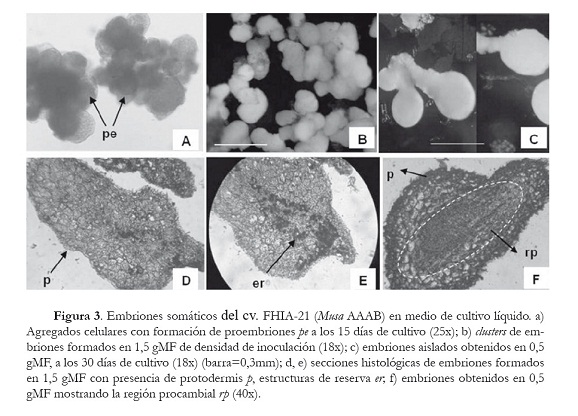
Durante la formación de los ES, el desarrollo ontogénico de los agregados celulares embriogénicos fue similar con las cuatro densidades de inoculación analizadas. A los 15 días de cultivo, se observó un aumento en el tamaño de los agregados, aparecieron en su periferia numerosas zonas embrionarias que progresivamente se organizaron y dieron lugar a los proembriones (figura 3a). A los 30 días de cultivo se observaron ES con diferentes longitudes como consecuencia del efecto de la densidad de inoculación.
Los ES formados en 1,5 gMF permanecieron agrupados en clusters (figura 3b), y las secciones histológicas mostraron evidencias anatómicas de la etapa globular. Estos presentaron una protodermis definida y la presencia de células meristemáticas con intensa actividad mitótica. Además, se observaron estructuras de reserva en las células centrales cercanas a la base del embrión (figura 3d, e). Similares características mostraron los embriones obtenidos en 2,0 gMF de densidad de inoculación. Por el contrario, los embriones formados en 0,5 y 1,0 gMF se encontraban individuales, y la formación de embriones secundarios se observó en la base de los embriones primarios (figura 3c). En las secciones histológicas de estos se identificó la formación de bandas procambiales en la región central del embrión, estructuras que identifican a ES de avanzado desarrollo morfológico (figura 3f).
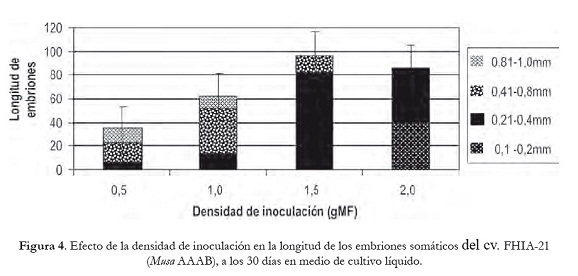
El efecto de la densidad de inoculación influyó en la longitud de los ES. Para su análisis se establecieron cuatro rangos de longitudes (0,1-0,2; 0,21-0,4; 0,41-0,8; 0,81-1,0 mm). Como resultado se obtuvo que el 86,4% de los embriones formados en 1,5 gMF presentaron de 0,21 a 0,4 mm de longitud. Sin embargo, la longitud de los embriones obtenidos en 0,5 y 1,0 gMF varió de 0,21 a 1,0 mm, mostrando alta variabilidad de esta variable (figura 4).
Discusión
En plátanos y bananos son pocos los estudios referentes a la formación de ES en medios de cultivo líquido (Gómez-Kosky et al., 2002; Cabrera et al., 2002; Barranco et al., 2009). El efecto de la densidad de inoculación y la influencia del genotipo están entre los factores que determinan la formación de ES a partir de suspensiones celulares embriogénicas. Por ejemplo, Cabrera et al. (2002) obtuvieron la mayor formación de ES del cv. Navolean con 1,2 gMF de densidad de inoculación, mientras que Barranco et al. (2009) alcanzaron el mayor número de ES del cv. FHIA-18 cuando utilizaron una densidad de 1,0 gMF. No obstante, para la selección adecuada de la densidad de inoculación debe determinarse su efecto sobre la reducción de la asincronía durante el desarrollo del proceso de embriogénesis somática.
En la literatura científica se ha descrito el carácter asincrónico del proceso de embriogénesis somática, dado por la presencia de ES en diferentes etapas de desarrollo ontogénico (Celestino et al., 2005). En las Musáceas es difícil identificar las etapas de desarrollo ontogénico de los ES (globular, ecutelar y coleoptilar) porque no se distinguen grandes cambios morfológicos, como ocurre en las especies dicotiledóneas. Por esta causa, son pocos los estudios que evalúan la asincronía de los ES en los bananos y plátanos. Al respecto, los estudios histológicos se han limitado a establecer diferencias entre callos embriogénicos y no embriogénicos (Escalant et al., 1994; Grapin et al., 1996; Grapin et al., 1998), aunque los resultados de Georget et al. (2000) constituyeron un progreso en la descripción histológica de ES del cv. Grande Naine formados en medio de cultivo semisólido, a partir de agregados celulares embriogénicos. De madera similar, estos autores observaron una definición de la protodermis y un enriquecimiento de almidón vacuolar en las células cercanas a la base de los ES.
En las especies dicotiledóneas se pueden diferenciar con mayor facilidad las etapas ontogénicas de los embriones somáticos. Por tanto, el papel de la densidad de inoculación en medio de cultivo líquido, y su efecto en el proceso de diferenciación ha sido descrito por diferentes autores. Por ejemplo, Shigeta et al. (1996), en el cultivo de la zanahoria (Daucus carota L.), obtuvieron una mayor formación y multiplicación de los embriones somáticos en etapa globular con alta densidad de inoculación. Sin embargo, una baja densidad de inoculación desencadenó el proceso de diferenciación, con mayor número de embriones somáticos en etapa de torpedo y cotiledonal. Resultados similares fueron descritos por Barbón-Rodríguez et al. (2003) y Duco et al. (2007) en el cultivo del café (Coffea arabica L.).
La selección adecuada de la densidad de inoculación contribuiría a la reducción del efecto negativo de la asincronía, aspecto fundamental para el avance de la embriogénesis somática en la propagación masiva. La sincronización del proceso evitaría las operaciones de selección de los ES con características adecuadas para su posterior multiplicación, maduración, geminación y conversión de las plantas en condiciones ex vitro (Tonon et al., 2001; Barry-Etienne et al., 2002). Estas operaciones complicarían los protocolos e incrementarían sustancialmente los costos de producción (Gupta y Timmis, 2005).
Conclusiones
Los resultados obtenidos permitieron demostrar el efecto regulatorio de la densidad de inoculación en la formación y el desarrollo morfológico de los ES del cv. FHIA-21. La determinación de la longitud y su relación con la etapa de desarrollo del embrión contribuyó a la selección de la densidad de inoculación. A partir de esta investigación se estableció para la formación de ES del cv. FHIA-21 una densidad de inoculación de 1,5 gMF. Esta proporcionó un 86,4% de los ES con un desarrollo morfológico homogéneo en etapa globular. La sincronización del proceso de embriogénesis somática aumentará la eficiencia de este sistema de regeneración para su utilización en la propagación masiva de plantas de este cultivar.
Referencias bibliográficas
1 Barbón-Rodríguez, R., Jiménez, E., Capote, A. 2003. Influencia del genotipo y la densidad de inoculación sobre la diferenciación de embriones somáticos de Coffea arabica L. cv. Caturra rojo y Coffea canephora cv. Robusta. Biotecnología Vegetal, 3 (3): 131-135. [ Links ]
2 Barry-Etienne, D., Bertrand, B., Schlo¨nvoigt, A., Etienne, H. 2002. The morphological variability within a population of co?ee somatic embryos produced in a bioreactor a?ects them regeneration and the development of plants in the nursery. Plant Cell Tiss Org Cult, 68: 153-162. [ Links ]
3 Barranco, L. A., Gómez-Kosky, R., Reyes, M., Posada, L., Frerie, M., Herrera, I. 2009. Efecto de la densidad de inóculo en la multiplicación y diferenciación de suspensiones celulares embriogénicas en el cultivar híbrido de banano FHIA-18 (Musa spp. AAAB). Revista colombiana de Biotecnología, 2: 29-36. [ Links ]
4 Cabrera, M., López, J., Gómez-Kosky, R., Montano, N., Reyes, M., Reinaldo, D., Ventura, J. C., Medero, V., Santos, A., García, M., Basail, M., Espinosa, E. 2002. Multiplicación, histodiferenciación y regeneración de suspensiones celulares embriogénicas en plátanos vianda "Navolean" (AAB). Biotecnología vegetal, 2 (2): 115-117. [ Links ]
5 Celestino, C., Hernández, I., Carneros, E., López-Vela, D., Toribio, M. 2005. La embriogénesis somática como elemento central de la biotecnología Forestal. Invest Agrar: Sist Recur For, 14 (3): 345-357. [ Links ]
6 Daniels, D., Kosky, R., Vega, M. 2002. Plant regeneration system via somatic embryogenesis in the hibrid cultivar FHIA 21 (Musa spp. AAAB Gropl). In vitro Cell Dev Biol, 38: 330-333. [ Links ]
7 Ducos, J. P., Lambot, C., Pétiard, V. 2007. Bioreactors for Coffee Mass Propagation by Somatic Embryogenesis. International Journal of Plant Developmental Biology, 1 (1): 1-12. [ Links ]
8 Escalant, J. V., Teisson, C., Cote, F. 1994. Amplified somatic embryogenesis from male flowers of triploid banana and plantain cultivars (Musa spp.). In vitro Cell Dev Biol 30: 181-186. [ Links ]
9 FAOSTAT. Food and Agriculture organization of the United Nations (FAO). 2010. http://faostat.fao.org/site/567/DesktopDefault.aspx?PageID. [ Links ]
10 García, L., Pérez, B., Sarria, Z., Clavero, J. 2002. Alternativas para la propagación in vitro del cultivar híbrido FHIA-20. Infomusa, 11 (1): 35-38. [ Links ]
11 Georget, F., Cote, F., Domergue, R., Ferrière, N. 2000. Morphohistological study of different constituents of a banana (Musa AAA, cv. Grande naine) embryogenic cell suspension. Plant Cell Report, 19: 748-754. [ Links ]
12 Gómez-Kosky, R., De Feria, M., Pérez, L. P., Gilliard, T., Martínez, F. B., Reyes, M., Milian, R. C., Quiala, E. 2002. Somatic embryogenesis of the banana hybrid cultivar FHIA-18 (AAAB) in liquid medium and scaled up in a bioreactor. Plant Cell Tissue Organ Cult, 68: 21-26. [ Links ]
13 Grapin, A., Schwendiman, J., Teisson, C. 1996. Somatic embryogenesis in banana plant. In Vitro Cell Dev Biol, 32: 66-71. [ Links ]
14 Grapin, A., Ortiz, J. L., Domergue, R., Babeau, J., Monmarson, S., Escalant, J. V., Teisson, C., Côte, F. 1998. Establishment of embryogenic callus and initiation and regeneration of embryogenic cell suspensions from female and male immature flower of Musa spp. Infomusa, 7 (1): 13-15. [ Links ]
15 Gupta, P. K., Timmis, R. 2005. Mass propagation of conifer trees in liquid cultures: Progress towards commercialization. En: Hvoslef-Eide AK, Preil W (eds.). Liquid Culture Systems for In Vitro Plant Propagation. Dordrecht, the Netherlands: Springer. pp. 231-242. [ Links ]
16 Orellana, P., Alvarado, P., Guijarro, J. M., Pérez, J., Pérez, L., Rowe, P. et al. 1999. Introducción y validación de híbridos tetraploides de Musa en Cuba. Corbana, 24 (51): 79-84. [ Links ]
17 Tonon, G., Berardi, G., Rossi, C., Bagnaresi, U. 2001. Synchronized somatic embryo development in embryogenic suspensions of fraxinus angustifolia. In Vitro Cell Dev Biol, 37: 462-465. [ Links ]
18 Schenk, R. U., Hildebrandt, A. C. 1972. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell culture. Canadian Journal of Botany, 50: 199-204. [ Links ]
19 Shigeta, J., Sato, K., Mii, M. 1996. Effects of initial cell density, pH and dissolved oxygen on bioreactor production of carrot somatic embryos. Plant Science, 115: 109-114. [ Links ]