Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.12 no.2 Bogotá July/Dec. 2010
BIONOTA
Nuevo método para la selección rapida de plantas de banano (Musa spp. AAA cv. Grande naine) transformadas con gen bar procedentes de campo, empleando glufosinato de amonio
New method for rapid selection of banana (Musa spp. AAA cv. Grande naine) plants with bar gene in the field using ammonium gluphosinate
Rafael Gómez Kosky1 , Maritza Reyes Vega1 , Idalmis Bermúdez Caraballoso1 , Borys Chong Pérez1 , Yelenys Alvarado Capo1
1 Instituto de Biotecnología de las Plantas, Universidad Central "Marta Abreu" de Las Villas, Villa Clara, Cuba. kosky@ibp.co.cu
Recibido: enero 19 de 2010 Aprobado: noviembre 26 de 2010
Resumen
Los genes marcadores de la selección son ampliamente utilizados para la transformación eficiente de diferentes cultivos, sin embargo, existen muy pocas referencias sobre el desarrollo de métodos de selección temprana en campo de plantas supuestamente transformadas con marcador de selección tipo herbicidas. La presente investigación tuvo como objetivo evaluar el efecto del glufosinato de amonio a partir del herbicida Finale® en los fragmentos de hojas de plantas de campo cultivados in vitro, para la selección de líneas transformadas de banano cv. Grande naine (Musa spp. AAA), con una construcción que porta como marcador de selección el gen bar. A partir del método desarrollado con el empleo de fragmentos de hojas de plantas procedentes de campo, cultivados in vitro en el medio de cultivo agar al 1% más agua y 30,0 g/l-1 de glufosinato de amonio se logró diferenciar las dos líneas transformadas del control no transformado, a partir de la expresión del gen bar. Ambas líneas fueron positivas en el análisis molecular de PCR. Estos resultados permiten disponer de una herramienta útil y simple como parte de un protocolo de transformación genética para el cultivo del banano, siendo el primer informe de este resultado a nivel internacional.
Palabras clave: Musa, transformación genética, gen bar, glufosinato de amonio.
Abstract
Selector marker genes are widely used for the efficient transformation of different crops; however, there are very few references on the development of early selection methods in the fields of potentially transformed plants for herbicides. The objective of this research was to evaluate the effect of ammonium gluphosinate from the herbicide Finale® in leaf fragments from in vitro plants grown in the fields for the selection of putative transformed lines of banana cv. Grande naine (Musa spp. AAA), with a construction that has the bar gene as the selector marker gene. Since the method developed with the use of leaf fragments from field plants culture in vitro in the agar at 1% more water and 30.0 gl-1 ammonium gluphosinate did differentiate the two transformed lines untransformed control, from the bar gene expression. Both lines were positive in the PCR molecular analysis. These results were a useful tool and form a part of a protocol of genetic transformation for banana, being the first reported result.
Key words: Musa, genetic transformation, bar gene, ammonium gluphosinate.
Introducción
Los cultivos de banano y plátano se encuentran ampliamente distribuidos en el mundo y son un componente importante en la alimentación de millones de personas. La producción mundial de musáceas (bananos y plátanos) fue de 115.708.153 de toneladas métricas en el año 2007, y de ellas el 70,2% correspondieron a banano (Faostat, 2009). Este cultivo es afectado por varias enfermedades fungosas, dentro de las cuales se destaca la sigatoka negra (Mycosphaerella fijiensis Morelet) como la más nociva. Esta ha tenido un serio impacto en la producción de bananos especialmente sobre el cultivar Grande naine (Musa AAA; Cavendish) que es el más comercializado a nivel mundial. Es por ello que la búsqueda de alternativas para desarrollar nuevas variedades resistentes a la enfermedad es una necesidad en la actualidad (Bermúdez et al., 2006).
La ingeniería genética aparece como una vía para superar las limitaciones que presentan los métodos convencionales de mejoramiento en el género Musa, gracias a la posibilidad de introducir cambios genéticos específicos en un corto periodo de tiempo (Sagi et al., 1994). En la transformación genética de bananos los dos métodos más utilizados han sido el bombardeo de partículas (Becker et al., 2000; Matsumoto et al., 2007), y la mediada por la bacteria Agrobacterium tumefaciens (May et al., 1995; Ganapathi et al., 2001; Khana et al., 2004; Remy et al., 2005).
El establecimiento de un sistema de transformación genética requiere que la construcción que se va a introducir tenga genes marcadores que permitan la selección de los tejidos transformados. Dentro de los genes marcadores en la transformación genética los más utilizados son los neo y hpt que confieren resistencia a los antibióticos kanamicina e higromicina, y el gen bar o pat a los herbicidas que tienen como ingrediente activo la fosfinotricina (Miki y McHugh, 2004).
El glufosinato de amonio es un compuesto que actualmente se usa como herbicida no selectivo, de gran aceptación en la agricultura moderna ya que solo actúa sobre las partes verdes de la planta (Bayer CropScience, 2005). Contiene intrínsecamente al isómero L- de la fosfinotricina, responsable de la actividad herbicida, que inhibe la actividad de la enzima glutamina sintetasa, la cual interviene en la asimilación del nitrógeno y como resultado se alcanzan niveles tóxicos de amonio en las células de la planta. Está registrado en más de 80 países bajo diferentes nombres tales como: Basta®, Liberty®, Finale® y Rely® (Bayer CropScience, 2005). La resistencia a este herbicida ha sido desarrollada a través de un sistema de detoxificación. La enzima fosfinotricina acetil transferasa (PAT) codificada por el gen bar de Streptomyces hygroscopicus o el gen pat de Streptomyces viridochromogenes convierten el glufosinato de amonio en N-acetil glufosinato que es un compuesto no fitotóxico para la planta.
Autores como Yoon et al. (2002) y Shu et al. (2005) han utilizado el glufosinato de amonio para la selección de plantas transformadas en diferentes cultivos. Sin embargo, en el género Musa existen pocos trabajos que describen la utilización del glufosinato de amonio para la selección de plantas transformadas (Sreeramanan et al., 2006), la mayoría de las investigaciones refieren el empleo de la higromicina B (Sági et al., 1994; Tripathi et al. 2005; Sreeramanan et al. 2006) y la geneticina o kanamicina (Khana et al. 2004; Remy et al., 2005). Por otra parte, en la literatura consultada no existe referencia al uso de este compuesto para la diferenciación y evaluación de la expresión del gen bar en el cultivo de las Musáceas, por lo que estos resultados son de gran importancia para el trabajo de selección en bananos.
Tomando en cuenta los resultados presentados por Ishida et al. (2007) en el cultivo del maíz (Zea maíz L.), quienes desarrollaron un ensayo empleando fragmentos de hojas de planta transformadas cultivadas en invernadero para determinar, por cambio de color en los fragmentos de hojas cultivados in vitro en placas de Petri, si las plantas eras susceptibles al Basta y no transgénicas, este trabajo tuvo como objetivo evaluar el efecto del glufosinato de amonio a partir del herbicida Finale® en los fragmentos de hojas de plantas transgéncias que portan el gen bar procedentes de campo, para la selección rápida de líneas transformadas a este herbicida en el cultivo del banano.
Materiales y métodos
Efecto del glufosinato de amonio en fragmentos de hojas de plantas procedentes de campo cultivados in vitro
Las plantas seleccionadas para el experimento tenían 12 meses de cultivo en campo, en áreas del Instituto Nacional de Viandas Tropicales (Inivit), municipio de Santo Domingo, provincia Villa Clara, Cuba, y fueron seleccionadas durante un primer ciclo en campo por su resistencia a la enfermedad Sigatoka negra (M. fijiensis). Este ensayo fue aprobado por el Centro Nacional de Seguridad Biológica de República de Cuba del Ministerio de Ciencia y Medio Ambiente, licencia 012-06.
Las plantas supuestamente transformadas habían sido obtenidas previamente según protocolo de transformación genética empleado Agrobacterium tumefacies desarrollado por Bermúdez et al. (2006), con el plásmido pHCG59 (combinación de dos proteínas antifúngicas) formado por la combinación del gen de la ß-1,3-endoglucanasa (PR 2) de tabaco (Nicotiana tabacum) y el gen de la I quitinasa (PR 3) de frijol (Phaseolus vulgaris) y que portaban al gen bar como marcador de selección.
Los fragmentos de hojas de dos líneas transgénicas putativas provenientes de distintos eventos de transformación fueron tomados de las líneas Gn 59-11 y Gn 59-17. Para ello se colectó la hoja 1 de plantas de banano en cada línea transformada putativa y el control sin transformar del cultivar Grande naine (Musa spp. grupo AAA).
Las hojas se trasladaron al laboratorio, se lavaron con detergente, abundante agua y en la cabina de flujo laminar se realizó la desinfección con etanol (70%) durante 3 min, seguido de 3 lavados con agua estéril. Posteriormente, en platos metálicos estériles se procedió a cortar sobre papel de filtro 6 fragmentos de hojas de 2,0 cm2 aproximadamente. Estos se colocaron en placas Petri de 10,0 cm de diámetro que contenían 20,0 ml de las combinaciones de agar 1 g.l-1 + agua destilada con 1 mg.l-1 de ácido giberélico (AG3) y sin la presencia de este regulador del crecimiento. Como controles se utilizaron la mezcla agar 1 g.l-1 + agua sin reguladores del crecimiento, ni herbicida y con ácido giberélico sin herbicida. El pH fue ajustando a 5,8 antes de ser esterilizado en autoclave, y en la cabina de flujo laminar se le añadió la concentración de glufosinato de amonio de 30,0 g.l-1 empleando como fuente el herbicida comercial Finalé® (Bayer Crop Science, 2005) para plantas en casa de cultivo según Reyes (2008).
A los cinco días se evaluó la presencia o no de necrosis de los fragmentos de hojas según protocolo propuesto por Ishida et al. (2007) para maíz (Zea maydis L.)
Efecto de diferentes concentraciones de glufosinato de amonio en fragmentos de hojas de plantas procedentes de campo cultivados in vitro
Un segundo experimento se desarrolló con el objetivo de evaluar el efecto de menores concentraciones de glufosinato de amonio en fragmentos de hojas de plantas de campo. Los fragmentos de hoja se tomaron de las mismas líneas anteriormente señaladas y el procedimiento fue igual al descrito anteriormente. A la mezcla de agar al 1 g.l-1 + agua se le adicionaron 7,5; 15,0 y 30,0 g.l- 1 de glufosinato de amonio, además de un control sin el herbicida.
Las evaluaciones se realizaron a los tres y cinco días, de forma similar a lo descrito anteriormente para cada concentración de glufosinato de amonio.
Análisis de PCR
Como material vegetal para la extracción de ADN que fue utilizado en la reacción en cadena de la polimerasa (PCR), se tomaron muestras de hojas cigarro de una de las líneas referidas (Gn 59-17).
Para la extracción del ADN se tomaron 100 mg de tejido foliar. Posteriormente, se pulverizaron en nitrógeno líquido y se procesaron utilizando el sistema de purificación de ADN Wizard® Genomic DNA Purification Kit (Promega). Se siguieron las instrucciones del fabricante, con modificaciones en la solución tampón de extracción basado en el método descrito por Dellaporta et al. (1983) (100 mM Tris-HCl pH=5,8, 50 mM EDTA, 500 mM cloruro de sodio, 2% polivinil pirrolidona y 10 mM ß-mercaptoetanol). Luego de obtenido el ADN genómico, su integridad fue comprobada mediante electroforesis en gel de agarosa al 0,8%, y como criterio de pureza se determinaron las razones A 260/230 y A 260/280 con el uso de un espectofotómetro (BioPhotometre, Eppendorf, Hamburg). La concentración del ADN fue ajustada a 50 ng/µl para ser usados en el análisis de PCR.
La reacción de PCR se llevó a cabo en las condiciones siguientes: 1,5 mM MgCl2, 1X del tampón comercial Taq ADN polimerasa (50 mM Tris-HCl pH 9,0 a 25 oC, 50 mM KCL, 50 mM NaCl), 0,2 mM de cada dNTP, 1 µM de cada oligonucleótido (bar 5‘:5’-CGAGACAAGCACGGTCAACTTC-3’ y bar 3’:5’-GAA ACCCACGTCATGCCAGTTC-3’) y 1 U de Taq ADN polimerasa (Fermentas, Alemania) en un volumen final de 25 ol. En cada reacción se usaron 100 ng de ADN genómico.
Se utilizó un bloque térmico personal Mastercycler (Eppendorf, Alemania). Las reacciones se realizaron bajo las siguientes condiciones: un ciclo a 94 oC durante 1 min y 35 ciclos a 94 oC durante 1 min, 65 oC durante 45 s y 72 oC durante 1 min, y para finalizar 72 oC durante 7 min. Los productos de la reacción fueron visualizados mediante electroforesis en gel de agarosa al 1,5% (p/v) con tampón TBE 1X (40 mM Tris-acetato, 1mM EDTA). Las muestras para analizar (10 µl) se mezclaron con 1 µl del tampón cargador 10 X (bromofenol azul 0,25%, glicerol 50% y EDTA 10 mM). Luego se realizó la tinción con bromuro de etidio 0,5 mg.ml-1 por 10 min, y se observó en un transiluminador MacroVue (Pharmacia LKB, Alemania) mediante la incidencia de radiación ultravioleta.
Como control positivo de las reacciones de PCR, se usaron como molde 10 ng del plasmidio pHCG59 que porta el gen bar.
Resultados y discusión
Efecto del glufosinato de amonio en fragmentos de hojas de plantas procedentes de campo cultivados in vitro
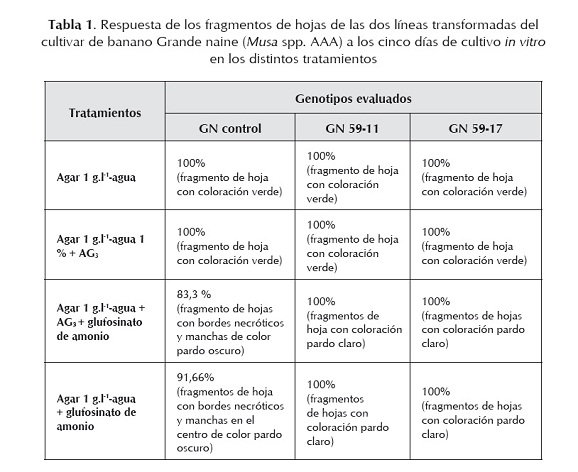
La mezcla de agar 1 g.l-1 más agua y 30,0 g.l-1 de glufosinato de amonio, así como la mezcla similar pero con 1 mg.l-1 de ácido giberélico, permitieron diferenciar las dos nuevas líneas transformadas del control, empleando fragmentos de hojas de plantas de campo a los 5 días de cultivarlas in vitro (tabla 1). Estos resultados similares en los dos tratamientos estudiados indican que no es necesaria la presencia de este regulador del crecimiento en el medio de cultivo, pues los fragmentos de hojas no tuvieron ninguna afectación y mantuvieron su estado juvenil, lo que puede estar relacionado con el corto periodo en que permanecieron expuestos a estas condiciones in vitro.
Las dos líneas transgénicas del cultivar Grande naine tuvieron igual respuesta al cambiar de color el fragmento de hoja de verde a pardo claro, no así en el control no transformado donde el cambio de color fue de verde a pardo oscuro. Todos los fragmentos de hojas sin el herbicida (control) se mantuvieron todo el tiempo de color verde (tabla 1 y figura 1).
Efecto de diferentes concentraciones de glufosinato de amonio en fragmentos de hojas de plantas procedentes de campo cultivados in vitro
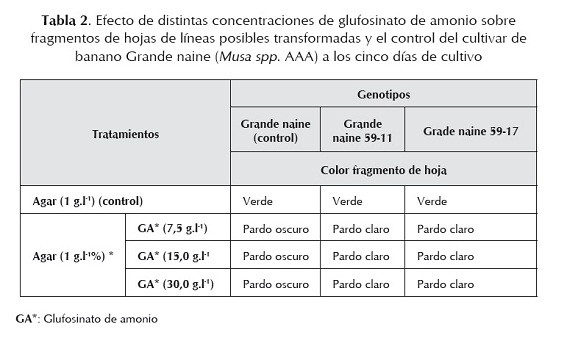
No se obtuvieron diferencias en el cambio de color de los fragmentos de hojas de las dos líneas transformadas con relación al control en las distintas concentraciones estudiadas de glufosinato de amonio (tabla 2). La respuesta fue similar al acápite anterior a pesar de utilizar concentraciones más bajas del herbicida, lo cual demuestra que con la concentración de 7,5 g.l-1 fue posible diferenciar las líneas transgénicas putativas del control.
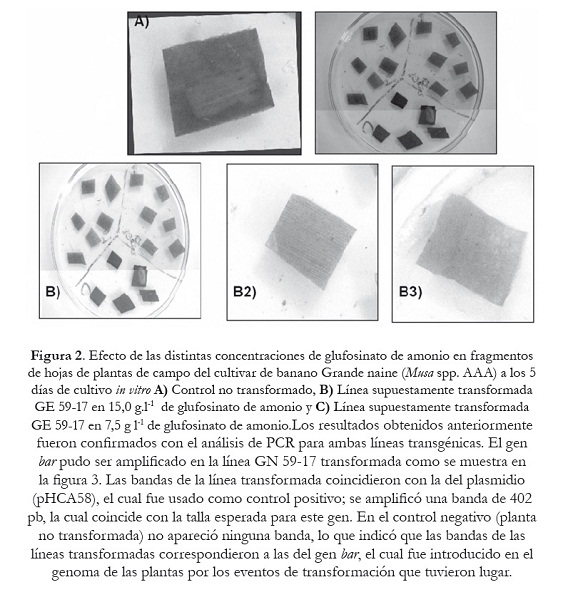
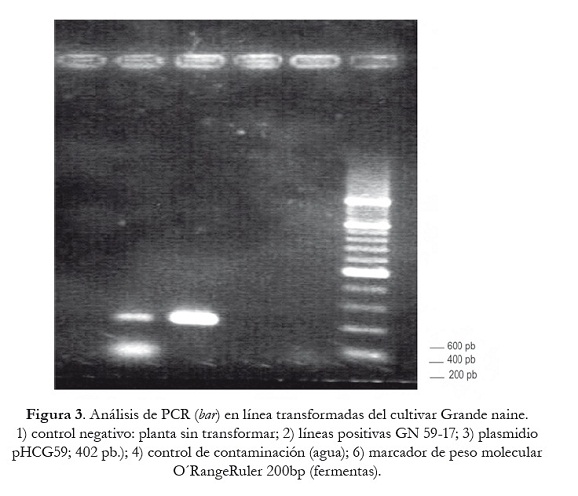
Los resultados obtenidos anteriormente fueron confirmados con el análisis de PCR para ambas líneas transgénicas. El gen bar pudo ser amplificado en la línea GN 59-17 transformada como se muestra en la figura 3. Las bandas de la línea transformada coincidieron con la del plasmidio (pHCA58), el cual fue usado como control positivo; se amplificó una banda de 402 pb, la cual coincide con la talla esperada para este gen. En el control negativo (planta no transformada) no apareció ninguna banda, lo que indicó que las bandas de las líneas transformadas correspondieron a las del gen bar, el cual fue introducido en el genoma de las plantas por los eventos de transformación que tuvieron lugar.
Al analizar los resultados del método desarrollado para el ensayo con fragmentos de hojas de plantas transgénicas de maíz, propuesto por Ishida et al. (2007), se encontró que estos autores utilizaron un medio de cultivo completo con las sales y vitaminas Murashige-Skoog (1962) y suplementado con 6 BAP 0,5 mg.l-1 y 0,5 g de Metilenato sulfónico (MES), solidificado con agar 8,0 g.l-1 y un pH de 5,8 antes de la esterilización por autoclave con una concentración de glufosinato de amonio del 0,1% (Basta, Bayer CropScience), este último suplemento fue adicionado posterior a la esterilización del medio de cultivo. En el presente trabajo el medio de cultivo propuesto es más sencillo y se obtienen similares resultados, al emplear solamente una mezcla de agar 1,0 g.l-1 más agua, aunque es en el cultivo del banano.
Los resultados descritos por Twizeyimana et al. ( 2007) obtuvieron los menores porcentajes de clorosis en los fragmentos de hojas cuando le adicionaron el ácido gibérelico al medio de cultivo para mantener su estado juvenil, por un periodo de 45 días, a fin de poder evaluar en cultivares de Musa la resistencia a la enfermedad Sigatoka negra. En el presente trabajo el regulador del crecimiento no tuvo ningún efecto producto del corto tiempo que se necesitó en el ensayo para obtener resultados, entre 3-5 días.
En el cultivo del maíz, la concentración de 0,1% de glufosinato de amonio empleada para ensayo con los fragmentos de hojas de plantas de maíz cultivadas in vitro permitió la diferenciación entre líneas transgénicas y el control a partir del cambio de color en los fragmentos de hojas de verde a amarillo; sin embargo, en las líneas transgénicas los fragmentos de hojas mantuvieron el color verde. En el caso del banano a las concentraciones ensayadas no ocurrió así a pesar de que las líneas transformadas tuvieron una respuesta diferente con respecto al control no transformado, pues el cambio fue de verde a pardo claro para las transformadas y de verde a pardo oscuro para las no transformadas. Esto puede ser debido a las concentraciones de glufosinato de amonio ensayadas que fueron superiores a las utilizadas en el método para el maíz. Esto llevaría a continuar los estudios en este sentido y a evaluar el efecto de concentraciones menores sobre los fragmentos de hojas de plantas transformadas y no.
A nivel mundial se trata de evitar el uso de antibióticos como agentes selectivos en los protocolos de transformación genética, ya que una de las mayores preocupaciones de los cultivos modificados genéticamente es la presencia de genes que confieren resistencia a antibióticos de importancia clínica. En las plantas transgénicas estos podrían inactivar las dosis orales de estos antibióticos en los animales y el hombre (Daniell, 1999). Otro aspecto importante es que los genes resistentes a antibióticos pueden ser transferidos a microbios patógenos del tracto gastrointestinal y, al ser vertidos al suelo, ellos resistan el tratamiento con tales antibióticos (Daniell et al., 2001). Estos hechos aún no han podido ser probados, pero sí tienen una gran influencia en los organismos regulatorios y en la percepción y aceptación de los organismos transgénicos por la opinión pública (Darbani et al., 2007). En el caso de los marcadores de selección que confieren resistencia a herbicidas, se ha estudiado la transferencia de estos genes por polinización cruzada a especies relacionadas (Stewart et al., 2003; Zapiola et al., 2007); en el caso de los bananos, debido a su esterilidad, este riesgo es poco probable.
Los resultados alcanzados en el presente trabajo permitieron adecuar el método desarrollado por Ishida et al. (2007) para el cultivo del maíz transgénico, al cultivo del banano. Al respecto, en la literatura consultada no existe referencia de este tipo de ensayo para la diferenciación y evaluación de la expresión del gen bar en el cultivo de las Musáceas, por lo que estos resultados son de gran importancia para el trabajo de selección en la transformación genética del banano empleando como marcador de selección el gen bar.
Referencias bibliográficas
1 Bayer. 2005. Technical information Glufosinate-ammonium. CropScience, p 38. [ Links ]
2 Beck, E., Ludwig, A., Anerswald, E., Reiss, B., Achaller, H. 1982. Nucleotide sequence and exact localisation of the neomycin phosphotransferase gene from transposon Tn 5. Gene 19: 327-336. [ Links ]
3 Becker, D., Dugdale, B., Smith, M., Harding, R., Dale, J. 2000. Genetic transformation of Cavendish banana (Musa spp. AAA group) cv. "Grande Naine" via microprojectile bombardment. Plant Cell Report 19: 229-234. [ Links ]
4 Bermúdez, I., Gómez, R., Reyes, M., Chong, B. 2006. Determinación de la dosis letal mínima de fosfinotricina para la selección de transformantes de banano cv. Grande naine (Musa AAA). Biotecnología Vegetal 6 (3): 32-36. [ Links ]
5 Daniell, H. 1999. GM crops: Public perception and scientific solutions. Trenes Plant Sci 4: 467-469. [ Links ]
6 Daniell, H., Muthukumar, B., Lee, S. B. 2001. Marker free transgenic plants: engineering the chloroplast genome without the use of antibiotic selection. Curr Genet 39: 109-116. [ Links ]
7 Darbani, B., Eimanifar, A., Neal, C., Camargo, W. 2007. Methods to produce marker-free transgenic plants. Biotechnol J 2: 83-90. [ Links ]
8 Dellaporta, S., Wood, L., Hicks, J. B. 1983. A plant DNA minipreparation: version II. Plant Molecular Biology Reporter 1(14):19-21. [ Links ]
9 Faostat. 2009. Base de Datos estadística de la FAO [en línea] En: http://faostat.fao.org/site/567 [consulta: 6 de marzo de 2009]. [ Links ]
10 Ganapathi, T. R., Higgs, N. S., Balint-Kurti, P. J., Artzen, C. J., May, G. D., van Eck. J. M. 2001. Agrobacterium-mediated transformation of embryogenic cell suspension of the banana cultivar Rasthali (AAB). Plant Cell Report 20: 157-162. [ Links ]
11 Ishida, Y., Hiei, Y., Komari, T. 2007. Agrobacterium-mediated transformation of maize. Nature Protocols 2 (7): 1614-1621. [ Links ]
12 Khanna, H., Becker, D., Kleidon, J., Dale, J. 2004. Centrifugation assisted Agrobacterium tumefaciens-mediated transformation (CAAT) of embryogenic cell suspensions of banana (Musa spp. Cavendish AAA and Lady Finger AAB). Molecular Breeding 14: 239-252. [ Links ]
13 Matsumoto, K., Cunha, N. B., Morais, L. S., Aragao, F. J. L. 2007. Instability of Transgenes in In Vitro-Maintained Banana Plants. Acta Hort: 738. [ Links ]
14 May, G. D., Afza, R., Mason, H. S., Wiecko, A., Novak, F. J., Artzen, C. J. 1995. Generation of transgenic banana (Musa acuminata) plants via Agrobacterium-mediated transformation. Bio/Technology 13: 486-492. [ Links ]
15 Miki, B., McHugh, S. 2004. Selectable marker genes in transgenic plants: Applications, alternatives and biosafety. J Biotech 107: 193-232. [ Links ]
16 Murashige, T., Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 15: 473-497. [ Links ]
17 Remy, S., Thiry, E., Coemans, B., Windelinckx, S., Swennen, R., Sági, L. 2005. Improved T-DNA vector for tagging plant promoters via high-throughput luciferase screening. BioTechniques 38: 763-770. [ Links ]
18 Reyes, M. V. 2008. Use of Ammonium gluphosinate as selective agent in banana cv. Grande Naine (Musa spp. AAA) cells and putatively transformed plants. MSc Dissertation, Plant Biotechnology Institute, Cuba. [ Links ]
19 Sagi, L., Remy, S., Panis, B., Swennen, R., Volckaert, G. 1994. Transient gene expression in electroporated banana (Musa spp., cultivar "Bluggoe", ABB group) protoplast isolated from regenerable embryogenic cell suspension. Plant Cell Reports 13: 262-266. [ Links ]
20 Sagi, L., Panis, B., Remy, S., Schoofs, H., De Smet, K., Swennen, R., Cammue, B. P. 1995. Genetic transformation of banana and plantain (Musa) via particle bombardment. Biotechnology 13: 481-485. [ Links ]
21 Steward, C.N., Halfhill, M.D., Warwick, S. I. 2003. Transgene introgression from genetically modified crops to their wild relatives. Nature Rev Genet 4: 806-817. [ Links ]
22 Shu, Q. Y., Liu, G. S., Xu, S. X., Li, X. F., Li, H. J. 2005. Genetic transformation of Leymus chinensis with the PAT gene through microprojectile bombardment to improve resistance to the herbicide Basta. Plant Cell Rep 24: 36-44. [ Links ]
23 Sreeramanan, S., Maziah, M., Abdullah, M. P., Rosli, N. M., Xavier, R. 2006. Potential Selectable Marker for Genetic Transformation in Banana. Biotecnology 5 (2): 189-197. [ Links ]
24 Triparthi, L., Triparthi, J. N., Hughes, J. D. A. 2005. Agrobacterium -mediated transformation of plantain (Musa ssp.) cv Agbagba. African Journal of Biotechnology 4 (12): 1378-1383. [ Links ]
25 Twizeyimana, M., Tenkouano, A., Ikotun, T., Ojiambo, P. S., Bandyopadhyay, R. 2007. Using In Vitro Plantlets in Tubes and Detached Leaves. Plan Disease 91 (3): 308-314. [ Links ]
26 Yoon E.S., Jeong, J.H., Choj, Y.E. 2002. Recovery of Basta resistant Sedum erythrostichum via Agrobacterium tumefaciens mediated transformation. Plant Cell Rep 21: 70-75. [ Links ]
27 Zapiola, M. L., Campbell, C. K., Butler, M. D., Mallory-Smith, C. A. 2007. Escape and establishment of transgenic glyphosate-resistant creeping bentgrass Agrostis stolonifera in Oregon, USA: a 4-year study. Journal of Applied Ecology 45 (2): 486-494. [ Links ]