Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.13 no.1 Bogotá Jan./June 2011
ARTÍCULO DE INVESTIGACIÓN
Biotransformación de carbón de bajo rango por bacterias aisladas de microhábitats influenciados por residuos de carbón
Biotransformation of low rank coal by bacteria isolated from environments influenced by coal residue
Título corto: Biotransformación de carbón por bacterias
Nelson Osvaldo Valero Valero 1 , Jocelyn Beleño Carrillo 2 , Sandra Mancilla 2
1 Biólogo, MSc. Microbiología, Candidato Dr. Universidad Popular del Cesar – Laboratorio de investigación en microbiología agrícola y ambiental. Campus Sede Sabanas Cuarto piso. nelsonvalero@unicesar.edu.co.
2 Microbiólogo. Universidad Popular del Cesar
Recibido: febrero 09 de 2011 Aprobado: mayo 25 de 2011
Resumen
Se describió la capacidad de cinco cepas bacterianas para transformar un carbón de bajo rango (CBR), para ello se evaluaron cepas aisladas de microhábitats con presencia de partículas procedentes de los procesos de almacenamiento y lavado de carbón en la mina El Cerrejón (Colombia). Se realizaron ensayos de solubilización de CBR en medio de cultivo sólido y líquido, además de la decoloración de sustancias húmicas (SH) extraídas del CBR. Todas las bacterias evaluadas presentaron capacidad para biotransformar CBR en medio sólido, esta actividad es mayor cuando el CBR ha sido pretratado con ácido nítrico; en medio líquido se alcanzó una pérdida de peso de CBR hasta del 37% por acción de una cepa de Acinetobacter baumannii, acompañada de la aparición de hasta 8,06 mg/ml-1 de sustancias solubles con absorbancia a 465 nm; los cambios en el pH del medio sugieren que la actividad biotransformadora de CBR está asociada a la liberación de sustancias alcalinas; finalmente, se encontró evidencia para sugerir que las SH presentes en el CBR son transformadas por cometabolismo, posiblemente mediante reacciones de depolimerización, decoloración y repolimerización.
Palabras clave: solubilización de carbón, sustancias húmicas, El Cerrejón, Acinetobacter baumannii.
Abstract
in this study were evaluated five bacterial strains isolated from microhabitats with high content of coal particles generated from storage and washing processes, in "The Cerrejón" open coal mine (Colombia), their ability to biotransform a low rank coal (LRC) was described by testing solubilization on solid and liquid culture medium, as well as bleaching of humic substances (HS) extracted from LRC. All tested bacteria showed ability to biotransform LRC on solid medium, this activity is greater when the LRC has been pretreated with nitric acid; in liquid medium LRC reached 37% of weight loss by Acinetobacter baumannii strain, accompanied by the appearance of up to 6.8 mg/ml-1 of soluble substances with absorbance at 465 nm, changes in culture medium pH suggest that LRC biotransformations activity is associated with alkaline substances release, finally found evidence to suggest that HS contained within LRC are transformed by cometabolism, possibly by depolymerization reactions, bleaching and repolimerization.
Key words: Coal solubilization, humic substances, El Cerrejón, by Acinetobacter baumannii.
Introducción
La fracción orgánica del carbón es compleja, heterogénea y se organiza en tres fases principales (matriz, bitumen y sustancias húmicas) (Schmiers y Ktipsel, 1997); la matriz comprende un conjunto de estructuras macromoleculares aromáticas y alifáticas de alto peso molecular, similares a la lignina; el bitumen es una mezcla heterogénea de moléculas alifáticas y aromáticas de bajo peso molecular (asfaltenos, ceras, resinas), las sustancias húmicas (SH) son complejos supramoleculares formados por compuestos aromáticos de carácter fenólico, unidos por cadenas alifáticas de diferentes tamaños, exhiben diversos grupos funcionales y compuestos nitrogenados, tanto cíclicos como alifáticos; las SH son generadas por repolimerización de moléculas heterogéneas relativamente pequeñas derivadas de la degradación y descomposición de materiales biológicos (Piccolo, 2002).
Los carbones de bajo rango (CBR) presentan alta humedad, sustancias volátiles, cenizas y bajo contenido de carbono fijado, en consecuencia no son usualmente utilizados para la obtención de energía debido su bajo poder calorífico (Oboirien et al., 2008); por estas razones, los CBR generados en la minería de carbón a cielo abierto se consideran un residuo. Sin embargo, se ha demostrado que los CBR pueden transformarse mediante licuefacción para obtener combustibles limpios y diversas sustancias como materia prima con valor agregado en la industria química, farmacéutica, o para aplicaciones ambientales (Gianoulli et al., 2009); la aplicación más conocida es la extracción de las SH para su utilización como acondicionadores orgánicos del suelo (Piccolo y Mbagwu,1999), estimuladores del crecimiento y desarrollo vegetal (Nardi et al., 2002), o como coadyuvantes en procesos de fitorremediación de suelos contaminados (Bandeira et al., 2009).
Los procesos de transformación del carbón mediante pirolisis, gasificación o licuefacción demandan alta energía, por tanto, resultan inconvenientes económicamente; frente a esta situación se ha estudiado la transformación biológica de CBR mediante la actividad de hongos lignonolíticos (Elbeyli et al., 2006) y bacterias (Wise, 1990), por medio de mecanismos basados en la similaridad entre la estructura química de la lignina, el carbón y las SH. Se ha prestado mayor atención a la biotransformación del CBR por medio de la actividad de las enzimas manganeso peroxidasa, lignino peroxidasa y lacasas en hongos basidiomicetos de la podredumbre de la madera y hongos saprofíticos del suelo; sin embargo, la capacidad de las bacterias para solubilizar el CBR parece estar más asociada a mecanismos no enzimáticos como la producción de agentes surfactantes (Yuan et al., 2006), liberación de agentes quelantes (Bumpus, 1998) y la producción de sustancias alcalinas que disuelven las moléculas solubles y SH presentes en el carbón (Hofrichter and Fakoussa, 2004); pero también se ha asociado a la producción de enzimas laccasas que son secretadas en ambientes naturales para solubilizar lignina (Kiiskinen et al., 2004).
La transformación biológica del carbón es un fenómeno complejo que involucra varios conceptos; el término biotransformación designa la ocurrencia de cualquier cambio en la forma del material mediado por la actividad biológica (Ward, 1991), la solubilización conlleva la formación de sustancias líquidas de color oscuro a partir del carbón en estado sólido, y es debida a la liberación microbiana de enzimas, sustancias alcalinas o agentes quelantes y surfactantes (Steinbüchel, 2001); la decoloración hace referencia a la pérdida de color de los ácidos húmicos cuando son utilizados como sustrato, este proceso está asociado a la disminución de absorbancia a 465 nm y ocurre por depolimerización (Willmann y Fakoussa,1997).
El objetivo de este trabajo fue describir el potencial para la biotransformación de un CBR por medio de cinco cepas bacterianas nativas aisladas en microambientes que han estado en contacto permanente con partículas de carbón en la mina El Cerrejón (Colombia), y aproximarse a los mecanismos expresados por estas bacterias para la biotransformación del CBR, con el propósito de desarrollar futuras aplicaciones biotecnológicas para producir sustancias líquidas de valor agregado a partir del carbón, o SH para aplicaciones en el manejo de suelos, aprovechando la oferta de CBR derivado de la minería del carbón.
Materiales y métodos
Muestras de carbón y sustancias húmicas. Se utilizó un CBR colectado en el manto 40 del frente de extracción denominado Tajo Patilla en la mina El Cerrejón; se tamizó para obtener partículas de 2,36 mm y 300 µm y se aplicó un pretratamiento oxidativo con HNO3 al 10% de acuerdo al protocolo utilizado por Machnikowska et al. (2002). Las SH contenidas en el CBR se extrajeron con álcali siguiendo el protocolo descrito por Sharif (2002), se determinó el porcentaje de carbono en el extracto húmico total (EHT) y las fracciones de ácidos húmicos (AH) y ácidos fúlvicos (AF) siguiendo la metodología descrita por la International Humic Substances Society (IHSS, 2007). El EHT obtenido fue analizado mediante espectroscopia infraroja (FT-IR Nicolet Magna560, con detector MCT/A). El CBR utilizado fue caracterizado para determinar el contenido de metales pesados (As, Co, Pb, V, Cu, Zn, Ni, Cr, B, Mo, Cd), humedad total, contenido de cenizas, poder calorífico, contenido de sustancias volátiles, carbono fijado, azufre, hidrógeno, nitrógeno y oxígeno; minerales presentes en las cenizas (Fe2O3, CaO, MnO2, MgO, SrO, K2O, BaO); todas las determinaciones se realizaron mediante los métodos estándar correspondientes descritos en las normas de la American Society for Testing and Materials (ASTM), estas son las normas de referencia adoptadas para análisis de carbón; los metales pesados se determinaron según la norma D6357, y los minerales en cenizas según la norma D-6349-08; las determinaciones de humedad, cenizas, sustancias volátiles, poder calorífico, S (C, H y N) y O, según las normas D3302-07, D5142-04, D3175-07, D51-42-(04), D-4239-08a métodoB, D-5373-08 y D3176-89(02) respectivamente.
Cultivos bacterianos. Se utilizaron 5 cepas bacterianas denominadas BSC5, BSC7, BSC13, BSC19 y BSC20. BSC5 aisladas de la rizosfera de Typha domingensis, una gramínea que crece sobre sedimentos con abundantes residuos carbonosos procedentes del proceso de lavado de carbón; BSC7 y BSC13 fueron aisladas del sedimento descrito anteriormente, sin presencia de plantas; BSC19 y BSC20 se aislaron de la rizosfera de pasto buffel (Cenchrus ciliaris), una gramínea que crece sobre un depósito de materiales rocosos triturados extraídos en el proceso de excavación en la mina, este material está mezclado con partículas de carbón de diferente tamaño que se fugan de un patio de almacenamiento de carbón. Las cinco cepas bacterianas fueron seleccionadas por su capacidad para crecer abundantemente sobre un medio de cultivo mínimo de sales con carbón en polvo al 5% como única fuente de carbono, diseñado por Wise (1990).
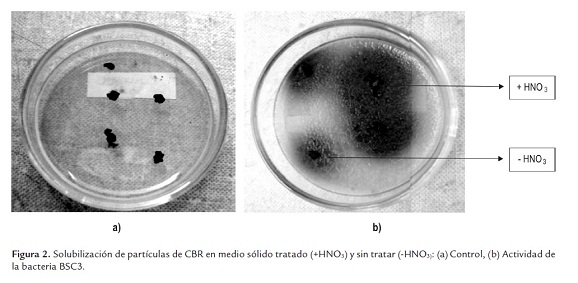
Solubilización de carbón en medio sólido. Los cinco aislamientos bacterianos se cultivaron en forma masiva sobre placa de agar nutritivo (Oxoid), partiendo de un inóculo de 0,5 escala de Mcfarland, se incubaron por 48 horas a 37 °C; posteriormente, sobre la superficie del cultivo masivo se colocaron partículas de carbón estéril de 2,36 mm, tratadas y sin tratar con HNO3 al 10%, se incubaron por 8 días más a 30 °C y se determinó la solubilización a las 24, 48 y 72 horas, midiendo el diámetro de un halo de color marrón formado alrededor de la partícula de CBR, generado por la difusión de sustancias solubilizadas procedentes de la matriz del carbón; como control se colocaron partículas de CBR sobre una placa de agar nutritivo sin crecimiento bacteriano.
Solubilización de carbón en medio líquido. A partir de un inóculo bacteriano de 0,5 escala de Mcfarland en caldo nutritivo (Merck), se tomó 0,1 ml y se inoculó en tubos con 20 ml de caldo nutritivo con adición de 5% (p/v) de partículas de CBR de tamaño inferior a 300 µm, tratado y sin tratar con HNO3, los cultivos se incubaron en agitación por 7 días a 25 ºC, después de la incubación el cultivo se centrifugó a 3200 rpm por 10 min, el sobrenadante de color marrón fue filtrado en papel Whatman N° 42 con un diámetro de poro de 2,5 µm, y se midió la absorbancia del filtrado a 465 nm para determinar la presencia de las sustancias solubles derivadas del CBR que fueron liberadas al medio por actividad bacteriana (Oboiren et al., 2008), se midió el pH inicial y final de los medios de cultivo. La pérdida de peso del carbón se determinó después de lavar tres veces el CBR residual en agua destilada y secarlo en horno a 105 ºC hasta obtener peso constante. Para determinar la concentración de las sustancias solubles con absorbancia a 465 nm producidas a partir del CBR, se elaboró una curva de interpolación con los valores de absorbancia de soluciones de concentración conocida de EHT obtenidos previamente del CBR.
Prueba de depolimerización de sustancias húmicas (SH). Se evaluó esta actividad en caldo nutritivo (CN) y en caldo mínimo de sales (CMS) según la siguiente composición (g/l-1): NH4NO3 2,50, KH2PO4 1,75, MgSO4 0,75, K2HPO4 0,75, NaCl 0,25, ZnSO4 0,088, FeCl3 0,08, CuSO4 0,016, MnCl2 0,014, MoO3 0,007, Co(NO3)2 0,005; a cada uno de los medios se le adicionó SH al 15% (p/v) como fuente de carbono. El inóculo se preparó como fue descrito anteriormente, el cultivo se incubó con agitación a 420 rpm durante 7 días a 30 °C ± 3, después de la incubación se centrifugó a 3200 rpm por 10 min, se filtró el sobrenadante y se midió la absorbancia a 465 nm, la disminución en el valor de absorbancia indica la depolimerización de las SH por la actividad microbiana (Willmann y Fakoussa, 1997).
En cada experimento el diseño fue completamente al azar, se utilizaron tres réplicas para cada tratamiento. Los datos obtenidos para las variables respuesta de los tres experimentos fueron analizados mediante la prueba no paramétrica de Kruskal Wallis, utilizando el programa estadístico SPS versión 14.
Resultados y discusión
Caracterización del carbón y las SH. El carbón utilizado presentó humedad del 28,44%, 11,12% de cenizas, 47,79% de sustancias volátiles, poder calorífico de 4781 Kcal/kg-1, 41,09% de carbono fijado, C 57,75%, S 0,13%, H 2,67%, N 2,3%, O 26,03%; los minerales en cenizas presentan valores de Fe2O3 4,24%, CaO 69,3, MnO2 0,14%, MgO 9,37% SrO 0,89% K2O 0,05% BaO 0,08%. Estos resultados confirman que la muestra de carbón corresponde a un CBR tipo lignito, por su alto contenido de humedad y de materiales volátiles, y poder calorífico menor a 6,390 Kcal/kg-1. La determinación de elementos traza con valores de 0,71, 2,31, 1,73, 1,66, 0,55, 22,43, 3,35, 2,4, 15,11 y 2,52 y 0,08 ppm respectivamente para As, Co, Pb, V, Cu, Zn, Ni, Cr, B, Mo y Cd, indica que el CBR no ofrece riesgo de toxicidad por estos elementos.
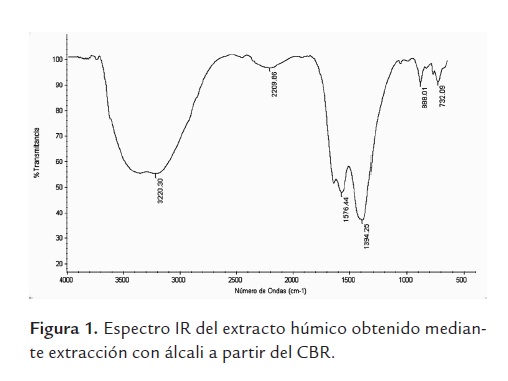
Los valores para el contenido de carbono del extracto húmico total (CEHT), carbono de ácidos húmicos (CAH) y carbono de ácidos fúlvicos CAF fue de 32,91, 24,31 y 8,6% respectivamente. El espectro IR (figura 1) muestra las bandas características para espectros de SH, alrededor de 3400, 1600, 1300 y 1000 ondas/cm-1 (Dick et al., 2002); estas bandas corresponden a los grupos funcionales esperados, que incluyen grupos OH en fenoles, alcoholes y polisacáridos, grupos C = O y COOH, C = C en compuestos aromáticos y N-H; además, hay evidencia de aromaticidad y de uniones covalentes en unidades alifáticas. Los anteriores resultados confirman la presencia de SH en el carbón que se utilizó para el experimento, este hecho permite suponer que al ocurrir el contacto entre el carbón y las bacterias estas pueden actuar sobre el carbón para solubilizarlo y liberar al medio las SH que contiene, debida a la expresión de los mecanismos de acción relacionados con la liberación microbiana de enzimas, sustancias alcalinas o agentes quelantes y surfactantes (Hofrichter y Fakoussa, 2004). A la fecha se ha comprobado que la presencia de microorganismos en la superficie y el interior del carbón, principalmente el lignito, es un fenómeno natural que contribuye a la transformación y evolución de los minerales y la materia orgánica del mismo, no solo cuando es expuesto a la superficie sino también en el interior de los yacimientos (Yossifova et al., 2010; Bulankina et al., 2007).
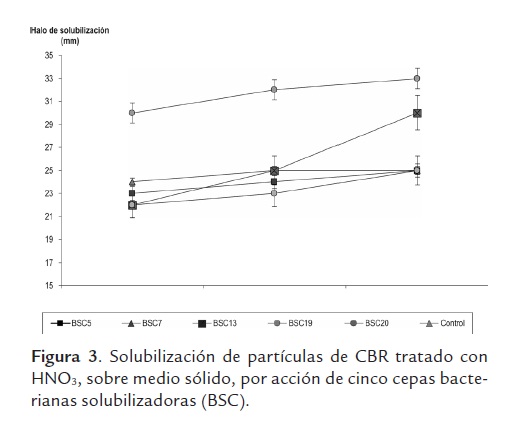
Solubilización de carbón en medio sólido. Las cinco cepas bacterianas estudiadas presentaron actividad solubilizadora en mayor grado sobre las partículas de CBR tratado con HNO3 (figura 2), el diámetro del halo de solubilización aumentó con el tiempo alcanzando valores entre 23 y 33 mm a las 72 horas (figura 3); este efecto ha sido descrito previamente para muestras de carbón de diferente rango, incluyendo carbones duros (Machnikowska et al., 2002). Sobresale la actividad de la BSC7con diferencia significativa sobre las demás bacterias y el control (P< 0,05) que desde las 24 horas registró mayores valores en el diámetro del halo de solubilización.
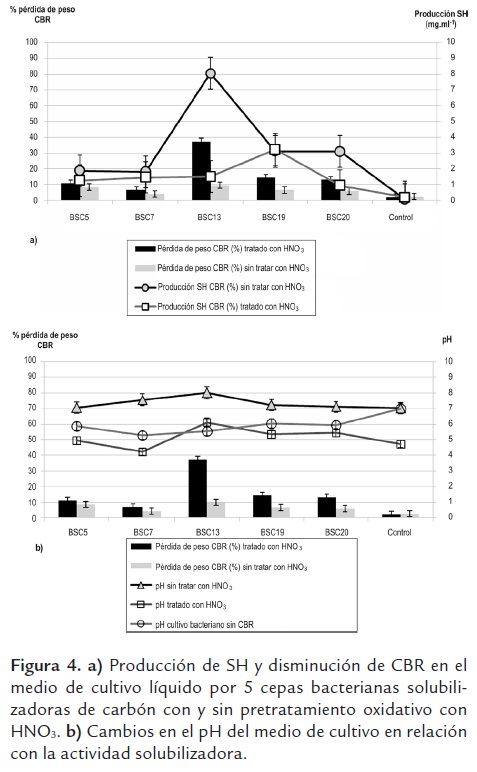
Solubilización de carbón en medio líquido. Los cinco cultivos bacterianos evaluados ocasionaron disminución del CBR con pérdida de peso que va desde el 4,17% hasta el 37,4% (BSC13), la disminución del CBR sólido está acompañada de la aparición de sustancias solubles con absorbancia a 465 nm (figura 4a). En estudios previos se ha comprobado que las sustancias solubles con absorbancia a 465 nm obtenidas por solubilización microbiana del carbón presentan alta similaridad en cuanto a su composición elemental, grupos funcionales y características espectroscópicas, al ser comparadas con SH obtenidas mediante extracción química a partir del mismo carbón (Wilson et al., 1987; Quigley et al., 1988; Filip y Kubát, 2001); estos antecedentes permiten sugerir que las sustancias producidas por la actividad de las cinco cepas bacterianas evaluadas en este estudio pueden ser SH.
Se encontró diferencia significativa (P< 0,05) para el valor promedio de carbón transformado por las bacterias BSC13, 19 y 20 con respecto al control, y las bacterias BSC5 y BSC7, utilizando tanto el carbón pretratado como sin tratar, y diferencia significativa en la producción de SH por todas las bacterias utilizando carbón con y sin pretratamiento previo, pero con disminución en la magnitud de la solubilización, excepto para la BSC19.
La pérdida de peso, tanto del CBR preoxidado con HNO3 (2,55%) y sin oxidar (2,22%), en el tratamiento control indica que ocurre cierto grado de autosolubilización del CBR en el medio de cultivo sin presencia de microorganismos. La biosolubilidad del carbón está correlacionada fuertemente con su grado de oxidación; así, Machnikowska et al. (2002) reportan un mayor rendimiento en la solubilización de CBR mediada por hongos y bacterias al someter el CBR a pretratamiento con HNO3, sin embargo, los resultados demuestran que en este caso el pretratamiento oxidativo no ocasiona un mayor rendimiento en la solubilización con respecto al carbón sin tratar. La biotransformación de un 37,4% de CBR sin pretratamiento oxidativo por la BSC 13 es un porcentaje mayor al rendimiento de extracción de SH con álcali, que fue del 33%, aunque se ha demostrado que la optimización de la metodología con extracciones sucesivas puede alcanzar rendimientos hasta del 60,85% de material húmico potencialmente extractable de este tipo de carbones (Siong et al., 2007).
Utilizando CBR sin tratamiento ácido se observó transformación del mismo con incremento del pH en los cultivos con respecto al valor inicial (pH = 7,02) y al valor de pH final en los cultivos bacterianos sin adición de CBR (figura 4b), este resultado se puede relacionar con la solubilización bacteriana del CBR por mecanismos no enzimáticos como la producción de sustancias alcalinas que disuelven las moléculas solubles y sustancias húmicas de la matriz del carbón, como ha sido reportado por Hofrichter y Fakoussa (2004) o, en segundo lugar, por el carácter alcalino de los metabolitos producidos por la solubilización del CBR. Sin embargo, utilizando CBR pretratado con HNO3 hubo menor porcentaje del mismo transformado y, a la vez, los valores de pH final en el medio de cultivo fueron más bajos que en en los cultivos bacterianos sin CBR, excepto para la BSC13 que a su vez presentó la mayor actividad sobre el CBR. Los resultados descritos sugieren que las bacterias evaluadas expresaron la producción de metabolitos alcalinos como mecanismo para solubilizar el CBR, también se puede sugerir que este mecanismo es inducido por la presencia del CBR en el medio, pero al utilizarlo pretratado su acción es neutralizada por el HNO3 residual que en medio líquido se puede difundir desde la matriz del CBR.
La cepa BSC13 que presentó la mayor actividad fue identificada mediante la amplificación por PCR de una región de 1465 pb del gen rDNA16S utilizando los iniciadores 27F, 1492R, 518F y 800R, los productos de la reacción fueron secuenciados y ensamblados en una secuencia consenso problema, la comparación con bases de datos de referencia del Centro Nacional de Biotecnología de los Estados Unidos (NCBI) generó la clasificación taxonómica mediante la elaboración de un árbol filogenético del grupo de secuencias con mayor similitud a la secuencia consenso; así se determinó que este aislamiento corresponde a Acinetobacter baumannii. str. CCGE2017 con un 99% de identidad con el identificador 569106 del gene bank.
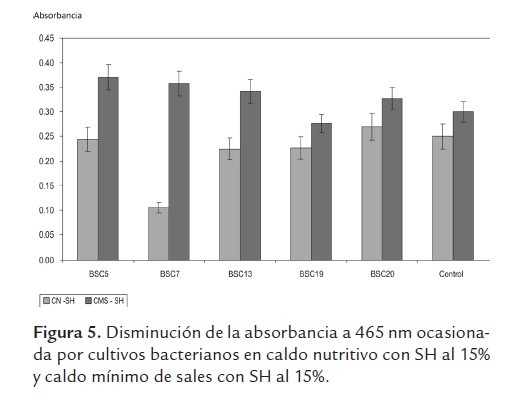
Depolimerización de SH. Se presentó disminución en la absorbancia en todos los cultivos bacterianos en caldo nutritivo con sustancias húmicas (CN-SH) con respecto al tratamiento control, excepto para la BSC20, pero la diferencia solo fue significativa (P<0,05) para las BSC7 y 13; en el caldo mínimo de sales (CMS-SH) solo hubo una leve disminución en la absorbancia para la BSC19, para los demás cultivos bacterianos hubo incremento en los valores de absorbancia con respecto al tratamiento control pero son diferencias significativas (figura 5). Se sabe que los mismos mecanismos enzimáticos responsables de la biosolubilización de CBR también pueden desencadenar depolimerización de las SH una vez liberadas de la matriz del carbón, estos sistemas enzimáticos presentan una regulación compleja que depende de la presencia de fuentes de nitrógeno y fuentes adicionales de carbono de fácil asimilación (Bublitz et al., 1994). En la degradación de lignina por bacterias, estas utilizan primero la glucosa para su crecimiento y luego la lignina como co-metabolito (Jeffries et al., 1981), lo anterior sugiere que en este caso el fenómeno de depolimerización de SH puede estar asociado a fenómenos de cometabolismo, dado que solo se presentó una disminución marcada en la absorbancia en caldo nutritivo, mas no en caldo mínimo de sales. Incrementos en los valores de absorbancia en el caldo mínimo de sales pueden indicar que tras la depolimerización de SH por mecanismos no enzimáticos (sustancias alcalinas y agentes quelantes), la concentración de los productos de la solubilización inducen reacciones de repolimerización mediados por la acción de enzimas extracelulares (principalmente lacasas), hecho demostrado por Hofrichter y Fritsche (1997). Ecológicamente, fenómenos como la solubilización de carbón por cometabolismo y la repolimerización de los productos resultan adecuados como una forma de controlar el consumo o la degradación completa de los materiales húmicos en el suelo (Kydralieva, 2006), puesto que es conveniente que permanezcan allí para poder desencadenar los efectos físicos y químicos sobre el suelo y los efectos fisiológicos benéficos sobre las plantas (van Trump et al., 2006).
Conclusiones
Se demostró que las bacterias nativas aisladas de microambientes que han estado en contacto permanente con partículas de carbón presentan la capacidad de solubilizar el CBR en medio sólido y en medio líquido, como resultado ocasionan pérdida de peso del carbón y la consecuente producción de sustancias coloreadas con absorbancia a 465 nm, que posiblemente corresponden a las SH contenidas en la macroestructura del CBR. El pretratamiento oxidativo del CBR con HNO3 incrementa su solubilización en medio sólido pero no en medio líquido. Se encontró evidencia para sugerir que las bacterias producen sustancias alcalinas que disuelven el CBR; estas bacterias también presentan la capacidad de depolimerizar las SH presentes en el CBR, posiblemente por cometabolismo. Los hallazgos demuestran la posibilidad de uso de las bacterias estudiadas, especialmente la BSC13 (Acinetobacter baumannii), para la solubilización del CBR producido en la mina El Cerrejón, para producir SH que posteriormente pueden tener diferentes aplicaciones.
Agradecimientos
Los autores agradecen a la Universidad Popular del Cesar, Carbones del Cerrejón Limited y Colciencias por la financiación de la presente investigación desarrollada en el marco del proyecto "Evaluación de carbones meteorizados generados en El Cerrejón para su aprovechamiento como materia prima en la producción de enmiendas orgánicas", según convenio RC-591-2008.
Referencias bibliográficas
1 Bandeira, M., Mosca, G., Vamerali, T. 2009. Humic acids affect root characteristics of fodder radish (Raphanus sativus L. var. oleiformis Pers.) in metal-polluted wastes. Desalination, 246: 78-91. [ Links ]
2 Bublitz, F., Günther, T., Fritsche, W. 1994. Screening of fungi for the biological modification of hard coal and coal derivatives. Fuel Processing Technology, 40 (2-3): 347-354. [ Links ]
3 Bulankina, M. A., Lysak, L. V., Zvyagintsev, D. G. 2007. Lignite microorganisms. Biology Bulletin, 34 (2): 194-197. [ Links ]
4 Bumpus, J., Senko, J., Lynd, G., Morgan, R., Sturm, K., Stimpson, J., Roe, S. 1998. Biomimetic solubilization of a low rank coal: Implications for its use in methaneproduction. Energy and Fuels, 12: 664-671. [ Links ]
5 Dick, D., Mangrich, A., Menezes, S. M., Pereira, B. 2002. Chemical and Spectroscopical Characterization of Humic Acids from two South Brazilian Coals of Different Ranks. J. Braz. Chem. Soc., 13 (2) 177-182. [ Links ]
6 Elbeyli, I., Palantoken, A., Piskin, S., Kuzu, H., Peksel, A. 2006. Liquefaction/Solubilization of Low-Rank Turkish Coals by White-Rot Fungus (Phanaerochete chrysosporium). Energy Sources, 28 (11): 1063-1073. [ Links ]
7 Filip, Z., Kubát, J. 2001. Microbial utilization and transformation of humic substances extracted from soils of long-term field experiments. Eur. J. Soil Biol., 37: 167-174. [ Links ]
8 Giannouli, A., Stavros, K., Siavalas, G., Chatziapostolou, A., Christanis, K., Papazisimou, S., Papanicolaou, C., Foscolos, A. 2009. Evaluation of Greek low-rank coals as potential raw material for the production of soil amendments and organic fertilizers. International Journal of Coal Geology, 477 (3-4): 383-393. [ Links ]
9 Hofrichter, M., Fakoussa, R. 2004. Microbial degradation and modification of coal. In: Steinbüchel, A. (ed.). Biopolymers, vol 1. Lignin, humic substances and coal. Weinheim: Wiley-VCH. [ Links ]
10 Hofrichter, M., Fritsche, W. 1997. Depolymerization of low-rank coal by extracellular fungal enzyme systems. II. The ligninolytic enzymes of coal-humic-acid-depolimerizing fungus Nematoloma frowardii b19. Appl. Microbiol. Biotechnol., 47: 419-424. [ Links ]
11 International Humic Substances Society (IHSS) 2007. Isolation of IHSS soil fulvic and humic Acids. www.ihss.gatech.edu/soilhafa.html. [ Links ]
12 Jeffries, T., Choi, W., Kirk, S. (1981). Nutritional degradation of lignin degradation by Phanerochaete chrysosporium. Appl. Environ. Microbiol. Rev., 13: 125-135. [ Links ]
13 Kidralieva, K. 2006. Biodegradation of soil humic subsatances by autochtonous microorganisms. Geophysical Research Abstracts, 8: 3 -12. [ Links ]
14 Kiiskinen, L., Rato, M., Kruus, K. 2004. Screening for novel laccasa - producing microbes. Journal of applied microbiology, 97: 640-646. [ Links ]
15 Machnikowska, H., Pawelec, A., Podgorska, A. 2002. A microbial degradation of low rank coals. Fuel Processing Technology, 77 (78): 17-23. [ Links ]
16 Nardi, S., Pizzeghello, D., Muscolo, A., Vianello, A. 2002. Physiological effects of humic substances on higher plants. Soil Biol. Biochem., 34: 1527-1536. [ Links ]
17 Oboirien, B., Burton, S., Cowan, D., Harrison, S. 2008. The effect of the particulate phase on coal biosolubilisation mediated by Trichoderma atroviride in a slurry bioreactor. Fuel Processing Technology, 89 (2): 123-130. [ Links ]
18 Piccolo, A., Mbagwu, J.1999. Role of hydrophobic components of soil organic matter on soil aggregate stability. Soil Sci. Soc. Am. J., 63: 1801-1810. [ Links ]
19 Piccolo, A. 2002. The supramolecular structure of humic substances: A novel understanding of humus chemistry and implications in soil science. Advances in Agronomy, 75: 57-134. [ Links ]
20 Quigley, D., Wey, J., Breckenridge, C., Stoner, D. 1988.The influence of pH on biological solubilization of oxidised low rank coal. Science Direct, 1: 163-174. [ Links ]
21 Schmiers, H., Ktipsel, R.1997. Macromolecular structure of brown coal in relationship to the degradability by microorganisms. Fuel processing technology, 52: 109-114. [ Links ]
22 Sharif, M., Khattak, R., Sarir, M. 2002. Effect of different levels of lignitic coal derived humic acid on growth of maize plants. Commun. Soil Sci. Plant Anal., 33: 3567-3580. [ Links ]
23 Siong, F., Lau, S., Norrafidah, B., Haslinda, M. 2007. A comparative evaluation on the oxidative approaches for extraction of humic acids from low rank coal of Mukah Sarawak. J. Braz. Chem. Soc., 18 (1): 34-40. [ Links ]
24 Steinbüchel, A. 2001. Biopolymers. Vol. 1: Lignin, Humic Substances and Coal. Weinheim: Institute of Microbiology, University of Münster. Wiley-VCH. [ Links ]
25 van Trump, J. I., Sun, I., Coates, J. D. 2006. Microbial Interactions with Humic Substances. Advances in Applied Microbiology, 60: 55-96. [ Links ]
26 Ward, B. 1991. Isolation and application of coal-solubilizing microorganisms. In: Donald L.Wise (ed.). Bioprocessing and biotreatment of coal. Boston: Northesastern University, Marcel Dekker. [ Links ]
27 Willmann, G., Fakoussa, R. 1997. Biological bleaching of water-soluble coal macromolecules by a basidiomycete strain. Appl. Microbiol. Biotechnol., 47: 95-101. [ Links ]
28 Wilson, B., Bean, R., Franz, T. 1987. Microbial conversion of low rank coal: characterization of biodegraded product. Energy and Fuels, 1: 80-84. [ Links ]
29 Wise, D. 1990. Bioprocessing and biotreatment of coal. New York: CRC Press. [ Links ]
30 Yossifova, M. P., Valceva,S. P., Nikolova, S. F. 2010. Exogenic microbial activity in coals. Fuel Prosscesing Technology (in press). [ Links ]
31 Yuan, H., Yang, H., Wang, F., Chen, W. 2006. Degradation and solubilization of chinesse lignite by Penicillium sp p6. Applied Biochemistry and Microbiology, 42 (1): 52-55. [ Links ]