Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol v.13 n.1 Bogotá jan./jun. 2011
ARTÍCULO DE INVESTIGACIÓN
Multiplicación en sistemas de inmersión temporal y enraizamiento ex vitro de ocumo blanco (Xanthosoma sagittifolium (L.) Schott)
Multiplicación en sistemas de inmersión temporal y enraizamiento ex vitro de ocumo blanco (Xanthosoma sagittifolium (L.) Schott)
Jorge Vilchez 1 , Nilca Albany 2 , Leonardo Martínez 3 , Miguel Molina 4 , Carolina Pirela 5 , Mireya Molina 5 , Carlos Alvarez 5 , Jorge Chirinos 5
1Profesor Asociado. Magíster en Biotecnología Vegetal, Departamento de Botánica, Laboratorio de Fisiología Vegetal "Merylin Marin", Facultad de Agronomía, Universidad del Zulia, República Bolivariana de Venezuela. jvilchezp@fa.luz.edu.ve
2 Profesora Asociado. Magíster en Biotecnología Vegetal, Departamento de Química, Facultad de Agronomía, Universidad del Zulia, República Bolivariana de Venezuela. nalbany@fa.luz.edu.ve
3Asistente de Campo y Laboratorio. Ingeniero Agrónomo, Departamento de Botánica, Laboratorio de Fisiología Vegetal "Merylin Marin" Facultad de Agronomía, Universidad del Zulia, República Bolivariana de Venezuela. ljmartinez@fa.luz.edu.ve
4 Asistente de laboratorio. Técnico superior en Química, Departamento de Química, Facultad de Agronomía, Universidad del Zulia, República Bolivariana de Venezuela. mmolina@fa.luz.edu.ve
5 Ingenieros Agrónomos. Laboratorio de Biotecnología "Profa. Silvia León de Sierralta", Facultad de Agronomía, Universidad del Zulia, República Bolivariana de Venezuela.
Recibido: septiembre 12 de 2010 Aprobado: mayo 30 de 2011
Resumen
El ocumo (Xanthosoma sagittifollium (L.) Schott) es una Arácea cultivada en países tropicales debido al valor nutritivo de sus cormos. La principal limitante para su cultivo es la carencia de semilla de calidad, por esta razón se planteó evaluar la multiplicación de brotes de ocumo blanco en sistemas de inmersión temporal, y el enraizamiento ex vitro de los mismos, para lo cual se estudió el tiempo y la frecuencia de inmersión, y la densidad de explantes sobre la proliferación de los brotes. Asimismo, el efecto del ácido indolacético (AIA) y ácido indolbutírico (AIB) sobre el enraizamiento ex vitro de brotes. De acuerdo con los resultados obtenidos, la mayor eficiencia en la proliferación de brotes se obtuvo utilizando el sistema de inmersión temporal del tipo RITA®, con una frecuencia y tiempo de inmersión de 6 veces/día y 5 min, respectivamente, y una densidad de 9 explantes/RITA®. En el enraizamiento ex vitro se determinó que bajo las condiciones de cultivo empleadas no es necesario el uso de auxinas. Se concluye que es posible la multiplicación eficiente de ocumo blanco en sistemas de inmersión temporal, y realizar el enraizamiento ex vitro sin el uso de auxinas.
Palabras clave: aclimatización, frecuencia de inmersión, medio de cultivo líquido, tiempo de inmersión, RITA®.
Abstract
The white cocoyam (Xanthosoma sagittifollium (L.) Schott), is an Arácea cultivated in tropical countries, due to the nutritional value of its corms. The main limiting factor for cultivation is the lack of healthy seed, by this reason be outlined to evaluate the multiplication of shoots of white cocoyam in temporary immersion systems and the ex vitro rooting of the same. For that which, itself study, the time and frequency of immersion and the density of explants on the proliferation of the shoots. As well as, the effect of the indole acetic acid (IAA) and indole butyric acid (IBA) on ex vitro rooting the shoots was studied. According to the results obtained, the greater efficiency in the proliferation of shoots was obtained utilizing the temporary immersion system of the type RITA®, with a frequency and time of immersion of 6 times/day and 5 min, respectively and a density of 9 explantes/RITA®. In the ex vitro rooting was determined that under the conditions of employed cultivation is not necessary the use of auxins. It is concluded that is possible the efficient multiplication of white cocoyam in temporary immersion systems and to carry out the ex vitro rooting without the use of auxins.
Key words: Acclimatation, liquid media, immersion time, immersion frecuency, RITA®.
Introducción
Las tendencias actuales en la agricultura están orientadas hacia la búsqueda de especies de cultivo que contribuyan al abastecimiento de alimento a bajo costo, protección de los recursos naturales, equidad y alivio de la pobreza. El cultivo de especies con raíces y tallos reservantes cumple en su mayoría con estos requisitos. Dentro del grupo de tallos reservantes comestibles de importancia agrícola se encuentran los géneros Xanthosoma y Colocasia de la familia de las Aráceas (Blanco y Valverde, 2004).
Xanthosoma sagittifolium (L.) Schott es comúnmente conocido en Venezuela como ocumo blanco, y como malanga, quequisque, taro o yautía en las Antillas, Centroamérica y Suramérica. Por el alto valor nutricional de sus cormos o cormelos puede ser sustituto de la papa y su contenido de almidón es superior al de la yuca; además, el tamaño del grano de almidón es extremadamente pequeño (de 1 a 3 µm), lo que le permite que se recomiende como dieta alimenticia por su alta digestibilidad (López et al., 1995). En algunos países las hojas del ocumo blanco son consumidas como hortaliza (Seganfredo et al., 2001).
La propagación de este cultivo es asexual, a partir de la siembra de cormelos o fragmentos del cormo, esto tiene como ventaja el mantenimiento de la identidad y estabilidad genética de la descendencia. Sin embargo, este método de propagación tiene como desventaja la diseminación de plagas y enfermedades virales, fungosas y bacterianas (Zeledon, 2006), que pueden disminuir el rendimiento del cultivo (Rodríguez et al., 1999). Una de las principales limitantes para la producción de esta especie por los pequeños y medianos productores es la falta de semilla de calidad (Matheus et al., 2006). Esta limitación puede ser satisfecha principalmente con la implementación de técnicas de propagación in vitro a partir de yemas axilares y ápices caulinares de ocumo (Saucedo et al., 2008).
En el protocolo de micropropagación de cualquier especie, algunos puntos claves son: la fase de multiplicación por ser la más costosa debido al uso de agentes gelificantes y mano de obra especializada (Pérez et al., 1998; Adelberg et al., 2007); la fase de enraizamiento, la más voluminosa, pues en ella cada brote, esqueje o yema debe crecer y desarrollar un tallo o pseudotallo y las primeras raíces (Orellana, 1998), y la fase de aclimatización, donde se registran las mayores pérdidas de plantas como consecuencia del cambio brusco de condiciones ambientales controladas por un ambiente con temperaturas más altas y humedad relativa más baja, estresante para la vitroplanta (van Huylenbroeck et al., 1998).
Las principales medidas que pueden adoptarse para dar respuesta a lo anteriormente planteado son el uso de medios de cultivos líquidos como vía para reducir los costos y posibilitar la automatización de la micropropagación (Preil, 2005). Otra de las medidas es el enraizamiento ex vitro, que permitiría una reducción de los costos de un 30 al 60% (Agramonte et al., 1998). Además, sería posible acortar el tiempo del protocolo de micropropagación, con lo cual se generaría una reducción de la utilización de instalaciones con condiciones controladas durante la fase de enraizamiento in vitro (Saucedo et al., 2008).
Considerando la gran importancia económica del ocumo blanco para Venezuela y países de Centroamérica, Suramérica y el Caribe, así como la utilidad de la micropropagación como método de propagación masiva de plantas, se realizó la presente investigación, cuyo objetivo fue evaluar la multiplicación de brotes de ocumo blanco en sistemas de inmersión temporal y el enraizamiento ex vitro de los mismos.
Materiales y métodos
Esta investigación se llevó a cabo en el laboratorio de biotecnología vegetal "Profa. Silvia León de Sierralta", de la Facultad de Agronomía de la Universidad del Zulia.
El material vegetal empleado en los ensayos lo constituyeron brotes de ocumo blanco (Xanthosoma Sagittifolium (L.) Schott) establecidos in vitro a partir de plantas madres obtenidas de la finca Casa de Zinc ubicada en sector la Alemania-Socuy, de la parroquia José Ramón Yépez, municipio Jesús Enrique Losada. Los ensayos se realizaron bajo las condiciones de cultivo: temperatura de 26 ± 1 °C, intensidad lumínica de 215 µmol/m-2/s-1, bajo luz blanca fluorescente continua, y humedad relativa promedio de 46%.
Tiempo y frecuencia de inmersión en la multiplicación in vitro de ocumo blanco en sistemas de inmersión temporal tipo RITA®
Para desarrollar un método de micropropagación eficiente en sistemas de inmersión temporal es esencial optimizar los parámetros técnicos para cada cultivo, siendo el tiempo y la frecuencia de inmersión los parámetros más críticos del sistema. Para determinar dichos parámetros mediante un diseño factorial se evaluaron dos frecuencias (3 y 6 veces al día), dos tiempos de inmersión (5 y 10 min), y un control en medio de cultivo semisólido para un total de cinco tratamientos. El sistema de inmersión temporal utilizado fue el tipo RITA® (recipiente de inmersión temporal automatizado, Cirad, Francia) cuyo funcionamiento y características son descritas por Etienne y Berthouly (2002).
La repetición la constituyó un RITA® y se evaluaron cuatro repeticiones por tratamiento, cada uno con 200 mL de medio de cultivo de MS y diez frascos de vidrio, con 25 mL de medio de cultivo gelificado con 6 g/L-1 de Agargel (Sigma Co) como control. En cada RITA® se cultivaron seis brotes y en los frascos de vidrios tres explantes en cada uno.
En todos los tratamientos se emplearon brotes de un cuarto subcultivo (cada subcultivo de 4 semanas). El medio de cultivo estuvo constituido por las sales y vitaminas de MS (Murashige y Skoog, 1962), suplementado con 3 mg/L-1 de N6-bencilaminopurina (BAP), 30 g/L-1 de sacarosa. Después de cuatro semanas de cultivo se evaluaron las variables: promedio de brotes totales, promedio de brotes menores a 5 mm, promedio de brotes mayores a 5 mm, altura del brote —medida en centímetros desde la base del cormo hasta la zona distal de la hoja del brote más largo—, y el promedio de masa fresca, el cual se calculó dividiendo la sumatoria de la masa de los explantes por recipiente de cultivo entre el número de explantes sembrados. En el momento de la siembra in vitro de los brotes se les realizó un corte transversal por encima del meristemo central, a una altura de 2,5 cm, a fin de homogeneizar su tamaño.
Densidad de brotes de ocumo blanco en sistemas de inmersión temporal tipo RITA®
Con el fin de determinar la cantidad de propágulos de ocumo blanco para sembrar en cada unidad RITA®, durante la fase de multiplicación se evaluaron tres densidades de 6, 9 y 12 brotes por cada RITA®. El número de repeticiones fue de cinco por cada densidad. El medio de cultivo utilizado fue similar al señalado en el experimento 1. A las cuatro semanas se evaluaron las variables:
Número de brotes, número de brotes mayores a 5 mm, y menores a 5 mm, altura del brote e índice de incremento de crecimiento (IIC). El IIC se calculó mediante la fórmula (Vilchez et al., 2009): IIC = (MT-MBI) x MBI-1, donde MT es la masa fresca total, que incluye la masa de todo el brote inicial, de los brotes emitidos y de las hojas, y MBI es la masa del brote inicial. Al igual que en el ensayo anterior, en el momento de la siembra in vitro de los brotes se les realizó un corte transversal por encima del meristemo central, a una altura de 2,5 cm a fin de homogeneizar su tamaño; posteriormente, el grupo de brotes que conformaron cada repetición se pesaron en una balanza de precisión (Ohaus modelo Adventurer), constituyendo de esta manera la MBI. Transcurridas cuatro semanas de cultivo en los RITA, el grupo de brotes que conformaron cada repetición se pesaron nuevamente en la balanza de precisión, constituyendo esta pesada el MT.
En todos los ensayos el pH del medio de cultivo se ajustó a 5,8 con soluciones 0,5 M de NaOH o HCl según el caso, y posteriormente fue esterilizado en autoclave a 121 °C y 1,1 kg/cm-2 durante 20 min.
Enraizamiento ex vitro de brotes de ocumo blanco
Para inducir la formación de raíces adventicias en brotes de ocumo blanco se emplearon brotes provenientes de la fase de multiplicación in vitro de un décimo subcultivo, los cuales se cultivaron previamente en medio de cultivo de MS libre de reguladores de crecimiento por un periodo de cuatro semanas. Esto con el fin de reducir el efecto de la citoquinina, favorecer el alargamiento de los brotes y homogeneizar su tamaño a 5-6 cm de altura.
Los brotes se sembraron en bandejas de germinación plásticas negras de 75 mL de capacidad por hoyo, bajo condiciones de cámara húmeda con una temperatura de 25 °C y 75% de humedad relativa. El sustrato utilizado fue una mezcla de arena lavada y abono río (2:1). Este último es un abono orgánico que resulta de la descomposición del material vegetal acumulado en la desembocadura de los ríos. Este sustrato se esterilizó en autoclave por un periodo de 60 min. Los tratamientos evaluados fueron tres combinaciones de ácido indolacético (AIA) y ácido naftalenacético (ANA), y un control sin auxina: T1. 125 mg/L-1 de AIA + 125 mg/L-1 de ANA; T2. 250 mg/L-1 de AIA + 250 mg/L-1 de ANA; T3. 500 mg/L-1 de AIA + 500 mg/L-1 de ANA; T4. 0 mg/L-1 de AIA + 0 mg/L-1 de ANA (Control).
La formulación de los reguladores de crecimiento fue en forma de polvo. El número de repeticiones por tratamiento fue de ocho y la unidad experimental estuvo constituida por tres brotes.
Como tratamiento preventivo los brotes fueron sumergidos por 5 min en una solución fungicida constituida por Ridomil® (Metalaxil + Mancozeb) a razón de 3 g/L-1, antes de la aplicación de la combinación de auxinas.
Después de cuatro semanas se evaluaron las variables número de raíces, longitud de la raíz más larga, porcentaje de brotes enraizados y porcentaje de sobrevivencia. Los porcentajes se calcularon con base en el total de brotes por repetición. Dada la importancia del proceso de aclimatización en condiciones ex vitro implícito en este experimento también se evaluaron las variables número y longitud de hojas.
Todas las variables estudiadas fueron analizadas estadísticamente mediante varianza simple, y se realizó la prueba de comparación de medias por Tukey, cuando las variables arrojaron diferencias estadísticas. Los valores de las variables expresadas en porcentaje X’ = 2 x arcfueron transformados por X’ = 2 x arcsen ( √ ( X / 100 ) + 0,5 )). Todos los análisis estadísticos se realizaron con el programa computarizado Statistix versión 8.0 para ambiente Windows de Microsoft® (Statistix, 2008).
Resultados y discusión
Tiempo y frecuencia de inmersión en la multiplicación in vitro de ocumo blanco en sistemas de inmersión temporal tipo RITA®
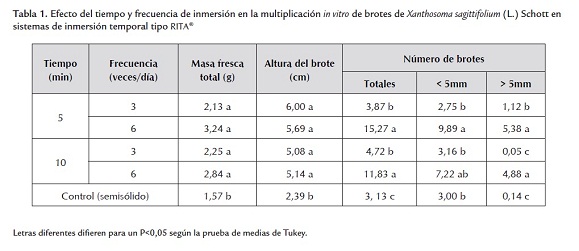
En la tabla 1 se muestran los valores de las variables masa fresca total, altura del brote, número de brotes mayores a 5 mm, menores a 5 mm y brotes totales evaluados después de cuatro semanas de cultivo.
El cultivo de brotes de ocumo blanco en sistemas de inmersión temporal tipo RITA® produjo los mayores valores de número de brotes totales, tratamiento que difirió del control (tabla 1). La mayor cantidad de brotes totales se obtuvo al realizar 6 inmersiones al día con tiempos de 5 min o 10 min, respuesta que fue estadísticamente similar. Alvard et al. (1993) señalaron que la duración de la inmersión del explante es probablemente el factor que merece mayor atención en el diseño de sistemas de cultivo basado en la inmersión temporal. Berthouly y Etienne (2005) señalan la existencia de un periodo de adaptación cuando se emplean bajas frecuencias de inmersión, debido a un estrés causado por la desecación de los brotes entre cada inmersión, que posteriormente es recuperado.
Zeledon (2006), con un tiempo de inmersión de 7 min tres veces al día indicó un valor para el número de brotes de 1,63 brotes/explante, y Dottin (2000) con un tiempo de inmersión de 10 min 3 veces al día obtuvo 13,2 brotes de ocumo cv. México 8 al cultivarlo en sistema de inmersión temporal. Los valores de número de brotes reportados por estos autores son inferiores a los encontrados en este experimento (15,27 brotes) empleando un tiempo de inmersión de 5 min y seis veces al día.
Los mayores valores de masa fresca de brotes se obtuvieron en sistemas de inmersión temporal, siendo estadísticamente diferentes a los valores obtenidos con el control (tabla 1). Aunque no se detectaron diferencias entre las combinaciones de tiempo y frecuencia de inmersión evaluadas, se observó que existe una tendencia a obtener valores superiores de masa fresca cuando se realizan más inmersiones al día, lo cual pudiera estar relacionado con las relaciones hídricas, el intercambio gaseoso y el incremento de la toma de nutrientes que se logra en esta forma de cultivo (Escalona et al., 1999). Aspectos que de alguna forma favorecen el crecimiento y desarrollo vegetal. En este sentido, Berthouly y Etienne (2005) señalaron que el tiempo y la frecuencia de inmersión varían considerablemente dependiendo de la especie y el objetivo para el cual se utilizan los sistemas de inmersión temporal (organogénesis, brotes, germinación de embriones, etc.), debido a que dichos parámetros están muy relacionados con la asimilación de nutrientes.
La variable altura de los brotes cultivados en las unidades RITA® difirió significativamente de la registrada en medio de cultivo semisólido. Sin embargo, no se observaron diferencias con relación al tiempo y la frecuencia de inmersión (tabla 1). En este sentido, Albany et al. (2005) señalaron que el cultivo en sistema de inmersión temporal promueve un mayor desarrollo de los brotes, que en algunos casos puede llegar a ser excesivo. La mayor altura de los brotes de ocumo en los sistema de inmersión temporal tipo RITA® pudo ser consecuencia de una mayor disponibilidad de los nutrientes ya que se ha señalado que la absorción de estos se encuentra reprimida en los medios de cultivo semisólidos (Smith y Spoomer, 1995).
Desde el punto de vista práctico, para el manejo de los brotes en la fase de multiplicación in vitro se deberían seleccionar los brotes mayores a 5 mm para facilitar su manipulación; brotes menores a 5 mm tienen pocas reservas y son poco vigorosos, lo que se traduce en un crecimiento lento en subcultivos posteriores, si son separados del brote madre, estos deben dejarse unidos a dicho brote hasta que estén aptos para crecer independientemente del tejido que les dio origen.
Un comportamiento similar al observado en este experimento para la variable altura del brote se ha reportado para otras especies como Anturium andraeanum (Del Rivero et al., 2004), D. alata (Cabrera et al., 2004) y D. cayenensis - D. rotundata (Cabrera et al., 2008).
Densidad de brotes de ocumo blanco en sistemas de inmersión temporal tipo RITA®
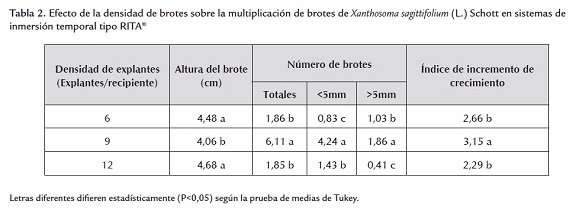
Después de seis semanas de cultivo, el análisis estadístico detectó diferencias para las variables evaluadas número de brotes totales, número de brotes mayores a 5 mm, número de brotes menores a 5 mm, altura del brote e índice de incremento de masa fresca (tabla 2). El mayor valor para el número de brotes se encontró con la densidad de 9 brotes/recipiente, siendo este valor estadísticamente superior a las otras densidades evaluadas. En este experimento se pudo observar que por encima o por debajo de 9 brotes/recipiente, el número de brotes totales disminuía. Este comportamiento fue similar para las variables número de brotes menores a 5 mm y brotes mayores a 5 mm. Probablemente, la disminución observada para el número de brotes mayores a 5 mm en la densidad 12 brotes/recipiente pudiera estar relacionada por estrés en el brote debido a la competencia por nutrientes (Pérez et al., 1998), lo cual se evidenció por la clorosis que presentaron algunos brotes en sus hojas más viejas.
Etienne y Berthouly (2002) destacaron que la densidad de explantes es un factor determinante en un protocolo de micropropagación, pero que ha sido poco estudiado en sistemas de inmersión. Los criterios para establecer la misma han sido tomados a partir de las experiencias prácticas, conociendo el comportamiento de especies afines o simplemente se establece una densidad sobre la base de que el explante disponga de una cantidad de medio de cultivo. En otros casos se considera el diámetro de vaso de cultivo y se maneja la misma densidad para todas las especies (Zeledon, 2006).
En otras especies como Psidium guajava L. (De Feria et al., 2003), D. alata L. (Cabrera et al., 2004), Sacharum sp y Musa AAAB (Posada et al., 2003), se ha reportado comportamiento similar al encontrado en este ensayo para el número de brotes totales.
Con la densidad de 9 brotes/recipiente se obtuvo el máximo valor de brotes totales, de brotes menores a 5 mm y brotes mayores a 5 mm. Esto sugiere que con dicha densidad se logró mayor eficiencia para la multiplicación in vitro de ocumo en sistema de inmersión temporal tipo RITA®. Además, se alcanzó la mayor cantidad de brotes separables del brote madre o inicial para el subcultivo. Salazar y Hoyos (2007) señalan que una densidad de siembra baja en sistemas de inmersión temporal sería inadecuada porque se subutilizarían los recipientes de cultivo y se ocasionaría pérdida de medio de cultivo. Por otro lado, si se opta por una alta densidad de siembra se podría generar un crecimiento limitado de los brotes y una baja en su proliferación.
Con las densidades de 6 y 12 brotes/recipiente se obtuvieron los máximos valores promedios de altura de brotes (tabla 2), los cuales difirieron estadísticamente de la densidad de 9 explantes/recipiente. Es evidente que la menor altura con la densidad de 9 explantes/recipiente es causada por un desvío de la producción de biomasa hacia la formación de brotes en detrimento del desarrollo de los mismos. Esto se puede reafirmar con el índice de incremento de crecimiento. Esta variable registró los mayores valores con la densidad de 9 explantes/recipiente.
Enraizamiento ex vitro de brotes de ocumo blanco
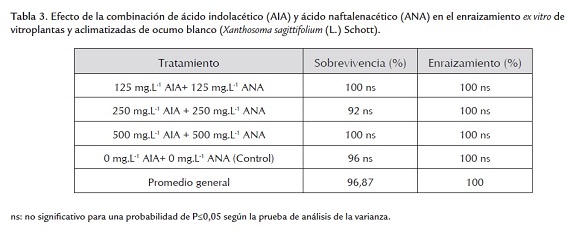
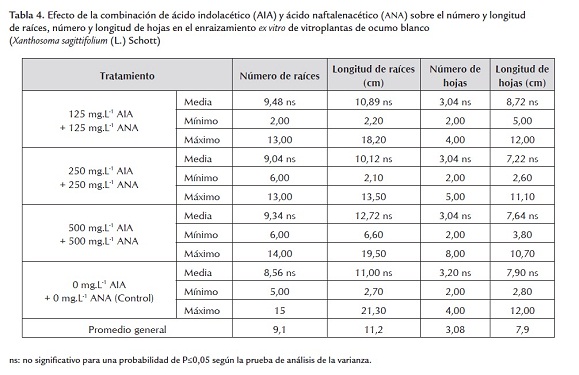
Después del periodo de evaluación, el análisis no detectó diferencias estadísticas significativas para las variables evaluadas (tablas 3 y 4), por lo que se determinó el promedio general de las mismas y sus valores máximos y mínimos para su discusión.
El porcentaje general de enraizamiento obtenido en este ensayo fue de 100% (tabla 3), comportamiento que indica que es una especie con alta capacidad de desarrollo de raíces adventicias, lo cual es confirmado por el 100% de enraizamiento señalado por Saucedo et al. (2008) en el enraizamiento ex vitro de ocumo.
El porcentaje de enraizamiento tuvo una influencia en la sobrevivencia de las vitroplantas, ya que todas las plantas que sobrevivieron presentaron raíces, obteniéndose un porcentaje de sobrevivencia de 96,87% (tabla 3). Saucedo et al. (2008) señalaron que una buena calidad de los brotes en la fase previa a enraizamiento ex vitro garantiza que se formen y desarrollen varias raíces, que le permitan comenzar la absorción de nutrientes al trasplantarlos sobre un buen sustrato y convertirse en plantas obtenidas in vitro aclimatizadas listas para llevar al campo.
Zeledón (2006) y Chin-Ying et al. (2008) indican porcentajes de sobrevivencia de alrededor de 97%, similares a los obtenidos en este experimento (96,87%); mientras que Saucedo et al. (2008) señala un 100% de sobrevivencia en la aclimatización; porcentaje ligeramente superior al obtenido en este ensayo.
Las raíces de las vitroplantas de ocumo se caracterizaron por ser blancas, finas, entre 2 y 3 mm de diámetro, muy ramificadas y con incontables raíces de tercer orden y pelos absorbentes. Estas características garantizan un excelente sistema radical, lo cual implica una mayor probabilidad de aclimatización a condiciones ex vitro (Agramonte et al., 1998).
Se obtuvieron 9,1 raíces, con una longitud de 11,2 cm (tabla 4). Saucedo et al. (2008), evaluando diferentes concentraciones de ANA más AIA en el enraizamiento y la aclimatización ex vitro de ocumo blanco, encontraron que las mejores respuestas para las variables número y longitud de raíces se lograron con la combinación de 500 mg/L-1 ANA + 500 mg/L-1 AIA. Estos resultados difieren de los obtenidos en el presente ensayo, donde no se encontraron diferencia entre los tratamientos evaluados. Esto pudiera ser debido a que en ciertas especies no es necesaria la adición de auxinas para estimular la producción y el desarrollo de raíces (Taiz y Seiger, 2002). Esto es valioso a la hora de multiplicar o micropropagar comercialmente esta especie ya que al no utilizar estimuladores del enraizamiento los costos de producción se reducen y se pueden ofrecer plantas mucho más económicas y accesibles a los productores de ocumo.
El promedio general en este ensayo para el número de hojas fue de 3,08 y para su longitud fue de 7,9 cm (tabla 4). Zeledón (2006) señaló 3 como valor más alto de número de hojas en la aclimatización de vitroplanatas de ocumo, coincidiendo con los resultados de esta investigación, mientras que para la longitud de hojas este autor reportó 5 cm, a diferencia de este experimento donde se obtuvo un valor de 7,9 cm de longitud.
Las diferencias encontradas para la variable longitud de hojas señaladas por Zeledon (2006) y la obtenida en esta investigación pudieron ser debidas a que el mencionado autor realizó el enraizamiento bajo condiciones in vitro las cuales tal vez fueron desfavorables para el desarrollo de este órgano ya que se sabe que la tasa fotosintética de las vitroplantas in vitro es baja, lo que conlleva una baja síntesis y producción de energía que afecta directamente el crecimiento y desarrollo del mismo (Agramonte et al., 1998).
Conclusiones
El cultivo en sistema de inmersión temporal tipo RITA® en la fase de multiplicación favoreció el crecimiento y la proliferación de los brotes en ocumo blanco.
Se determinó que el tiempo y la frecuencia de inmersión adecuados para multiplicación in vitro de ocumo fue de 5 min seis veces al día.
La densidad de 9 brotes/recipiente permitió mayor eficiencia en el uso del recipiente de sistema de inmersión temporal tipo RITA®.
Bajo las condiciones de enraizamiento ex vitro evaluadas no es necesaria la aplicación de reguladores de crecimiento para promover la formación de raíces adventicias en los brotes de ocumo blanco.
Agradecimientos
Los autores agradecen al Consejo de Desarrollo Científico y Humanístico de la Universidad del Zulia por el financiamiento del Proyecto del VAC-CONDES-CC-0092-08 con el cual se llevó a cabo esta investigación.
Referencias bibliográficas
1 Adelberg, J., J. Naylor-Adelberg y M. Tascan. 2007. Larger Plants From Liquid-Based Micropropagation: A Case Study With Hydrangea quercifolia Bartr. "Sikes Dwarf". Combined Proceedings International Plant Propagators Society, 57: 1-10. [ Links ]
2 Agramonte, D., F. Jiménez y M. Dita. 1998. Aclimatación (p. 193-205). En: Pérez J. (ed.). Propagación y mejora genética de plantas por biotecnología. Santa Clara: Instituto de Biotecnología de las Plantas, Universidad Central de las Villas. [ Links ]
3 Albany, N., E. Jiménez, J. Vilchez, L. García, M. de Feria, N. Pérez et al. 2005. Use of growth retardants for banana (Musa AAA cv. Grand Naine) shoot multiplication in tempory immersion systems (p. 213-224). En: Hvoslef-Eide A. y W. Preil (eds.). Liquid culture systems for in vitro plant propagation. Dordrecht: The Netherland Springer. [ Links ]
4 Alvard, D., F. Cote y C. Teisson. 1993. Comparison of methods of liquid medium cultures for banana micropropagation: effect of temporary immersion of explants. Plant Cell, Tissue and Organ Culture, 32: 55-60. [ Links ]
5 Berthouly, M., y H. Etienne. 2005. Temporary immersion system a new concept for use liquid medium in mass propagation. p. 165-195. En: Hvoslef-Eide A. y W. Preil. (Eds.). Liquid culture systems for in vitro plant propagation. First edition. Dordrecht, The Netherland. Springer. [ Links ]
6 Blanco, M. y R. Valverde. 2004. Micropropagación de Philodendron sp. (posiblemente P. corcovadense). Agronomía Costarricense, 28: 39-46. [ Links ]
7 Cabrera, M., M. Basail, Y. Torres, A. Robaina, A. Santos, V. Medero, A. Rayas, J. López, M. García, J. Ventura y M. Oliva. 2004. Empleo de Sistemas de Inmersión Temporal para la multiplicación de segmentos nodales de Dioscorea alata L. en el clon "Pacala Duclos". Biotecnología Vegetal, 4: 3-8. [ Links ]
8 Cabrera, M., Gómez, R., Rodríguez, S. López, J., Rayas, A., Basail et al. 2008. Multiplicación in vitro de segmentos nodales del clon de ñame Blanco de Guinea (Dioscorea cayenensis - D. rotundata) en sistemas de cultivo semiautomatizado. Revista Colombiana de Biotecnología, 10:97-103. [ Links ]
9 Chien-Ying, K., K. Ji-Ping y R. McDonald. 2008. In vitro Micropropagation of white dasheen (Colocassia esculenta). African Journal of Biotechnology, 7: 41-43. [ Links ]
10 De Feria, M., M. Chávez, E. Quiala y E. Jiménez. 2003. Efecto de la densidad de inóculo y la frecuencia de inmersión en la propagación in vitro de Psidium guajava cv. Enana Roja en sistemas de inmersión temporal. Biotecnología Vegetal, 3: 149-154. [ Links ]
11 Del Rivero, N., E. Quiala, D. Agramante, R. Barbón, W. Camacho, L. Morejón y M. Pérez. 2004. Empleo de sistemas de inmersión temporal para la multiplicación in vitro de los brotes de Anthurium andraeanum Lind. var. Lambada. Biotecnología Vegetal, 4: 97-100. [ Links ]
12 Dottin, M. 2000. Propagación in vitro de Xanthosoma sagittifolium (L.) Schott. Tesis de doctorado. Universidad Central "Marta Abreu" de la Villas, Sta. Clara, Cuba. [ Links ]
13 Escalona, M., J. Lorenzo, B. González, M. Daquinta, C. Barroto, J. González y Y. Desjardines. 1999. Pineapple (Ananas comosus Merr) micropropagation in temporary immersion systems. Plant Cell Report, 18: 743-748. [ Links ]
14 Etienne, H. y M. Berthouly. 2002. Temporary immersion systems in the plant micropropagation. Plant Cell, Tissue and Organ Culture, 69: 215-231. [ Links ]
15 López, M., E. Vásquez y R. López. 1995. Raíces y tubérculos. 2 ed. La Habana: Pueblo y Educación. [ Links ]
16 Matheus, J., G. Romay y M. Santana. 2006. Multiplicación in vitro de ocumo y taro. Agronomía Tropical, 56: 607-613. [ Links ]
17 Murashige, T. y F. Skoog. 1962. A revised medium for rapid growth and biossay with tobacco tissue culture. Physiologia Plantarum, 15: 473-497. [ Links ]
18 Orellana, P. 1998. Propagación vía organogénesis (pp. 151-178). En: J. Pérez (ed.). Propagación y mejora genética de plantas por biotecnología. Santa Clara: Instituto de Biotecnología de las Plantas. Universidad Central de las Villas. [ Links ]
19 Pérez, J., E. Jiménez y D. Agramonte. 1998. Aumento de la eficiencia en la micropropagación. En: J. Pérez (ed.). Propagación y mejora genética de plantas por biotecnología. Santa Clara: Instituto de Biotecnología de las Plantas. Universidad Central de las Villas. [ Links ]
20 Posada, L., R. Gómez, M. Reyes y L. Álvarez. 2003 empleo de los sistemas de inmersión temporal (RITA) en la propagación de plantas vía organogénesis en caña de azúcar. Biotecnología Vegetal, 3: 3-8. [ Links ]
21 Preil, W. 2005. General introduction a personal reflection on the use of liquid media for in vitro cultura (pp. 1-20). En: A. Hvoslef-Eide y W. Preil. Liquid culture systems for in vitro plant propagation. Dordrecht: The Netherland Springer. [ Links ]
22 Rodríguez, A., A. Rodríguez y S. Quintero. 1999. Caracterización de germoplasma y mejoramiento participativo en especies de raíces y tubérculos alimenticios tropicales y en musáceas. Simposio Internacional y Talleres sobre Fitomejoramiento Participativo (FMP) en América Latina y el Caribe: un intercambio de experiencias. Quito, Ecuador. [ Links ]
23 Salazar, R. y R. Hoyos. 2007. Multiplicación y tuberización in vitro de ñame (Dioscorea alata L.) en sistema de inmersión temporal. Revista Facultad Nacional de Agronomía, Medellín, 60: 3907-3921. [ Links ]
24 Saucedo, S., L. Ramos y T. Reyes. 2008. Efecto de los reguladores de crecimiento para la micropropagación in vitro de la malanga (Xanthosoma sagittifolium (L.) Schott). Ciencia y Tecnología, 1: 17-21. [ Links ]
25 Seganfredo, R., F. L. Finger, R. S. Barros, P. R. Mosquim. 2001. Influência do momento de colheita sobre a deterioração pós-colheita em folhas de taioba. Horticultura Brasileira. Brasília, 19: 184-187. [ Links ]
26 Smith, M. y L. Spoomer. 1995. Vessels, gels, liquid media and support systems (pp. 145-163). En: J. Aitken-Christie, T. Koza y M. A. Smith (eds.). Automation and environmental control in plant tissue culture. The Netherland: Kluwer Academic Publishers Dordrecht. [ Links ]
27 Taiz, L. y E. Zeiger. 2002. Plant physiology. 3 ed. Sunderland: Sinauer Associates. [ Links ]
28 van Huylenbroeck, J., A. Piqueras y P. Debergh. 1998. Photosynthesis and carbon metabolism in leaves formed prior and during ex vitro acclimatization of micropropagated plants. Plant Physiology, 134: 21-30. [ Links ]
29 Vilchez, J., Y. Rivas, N. Albany, M. Molina y L. Martínez. 2009. Efecto de la N6 bencilaminopurina sobre la multiplicación in vitro de ocumo criollo (Xanthosoma sagittifolium L. Schott). Rev. Fac. Agron. (LUZ), 26 (3): 212-222. [ Links ]
30 Zeledón, M. 2006. Organogénesis directa y embriogénesis indirecta en el cultivo in vitro de quequisque (Xanthosoma sagittifolium L. Schott), cultivar blanco. Managua, Nicaragua. Universidad Nacional Agraria, Facultad de Agronomía. Trabajo de diploma. [ Links ]