Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.13 no.1 Bogotá Jan./June 2011
ARTÍCULO DE INVESTIGACIÓN
Efecto de nutrientes sobre la producción de biomasa del hongo medicinal Ganoderma lucidum
Effect of nutrients in the biomass production of the medicinal mushroom Ganoderma lucidum
Título corto: Efecto de nutrientes sobre la producción de G. lucidum
Ana María Torres López 1 , Juan Carlos Quintero Díaz 2 , Lucía Atehortua Garcés 3 ,
1 Ingeniera Química, M. Sc. Programa de Bioingeniería, Facultad de Ingeniería, Universidad de Antioquia. atorres@udea.edu.co
2 Ingeniero Químico, M. Sc., Ph. D. Grupo de Bioprocesos, Facultad de Ingeniería, Universidad de Antioquia. jcquinte@udea.edu.co
3 Bióloga, Ph. D. Grupo de Biotecnología, Sede de Investigaciones Universitarias, Universidad de Antioquia. latehor@udea.edu.co
Recibido: marzo 25 de 2010 Aprobado: mayo 30 de 2011
Resumen
El hongo Ganoderma lucidum, en los constituyentes de su biomasa, tiene compuestos con propiedades benéficas para la salud; es por esto que el conocimiento de las condiciones nutricionales adecuadas para su crecimiento permitirá su producción industrial y a bajo costo. En este trabajo se evaluó a nivel de matraz el efecto de la relación C/N, y la presencia de diferentes fuentes de carbono, nitrógeno y micronutrientes sobre la producción de biomasa. Empleando glucosa y peptona como fuentes de carbono y nitrógeno, respectivamente, se encontró una relación C/N óptima de 16,7:1 para la cual la máxima producción de biomasa fue de 25 g/L. Manteniendo esta relación C/N, y sustituyendo la glucosa por lactosa o harina de cebada y la peptona por extracto de levadura, la producción de biomasa se incrementó a 35 g/L. En presencia de harina de cebada la adición al medio de cultivo de sales de Mg y K, y de tiamina, no generó un mayor incremento en la producción de biomasa. La producción de biomasa de G. lucidum se ve favorecida por la presencia en el medio de cultivo de relaciones C/N cercanas a las reportadas conforme a la composición típica de los hongos, así como por la presencia de sustratos complejos como la harina de cebada que le aportan además de la fuente de carbono micronutrientes necesarios para su desarrollo.
Palabras clave: harina de cebada, relación C/N, micronutrientes, fuentes de carbono, fuentes de nitrógeno.
Abstract
Ganoderma lucidum fungus has some biomass components with beneficial health properties. The knowledge about its nutritionals requirements for growing will favor its industrial production at lower cost. In this work, the effect of C/N ratio, the presence of different carbon, nitrogen and micronutrients sources, on fungal biomass production, were evaluated. Using glucose and peptone as carbon and nitrogen sources, respectively, an optimal C/N ratio of 16,7:1 was found, for which the maximal biomass production was 25 g/L. Replacing glucose by lactose or barley flour and peptone by yeast extract at the same C/N ratio, the biomass production was enhanced to 35 g/L. With barley flour in the culture medium, the presence of Mg and K salts and thiamine did not turn out into a major increase of biomass. The G. lucidum biomass production is promoted by C/N ratios in the culture medium nearly equivalent to that found in the fungus, as well as the presence of complex substrates as barley flour which, additionally, contributes with important micronutrients along with the carbon source.
Key words: Barley flour, C/N ratio, micronutrients, carbon sources, nitrogen sources.
Introducción
Existe evidencia de que a partir del consumo regular de hongos o de sus componentes biológicos activos se puede lograr un tratamiento benéfico para muchas de las enfermedades que padece la población mundial. Entre los hongos medicinales de mayor interés se encuentra Ganoderma lucidum, conocido comúnmente en China con el nombre de "Ling zhi", y en el Japón con el nombre de "Reishi". En estos países ha sido ampliamente usado como ingrediente en muchos alimentos y materia prima para el desarrollo de medicamentos (Lakhanpal y Monika, 2005) debido a sus comprobados efectos como estimulador del sistema inmunológico y a su actividad anticancerígena (Chen et al.,2006; Marin et al., 2003; Paterson 2006), entre otros.
Para cualquier organismo, una eficiente producción de biomasa y de los metabolitos de interés depende en gran medida de las fuentes de nutrientes, su composición y un adecuado balance entre estas fuentes. La relación carbono-nitrógeno (C/N) es un factor importante que afecta la formación del micelio y del cuerpo fructífero de los hongos medicinales, aunque se ha encontrado poco efecto sobre la producción de intra y exo-polisacáridos (Kim et al., 2002, Lee et al., 2007). Para Ganoderma lucidum, se ha estudiado el efecto de diversas fuentes de carbono y nitrógeno sobre su crecimiento, encontrándose que la glucosa, xilosa, lactosa, junto con la peptona y el extracto de levadura, promueven un mayor crecimiento y producción de metabolitos respecto de otras fuentes como la fructosa y el almidón, y fuentes de nitrógeno inorgánicas (Tang y Zhong, 2002: Chang et al., 2006; Fang y Zhong, 2002); sin embargo, no se ha estudiado el efecto de la relación entre las fuentes de carbono y nitrógeno que permita un óptimo crecimiento de la biomasa.
Aunque la relación C/N de la biomasa fúngica es alrededor de 20/1 (Wallander et al., 2003), se ha encontrado que el valor óptimo de esta relación en los medios de cultivo usados para el crecimiento de los hongos es específico para cada especie y, en general, es superior al valor presente en la biomasa. Por ejemplo, se han encontrado como óptimas para la producción de biomasa micelial de hongos, relaciones C/N de 20/1 para Paecilomyces sinclairii, 24/1 para Pleurotus tuber-regium, de 40/1 para Antrodia cinnamomea e incluso de 129/1 para Ganoderma applanatu (Lin y Chen 2007; Lee et al., 2007; Kim et al., 2002; Wu et al., 2004).
Adicional a una adecuada fuente de carbono y nitrógeno, otros elementos como el azufre, fósforo, potasio y magnesio son esenciales para el crecimiento de los hongos ya que forman parte de la síntesis de aminoácidos, ácidos nucleicos, y ATP, y participan como cofactores en diversas reacciones enzimáticas entre otras muchas funciones. Igualmente, las vitaminas también juegan un papel esencial en el metabolismo, en su función como coenzimas. La tiamina se requiere para múltiples reacciones bioquímicas, se emplea como cofactor de diversas enzimas incluyendo la piruvato descarboxilasa, piruvato deshidrogenasa, alfa-cetoglutarato deshidrogenasa en el ciclo de Krebs y transcetolasa de la vía pentosa fosfato; además, se ha demostrado que la tiamina estimula el crecimiento de la mayoría de hongos (Chung y Tzeng, 2009).
En la presente investigación se evaluó el efecto de los siguientes factores sobre el crecimiento de G. lucidum: relación C/N, diferentes fuentes de carbono (glucosa, lactosa y harina de cebada), relación peptona/extracto de levadura y algunos micronutrientes.
Materiales y métodos
Mantenimiento y preparación del inóculo
Se empleó una cepa de Ganoderma lucidum de la colección de cepas del Laboratorio de Biotecnología de la Universidad de Antioquia. La cepa se mantuvo a 4 °C en cajas Petri con agar enriquecido con cebada.
El inóculo se preparó a partir del cultivo de mantenimiento en erlenmeyers de 250 mL que contenían 100 mL de medio de cultivo basal compuesto por: 30 g/L de glucosa; 8,95 g/L de peptona; 1 g/L de KH2PO4; 0,5 g/L de MgSO4.7H2O y 0,05 g/L de tiamina. El pH inicial del medio fue ajustado a 5,6. Los cultivos fueron incubados durante 10 días a 30 ºC y 120 rpm. Transcurrido este tiempo, el inóculo se homogeneizó en una licuadora durante 15 s, quedando listo para su uso en los diferentes ensayos.
Estudio de la relación C/N
Se empleó el mismo medio de cultivo del inóculo pero se varió la concentración de glucosa entre 10 y 50 g/L, y de peptona entre 3 y 15 g/L, de tal manera que se obtuvieron relaciones C/N entre 2/1 y 50/1. Al final del cultivo se determinó la biomasa del hongo y la glucosa consumida con el fin de evaluar el coeficiente de rendimiento global (Yxs).
Con el propósito de maximizar la concentración de biomasa y de este modo encontrar una relación C/N óptima, se empleó un diseño factorial 32 con superficie de respuesta desarrollado con el software Design Expert® 5.0.7. versión de prueba.
Evaluación de diferentes fuentes de carbono y nitrógeno
Conservando la relación C/N óptima encontrada en el estudio de la relación C/N, se evaluó la producción de biomasa a diferentes fuentes de carbono: glucosa, lactosa y harina de cebada, y una fuente de nitrógeno compuesta por diferentes relaciones de peptona/extracto de levadura (100/0, 75/25, 50/50, 25/75, 0/100).
Se consideró que la harina de cebada es fuente de carbono y de nitrógeno, mientras que la peptona y el extracto de levadura son solo fuente de nitrógeno. Los porcentajes de carbono y nitrógeno en estos sustratos fueron: harina de cebada (51,27% de carbono y 1,68% de nitrógeno), peptona (13,4% de nitrógeno) y extracto de levadura (11,4% de nitrógeno).
Evaluación de micronutrientes
El efecto de tres micronutrientes: potasio (como KH2PO4), magnesio (como MgSO4.7H2O) y tiamina, sobre la producción de biomasa micelial de G. lucidum fue evaluado empleando diferentes combinaciones, así: 0/0/0, 1/0/0, 0/1/0, 0/0/1, 1/1/0, 1/0/1, 0/1/1, 1/1/1. El nivel 0 indica ausencia del micronutriente y el nivel 1 corresponde a la concentración del medio de cultivo basal.
Todos los ensayos fueron realizados empleando erlenmeyers de 250 mL que contenían 100 mL de medio de cultivo y 10% de inóculo, el pH inicial se ajustó en 5,6. El tiempo de cultivo se fijó en 10 días, los cultivos fueron incubados en un agitador orbital a 30 °C y 120 rpm. Los ensayos de evaluación de diferentes fuentes de carbono y nitrógeno, y de micronutrientes se realizaron por triplicado. Las diferencias significativas entre los diversos factores y combinaciones de micronutrientes estudiados, fueron determinadas empleando la prueba prueba t de Student.
Técnicas analíticas
Determinación de biomasa. La concentración de biomasa se determinó midiendo su peso seco. De cada cultivo se tomó una muestra de 10 mL y se filtró mediante vacío, a través de una membrana de filtración de 0,45 ?m previamente pesada. La torta formada se lavó con 20 mL de agua destilada. Posteriormente, la membrana con la torta de biomasa se secaron a una temperatura de 105 °C durante 2 horas. La diferencia de peso con el peso de la membrana seca da el peso seco de la biomasa.
Determinación de glucosa. La concentración de glucosa presente en las muestras del tiempo final de los cultivos se determinó por el método espectrofotométrico de azúcares reductores con ácido dinitrosalicílico (DNS) a 540 nm (Miller, 1959).
Resultados y discusión
Efecto de la relación C/N
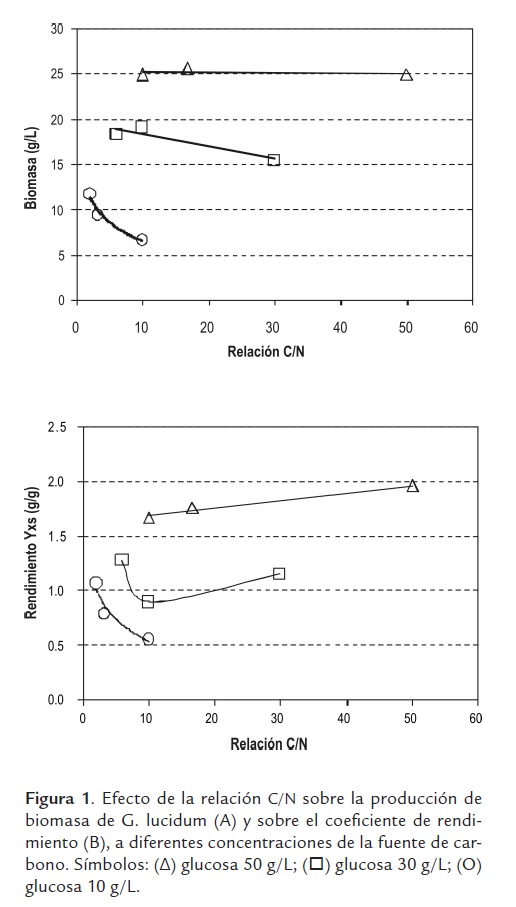
Los resultados del estudio del efecto de la relación C/N mostraron que la concentración de biomasa de G. lucidum se incrementa significativamente de 6,6 a 25 g/L, al incrementar la concentración de la fuente de carbono de 10 a 50 g/L, aun cuando se mantuvo constante la relación C/N en 10. Para este caso, los rendimientos también se incrementaron de 0,56 a 1,57 (gráfica 1). Los mayores valores de biomasa obtenida de 25,5 g/L se observaron a una concentración de glucosa de 50 g/L. También se observó que la concentración de biomasa no varía significativamente al modificar la relación C/N de 10 a 50, para esta concentración de glucosa. Mientras que a una concentración de glucosa de 10 g/L se observó un descenso en la biomasa producida al incrementarse la relación C/N de 2 a 10. De lo anterior se puede concluir que el cambio en la concentración de nitrógeno no tiene efecto sobre la producción de biomasa a altas relaciones C/N, mientras que a bajas relaciones el nitrógeno sí tiene un efecto importante. Sin embargo, el mayor efecto sobre la producción de biomasa lo tiene la fuente de carbono.
Con relación al rendimiento de biomasa en sustrato Yxs (figura 1), se observa que a altas relaciones de la fuente de carbono (glucosa a 50g/L), el rendimiento aumenta al incrementarse la relación C/N. Este efecto va cambiando al disminuir la concentración de glucosa, y para una concentración de 10 g/L el rendimiento disminuye al incrementar la relación C/N. Un comportamiento intermedio se observa en los resultados obtenidos con la concentración de glucosa de 30 g/L, para la cual a relaciones: C/N por debajo de 10 el rendimiento disminuye al incrementarse la relación C/N, y por encima de 10 el rendimiento aumenta.
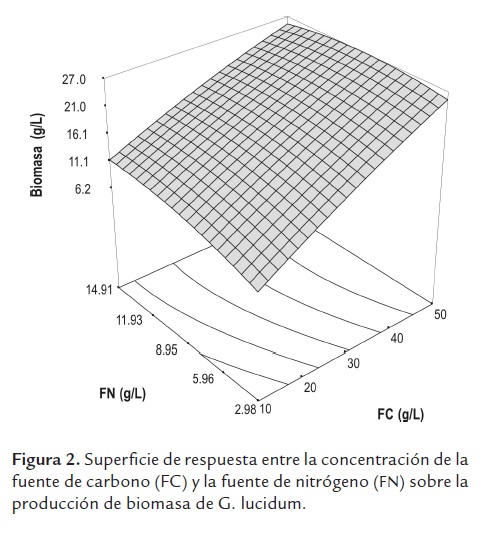
El mayor valor de biomasa producida 25,5 g/L se encontró con una concentración de glucosa de 50 g/L a relaciones C/N entre 10 y 50. Mientras que el máximo rendimiento se encontró a la misma concentración de glucosa y relación C/N de 50. Con el fin de determinar las concentraciones óptimas de la fuente de carbono y de nitrógeno para obtener un máximo de biomasa dentro de los intervalos evaluados, se realizó un análisis de superficie de respuesta (figura 2), encontrándose que la máxima concentración de biomasa se obtiene con 50 g/L de glucosa y 10,6 g/L de peptona que equivalen a una relación C/N de 16,7:1. La prueba Anova mostró una significancia del modelo incluso para una P < 0,0001, y se obtuvo una correlación de 0,9929.
Kim et. al. (2002) para el hongo P. tuberregium, y Wu et. al. (2004) con P. sinclairii, han encontrado que para el crecimiento micelial son adecuados valores de la relación C/N alrededor de 20/1, mientras que valores inferiores producen menos biomasa. Este comportamiento se puede explicar debido a los bajos valores de fuente de carbono (entre 10 y 30 g/L) empleados, los cuales coinciden con nuestros resultados cuando se emplearon bajas concentraciones de glucosa. De otro lado, resultados obtenidos por Lee et. al. (2007) con el hongo G. applanatum mostraron que la relación C/N de entre 20 y 50 no afecta significativamente la producción de biomasa al emplear concentraciones de fuente de carbono de 40 g/L. Estos últimos resultados están en concordancia con los obtenidos en este trabajo donde no se observó efecto de la relación C/N entre 10 y 50 sobre la producción de biomasa con una concentración de la fuente de carbono de 50 g/L. De lo anterior se puede concluir que una concentración alta de la fuente de carbono, alrededor de 40-50 g/L, es importante para independizar el efecto de la relación C/N sobre la producción de biomasa, mientras que con concentraciones bajas de la fuente de carbono el efecto de la relación C/N sobre la biomasa es significativo. El valor óptimo de la relación C/N encontrado para la formulación de un medio de cultivo adecuado para el crecimiento de G. lucidum fue de 16,7:1, que es cercano al valor de la relación C/N presente en la biomasa de los hongos.
Influencia de diferentes fuentes de carbono y la relación peptona/extracto de levadura sobre la producción de biomasa de G. lucidum
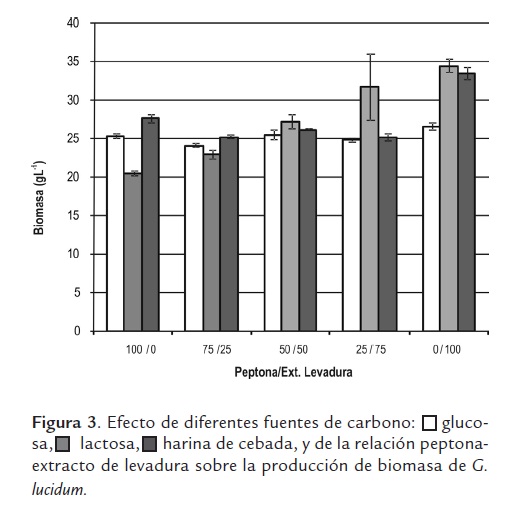
Para evaluar el efecto de diferentes fuentes de carbono y de nitrógeno sobre la producción de biomasa se tomaron la glucosa y la peptona como fuentes de carbono y nitrógeno basales en una concentración de 50 y 10,6 g/L respectivamente. A partir de estas condiciones, y manteniendo la misma relación C/N encontrada en el apartado anterior de 16,7:1, se sustituyó la glucosa por lactosa o harina de cebada, y la peptona por mezclas de peptona/extracto de levadura en diferentes proporciones.
Como se muestra en la figura 3, los más altos valores de producción de biomasa, alrededor de 34 g/L, fueron obtenidos con lactosa o harina de cebada empleando como fuente de nitrógeno únicamente extracto de levadura. Con glucosa, la concentración de biomasa no se vio afectada al variar la relación de las fuentes de nitrógeno. Similar comportamiento se observó con harina de cebada, y solamente se encontró un incremento significativo (prueba t, P< 0,05) de la biomasa en los cultivos realizados con extracto de levadura; en los demás casos el efecto fue poco significativo. Por otro lado, con lactosa la biomasa de G. lucidum se fue incrementando significativamente (prueba t, P<0,05) a medida que aumentaba la proporción de extracto de levadura en los cultivos, hasta obtener su valor máximo únicamente con extracto de levadura.
Fang y Zhong (2002), empleando una relación peptona/extracto de levadura de 1/2 y glucosa como fuente de carbono, obtuvieron una concentración máxima de biomasa de G. lucidum de 15,4 g/L después de 8 días de cultivo. En este trabajo no se observó un efecto significativo de dicha relación cuando la fuente de carbono es glucosa, sin embargo, los valores de producción de biomasa fueron un 66% superiores (25 g/L) a los encontrados como óptimos por Fang y Zhong; mientras que con lactosa y harina de cebada la biomasa se incrementó significativamente sin requerir de la presencia de peptona. Estos mismos autores sugieren que la peptona puede tener algunos componentes inhibidores del crecimiento para G. lucidum. Dicho fenómeno no es observado en los cultivos realizados con glucosa; no obstante, a medida que se redujo la concentración de peptona en los cultivos con lactosa la producción de biomasa se iba incrementando, lo cual muestra un efecto inverso del crecimiento y la concentración de peptona que no sugiere que la peptona tenga efecto inhibitorio sino que el extracto de levadura es una mejor fuente de nitrógeno, como ha sido también sugerido por otros autores (Ayodele, 2008). Un comportamiento similar se observó cuando se empleó harina de cebada como fuente de carbono. Tang y Zhong (2002), al evaluar la producción de biomasa de G. lucidum con lactosa y una relación peptona/extracto de levadura 1/1, encontraron un valor máximo de biomasa de 12,3 g/L, inferior al encontrado en este trabajo con la misma fuente de carbono. Con relación a la harina de cebada, es notable que su uso pueda reducir los costos de producción de la biomasa del hongo, dado que el costo de 1 kg de harina de cebada es aproximadamente el 4% del costo de 1 kg de glucosa y el 3% del costo de 1 kg de lactosa. Al ser un sustrato económico y permitir obtener elevadas concentraciones de biomasa, similares a las encontradas con lactosa y superiores a las alcanzadas con glucosa, la harina de cebada se constituye en una apropiada fuente de carbono que también aporta nitrógeno y otros micronutrientes para la formulación de medios de cultivo con aplicación industrial.
Efecto de algunos micronutrientes sobre la producción de biomasa de G. lucidum
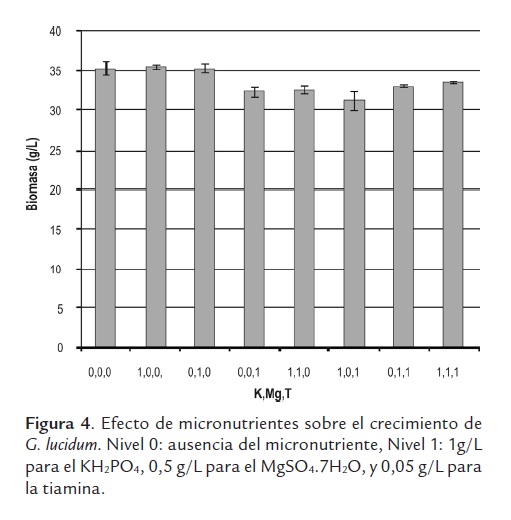
La presencia de elementos trazas normalmente influencia la biosíntesis de muchos metabolitos; sin embargo, son pocos los trabajos que se han realizado evaluando su efecto sobre la producción de biomasa de hongos medicinales. Los resultados de los ensayos realizados con sales de potasio y magnesio, y con tiamina, se muestran en la figura 4. Allí se observa que no existen diferencias significativas en la producción de biomasa, al considerar la adición de micronutrientes al medio de cultivo, e incluso la concentración de biomasa, al final del cultivo es ligeramente superior en ausencia de micronutrientes que la lograda en el medio suplementado. Estos resultados se pueden explicar por la presencia de harina de cebada y extracto de levadura, que al ser sustratos complejos pueden contener los requerimientos nutricionales mínimos para el desarrollo del hongo.
Los valores de producción de biomasa de G. lucidum no se vieron afectados por presencia fosfato de potasio o sulfato de magnesio adicionados de modo individual, alcanzándose la misma concentración de biomasa (35 g/L) en ausencia de estas sales. Por el contrario, la inclusión de tiamina produjo una ligera disminución, aunque significativa, en el contenido de la biomasa al final del cultivo (prueba t, P<0,05). La tiamina, con respecto a otras vitaminas como la riboflavina, el ácido ascórbico, el ácido fólico entre otros, ha mostrado ser la vitamina que más estimula el crecimiento de biomasa micelial de los hongos (Ayodele, 2008; Chung y Tzeng, 2009), además, las sales de potasio y magnesio también han mostrado incrementar significativamente la biomasa de G. lucidum (Hsieh et al., 2006), lo que contrasta con los resultados obtenidos en este trabajo. Sin embargo otros autores, al cultivar el hongo Antrodia cinnamomea por fermentación sumergida, también observaron que el KH2PO4, el MgSO4 y la tiamina no tienen un efecto importante en el crecimiento de la biomasa micelial. En G. lucidum también se ha encontrado que las sales no afectan la producción de biomasa en las concentraciones evaluadas en este trabajo; no obstante, a concentraciones mayores la biomasa se ve incrementada (Hsieh et al., 2006). El crecimiento importante del hongo en ausencia de sales y de tiamina se debe a que estos nutrientes están presentes en las cantidades necesarias en la harina de cebada.
Conclusiones
En este trabajo se encontró que la relación C/N no afecta significativamente la producción de biomasa a concentraciones altas de la fuente de carbono, mientras que a concentraciones bajas la relación C/N sí la afecta. Manteniendo constante la relación C/N, la concentración de biomasa de G. lucidum se incrementa con el aumento de la fuente de carbono. La lactosa y la harina de cebada son fuentes de carbono adecuadas para el crecimiento de G. lucidum, pero por su bajo costo la harina es la más adecuada para la formulación de medios a escala industrial. Tal como se ha observado en trabajos de diversos autores, el extracto de levadura es la fuente de nitrógeno más adecuada para el desarrollo del hongo. Finalmente, tanto la presencia de sales, como de tiamina, no afectan significativamente la producción de biomasa, y con la suplementación de la harina de cebada como fuente de carbono no se requiere la adición de sales y tiamina en el medio, haciéndolo más competitivo.
Agradecimientos
Los autores agradecen al Departamento Administrativo de Ciencia, Tecnología e innovación (Colciencias) el apoyo financiero otorgado para desarrollar este trabajo, a través del contrato de investigación 182-2006.
Referencias bibliográficas
1 Ayodele, M. J. 2008. Studies on the vegetative growth requirements of Psathyrella atroumbonata, pegler, an edible mushroom in Nigeria. African Journal of Plant Science, 2: 028-033. [ Links ]
2 Chang, M. Y., G. J. Tsai y J. Y. Houng. 2006. Optimization of the medium composition for the submerged culture of Ganoderma lucidum by Taguchi array design and steepest ascent method. Enzyme and Microbial Technology, 38: 407-414. [ Links ]
3 Chen, X., Z. Hu, X. Yang, M. Huang, Y. Gao, W. Tang, S. Chan, X. Dai, J. Ye, P. Ho, W. Duan, H. Yang, Y. Zhu y S. Zhou. 2006. Monitoring of immune responses to a herbal immuno-modulator in patients with advanced colorectal cancer. International Immunopharmacology, 6: 499-508. [ Links ]
4 Chung, K. R. y D. D. Tzeng. 2009. Thiamine (Vitamin B1) Plays a Critical Role on Sugar Utilization by the Phytopathogenic Fungus, Ustilago esculenta. Research Journal of Microbiology, 4: 178-185. [ Links ]
5 Fang, Q. H. y J. J. Zhong. 2002. Submerged fermentation of higher fungus Ganoderma lucidum for production of valuable bioactive metabolites -ganoderic acid and polysaccharide. Biochemical Engineering Journal, 10: 61-65. [ Links ]
6 Hsieh, C., M.-H. Tseng y C.-J. Liu. 2006. Production of polysaccharides from Ganoderma lucidum (CCRC 36041) under limitations of nutrients. Enzyme and Microbial Technology, 38: 109-117. [ Links ]
7 Kim, S., H. Hwang, C. Xu, Y. Na, S. Song y J. Yun. 2002. Influence of nutritional conditions on the mycelial growth and exopolysaccharide production in Paecilomyces sinclairii. Letters in Applied Microbiology, 34: 389-393. [ Links ]
8 Lakhanpal, T. N. y R. Monika. 2005. Medicinal and nutraceutical genetic resources of mushrooms. Plant Genetic Resources, 31: 288-303. [ Links ]
9 Lee, W. Y., Y. Park, J. K. Ahn, K. H. Ka y S. Y. Park. 2007. Factors influencing the production of endopolysaccharide and exopolysaccharides from Ganoderma applanatum. Enzyme and Microbial Technology, 40: 249-254. [ Links ]
10 Lin, E. y Y. Chen. 2007. Factors affecting mycelial biomass and exopolysaccharide production in submerged cultivation of Antrodia cinnamomea using complex media. Bioresource Technology, 98: 2511-2517. [ Links ]
11 Marin, B., H. Jozica, Z. Irena, W. Branka, H. Damjan, B. Bojana y F. Pohleven. 2003. Submerged cultivation of Ganoderma lucidum biomass and immunostimulatory effects of fungal polysaccharides. Journal of Biotechnology, 103: 77-86. [ Links ]
12 Miller, G. L. 1959. Use of DNS for determination of reducing sugar. Analytical Chemistry, 31: 426-428. [ Links ]
13 Paterson, R. 2006. Ganoderma - a therapeutic fungal biofactory. Phytochemistry, 67: 1985-2001. [ Links ]
14 Tang, Y. J. y J. J. Zhong. 2002. Fed-batch fermentation of Ganoderma lucidum for hyperproduction of polysaccharide and ganoderic acid. Enzyme and Microbial Technology, 31: 20-28. [ Links ]
15 Wallander, H., L. O. Nilsson, D. Hagerberg y U. Rosengren. 2003. Direct estimates of C:N ratios of ectomycorrhizal mycelia collected from Norway spruce forest soils. Soil Biology & Biochemistry, 35: 997-999. [ Links ]
16 Wu, J., P. Cheung, K. Wong y N. Huang. 2004. Studies on submerged fermentation of Pleurotus tuber-regium (Fr.) Singer. Part 2: effect of carbon-to-nitrogen ratio of the culture medium on the content and composition of the mycelial dietary fibre. Food Chemistry, 85: 101-105. [ Links ]