Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.13 no.1 Bogotá Jan./June 2011
ARTÍCULO CORTO
Efecto biofertilizante del preparado: residuos vegetales -bacteria nativa diazótrofa, sobre las variables biométricas en plántulas de Rhapanus sativus
Biofertilizer effect of the prepared from vegetales wastes -diazotroph native bacterium on biometrics variables of Rhapanus sativus seedlings
Cecilia Lara Mantilla 1 , Liliana Pahola García Támara 2 , Luis E Oviedo Zumaqué 3.
1 Química, M. Sc., Ph. D. Línea de Investigación en Biotecnología. Directora e investigadora Grubiodeq (Grupo de Biotecnología). Investigadora principal proyecto. Directora Tesis Maestría. Universidad de Córdoba. lara_mantilla_cecilia@hotmail.com; clara@sinu.unicordoba.edu.co
2 Q.F. M. Sc. en Biotecnología. Investigadora Grubiodeq (Grupo de Biotecnología), Universidad de Córdoba. lipagt@hotmail.com
3 Ingeniero Agrónomo, M.Sc. Investigador Grubiodeq . luisoviedo59@hotmail.com
Recibido: febrero 24 de 2011 Aprobado: mayo 30 de 2011
Resumen
El uso de bioinoculantes a base de microorganismos con potencial biofertilizante representa una alternativa económicamente viable y de producción limpia para el sector agrícola. El objetivo del presente trabajo fue evaluar el efecto biofertilizante de un preparado elaborado con residuos sólidos vegetales (RSV) procedentes del mercado y la bacteria nativa diazótrofa Azotobacter A15M2G. Se elaboraron biopreparados utilizando diferentes concentraciones de bacteria (106, 107 y 108 UFC) en un medio de cultivo obtenido a partir del 25% p/v de cada uno de los siguientes RSV: Brassica oleracea (repollo), Lactuca sativa (lechuga) y Allium fistulosum (cebollín). Los biopreparados fueron evaluados en plantas de rábano (Rhapanus sativus) en invernadero, utilizando un diseño estadístico completamente al azar de 5 tratamientos con 3 repeticiones: T1, control; T2, semillas pregerminadas tratadas con RSV al 25% p/v; T3, semillas pregerminadas con bioinoculante de 106 UFC; T4, semillas pregerminadas con bioinoculante de 107 UFC; T5, semillas pregerminadas con bioinoculante de 108 UFC. Se evaluó: número de hojas, área foliar, longitud de la planta, longitud de la raíz y peso seco de toda la planta (ensayos por triplicado). Se observó un incremento altamente significativo en peso seco para T5 (0,88 g) y T4 (1,10 g); y diferencias significativas en el área foliar, para los mismos tratamientos, con un valor superior a 2000 cm2. El biopreparado con bacterias nativas y RSV mejoró el crecimiento y desarrollo de las plantas de rábano, pudiéndose dar un valor agregado a estos residuos y de esta manera obtener un biofertilizante potencialmente utilizable en otros cultivos.
Palabras clave: Azotobacter A15M2G, Brassica oleracea, Lactuca sativa, Allium fistulosum, bioinoculante.
Abstract
The use of bioinoculantes from microorganisms with biofertilizer potential, represents an economically viable alternative and of clean production for the agricultural sector. The aim of this study was to evaluate the effect of biofertilizer preparation obtained from vegetable solid waste (RSV) of the market and the native bacteria Azotobacter A15M2G diazotroph. Biological cultures were prepared using different inoculum concentrations, 106, 107 y 108 UFC in a culture medium obtained from 25% w / v of each of the following substrates: Brassica oleracea (cabbage), Lactuca sativa (lettuce) and Allium fistulosum (chives). The microbial inoculants were evaluated in radish plants (Rhapanus sativus) in greenhouse using a completely randomized design of 5 treatments with 3 replicates: T1, pre-germinated seeds without any treatment; T2, pre-germinated seeds treated with the dye waste vegetables 25% w / v; T3, pre-germinated seeds treated with bacterial concentration bioinoculants to 106 UFC; T4, pre-germinated seeds treated with bacterial concentration bioinoculants to 107 UFC, and T5, pre-germinated seeds treated with bacterial concentration bioinoculants to 108 UFC. Assessed variables were: number of leaves, leaf area, plant length, root length and dry weight of the entire plant (all assays in triplicate). The results showed a highly significant increase in dry weight, for T5 (0.88 g) and T4(1.10 g); and significant differences in leaf area for the same treatments, with a value greater than 2000 cm2, compared to others. The biopreparado from native bacteria and RSV improved the growth and development of the radish plants, being able to give a added value to these residues and to obtain a potentially usable biofertilizer in other cultures.
Key words: Azotobacter A15M2G, Brassica oleracea, Lactuca sativa, Allium fistulosum, bioinoculants.
Introducción
La sobreexplotación de los terrenos y el impacto de los agroquímicos sobre el suelo han generado, con el paso del tiempo, un efecto contradictorio en los rendimientos de los cultivos, debido a que se ha propiciado un desequilibrio nutricional del suelo, un aumento considerable de la erosión, una pérdida acelerada de la capa orgánica, resistencia a las plagas y enfermedades, así como un aumento de contaminantes del medioambiente (Sáenz, 2006; Setboonsarng y Gilman, 1999). Igualmente, se ha afectado la microbiota que cumple con funciones importantes como aporte de nutrientes y sustancias promotoras de crecimiento vegetal (Moreno y Rojas, 2008). Desde el punto de vista de una agricultura sostenible, el empleo de bioinoculantes —productos elaborados a partir de microorganismos con potencial biofertilizante— representa una importante alternativa para limitar el uso de abonos químicos (Gómez, 2000).
El empleo de microorganismos fijadores asimbióticos de nitrógeno y productores de sustancias promotoras de crecimiento vegetal como inoculante toma cada día mayor auge; bacterias del género Azotobacter sp han demostrado un aumento significativo de los rendimientos de los cultivos, ahorro de fertilizantes minerales y disminución de la contaminación ambiental (Singh et al., 2003). En Cuba se ha desarrollado y comercializado un grupo de bioproductos ampliamente empleados en la agricultura urbana, constituidos por la serie de biofertilizantes y bioestimuladores elaborados a base de Azotobacter chroococcum (Dimargon®); este producto es comúnmente empleado en diferentes cultivos de importancia económica, demostrándose su mayor respuesta en hortalizas tales como tomate, cebolla, cebollino, pimiento, pepino, ajo, lechuga, acelga, berenjena, remolacha, rábano, coliflor y brócoli, entre otras; el efecto de la bacteria se evidencia desde los inicios del cultivo, incrementándose del 15-25% el número de plántulas que emergen en los semilleros, lo que aumenta su eficiencia y posibilita el ahorro de semillas por emplear. Igualmente, se logra un aumento entre 20-36% de los diferentes indicadores de crecimiento en plántulas como altura, número de hojas, diámetro del tallo, área foliar y biomasa vegetal, posibilitando el acortamiento entre 7-10 días del ciclo de obtención de la cosecha. Se destaca el aumento en la calidad de los productos de cosecha, registrando indicadores entre 28 y 35% de aumento en cuanto al peso y diámetro de frutos y bulbos cosechados (Dibut y Martínez, 2006). También se observan cultivos más sanos como resultado de la antibiosis que desarrolla la bacteria frente a un amplio conjunto de microorganismos patógenos presentes en el suelo y los sustratos; otros efectos positivos se demuestran en los procesos de polinización, por la adecuada disposición de las flores en la plantación, y la mayor superficie de hojas que actúa como un colchón homogéneamente extendido creando mejores condiciones para la atracción y el asentamiento de los polinizadores.
Por otra parte, los desechos biodegradables de la agroindustria, la agricultura y el hogar vienen aumentando con el paso del tiempo, convirtiéndose en un serio problema de salud pública que puede minimizarse al usar alternativas que permitan su aprovechamiento como es el caso de la industria de la producción de abonos orgánicos (Sáenz, 2006). La normatividad colombiana cuenta con reglamentaciones que permiten implantar sistemas de aprovechamiento de residuos y producción de bioproductos que no deterioren el ambiente; establece el empleo de los mejores métodos, de acuerdo con los avances de la ciencia y la tecnología, para recolección, tratamiento, procesamiento o disposición final de residuos sólidos, basuras, desperdicios y, en general, de desechos de cualquier clase (Decreto 2811 de 1974, artículo 34; Decreto 2811 de 1974, artículo 36) (Constitución Política de Colombia, 1991). En la actualidad, los residuos vegetales del mercado no son tratados y son completamente desaprovechados generando una problemática ambiental debido a los malos olores e infecciones causadas por su descomposición, y al gran volumen de disposición final que ocupan en su proceso de descarte (Lara et al., 2010; Servigenerales S.A E.S.P, 2009).
El objetivo del presente trabajo de investigación fue evaluar, en plantas de rábano, un bioinoculante preparado partir de residuos vegetales procedentes del mercado local de la ciudad de Montería, y una cepa nativa del género Azotobacter A15M2G, proporcionando un valor agregado a los residuos como una alternativa viable, de bajo costo, amigable con el ambiente y que garantiza una producción limpia.
Materiales y métodos
Preparación del bioinoculante. El bioinoculante se preparó utilizando residuos sólidos vegetales procedentes del mercado de la ciudad de Montería (Córdoba, Colombia): Brassica oleracea (repollo), Lactuca sativa (lechuga) y Allium fistulosum (cebollín), y una cepa nativa Azotobacter A15M2G fijadora asimbiótica de nitrógeno y productora de ácido indolacético, aislada de la región de Córdoba (Lara et al., 2007, 2006). El procedimiento se llevó a cabo de la siguiente manera: se recolectaron 500 g de cada uno de los residuos sólidos, se lavaron con agua corriente y destilada, y luego fueron secados al aire libre; se realizó pesaje, picado y licuado en un volumen adecuado de agua destilada hasta obtener una concentración de 25% p/v de cada uno de ellos; el pH fue ajustado a 6,70 con una solución de bicarbonato de sodio al 10%; este preparado fue esterilizado a 1 atm de presión, 121 °C, durante 15-20 min (Lara y García, 2010). La bacteria nativa fue producida a pequeña escala en el preparado hasta obtener las diferentes concentraciones: 106 UFC/ml, 107 UFC/ml y 108 UFC/ml; a estos biopreparados se les llamó bioinoculantes.
Ensayo de los bioinoculantes sobre plantas de Rhapanus sativus. Para llevar a cabo el experimento se utilizó la semilla comercial Rabano Crimson Giant Variedad del Instituto Colombiano Agropecuario (ICA). Se realizó una pregerminación por un periodo de 48 horas.
Las semillas pregerminadas fueron impregnadas con los bioinoculantes durante 60 min y se realizaron cinco tratamientos:
T1: Control.
T2: Medio residuos 25% p/v.
T3: Medio residuos 25% p/v + Azotobacter A15MG 106 UFC/ml.
T4: Medio residuos 25% p/v + Azotobacter A15MG 107 UFC/ml.
T5: Medio residuos 25% p/v + Azotobacter A15MG 108 UFC/ml.
El establecimiento de las semillas pregerminadas se llevó a cabo en canastas plásticas que correspondían a las unidades experimentales; en cada unidad experimental se sembraron 30 plantas y se hicieron 3 repeticiones por cada tratamiento, para un total de 15 unidades experimentales. Las plantas de rábano se desarrollaron en el invernadero de la Universidad de Córdoba (3 km vía Montería-Cereté), a temperatura promedio de 29 ºC y humedad relativa de 79%; el suelo utilizado fue de textura arcillosa (Degiovanni et al., 2004). No se utilizó ningún tipo de plaguicida. Durante la experimentación se tomaron muestras en los días 15, 30 y 45; en cada muestreo se recogieron 5 plantas al azar de cada unidad experimental (15) y se evaluaron los siguientes parámetros biométricos (Hernández, 2002; Ramírez y Pérez, 2006): a) número de hojas (No.): conteo de las hojas cotiledonales y verdaderas fotosintéticamente activas en las diferentes plantas; b) área foliar (cm2): se midió tomando como referencia las cuadrículas de hojas de papel milimetrado en cada una de las hojas cotiledonales de las plantas muestreadas; c) longitud de la planta (cm): se tomó en cuenta la medida desde la raíz hasta la hoja más larga de cada una de las plantas muestreadas; d) longitud de la raíz (cm): medición de la raíz principal de cada planta muestreada; e) peso seco (g): se llevaron a secado en estufa a 60 ºC hasta alcanzar peso seco constante, una vez secas se determinó su peso. Todos los ensayos se realizaron por triplicado.
Análisis estadístico. Se utilizó el paquete estadístico SAS (SAS, 2008); se empleó un diseño completamente al azar y las medias se compararon mediante contrastes ortogonales en el mismo software; se consideró P<0,05 y P<0,01 como diferencias significativa y altamente significativa, respectivamente. También se aplicó la prueba de Duncan y Tukey confirmándose la significancia. No se realizó transformación de las variables discretas.
Resultados y discusión
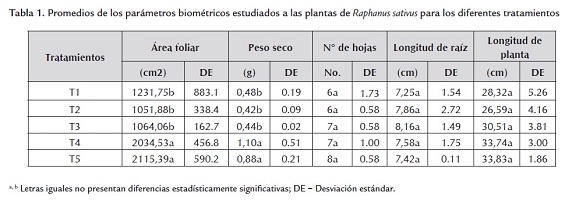
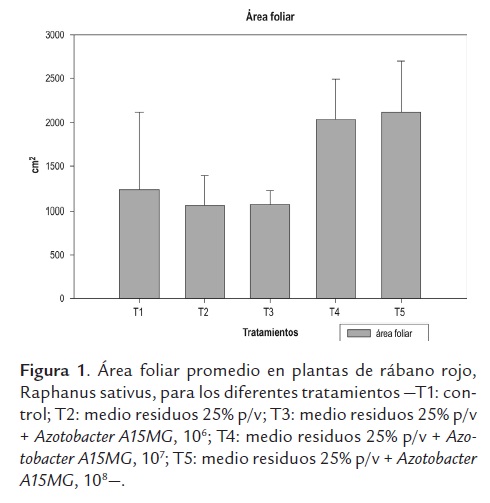
Los resultados del análisis biométrico se muestran en la tabla 1 y corresponden a valores promedios de los ensayos realizados por triplicado para los diferentes tratamientos: T1: control; T2: medio residuos 25% p/v; T3: medio residuos 25% p/v + Azotobacter A15MG, 106 UFC/ml; T4: medio residuos 25% p/v + Azotobacter A15MG, 107 UFC/ml; T5: medio residuos 25% p/v + Azotobacter A15MG, 108 UFC/ml.
Cantidad de hojas (No.). Se observó el brote de las hojas cotiledonales paralelamente en todos los tratamientos a los 15 días de siembra. El mayor número de hojas por planta fue hallado en los tratamientos T4 y T5 alcanzando valores de 7 a 8 hojas. En los demás tratamientos se presentó un número intermedio entre 6 a 7.
Área foliar (cm2). La mayor área foliar se obtuvo en los tratamientos T4 y T5 con un valor superior a 2000 cm2, observándose diferencias estadísticamente significativas (valor de P = 0,0032) con respecto a los demás tratamientos que alcanzaron áreas intermedias entre 1051 a 1231 cm2 (figura 1).
Longitud de la planta (cm). Los tratamientos T4 y T5 presentaron mayor longitud con un valor superior a 33 cm, en comparación con los demás tratamientos cuyos valores fueron inferiores (30-28 cm).
Longitud de la raíz (cm). En este parámetro no se observaron diferencias significativas.
Peso seco. En lo referente al peso seco de las plantas se presentó un incremento constante en los distintos tratamientos, encontrándose los valores más altos para T5 (0,88 g) y T4 (1,10 g); pesos significativamente inferiores se mostraron en los tratamientos T1, T2 y T3 con un valor entre 0,42 a 0,48 g (figura 2).
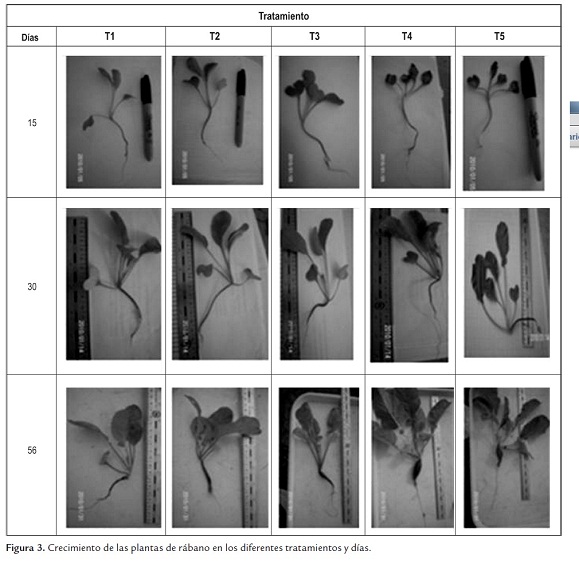
En la figura 3 se denota el crecimiento de las plantas de rábano rojo, Raphanus sativus, en los distintos tratamientos. En la presente investigación se utilizaron plantas de rábano debido a su rápido crecimiento (cinco semanas) y contacto directo entre el sustrato y la parte comestible (raíz).
Los resultados de la investigación demostraron que los parámetros biométricos más representativos corresponden a peso seco y área foliar; peso seco denotó diferencias altamente significativas (P<0,01) entre los tratamientos control, T1 y T2 frente a los tratamientos inoculados con Azotobacter A15MG en concentración de 107 UFC, T4 y concentración de 108 UFC, T5; con respecto al área foliar se observaron diferencias significativas de los tratamientos T4 y T5; esta característica incide en una mejor capacidad fotosintética de las plantas que redunda en un mayor crecimiento y, por ende, contribuye a un mayor peso seco.
Los efectos positivos observados en las plantas de rábano inoculadas con Azotobacter A15MG nativo se fundamentan en el hecho de que la bacteria demostró ser eficiente en la fijación de nitrógeno y producción de ácido indolacético (Lara y García, 2010). La promoción del crecimiento estimula la densidad y longitud de los pelos radicales aumentando así la cantidad de raíces en las plantas; se incrementa la capacidad de absorción de agua y nutrientes, y permite que las plantas sean más vigorosas, productivas y tolerantes a condiciones climáticas adversas (Kloepper et al., 1991). La aplicación de Azotobacter sp ha dado como resultado un incremento en la emergencia, el vigor, la biomasa, el desarrollo en sistemas radiculares e incrementos de hasta 30% en la producción de cultivos de interés comercial, tales como papa, rábano, tomate, trigo y soja, entre otros (Kloepper et al., 1991).
Estudios realizados utilizando Azotobacter chrooccocum sobre cultivos de sorgo (Pennisetum glaucum (L)R.Br) denotaron incrementos significativos de un 4,9 a 5,4% en la producción del grano con respecto al control (Singh et al., 2003); igualmente, se encontraron buenos rendimientos en los cultivos de maíz con disminución en la utilización de fertilización química utilizando la misma especie bacteriana (Wu et al., 2005).
La inoculación de bacterias Azotobacter chroococcum y Azotobacter brasilense a cultivos de trigo incrementó notablemente el crecimiento en las plantas y en la productividad (Mohsen et al., 2004); Sayeda et al. (2005), utilizando los mismos géneros bacterianos, encontraron una disminución en la fertilización nitrogenada sobre cultivos de trigo y cebada.
Las respuestas positivas obtenidas en las investigaciones realizadas con microorganismos del géneros Azotobacter sp han sido atribuidas a la capacidad de fijar nitrógeno atmosférico en forma asimbiótica, y a la capacidad productora de sustancias promotoras del crecimiento vegetal (auxinas) que estimulan los rendimientos en las cosechas (Dey et al., 2004; Vessey, 2003; Dobbelaere et al., 2003). Estas bacterias presentan un gran potencial para la agricultura sostenible por su efectividad, la cual les permite aumentar el rendimiento de los cultivos, acortar ciclos, disminuir el uso desmedido de fertilizantes minerales y productos químicos y, por consiguiente, reducir la contaminación ambiental.
De acuerdo con los resultados se observó que el bioinoculante a base de Azotobacter A15MG y residuos vegetales posee un gran potencial biofertilizante que puede ser aprovechado para mejorar la agricultura cordobesa; al ser una bacteria nativa, trae como ventaja la adaptación a suelos y condiciones propias de la región.
Adicionalmente, la aplicación del bioinoculante a los cultivos permite bioaumentar la población microbiana presente en la rizosfera, contribuyendo a una mayor actividad nutricional para las plantas. Los bioinoculantes son un componente vital en los sistemas sustentables porque constituyen un medio económicamente atractivo y ecológicamente aceptable al reducir insumos externos y mejorar la cantidad y la calidad de los recursos internos.
Conclusiones
El presente trabajo demostró que el biopreparado obtenido a partir de residuos-sólidos vegetales del mercado y la bacteria nativa Azotobacter A15M2 tiene un efecto biofertilizante sobre el desarrollo de las plantas de rábano (Raphanus sativus).
El bioinoculante ejerció efectos significativos en los parámetros biométricos de biomasa y área foliar a concentraciones bacterianas de 107 y 108 UFC/ml, comprobándose la eficiencia de la bacteria nativa en la fijación de nitrógeno y producción de ácido indolacético.
Los residuos-sólidos vegetales del mercado pueden ser utilizados en la elaboración de productos de interés agrícola dando un valor agregado a los mismos y disminuyendo la contaminación ambiental.
Se sugiere el uso del biopreparado en otras plantas propias de la región de Córdoba para mejorar la productividad, como una alternativa viable y de producción más limpia.
Referencias bibliográficas
1 Constitución Política de Colombia. 1991. Capítulo 3. De los derechos colectivos y del ambiente. Artículo 79. República de Colombia. [ Links ]
2 Degiovanni, V., Gómez, J., Sierra, J. 2004. Análisis de crecimiento y etapas de desarrollo de tres variedades de arroz (Oryza sativa L.) en Montería, Córdoba. Temas Agrarios, 9 (1): 21-29. [ Links ]
3 Dey, R., Pal, K., Bhatt, M., Chauhan, S. 2004. Growth promotion and yield enhancement of peanut (Arachis hypogaea L.) by application of plant growth-promoting rhizobacteria. Microbiological Research, 159: 371-394. [ Links ]
4 Dobbelaere, S., Vanderleyden, J., Okon, Y. 2003. Plant Growth-Promoting Effects of Diazotrophs in the Rhizosphere. Critical Reviews Plant Sciences, 22 (2): 107-149. [ Links ]
5 Dibut, B., Martínez, R. 2006. Obtención y manejo de biofertilizantes como insumos indispensables de la agricultura sostenible. Memoria Agricultura Orgánica. La Habana: Fundación Produce Sinaloa A.C. [ Links ]
6 Gómez, J. 2000. Abonos orgánicos. Santiago de Cali: Universidad Nacional de Colombia. [ Links ]
7 Hernández, A. 2002. Obtención de un biopreparado a partir de rizobacterias asociadas al cultivo del maíz (Zea Mays L.). Tesis de doctorado. Universidad de La Habana. [ Links ]
8 Kloepper, J. W., Zablotowicz, R. M., Tipping, B., Lifshitz, R. 1991. Plant growth promotion mediated by bacterial rhizosphere colonizers. In: The Rhizosphere and Plant Growth. D. L. Keister and P. B. Cregan (eds.). Dordrecht: Kluwer Academic Publisher. [ Links ]
9 Lara, C., García, L. 2010. Elaboración de un bioinoculante a partir de residuos vegetales del mercado y una bacteria nativa con potencial biofertilizante. Tesis de grado. Maestría en Biotecnología. Departamento de Química, Universidad de Córdoba. [ Links ]
10 Lara, C., Oviedo, L., Villalba. M. 2007. Bacterias fijadoras asimbióticas de nitrógeno de la zona agrícola de San Carlos. Córdoba, Colombia. Rev Colomb Biotecnol, 9 (2): 6-14. [ Links ]
11 Lara, C., Oviedo, L., Alemán, A. 2006. Evaluación química de la auxina: ácido indolacético a partir de aislados microbianos nativos con potencial biofertilizante para una alternativa de agricultura limpia en el Valle del Sinú Medio (Departamento de Córdoba). En VII Simposio Latinoamericano de Química Analítica y Ambiental. Ponencia Oral. Memorias. [ Links ]
12 Mohsen, K., Ebrahim, H., Aly, M. 2004. Physiological Response of Wheat to Foliar Application of Zinc and Inoculation with some Bacterial Fertilizers. Journal of Plant Nutrition, 27 (10): 1859-1874. [ Links ]
13 Moreno, N., Rojas, J. 2008. Producción y formulación de prototipos de un biofertilizante a partir de bacterias nativas asociadas al cultivo de arroz (Oryza sativa). Rev Colomb Biotecnol, 10 (2): 50-62. [ Links ]
14 Ramírez, P. R., Pérez, A. M. 2006. Evaluación del potencial de los biosólidos procedentes del tratameinto de aguas residuales para uso agrícola y su efecto sobre el cultivo de rábano rojo (Raphanus sativus L.). Rev. Fac. Nal. Agr. Medellín, 59 (2): 3543-3556. [ Links ]
15 Sáenz, L. 2006. Nutrición orgánica y tratamiento de desechos biodegradables. En: Documento técnico. 16 Sayeda, M., Mervat, A., Hamza, A., Fayez, M., Monib, M., Hegazi, N. 2005. Production of biofertilizers using baker's yeast effluent and their application to wheat and barley grown in north Sinai deserts. Archives of Agronomy and Soil Science, 51: 589-604. [ Links ] 17 Servigenerales. 2009. Reporte Director Operativo de la Empresa, Ing. Elkin Morales Del Toro. Montería. Córdoba. Colombia. [ Links ] 18 Setboonsarng, S., Gilman, J. 1999. Alternative agricultura in Thailand and Japan. En: Horizon Solutions 19 Singh, R., Singh, D., Tyagi, P. K. 2003. Effect of Azotobacter, farmyard manure and nitrogen fertilization on productivity of pearl millet hybrids (Pennisetum glaucum (l) r. br) in semi-arid tropical environment. Archives of Agronomy and Soil Science, 49 (1): 21-24. [ Links ] 20 Vessey, J. K. 2003. Plant grown promoting rhizobacteria as biofertilizers. Plant and Soil, 255: 571-586. [ Links ] 21 Wu, S., Caob, C., Lib, C., Cheunga, B., Wonga, B. 2005. Effects of biofertilizer containing N-fixer, P and K solubilizers and AM fungi on maize growth: a greenhouse trial. Geoderma, 125: 155-166 [ Links ]