Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.13 no.2 Bogotá July/Dec. 2011
ARTÍCULO DE INVESTIGACIÓN
Cultivo de Chlorella vulgaris sobre residual de soja con la aplicación de un campo magnético
Culture of Chlorella vulgaris using soy waste and applying a magnetic field Cultivo de C. vulgaris con soja y CM
Liliana Gómez Luna 1 , Inaudis Álvarez 2 , Roger Rivero 3
1Dra. C. Liliana Ma. Gómez Luna. (Verificar si en estos pie de páginas también se debe relacionar el nombre de los autores) Laboratorio de Ecotoxicología. Centro Nacional de Electromagnetismo Aplicado. Universidad de Oriente, Santiago de Cuba. Ave. De las Américas s/n Esq. I CP 90400. Santiago de Cuba. (www.cnea.uo.edu.cu), lilianag@cnea.uo.edu.cu
2MSc. Inaudis Álvarez Hubert. Departamento de Biología. Facultad de Ciencias Naturales. Universidad de Oriente. Ave. Patricio Lumumba s/n. Edificio Rectorado 3ra planta. Alturas de Quintero. Santiago de Cuba. inaudis@cnt.uo.edu.cu
3Lic. Roger Rivero González. Ministerio de Ciencia, Tecnología y Medioambiente. Delegación de Camagüey. Cisneros No. 105, entre Ángel y Pobre (www.cimac.cu), roger@cimac.cu
Recibido: marzo 23 de 2011 Aprobado: octubre 24 de 2011
Resumen
Chlorella ha ocupado la atención de los biotecnólogos al ser una importante fuente de biomasa para la producción de metabolitos de interés químico farmacéutico e industrial; sin embargo, el manejo de cultivos a gran escala sigue siendo un proceso que necesita economizarse, a partir de alternativas viables. Este trabajo presenta un estudio exploratorio en el que se evaluó la viabilidad del uso del residual de la línea de ablandamiento del grano de soya, como medio de cultivo para la microalga Chlorella vulgaris, obteniéndose excelentes valores de densidad celular máxima (Kmáx: 360 x 106 cél.mL-1). Posteriormente se evalúan los efectos de la aplicación de un campo magnético (CM) de 0.03T, obteniéndose densidades celulares máximas en un menor tiempo de cultivo, lo que puede constituir un fundamento esencial para una nueva metodología de cultivo. La calidad de la biomasa de C. vulgaris se evalúa desde el punto de vista bioquímico, lo que permite determinar la concentración de proteínas, carbohidratos y lípidos en la fase exponencial, cuya acumulación se ve favorecida dependiendo del protocolo de aplicación del CM, mientras que la concentración de lípidos es máxima si el CM es aplicado en la fase estacionaria, variando desde 1.70 ±0.02 hasta 3.48 ±0.03 pg cél; lo que constituiría una ventaja para el manejo de cultivos comerciales de esta microalga que depende de su destino.
Palabras clave: imán de neodimio, pigmentos, nitrógeno, biomasa, microalga.
Abstract
Chlorella has occupied the attention of biotechnologists to be an important source of biomass for the production of metabolites with a pharmaceutical, industrial and chemical interest; however, managing large-scale cultures, remains a process that needs to find alternatives become cheaper and viable. This paper presents an exploratory study that evaluated the feasibility of using the residual of soybeans softening, as a culture medium for the microalgae Chlorella vulgaris, yielding excellent values for maximum cell density (Kmax: 360 x 106 cells.mL-1). Subsequently assessed the effects of applying a magnetic field (MF) of 0.03T, obtaining maximum cell densities in a shorter time, which may constitute an essential base for a new culture methodology. The quality of the C. vulgaris biomass was evaluated from a biochemical point of view, determining protein concentration, carbohydrates and lipids concentration in the exponential phase of growth, whose accumulation is favored, depending on the MF application protocol, while the lipid concentration is maximum if the MF is applied during the stationary phase, with values from 1.70 ±0.02 to 3.48 ±0.03 pg cell. It would be an advantage for the management of commercial cultures of Chlorella depending on the biomass final use.
Key words: neodymium magnet, pigments, nitrogen, biomass, microalgae.
Introducción
La producción comercial de microalgas tiene alrededor de 50 años, siendo los principales géneros de interés comercial: Chlorella, Spirulina, Dunaliella y Haematococcus. A partir de 1990 aumentó el interés por el uso de la biomasa microalgal en la producción de biocombustibles, convirtiéndose esta en una alternativa factible por muchas razones: la rápida tasa de crecimiento de los cultivos algales, el contenido lipídico elevado de la biomasa algal, dependiendo de las condiciones de cultivo y la especie cultivada, la versatilidad de las microalgas, la posibilidad que ofrece el cultivo para usar tierras no cultivables y aguas no potables, incluso aguas residuales, entre otras. Por otra parte, las microalgas están presentes en prácticamente todos los hábitats; existe una variedad considerable de especies que viven en un amplio rango de condiciones ambientales, incluso en ambientes extremos.
Con el propósito de incrementar las ganancias económicas y para lograr mayor comprensión sobre el metabolismo y la manipulación de los cultivos en función del aumento de su capacidad productiva, las investigaciones se han concentrado en realizar ¨screening¨ de especies como: Chlorella vulgaris, Chlorella protothecoides, Spirulina maxima, Nannochloropsis sp., Neochloris oleabundans, Scenedesmus obliquus, Dunaliella tertiolecta (Mandal and Mallick 2009; Miao and Wu 2006; Gouveia and Oliveira 2009; Demirbas 2009) Dunaliella primolecta, Botryococcus braunii, Nannochloris sp., Crypthecodinium cohnii, Cylindrotheca sp., Isochrysis sp., Phaeodactylum tricornutum, Nitzschia sp. y Schizochytrium sp. (Chisti 2007, 2006; Mata et al., 2009). Algunas de estas microalgas son productoras de biomasa rica en aceites (Mata et al., 2009); no obstante, se estudian alternativas de cultivo que permitan variantes más económicas, métodos que estimulen el crecimiento y vías más acertadas para la inducción metabólica (Becker 1998; Liu et al., 2008; Hunt et al., 2009) de los productos de mayor interés comercial. Se trabaja, además, en la búsqueda de especies tolerantes a altas temperaturas, con el propósito de incrementar la eficiencia fotosintética, el rendimiento en biomasa y el contenido de metabolitos de interés; así como el mejoramiento del diseño de sistemas de cultivo. Por otra parte, aún cuando las modificaciones genéticas no han ocupado un lugar importante, los biotecnólogos tratan de seleccionar las cepas más tolerantes y estables desde el punto de vista productivo, identificando factores que estimulan la producción de determinados metabolitos a gran escala.
Algunos autores hacen énfasis en la versatilidad del cultivo de microalgas, considerando como ventajosa la posibilidad de producir biomasa a la vez que se trabaja en la biorremediación (Douskova et al., 2009), aún cuando los costos productivos sean altos, se necesite luz y las algas tengan una velocidad de crecimiento relativamente baja (Borowitzka 1999) dependiendo de la especie. En este caso se explica la efectividad del uso de medios de cultivo alternativos, específicamente residuales industriales (Cléber et al., 2006), contribuyendo a que se promuevan prácticas ambientales sensatas. Si bien se conoce que diferentes alternativas pueden funcionar como medio de cultivo para esta microalga, se hace necesario considerar posibilidades locales y el potencial de cepas autóctonas.
Específicamente Chlorella ha ocupado la atención de los biotecnólogos al ser una importante fuente de biomasa para la producción de biodiesel de segunda generación (non-food feedstock) (Cléber et al., 2006; Converti et al., 2009). Se han realizado algunas investigaciones para explicar los efectos de campos magnéticos y electromagnéticos sobre especies del género, reportando un incremento de la acumulación de nutrientes, cambios en los patrones de asimilación de iones, en la composición pigmentaria, el crecimiento y en la morfología, implicando incluso cambios de la ultraestructura, además algunos cambios fisiológicos y en el sistema de defensa antioxidante, entre otros bioefectos (Wang Hai-Ying et al., 2005; Wang et al., 2008; Wang et al., 2004; Wang et al., 2007; Takahaski and Kamezaki 1985). En 2006, Wang et al. explican, después de investigar los efectos de diferentes tratamientos magnéticos, sobre el crecimiento de C. vulgaris, usando campos constates, uniformes, estáticos y circulares, que para esta especie hay una estimulación en el rango de 5-35mT y una inhibición considerable desde 45mT hasta 200mT, con el incremento de la intensidad del campo; señalando, además, la efectividad del CM estático (Wang et al., 2006).
Este trabajo presenta una evaluación del uso del residual de la línea de ablandamiento del grano de soya del combinado lácteo de Santiago de Cuba, como medio de cultivo para la microalga Chlorella vulgaris; además, se evalúa el efecto de un campo magnético estático de 0.03T sobre parámetros de crecimiento y la composición bioquímica de la biomasa, con el propósito de proponer un método de cultivo que permita obtener mayor cantidad de biomasa, en menos tiempo, para la producción de biofertilizantes o biocombustibles, dependiendo de la composición bioquímica de esta.
Metodología
Breve descripción de la especie
Se utiliza la microalga Chlorella vulgaris Beijerinck (reino Protoctista, división Chlorophyta, orden Chlorococcales) aislada del medio local y mantenida en la Colección de Microalgas del Centro Nacional de Electromagnetismo Aplicado (CNEA), Santiago de Cuba, desde 2002 con el código F010102-A, en medio Bristol; condiciones controladas de temperatura (20°C ± 2°C) y luz continua (19.5 µE m2s-1) suministradas por lámparas fluorescentes Daylight 40W. Actualmente esta microalga se encuentra depositada en la colección del Centro de Estudios de Biotecnología Industrial (CEBI) de la Universidad de Oriente, Cuba, que pertenece a la Federación Latinoamericana de Colecciones de Cultivos (FELACC).
Condiciones experimentales de cultivo
Se desarrolla un cultivo unialgal asincrónico (batch) de C. vulgaris en medio Bristol, con nitrato como principal fuente de nitrógeno y pH 7.0; luz continua (Daylight F40T 12/D 40 W PHILIPS a 110.35 µE m-2s-1) sin suministro directo de CO2. Los cultivos fueron mantenidos con aireación constante a un flujo de 0.45 Lmin-1; el aire fue filtrado con prefiltros de microfibra de vidrio ALBET JFV-25 de 0.25 µm.
Para eliminar la interferencia electromagnética (IE), los cultivos fueron ubicados en lugares donde esta fue menor de 0.25 µT.
Se establecen cultivos controles en medio Bristol y otros en el residual de ablandamiento de soya a una concentración inicial de 20 x 106 cél.mL-1. La cinética de los cultivos se sigue por 14 días, y se realiza 5 réplicas para cada experimento.
Protocolo de aplicación del campo magnético
Se utiliza un esquema de aplicación de 1h y de forma permanente. Los cultivos se exponen a un arreglo de imanes de neodimio con un valor medio de intensidad de campo magnético estático de 0.0300T y un gradiente de variaciones de 0.0130 a 0.0610T (Figura 1 ). La intensidad se selecciona considerando el rango efectivo recomendado por varios autores (Wang et al., 2006; Hirano et al., 1998).
La exposición se realiza al comienzo de la fase exponencial (durante 1h) a cultivos establecidos con el residual de soya, utilizando un control sin CM. En el caso de la aplicación permanente, los cultivos se exponen al CM desde el primer día de establecidos.
Determinación del nitrógeno como nitrato
El nitrato, expresado en mg L-1, se determinó al residual que permitió mejores densidades celulares antes de inocular la cepa. Al finalizar la cinética de crecimiento los cultivos establecidos con el residual, con y sin aplicación del CM, fueron sometidos también a este análisis, realizado en los laboratorios ¨Elio Trincado¨ de la Empresa Geominera S.A., según las Normas ISO 14000. Estos se llevaron a cabo con el objetivo de determinar la influencia del campo magnético sobre la asimilación de este compuesto por C. vulgaris, a través de la determinación de nitrógeno (como nitrato) residual. Las determinaciones se hacen al residual y al sobrenadante de los cultivos a los 14 días.
En el caso de los cultivos, el sobrenadante se obtiene a partir de la suspensión celular por filtración previa en filtros Whatman GF/C 0.45 µm.
Análisis sobre células en cultivo
La densidad celular máxima (Kmáx) fue determinada por recuento del número de células en una cámara Neubauer mejorada con ayuda de un microscopio óptico de campo claro.
Los pigmentos fueron extraídos con metanol a partir de la biomasa fresca. Las muestras fueron previamente centrifugadas a 5000 g por 10 min. La extracción se realiza en la fase exponencial, en completa oscuridad 24 h a -7 oC después de agitación en vortex por 30 s. Posteriormente se realiza el análisis espectrofotométrico de pigmentos determinando clorofilas totales y carotenos (Wellburn 1994), para lo cual se determina la absorbancia a 665, 649 y 480 nm; los resultados se expresan en pg cél.-1.
Después de la extracción lipídica (Bligh and Dyer 1959), la cuantificación espectrofotométrica fue realizada por la reacción de la sulfofosfovainillina (Zöllner and Kirsch 1962), utilizando como patrón de calibración una mezcla proporcional de ácido palmítico (C16:0) BDH y esteárico (C18:0) Merck, a una concentración final de 0.4 mg mL-1. Se determina, además, la concentración proteica (Lowry et al., 1951) y de carbohidratos (Dubois et al., 1956); ambos análisis se realizaron sobre biomasa fresca previamente sonicada. Los resultados se expresan en pg cél.-1. Estas determinaciones se realizan en fase exponencial y en la estacionaria (7 y 14 días, respectivamente).
Análisis estadístico
Para analizar diferencias entre las medias se realizan análisis de varianza (ANOVA) y el test de Tukey para un nivel de confianza del 95% (p<0.05).
Resultados y discusión
Efecto de un campo magnético de 0.03T sobre cultivos de C. vulgaris en residual de soya
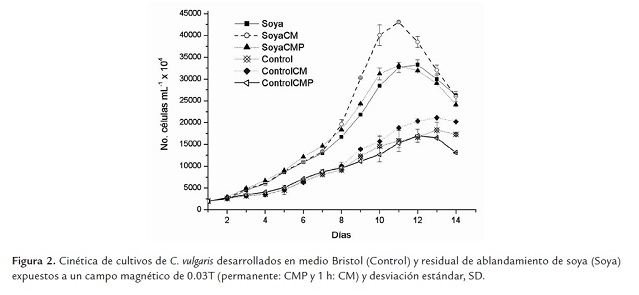
La cinética de crecimiento de C. vulgaris en residual de soya y controles establecidos en medio Bristol, con y sin tratamiento magnético se presenta en la figura 2 . En todos los casos el medio alternativo (soya) permitió mejores resultados en cuanto a crecimiento comparado con los controles (p<0.05).
El CM de 0.03T aplicado durante 1h en la fase exponencial de crecimiento, resultó ser la mejor alternativa, tanto para los cultivos controles como para aquellos establecidos sobre el residual de soya (p<0.05).
En los controles con medio Bristol, la densidad celular máxima se alcanza a los 13 días de cultivo, siendo mayor el valor de aquellos cultivos expuestos al CM durante 1h (Kmáx: 211.25 ±0.86 x 106 cél.mL-1); resultados significativamente inferiores (p≤0.05) a los que se obtienen en los cultivos desarrollados con residual de soya y expuestos al CM durante 1h (Kmáx: 430.62 ±2.34 x 106 cél.mL-1), los que duplican los resultados anteriores a los 11 días de cultivo, momento en que se obtiene la mayor densidad celular, lo que implica una reducción del tiempo de cultivo.
Existen diferencias significativas entre los valores medios de densidad celular máxima alcanzados para los cultivos sobre residual de soya expuestos al CM durante 1h, respecto a la exposición permanente (Kmáx: 430.62 ±2.34 x 106 cél.mL-1 vs 330.75 ±3.4 x 106 cél.mL-1), mostrando ventajas la primera. Asimismo, no existen diferencias significativas entre los cultivos establecidos en soya con y sin exposición permanente al CM (CMP).
Las densidades celulares máximas obtenidas con CMP son muy similares a las obtenidas en los controles desarrollados en residual de soya sin CM (332.50 ±11.88 x 106 cél.mL-1) (p≤0.05) (Figura 2 ). Estos resultados parecen no concordar con los obtenidos por Wilson (2008), quien explica que esta intensidad de campo permite mayores valores con una aplicación permanente que con 1h, en C. vulgaris; sin embargo, en los experimentos de dicho autor la cinética se realizó solo durante 10 días, y las condiciones experimentales no fueron las mismas que para el presente trabajo experimental; utilizándose una concentración inicial inferior y una menor intensidad de luz, lo que sin dudas repercute sobre el crecimiento de la especie (Mora et al., 2005) y puede haber influido en la cinética del cultivo (Wilson 2008).
La evidencia sugiere que la exposición permanente constituye una perturbación prolongada que se impone al cultivo desde el principio de su establecimiento, por lo que pudiera condicionar una adaptación inmediata, de manera que no exista una respuesta metabólica medible si existe suficiencia de nutrientes. En ambas situaciones (cultivo en medio Bristol y residual de Soya) la conducta de C. vulgaris es la misma en cuanto al crecimiento: no existen diferencias significativas entre los controles y la exposición permanente en cada caso (p≤0.05).
Conociendo que C. vulgaris utiliza el nitrato como fuente principal de nitrógeno (Gómez 1997) se determinó la concentración de nitrato en el ¨medio residual, antes y después de los 14 días de cultivo en los ensayos con residual de soya, con y sin la aplicación del campo magnético (Figura 3 ).
Este resultado ofrece una evidencia experimental del efecto del campo magnético sobre la asimilación de nitrógeno disponible como nitrato; lo que ha sido abordado por muy pocos autores (Gómez et al., 2009; Syrett 1987; Zhi-Yong et al., 2017; Li et al., 2807). La mayor cantidad de nitrato es removido o asimilado en los cultivos expuestos al CM durante 1h (p≤0.05). Sin embargo, en la exposición permanente la asimilación es mínima (p≤0.05), a pesar de lo cual se obtienen resultados en cuanto a crecimiento, similares al control, por lo que el metabolismo podría estar siendo desviado a la utilización de otras fuentes de nitrógeno disponibles, como el amonio, por ejemplo.
Los efectos del CM aplicado por 1h son evidentes y durables; se conoce que la activación de las partículas coloidales por campos magnéticos es un fenómeno que permanece en el tiempo, incluso varias horas después de terminada la exposición (Chibowski et al., 1994); todo parece indicar que esta perturbación provoca una estimulación del metabolismo del nitrógeno.
Diferentes autores, al aplicar campos electromagnéticos sobre microorganismos han descrito que existe un tiempo al cual la estimulación del cultivo es máxima con respecto al control, pero por encima de este se presenta una inhibición (Goldsworthy et al., 1999; Zapata et al., 2002; Zapata et al., 2005). Asimismo, en el caso de C. vulgaris y específicamente al hacer referencia al efecto de CM estáticos se describe que usando campos constates, uniformes y estáticos, hay una estimulación del crecimiento en el rango de 5-15mT y 10-35mT y una inhibición considerable desde 45mT a 200mT, con el incremento de la intensidad del campo (Wang et al., 2006); lo que significa la existencia de diferentes umbrales para la estimulación o inhibición del crecimiento de dicha microalga.
Si bien en estos experimentos no se busca un tiempo óptimo, se puede descartar la exposición permanente si lo que se busca es la estimulación del crecimiento. La intensidad de campo (0.03T) ha sido utilizada con éxito para promover el crecimiento y la división celular de la microalga clorofícea Haematococcus pluvialis (Gómez et al., 2009) y se encuentra en el rango de estimulación descrito por Wang et al. (2006). Los resultados obtenidos permiten evaluar al CM como un parámetro importante para el desarrollo de cultivos de C. vulgaris, puesto que se obtienen densidades celulares muy elevadas en menor tiempo de cultivo, lo que constituye una ventaja desde el punto de vista comercial. Por otra parte, la utilización de tiempos cortos facilita el diseño de los equipos de tratamiento con campos magnéticos, permitiendo incluso que se apliquen en sistemas de tuberías con velocidades de flujo líquido moderadas (Baker and Judd 1996; Zapata et al., 2002; Zapata et al., 2005).
El efecto que generan los campos magnéticos sobre el crecimiento celular se puede clasificar en inhibitorio, estimulatorio o no observable (Pothakamury et al., 1993); estos autores explican que los efectos de estimulación o inhibición se han atribuido a cambios en la orientación de biomoléculas, fundamentalmente proteínas, cambios a nivel de biomembranas, alteraciones del flujo de iones a través de la membrana plasmática y/o cambios de estructura. Por otra parte, se han propuesto varias teorías para explicar el efecto de los CM oscilantes de baja frecuencia sobre los organismos, haciendo mención al fenómeno denominado ¨resonancia del ciclotrón¨ como uno de los responsables (Goldsworthy et al., 1999; Hunt et al., 2009). Los campos magnéticos pueden activar partículas coloidales del medio de cultivo, haciendo que estas remuevan parte del calcio unido a los fosfolípidos de las membranas plasmáticas, incrementando su permeabilidad, lo que afecta el crecimiento (Goldsworthy et al., 1999).
Sin embargo, el caso que nos ocupa es el de un CM estático, y la evidencia experimental obtenida podría ser un indicador de alteraciones a nivel enzimático, en función de lograr una mejor tasa de incorporación del nitrato disponible en el medio, lo que sin dudas es un campo por investigar. Es bien conocido que la asimilación del nitrógeno inorgánico es fuertemente dependiente de la luz, y tanto la intensidad como la calidad de la luz, pueden controlar dicha asimilación mediante la modulación, bien de la incorporación del nitrato o de su reducción a través de la regulación de la síntesis y/o actividad de la enzima nitrato reductasa (NR) (Fidalgo 1995; Gómez 1997), factores que son invariables en estos experimentos.
El campo magnético aplicado durante 1h en la fase exponencial de crecimiento celular a cultivos de C. vulgaris, desarrollados sobre residual de ablandamiento de soya, permite obtener densidades celulares máximas en un menor tiempo de cultivo, basado este en una mejor incorporación del nitrato disponible en el medio.
El hallazgo puede constituir el fundamento de una nueva metodología para el manejo de cultivos de C. vulgaris.
Composición bioquímica de la biomasa de C. vulgaris.
Variación de la concentración de pigmentos
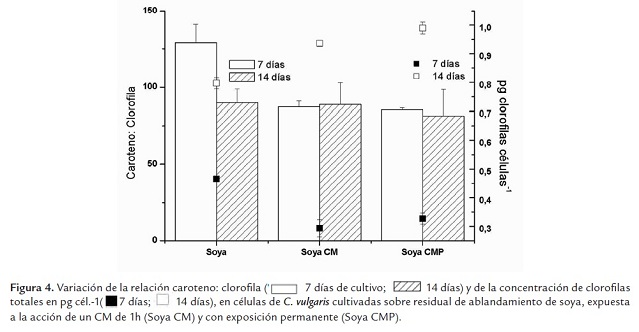
En la figura 4 se presenta la variación de la relación caroteno: clorofila y de la concentración de clorofilas totales (pg cél.-1) en C. vulgaris cultivada sobre residual de soya y expuesta a la acción del CM.
Independientemente del protocolo de aplicación, las células expuestas al CM, en la fase exponencial, presentan una concentración de clorofilas por célula menor que los controles (p<0.05), situación inversa a la que ocurre en la fase estacionaria, lo que tiene una relación directa con la densidad celular. Estos resultados coinciden con los obtenidos para H. pluvialis (Gómez et al., 2009), con un CM de igual intensidad. Ello podría constituir una evidencia del efecto del CM sobre la síntesis de clorofila.
Por otra parte, los cultivos controles establecidos con residual de soya y los expuestos al CM permanente, tienen valores similares de densidad celular; sin embargo, hay una disminución de la concentración celular de pigmentos significativa en los expuestos al CMP (p≤0.05) (Figura 4 ) que podría estar relacionada con una mejoría de la eficiencia fotosintética, por activación de sistemas multienzimáticos, lo que ha sido descrito por varios autores. Sonneveld et al. (1980), por ejemplo, en experimentos realizados con cloroplastos de espinaca, refieren haber obtenido con un CM de 0.3T un aumento de la emisión luminiscente de la clorofila a, y explican dicho proceso en términos de mecanismos de pares de radicales (Sonneveld et al., 1980). Por otra parte, se ha descrito que el CM acelera el crecimiento de Spirulina platensis mediante una activación de la excitación lumínica en el sistema fotosintético de transferencia de electrones, con un incremento del contenido de ficocianinas, efecto que se manifiesta alrededor de los 100 G (Hirano et al., 1998).
Para una mejor evaluación del estado de los cultivos a través de la composición pigmentaria se utiliza la relación caroteno: clorofila, la que resulta tener máximos valores en los cultivos controles a los 7 días (fase exponencial) con un valor medio de 129± 12 (p≤0.05). Las células en cultivo de C. vulgaris crecidas sobre residual de soya, presentan mayor concentración de carotenoides que de clorofilas. En los controles, esta relación disminuye con el tiempo de cultivo, alcanzando el valor de 89.88± 9; disminución que ocurre a expensas de un aumento de las clorofilas, mientras que la concentración celular de carotenoides se mantiene relativamente constante.
En la fase estacionaria la concentración de clorofilas por célula aumenta significativamente en todos los cultivos; sin embargo, resulta mayor en aquellos expuestos al CM (p≤0.05); resultados similares han sido descritos para H. pluvialis (Gómez et al., 2009). En esta fase, la relación caroteno: clorofila de los cultivos expuestos al CM, no difiere significativamente respecto al control (p≤0.05), lo que evidencia que existe un aumento de los carotenoides, dependiente tanto del tiempo de cultivo (p=0.01) como del efecto del CM (p≤0.05).
Si en los cultivos expuestos al CM se comparan los valores de la relación caroteno: clorofila, obtenidos a los 7 días (fase exponencial), con los de los 14 días (fase estacionaria), no existen diferencias significativas (p=0.01); sin embargo, a los 14 días de cultivo hay un aumento significativo y proporcional de la concentración de ambos pigmentos.
Si esta relación se usa como indicador de estado de los cultivos, aquellos expuestos al CM tienen un comportamiento similar a los controles durante la fase estacionaria, no así en la exponencial; a los 7 días de cultivo (fase exponencial) la relación caroteno: clorofila, disminuye significativamente (p≤0.05) en las células expuestas al CM, independientemente del protocolo de exposición, lo que se atribuye tanto a una disminución de las clorofilas por célula, como de los carotenos, siendo proporcionalmente mayor esta última. Esto pudiera soportar el planteamiento de que el CM constituye una perturbación impuesta al sistema que de alguna manera afecta la composición pigmentaria en C. vulgaris y que las células responden ajustando la proporción de pigmentos con el propósito de mejorar su habilidad para captar la luz, lo que ha sido descrito por varios autores como respuesta de diferentes especies de microalgas a las variaciones de la irradiancia espectral (Richardson et al., 1983; Bermúdez et al., 2002).
Variación de la concentración de proteínas, carbohidratos y lípidos
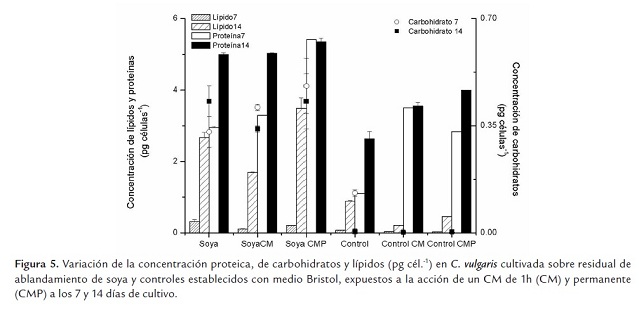
La calidad de la biomasa en cuanto a composición proteica, de carbohidratos y lípidos, obtenida a partir de cultivos desarrollados sobre residual de soya y expuestos a un CM de 0.03T, se presenta en la figura 5 , conjuntamente con los resultados de los controles.
Los resultados indican que el residual de soya permite una biomasa con una concentración celular de proteínas, carbohidratos y lípidos mayor que los controles, establecidos en medio Bristol (p≤0.05). En todos los casos, los resultados de la aplicación del CM permiten mayor acumulación de estos compuestos por célula, cuya concentración se favorece con los días de cultivo, durante el tiempo que dura la cinética, siendo significativamente mayores a los 14 días (p≤0.05).
Si bien la concentración celular de lípidos se ve favorecida por el residual de ablandamiento de soya (p≤0.05), de forma general C. vulgaris tiene mayores concentraciones celulares de proteína (p=0.01), resultados que coinciden con los que obtienen varios autores para el género y/o la especie estudiada (Becker 1998; Chisti 2007; Gómez 1997; Morris et al., 1999; Xu et al., 2006).
Un análisis más detallado del efecto del CM sobre la calidad de la biomasa de los cultivos en residual de soya, confirman lo antes expuesto en cuanto al metabolismo del nitrato y su modulación por el CM (Figura 6 ). La mejor alternativa de cultivo, atendiendo solamente a la calidad de la biomasa, sería la aplicación del CM permanente y la cosecha a los 7 días, lo que ahorraría tiempo de cultivo. No obstante, si bien no hay diferencias significativas entre la concentración celular de proteínas a los 14 días en los cultivos, con y sin los efectos del CM (p≤0.05), sí existe un aumento respecto a los controles al aplicar un CM durante 1 h; siendo los mejores resultados los de la aplicación permanente; estos últimos dependen más de la aplicación del CM que de la fase de cultivo (p=0.01).
El uso de CM aplicados por 1 h sería un buen protocolo de aplicación para cultivos discontinuos; sin embargo, para cultivos semicontinuos y continuos, sería útil la aplicación permanente, para promover acumulación de proteínas.
Mientras que los valores de proteínas por célula en los cultivos desarrollados con residual de soya al 7mo y 14vo día, son de 2.94 ±0.31 y 4.99 ±0.07 pg cél.-1, la aplicación del CM durante 1 h hace que estos valores se incrementen a 3.29 ±0.61 y 5.03 ±0.63 pg cél.-1, respectivamente. No existiendo diferencias significativas entre este último y los que se obtienen con la aplicación permanente (5.41 ±0.04 y 5.35 ±0.19 pg cél.-1 para 7 y 14 días, respectivamente), los que resultan ser los máximos valores obtenidos.
Singh et al. (1994) investigaron la aplicación de campos magnéticos permanentes de 0.3T en Anabaena doliolum, demostrando que estos tuvieron un incremento en el contenido proteico de hasta un 20% (Singh et al., 1994).
El contenido celular de proteínas (pg cél.-1) aumenta con el tiempo del cultivo, alcanzándose los valores máximos al final de la fase estacionaria. El alto contenido de proteína registrado al comienzo de dicha fase es igual o superior al observado durante el crecimiento exponencial; efecto observado repetidamente en microalgas clorofíceas cuando son cultivadas con altas concentraciones de nitrógeno (Syrett 1987), reflejando su consumo en exceso y el almacenamiento en proteína. Estas evidencias justifican los resultados obtenidos en la presente investigación, en la que las proteínas aumentan durante la fase exponencial si se aplica a los cultivos un CM de 0.03T, siendo la aplicación permanente la que más influye sobre su síntesis, lo que definitivamente está relacionado con el metabolismo del nitrato en estas condiciones. Probablemente el campo magnético induzca una elevada tasa de asimilación del nitrógeno y del carbono total, de tal manera que la incorporación de carbono a la fracción proteica sea mayor con respecto a la obtenida en la fracción de polisacáridos, favoreciendo más el mantenimiento de la viabilidad y el crecimiento celular; resultados similares fueron descritos para H. pluvialis (Gómez et al., 2009).
En el caso de los carbohidratos, la diferencia no es significativa (p≤0.05), si bien la biomasa con mayor concentración se obtiene a los 7 días con CM aplicado permanentemente (0.48 ±0.04 pg cél.-1). Los resultados constituyen una evidencia de que el CM no afecta el metabolismo de los carbohidratos en C. vulgaris. Hirano et al. (1998) observaron que Spirulina platensis incrementa la tasa de consumo de CO2 y la síntesis de azúcares durante el proceso fotosintético cuando son sometidas a un CM de 10 mT. Los campos magnéticos tienen efecto sobre el metabolismo e influeyen en procesos como la síntesis de carbohidratos, pigmentos, acumulación de aminoácidos esenciales y actividad fermentativa, entre otras (Hunt et al., 2009). Generalmente, como resultado de las perturbaciones a las que son sometidas las células tratadas con campo magnético, no solo se altera la síntesis proteica, sin embargo, en estos experimentos no se constata una influencia significativa sobre la síntesis de carbohidratos. El residual de soya ofrece una excelente alternativa para la obtención de biomasa rica en carbohidratos.
Al analizar la concentración lipídica por célula, se observa que hay un efecto del CM dependiente del protocolo de aplicación. De forma general, hay una acumulación celular mayor a los 14 días en los cultivos expuestos al CM (p=0.01), variando desde 1.70 ±0.02 hasta 3.48 ±0.03 pg cél. Sin embargo, en los cultivos sin CM el incremento de la concentración celular de lípidos entre los días 7 y 14, representa solamente el 50% del que se logra en la aplicación permanente (8.34 vs 16.57); mientras que el incremento con la aplicación de 1h representa el 91% (15 vs 16.57). El incremento de la composición lipídica ha sido descrito para C. vulgaris por una disminución del contenido de nitrógeno en el medio (Converti et al., 2009), lo que es coherente con los resultados de la presente investigación.
Si se quiere obtener una biomasa rica en lípidos utilizando el residual de soya como medio de cultivo alternativo en C. vulgaris, habría entonces que considerar la aplicación de un CM de 0.03T de forma permanente, lo que puede incrementar sus concentraciones celulares, sin modificar la cinética del cultivo significativamente. Sin embargo, para proponer una metodología de cultivo definitiva hay que hacer un análisis del rendimiento, y por tanto, un escalado. Por otra parte, sería recomendable hacer un análisis holístico que no pondere el resultado en cuanto a crecimiento, sino que integre los obtenidos en cuanto a la inducción de mayores concentraciones celulares de uno u otro metabolito.
Conclusiones
Un CM de 0.03T aplicado durante 1h en la fase exponencial del crecimiento a cultivos de C. vulgaris desarrollados sobre residual de ablandamiento de soya, permite obtener densidades celulares máximas en un menor tiempo de cultivo, por lo que puede constituir el fundamento de una nueva metodología de cultivo de esta especie para obtener biomasa de buena calidad. Desde el punto de vista metabólico, la aplicación del CM disminuye la concentración de clorofilas y favorece la acumulación de proteínas durante la fase exponencial, independientemente del protocolo aplicado; sin embargo, si se aplica de forma permanente, favorece no solo la acumulación de proteínas, sino la de carbohidratos y lípidos en la fase exponencial, y la de lípidos, en la fase estacionaria. El CM aplicado durante 1h no favorece la acumulación de lípidos por célula y no parece influir sobre la síntesis de carbohidratos; estas evidencias permiten explicar que existe una respuesta compleja de la microalga a la exposición del CM ensayado. De forma general, esta parece responder, movilizando la energía y recursos disponibles en función del crecimiento.
Referencias bibliográficas
1 Baker, J., and S. Judd. 1996. Magnetic amelioration of scale formation. Water Resource 30:247-260. [ Links ]
2 Becker, E. W. 1998. Microalgae for human and animal consumption. In Microalgal Biotechnology, edited by M. A. Borowitzka and L. J. Borowitzka. Cambridge, United Kingdom: Cambridge University Press, 222-256. [ Links ]
3 Bermúdez, J. L., C. Lodeiros, and E. Morales. 2002. Producción de biomasa de la microalaga marina Chroomonas sp. en función del pH, intensidad luminosa y salinidad Boletín de Investigaciones Marinas 31 (1). [ Links ]
4 Bligh, E. G., and W. J. Dyer. 1959. A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology 37:911-917. [ Links ]
5 Borowitzka, M. A. 1999. Commercial production of microalgae: ponds, tanks, tubes and fermenters Journal of Biotechnology 70 (1-3):313-321. [ Links ]
6 Cléber, F. E., M. Sant'Anna, G. L. Villela, and O. Barcelos. 2006. Lipids, fatty acid composition and carotenoids of Chlorella vulgaris cultivated in hydroponic wastewater. Grasas y aceites 57 (3):270-274. [ Links ]
7 Converti, A., A. A. Casazzaa, E. Y. Ortiza, P. Patrizia, and a. M. Del Borghia. 2009. Effect of temperature and nitrogen concentration on the growth and lipid content of Nannochloropsis oculata and Chlorella vulgaris for biodiesel production. Chemical Engineering and Processing: Process Intensification 48 (6):1146-1151 [ Links ]
8 Chibowski, E., L. Holysz, and W. Wójcik. 1994. Changes in zeta potential and surface free energy of calcium carbonate due to exposure to radiofrequency electric fields. Physicochemical Engineering Aspects 92:79-85. [ Links ]
9 Chisti, Y. 2006. Microalgae as sustainable cell factories. Environmental Engineering and Management Journal 5 (3):261-274. [ Links ]
10 ---. 2007. Biodiesel from microalgae. Biotechnology Advances 25 (3):294-306. [ Links ]
11 Demirbas, A. 2009. Production of biodiesel from algae oils. Energy Sources Part A: Recovery, Utilization & Environmental Effects 31 (2):163-168. [ Links ]
12 Douskova, I., J. Doucha, K. Livansky, J. Machat, P. Novak, D. Umysova, V. Zachleder, and M. Vitova. 2009. Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs. Applied Microbiology & Biotechnology 82 (1):179-185. [ Links ]
13 Dubois, M., K. A. Gilles, J. K. Hamilton, P. A. Rebers, and F. Smith. 1956. Colorimetric method for determination of sugars and related substances. Annalitical Chemistry 28:350-356. [ Links ]
14 Fidalgo, P. 1995. Variabilidad bioquímica de microalgas marinas en cultivo en función de la fuente de nitrógeno. Tesis Doctoral, Departamento de Biología Celular y Molecular, Universidade da Coruña, España. [ Links ]
15 Goldsworthy, A., H. Whitney, and E. Morris. 1999. Biological effects of physically conditioned water. Water Resource 33:1618-1626. [ Links ]
16 Gómez, L. 1997. Cultivo y aplicación de las microalgas Dunaliella salina y Chlorella vulgaris en Cuba, Universidad de La Coruña, La Coruña. [ Links ]
17 Gómez, L., J. Menéndez, I. Álvarez, and I. Flores. 2009. Efecto de diferentes protocolos de aplicación de un campo magnético (0.03T) sobre el crecimiento, viabilidad y composición pigmentaria de Haematococcus pluvialis Flotow en suficiencia y ausencia de nitrógeno. Biotecnología Vegetal 9 (2):105-117. [ Links ]
18 Gouveia, L., and A. C. Oliveira. 2009. Microalgae as a raw material for biofuels production. Journal of Industrial Microbiology & Biotechnology 36 (2):269-274. [ Links ]
19 Hirano, M., A. Ohta, and K. Abe. 1998. Magnetic field effects on photosynthesis and growth of the cyanobacterium Spirulina platensis. Journal of Fermentation & Bioengineering 86 (3):313-316. [ Links ]
20 Hunt, R. W., A. Zavalin, A. Bhatnagar, S. Chinnasamy, and K. C. Das. 2009. Electromagnetic biostimulation of living cultures for Biotechnology, Biofuel and Bioenergy applications. International Journal of Molecular Science 10 (11):4719-4722. [ Links ]
21 Li, Z. Y., S. Y. Guo, L. Lin, and M. Y. Cai. 2007. Effects of electromagnetic field on the batch cultivation and nutritional compostion of Spirulina platensis in an air-lift photobioreactor. Bioresource Technology 98:700-705. [ Links ]
22 Liu, Z.-Y., G.-C. Wang, and B.-C. Zhou. 2008. Effect of iron on growth and lipid accumulation in Chlorella vulgaris. Bioresource Technology 99 (11):4717-4722. [ Links ]
23 Lowry, O. H., N. J. Rosengbrough, A. L. Farr, and R. J. Randall. 1951. Protein measurements with the Folin phenol reagent. Journal of Biological Chemistry 193 (1):265-275. [ Links ]
24 Mandal, S., and N. Mallick. 2009. Microalga Scenedesmus obliquus as a potential source for biodiesel production. Applied Microbiology & Biotechnology 84 (2):281-291. [ Links ]
25 Mata, T. M., A. A. Martins, and N. S. Caetano. 2009. Microalgae for biodiesel production and other applications: A review. Renewable and Sustainable Energy Reviews 14 (1):217-232. [ Links ]
26 Miao, X., and Q. Wu. 2006. Biodiesel production from heterotrophic microalgal oil. Bioresource Technology 97 (6):841-846. [ Links ]
27 Mora, R., R. Moronta, J. Ortega, and E. Morales. 2005. Crecimiento y producción de pigmentos de la microalga nativa Chlorella sp. aislada de la Represa de Tulé, Municipio Mara, Estado Zulia, Venezuela. Ciencia Completa 12:1-9. [ Links ]
28 Morris, H., M. M. Quintana, Á. Almarales, and L. Hernández. 1999. Composición bioquímica y evaluación de la calidad proteica de la biomasa autotrófica de Chlorella vulgaris. Revista Cubana de Alimentación y Nutrición 13 (2):123-128. [ Links ]
29 Pothakamury, U., G. Barbosa, and B. Swanson. 1993. Magnetic fields inactivation of microoganisms and generation of biological changes. Food Technology 47:85-93. [ Links ]
30 Richardson, K., J. Beardall, and J. A. Raven. 1983. Adaptation of unicellular algae to irradiance: An analysis of stategies. New Phytology 93:157-191. [ Links ]
31 Singh, S. S., S. P. Tiwari, J. Abraham, S. Rai, and A. K. Rai. 1994. Magnetobiological effects on a cyanobacterium, Anabaena doliolum. Electromagnetic Biolological Medicine 13:227-235. [ Links ]
32 Sonneveld, A., L. N. M. Duysens, and A. Moerdijk. 1980. Magnetic field-induced increase in chlorophyll a delayed fluorescence of photosystem II: A 100- to 200-ns component between 4.2 and 300 K Proceeding of National Academy od Science USA 77 (10):5889-5893. [ Links ]
33 Syrett, P. J. 1987. Nitrogen assimilation by eukaryotic algae. In Inorganic Nitrogen Metabolism, edited by W. R. Ullrich, P. J. Aparicio, P. J. Sirte and F. Castillo. Berlín: Springer-Verlag, 25- 31. [ Links ]
34 Takahaski, F., and T. Kamezaki. 1985. Effect of magnetism of growth of Chlorella. Hakkokogaku 63:71-74. [ Links ]
35 Wang, H.-Y., S.-Y. Guo, B.-S. Zheng, and L. Li. 2004. Accumulating nutrient in Chlorella vulgaris enhanced by magnetic-treatment. Food Science and Technology (8). [ Links ]
36 Wang, H.-Y., X.-B. Zeng, and S.-Y. Guo. 2007. Effects of magnetic treatment on ultrastructure of Chlorella vulgaris. Acta Laser Biology Sinica (4). [ Links ]
37 Wang Hai-Ying, Zeng Xiao-Bo, and G. Si-Yuan. 2005. Effects of electro-magnetic field on the physiological characteristics of Chlorella vulgaris and mechanisms analysis. Fisheries Science (7). [ Links ]
38 Wang, H. Y., X. B. Zeng, and S. Y. Gui. 2006. Growth of Chlorella vulgaris under different magnetic treatments. Progress in Modern Biomedicine 12. [ Links ]
39 Wang, H. Y., X. B. Zeng, S. Y. Guo, and Z. T. Li. 2008. Effects of magnetic field on the antioxidant defense system of recirculation-cultured Chlorella vulgaris. Bioelectromagnetics 29:39-46. [ Links ]
40 Wellburn, A. 1994. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution. Journal of Plant Physiology 144:307-313. [ Links ]
41 Wilson, J. 2008. Cultivo de la microalga Chlorella vulgaris bajo la acción de campos magnéticos estáticos, Biología, Universidad de Oriente, Santiago de Cuba. [ Links ]
42 Xu, H., X. Miao, and Q. Wu. 2006. High quality biodiesel production from a microalga Chlorella protothecoides by heterotrophic growth in fermenters. Journal of Biotechnology 126 (4):499-507. [ Links ]
43 Zapata, J. E., G. Moreno, and E. J. Márquez. 2002. Efecto de los campos magnéticos sobre el crecimiento de Saccharomyces cerevisiae. Interciencia 27 (10). [ Links ]
44 Zapata, J. E. M., M. R. Hoyos, and G. O. Moreno. 2005. Acción de un campo magnético sobre un cultivo aireado de Saccharomyces cerevisiae. Interciencia 30 (7). [ Links ]
45 Zhi-Yong, L., G. Si-Yuan, L. Lin, and C. Miao-Yan. 2007. Effects of electromagnetic field on the batch cultivation and nutritional composition of Spirulina platensis in an air-lift photobioreactor. Bioresource Technology 98:700-705. [ Links ]
46 Zöllner, N., and K. Kirsch. 1962. Über die quantitative bestimmong von lipoiden (mikromethode) mittels der vielen natürlichen lipoiden (allen bekannten plamalipoiden) gemeinsamen sulphosphovainillin-reaktion. Z. German Experimental Medicine 135:545-561. [ Links ]