Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.13 no.2 Bogotá July/Dec. 2011
ARTÍCULO DE INVESTIGACIÓN
Regeneración vía embriogénesis somática de una variedad colombiana élite de Theobroma cacao L.
Regeneration through somatic embryogenesis of an elite colombian Theobroma cacao L. variety
Aura Inés Urrea Trujillo1 , Lucía Atehortúa Garcés2 , Adriana María Gallego Rúa3
11 Ph. D. en ciencias, Docente Instituto de Biología, Universidad de Antioquia (Medellín), Colombia. aurrea@matematicas.udea.edu.co
22 Ph. D. en ciencias, Docente Instituto de Biología, Universidad de Antioquia (Medellín), Colombia. latehor@gmail.com
33 Cand. Msc. en Biología, Investigadora grupo de Biotecnología, Universidad de Antioquia (Medellín), Colombia. adriana.gallego.02@gmail.com
Recibido: mayo 15 de 2011 Aprobado: octubre 27 de 2011
Resumen
El objetivo de esta investigación fue evaluar dos protocolos de propagación vía embriogénesis somática a partir de explantes florales en dos clones élite BIOB e ICS95 de Theobroma cacao L. Se obtuvo un 50 y 32% de callo embriogénico en ICS95 y BIOB respectivamente con el protocolo de Fontanel et al. (2002), modificado después de un periodo de cultivo de tres meses. Los embriones pasaron por fases que se correspondieron con medios de cultivo diferenciales: Inducción, Formación, Maduración y Mantenimiento. Para la embriogénesis somática secundaria se obtuvo un 23% de embriones a partir de embriones somáticos primarios en un medio, conteniendo 1mg/L de 2,4,5 T (2,4,5 Triclorofenoxiacético). Se logró, además, desarrollar enraizamiento adventicio aplicando pulsos de IBA (Ácido Indol Butírico) a 0.5mg/L y 0.5g/L durante un minuto. Las plantas enraizadas se llevaron a una mezcla de tierra: arena (1:1) para su adaptación ex vitro, obteniéndose un 66% de plantas aclimatadas. Los estudios histológicos mostraron diferentes características típicas del desarrollo embriogénico. Este es el primer reporte en el que se logra de manera exitosa la conversión hasta plántula (68%) y la adaptación ex vitro de una variedad colombiana de cacao vía embriogénesis somática primaria y secundaria.
Palabras clave: Cacao, embriones somáticos, propagación in vitro, cultivo de tejidos.
Abstract
In this research we evaluate two protocols of propagation via somatic embryogenesis from floral explants using two elite clones BIOB and ICS95 of Theobroma cacao L. We obtained 50 and 32% of embryogenic callus on ICS95 and BIOB respectively with Fontanel et al., (2002) protocol modified after three months of culture. The embryos went through four phases; Induction, Formation, Maduration and Mantenimiento which corresponded each one with different media culture. For secondary somatic embryogenesis we obtained 23% of embryos from primary somatic embryos in a medium with 1mg/L of 2,4,5 T (2,4,5 Triclorofenoxiacetic). Also we obtained plants that developed new roots applying pulses with IBA (Indol Butiric Acid) 0.5mg/L and 0.5g/L for a minute. The developed plants were moved to a mix of potting soil and sand (1:1) for their ex vitro adaptation, getting 66% of acclimatized plants. The histological analysis showed the typical characteristics of the embryogenic development. This is the first report where it is achieved the successful conversion to plantlets (68%) and ex vitro adaptation of a colombian cocoa variety via primary and secondary embryogenesis.
Key words: Cacao, somatic embryos, in vitro propagation, tissue culture.
Introducción
Theobroma cacao es un árbol perteneciente a la familia Malvaceae que crece en zonas tropicales húmedas y es considerado un importante cultivo a nivel mundial como materia prima para la fabricación del chocolate, el cual se produce a partir de las semillas (Despréaux, 2001). Su importancia económica es evidente en las 3.61 millones de toneladas producidas a nivel mundial. La producción para Colombia en el periodo 09/10 fue de 41 mil toneladas, lo que generó para el país un estimado de 38 mil empleos a familias campesinas de bajos recursos (FEDECACAO, 2011; ICCO, 2010).
En Colombia las variedades se obtienen básicamente por métodos tradicionales de cruces injertados entre diferentes clones, proceso que puede tomar más de 13 años para desarrollar una variedad premium. Los árboles de cacao élite presentan un alto grado de segregación cuando son multiplicados por semilla, debido a esto se han empleado diferentes sistemas de propagación clonal, tales como injertación y producción de estacas enraizadas (UNCTAD, 2008; Chávez y Mansilla, 2004). Dichos sistemas tienen un grado de efectividad variable al ser dependientes de las condiciones ambientales, de la cohesión entre la planta madre y el donador y de las enfermedades que aparecen durante el prendimiento.
Por consiguiente, se han evaluado otros métodos de propagación mediante la técnica de cultivo de tejidos. La regeneración de plantas de cacao mediante embriogénesis somática se ha establecido exitosamente a partir de explantes florales (Solano, 2008; Monsalve et al., 2005; Chanatásig, 2004), no obstante etapas como la aclimatización y evaluación en campo solo se han reportado con variedades provenientes del Oeste de la India (Maximova et al., 2008).
Inicialmente los trabajos en embriogénesis somática de cacao se enfocaron en la producción de embriones somáticos a partir de tejidos zigóticos sin lograr su desarrollo hasta planta (Janick et al., 1980). La limitación a la hora de trabajar con tejidos zigóticos es que al ser resultado de polinización cruzada, el material clonal no replica el genotipo del árbol, perdiéndose así la ganancia genética.
Posteriormente los esfuerzos se dirigieron al desarrollo de sistemas de cultivo de tejidos somáticos incluyendo hojas, con las que se presentó baja frecuencia de embriogénesis somática usando sales MS (Murashige y Skoog, 1962) y altos contenidos de auxina (Litz,
1986); con tejido nucelar se obtuvieron embriones somáticos, pero estos no maduraron (Janick, 1993; Söndahl, 1991; Esan, 1977), y utilizando explantes florales como pétalos y estaminodios se ha obtenido hasta un 90% de producción de embriones somáticos y 20% de germinación (Alemmano et al., 1997; López-Báez et al., 1993; Söndahl, 1991 y Söndahl et al. 1989). Aunque dichos sistemas fueron satisfactorios en producción de embriones somáticos, todavía eran de utilidad limitada, siendo aplicables solo a algunos genotipos y con muy bajas tasas de conversión a plántula.
Experimentos posteriores reconocieron la importancia de los reguladores de crecimiento como el Ácido Abscísico (ABA) y el Ácido Naftalenacético (ANA) en embriogénesis somática de cacao (Janick et al., 1980). Por otro lado, Guiltinan et al. (2003) desarrollaron un método eficiente de propagación usando TDZ (Thidiazuron) y las sales basales DKW (Driver y Kuniyuki, 1984), con lo que se logró establecer un protocolo para embriogénesis somática secundaria (ESS) a partir de embriones somáticos primarios, los cuales fueron convertidos a plántulas obteniéndose entre un 3.3 y 27.1% de germinación, para posteriormente establecerlas bajo condiciones de invernadero. Estos resultados constituyen una de las principales bases de la embriogénesis somática para cacao en el mundo.
Actualmente la cadena productiva colombiana de cacao enfrenta varios problemas, principalmente en el sector primario. Por un lado las condiciones ambientales fluctuantes, entre ellas los altos niveles de pluviosidad, dificultan el establecimiento de los injertos comerciales al favorecer la pudrición y, por otro, el carácter permanente de la producción del cacao que conlleva a la falta de renovación de los cultivos y el consecuente envejecimiento de los mismos (los cuales pueden alcanzar hasta 20 años), generan bajas productividades; además las plantaciones viejas se hacen susceptibles a enfermedades como la moniliasis (Moniliophthora roreri) y escoba de bruja (Moniliophthora perniciosa), las cuales causan entre el 10 y el 95% de las pérdidas del cultivo (Observatorio de Agrocadenas, 2008). Lo anterior se manifiesta a escala comercial, la cual hoy acude para la importación del grano y así responder a la demanda interna. Estas importaciones incrementan el costo del producto terminado, el cual se refleja en el precio para el consumidor (FEDECACAO 2011).
En este sentido, establecer una rápida producción masiva de clones élite que elimine la dependencia climática y el efecto de las plagas y enfermedades sería una alternativa efectiva para responder a las necesidades del mercado colombiano. De acuerdo con el estudio realizado por Solano (2008), los protocolos de propagación de cacao en general evidencian un fuerte efecto genotípico. Por tal motivo, se hace necesario establecer un protocolo de propagación para cada variedad de cacao. El objetivo de esta investigación fue evaluar protocolos de propagación clonal vía embriogénesis somática en dos variedades élite de cacao por su alta concentración de polifenoles, tamaño de grano y alta productividad.
Materiales y métodos
Material vegetal y desinfección
Botones florales de dos variedades de Theobroma cacao, BIOB (desarrollada en Colombia) e ICS95 (variedad introducida), fueron suministrados por la Compañía Nacional de Chocolates (CNCH), San Vicente de Chucurí, departamento de Santander.
Los ensayos preliminares de desinfección se basaron en el protocolo descrito por Guiltinan et al. (2003). Dado el alto porcentaje de contaminación bacteriana obtenido, se decidió evaluar diferentes antibióticos y tiempos de exposición. Los antiobiogramas permitieron determinar la estreptomicina a 250 ppm como la concentración más adecuada para el control bacteriano. El protocolo consistió en sumergir los botones florales en una solución de hipoclorito de sodio (NaClO) al 1% durante 30 minutos en constante agitación, luego se realizaron tres lavados con agua destilada estéril, se sumergieron en una solución de estreptomicina 250 ppm por 30 minutos y, finalmente, se enjuagaron de nuevo antes de la siembra.
Medios de cultivo
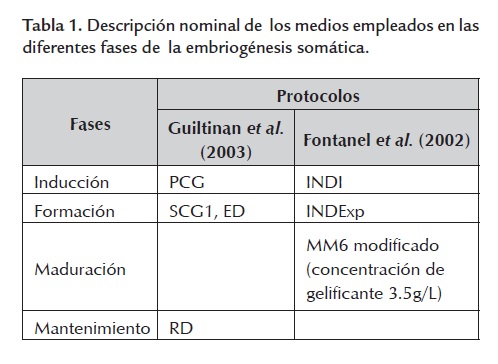
Se seleccionaron dos protocolos de propagación por embriogénesis somática evaluados exitosamente en otras variedades de cacao. Los protocolos fueron el desarrollado por Guiltinan et al. (2003) en Penn State University y el descrito por Fontanel et al. (2002) del Centro de Investigación de Nestlé en Tours, Francia. Las sales basales de los protocolos consistieron en DKW, MS y McCown's (Lloyd and McCown, 1981). Las fases de estos protocolos fueron: Inducción, Formación, Maduración y Mantenimiento. La denominación de los medios, de acuerdo con los autores, se presenta en la tabla 1 .
Se utilizó también el medio de Fontanel et al. (2002) CM2 para evaluar la embriogénesis somática secundaria. Todos los medios fueron esterilizados en autoclave a 121ºC y 120 libras de presión durante 20 minutos. El manejo del material vegetal se llevó a cabo en cámara de flujo laminar horizontal.
Inducción y formación de embriones somáticos
Para la etapa de inducción se extrajeron las bases de pétalo y los estaminodios de cada botón floral y se sembraron en cajas de Petri de 60X15 mm, conteniendo 20 ml de medio de cultivo PCG o INDI. Los cultivos se mantuvieron en oscuridad por 30 días a temperatura de 25ºC + 2ºC. Se sembraron 10 explantes por caja y se establecieron 4 cajas por cada repetición. Se realizaron 3 repeticiones por tipo de explante para un total de 240 explantes.
Después de este tiempo de cultivo los explantes siguieron la secuencia de subcultivos descrita en la figura 1 (según el protocolo establecido inicialmente), hasta la formación de los embriones somáticos. Las condiciones de cultivo se mantuvieron constantes. Las variables respuesta, porcentaje de callo y porcentaje de callo embriogénico fueron registradas después de la siembra a las 4 y 8 semanas respectivamente.
Maduración
Los embriones somáticos expresados en el medio INDexp del protocolo de Fontanel et al. (2002), que alcanzaron el estado cotiledonar, se aislaron y se subcultivaron en el medio de maduración MM6 del mismo protocolo. Se mantuvieron bajo un fotoperiodo de 12 horas luz /12 de oscuridad, intensidad lumínica de 32mmol/m2s y temperatura de 25ºC + 2ºC. El porcentaje de plantas enraizadas, la altura (cm) y el número de hojas por planta fueron registrados 45 días después del subcultivo en MM6.
Después de 4-6 semanas, las plántulas se subcultivaron en el medio de mantenimiento del mismo protocolo. Pasados 30 días la mayoría de las plántulas se tornaron cloróticas, por lo que se reemplazó el medio de mantenimiento de Fontanel et al. (2002) por el medio de mantenimiento RD modificado del protocolo de Guiltinan et al. (2003), considerando que este contiene calcio, sulfuro y magnesio en una mayor concentración, y que dichos elementos son clave para un adecuado desarrollo de las hojas (Azcón y Talón, 2008).
Enraizamiento adventicio
En esta etapa se procedió a inducir raíces adventicias en las plántulas procedentes del medio RD debido a que la mayoría solo había desarrollado la raíz principal, aspecto que dificultaba el establecimiento ex vitro. De acuerdo con los trabajos realizados por Pruski et al. (2005) y Traore et al. (2003) se seleccionaron dos pulsos de IBA como los más adecuados para el desarrollo de raíces, 0.5mg/L y 0.5g/L cada uno aplicado durante 1 minuto. Se tuvo en cuenta un control en el que no se aplicó pulso de IBA. Un total de 67 plantas fueron usadas para este experimento. La metodología consistió en sumergir la parte radical de cada una de las plantas en la solución enraizadora por un minuto y, posteriormente, se sembraron en medio basal DKW libre de reguladores. Las condiciones de cultivo fueron las mismas de la etapa de maduración. El porcentaje de plantas enraizadas y el número de raíces por planta se registraron 45 días después de la aplicación del pulso.
Embriogénesis somática secundaria (ESS)
Embriones somáticos en estado globular y cotiledonar de un tamaño promedio de 1-4 mm (dependiendo del estado de desarrollo) se cortaron transversalmente y se sembraron en cajas de Petri (60x15mm) con 10 ml del medio de multiplicación CM2. Los cultivos permanecieron en oscuridad a una temperatura de 25ºC + 2ºC. El porcentaje de explantes formando embriones somáticos secundarios fue registrado 45 días después del cultivo en el medio CM2. Los embriones secundarios obtenidos se aislaron del callo madre y se subcultivaron en el medio MM6 para su conversión a plántula.
Análisis histológico
Con el objetivo de corroborar el carácter embriogénico de los callos y desarrollo normal de los embriones somáticos, se realizó un análisis histológico empleando explantes en diferentes estados de desarrollo. Estos fueron procesados siguiendo el protocolo de Maximova et al. (2002), modificado como se describe a continuación: Los embriones fueron fijados en paraformaldehído 2%, glutaraldehído 1% y cafeína 1% (w/v), deshidratados con series de alcohol 70% 60 minutos, 95% 15 minutos, 95% 30 minutos y 100% 15 minutos, seguidos por imbibición en parafina PARAPLAST (Ref 501006). El material embebido fue fraccionado en un micrótomo rotatorio (LEICA Model RM 2125) en secciones de 4 µm de grosor. Las secciones se colorearon siguiendo la técnica de tinción Safranina-Fast Green. El registro fotográfico se realizó en un microscopio de luz Carl Zeiss Primo Star.
Análisis estadístico
Los resultados fueron analizados con el paquete estadístico SAS 9.1. Para los resultados de respuesta callogénica y enraizamiento se realizaron análisis categóricos. Para los datos obtenidos en la embriogénesis primaria y secundaria y maduración se realizó un análisis factorial. En las variables se determinó la media general con un nivel de confianza P < 0.05.
Resultados
Desinfección
El protocolo de asepsia optimizado permitió obtener resultados promedios de desinfección del 85% para el clon ICS95 y del 96% para el clon BIOB, porcentajes considerados altos para genotipos cuya procedencia fue de campo, donde se reconoce que la carga microbiana es mayor que para plantas provenientes de invernadero.
Inducción y formación de embriones somáticos
Los explantes cultivados en los medios PCG e INDI incrementaron dos veces su tamaño original y posteriormente sobre su superficie se formó un callo compacto blanco granular. En ambos medios y variedades, la formación de callo fue mayor al 90% después de un mes de cultivo (figura 2a ). Los embriones somáticos en estado globular fueron evidentes 15 días después del subcultivo en los medios SCG e INDExp, principalmente en las bases de pétalo para el clon ICS95 y exclusivamente en los estaminodios para el clon BIOB. Sin embargo solo los embriones del clon BIOB alcanzaron la etapa cotiledonar. Los embriones del clon ICS95 se formaron en la superficie del callo blanco compacto (Figura 2b ), en tanto que embriones independientes o agrupados (clusters) del clon BIOB se formaron a partir de un callo granular café de textura friable (Figura 2c y 2d). Para el clon BIOB, el número de embriones independientes por explante y el de clusters formados por explante, arrojaron una media de 3 y 15 respectivamente, obteniéndose la máxima producción dos meses después del subcultivo (tabla 2 ).
Maduración
Los embriones somáticos del clon BIOB, 45 días después de ser transferidos al medio MM6, alcanzaron una altura no superior a un centímetro, un número de hojas inferior a 2 y solo iniciaron la formación de la raíz principal. Cuando las plantas se subcultivaron en el medio de mantenimiento, el enraizamiento, altura y número de hojas no mejoraron, por el contrario las plantas perdieron vigor y algunas se tornaron necróticas, lo cual fue indicativo de una baja respuesta respecto a lo reportado para el protocolo en otras variedades.
Teniendo en cuenta que el tiempo de respuesta contemplado en este protocolo puede ser corto para los procesos de desarrollo en plantas leñosas como el cacao, se evaluó la transferencia a medio fresco MM6 cada 30 días durante dos meses adicionales. La permanencia por más de 45 días en este medio favoreció el vigor de las plántulas reflejado en la altura (1.44 + 0.94 cm), número de hojas (2.40 + 1.41) y porcentaje de plantas enraizadas (91.23%) (figura 3a). Las plantas de 3-4 cm de altura se adaptaron a condiciones ex vitro sin necesidad de un subcultivo previo en el medio de mantenimiento como lo describe el protocolo original de Fontanel et al. (2002). El porcentaje de conversión a plántula fue del 68,42 y el de establecimiento ex vitro fue del 66% (figura 3b).
Para el clon ICS95, teniendo en cuenta que los embriones formados en el medio INDExp solo alcanzaron la etapa globular, se procedió a evaluar de acuerdo con la literatura disponible el Ácido Abscísico (ABA) y diferentes concentraciones de sacarosa, con miras a mejorar el proceso de maduración de estos embriones (Alemanno et al., 1997, Fang et al., 2004). Los resultados de estos ensayos no mostraron un mejoramiento del proceso de maduración y desarrollo de los embriones somáticos, los cuales, por el contrario, formaron un callo blanco granular en su superficie (dato no mostrado).
Enraizamiento adventicio
Dado que las plantas del clon BIOB en el medio de mantenimiento perdían vigor y desarrollaban un sistema radicular pobre (máximo dos raíces por planta), se realizó un ensayo paralelo al planteado para maduración (periodo prolongado en el medio MM6), con el fin de mejorar el enraizamiento in vitro de estas plántulas.
En el pulso de 0.5g/L de IBA se obtuvo un 13% de plantas enraizadas y un mayor número de raíces (4-13), y para el pulso de 0.5mg/L se obtuvo un mayor número de plantas enraizadas (33%), pero con menor número de raíces (máximo 2 por planta). En ambos casos, las raíces eran delgadas y se originaron de nuevo en la parte basal del vástago. El análisis estadístico no mostró diferencias significativas en la formación de raíces (P = 0.3152) para ambos pulsos, no obstante en la aplicación del pulso de 0.5mg/L la formación de callo fue menor en la parte radical, contrario a lo que se obtuvo con el pulso de 0.5g/L.
Embriogénesis somática secundaria (ESS)
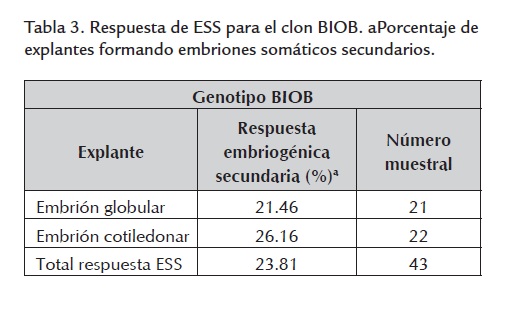
El porcentaje promedio de embriones somáticos secundarios, obtenido para el total de explantes, arrojó un valor alrededor del 23% (tabla 3 ). No se presentó diferencia significativa en la respuesta a partir de los dos tipos de explantes utilizados. Estos embriones se originaron directamente del explante o de un escaso callo granular de color café-claro previamente formado (figura 4 ).
Análisis histológico
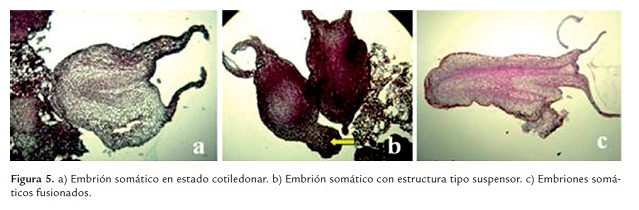
En los cortes histológicos realizados a los callos embriogénicos y embriones cotiledonares, se pudo observar la independencia del tejido madre de los embriones formados, estos además presentaron un estado bipolar en el que se pudo apreciar el eje apical y el radical (figura 5a). En los embriones se visualizó una capa de células bien definida que formaba la epidermis, seguida de células parenquimáticas que rodeaban la zona procambial y los haces vasculares. En algunos cortes fue posible observar la presencia de una protuberancia tipo suspensor en el polo radical de los embriones (figura 5b), mientras en otros cortes fue evidente el desarrollo de embriones malformados (unidos a través de un solo sistema vascular, figura 5c).
Discusión
Inducción y expresión de embriones somáticos
La respuesta de explantes florales a la callogénesis en la inducción de embriogénesis somática en cacao se ha estudiado anteriormente, obteniéndose diversos resultados de acuerdo con la metodología aplicada (López- Báez et al., 2000; Li et al., 1998; Pence, 1995; Söndahl et al., 1993). Varios autores afirman que las diferencias en la respuesta callogénica y embriogénica en cacao dependen del genotipo, condiciones de cultivo y tipo de explante (Monsalve et al. 2005; Chanatásig, 2004; Tan y Furtek, 2003; Maximova et al. 2002), lo cual ha sido corroborado también en otras especies (Fisichella et al. 2000; Etienne et al. 1999; Han y Park, 1999; Sreenath et al. 1995).
La respuesta obtenida en los dos genotipos evaluados con relación al porcentaje de callo fue aproximadamente del 90% y estuvo dentro del rango obtenido por Solano (2008), quien evaluó 4 variedades de cacao entre ellas ICS95, con resultados entre 55 al 96% de respuesta callogénica para un mismo medio de cultivo.
El porcentaje de callo embriogénico fue del 30 y 50% para el clon BIOB e ICS95 respectivamente. Este último clon ha sido reportado anteriormente con resultados entre
0.83 y 1.31%, y una producción de 0.01 embriones somáticos por cada 100 explantes (Solano, 2008). Una posible explicación a la diferencia de porcentajes obtenidos con respecto al trabajo de Solano (2008) puede deberse no solo a la variabilidad propia de cada clon, sino también al portainjerto que según dicho autor, influye en la capacidad embriogénica de las variedades. Por otro lado, Li et al. (1998) estableció un número promedio de embriones somáticos por explante entre 4 y 42, trabajando con los genotipos ICS1, ICS19, ICS39 e ICS67, variedades relacionadas con el clon ICS95. Los resultados revisados confirman que existe una fuerte dependencia del genotipo no solo para la respuesta embriogénica, sino también para la cantidad de embriones promedio obtenidos por cada explante.
Los reguladores de crecimiento son determinantes en la respuesta embriogénica ya que estos interactúan con los niveles hormonales endógenos y, en algunos casos, las respuestas están dadas por la acción conjunta de dos o más reguladores (Anami et al., 2010; Taiz y Zeiger, 2002). Los protocolos evaluados en las dos variedades, que consideraban combinaciones de auxinas y citoquininas en los medios de inducción, permitieron obtener una respuesta diferencial, resultando efectivo el protocolo de Guiltinan et al. (2003) en la inducción de embriones para el clon ICS 95 con el explante base de pétalo y el protocolo de Fontanel et al. (2002) para el clon BIOB con el explante estaminodio.
El tipo de explante se ha considerado como otro factor en la respuesta diferencial a la embriogénesis somática en cacao (Rivera, 2003). El efecto del tipo de explante en la formación de embriones somáticos de cacao fue descrito por Monsalve et al. (2005), estos autores afirman que las diferencias obtenidas en la formación de callo en los explantes se deben, posiblemente, a la naturaleza de las células que lo conforman. En el cojín floral, los estaminodios se encuentran fundidos en la base, en contacto con la zona meristemática, en comparación con los pétalos que están más externos en la estructura floral. De otro lado, durante la siembra la mayor parte de la superficie del estaminodio queda en contacto con el medio de cultivo, no siendo así para las bases de pétalo, ya que poseen una curva en forma de cuello de cisne. La estructura del estaminodio favorece una división mitótica temprana y la diferenciación de las células somáticas.
La formación de los embriones somáticos en el clon BIOB se originó de un callo café granular, de consistencia friable, diferente del obtenido con el clon ICS95, el cual fue blanco y granular, y donde los embriones somáticos permanecieron en estado globular. Respecto a este evento, Quiroz et al. (2001) mencionan que compuestos fenólicos presentes en el callo pueden actuar como inductores o inhibidores de la embriogénesis somática. Por su parte Omokolo et al. (1997) respaldan esta afirmación al indicar que los fenoles como antioxidantes podrían representar un mejor sustrato para las enzimas oxidativas, cuya acción permite la liberación de las auxinas para promover la diferenciación embriogénica. Estas observaciones hacen pensar que en cacao los compuestos fenólicos actúan como inductores indirectos de la embriogénesis somática; no obstante falta mayor investigación al respecto.
Etapa de maduración, mantenimiento y enraizamiento adventicio
Durante la etapa de maduración se da la acumulación de sustancias necesarias para la germinación del embrión. Entre los factores que pueden afectar la maduración de un embrión, se encuentran: las sales minerales, la fuente de carbono, el agente gelificante, suplementos hormonales como el ABA, la adición de carbón activado, entre otros (Perán-Quesada et al., 2004).
Las plantas que permanecieron en el medio de maduración por un tiempo más prolongado (12 semanas) presentaron un mayor vigor, altura y número de raíces en comparación con las plántulas que permanecieron en el medio de maduración por 6 semanas y que luego fueron subcultivadas en el medio de mantenimiento. Una de las posibles explicaciones a esta respuesta puede ser que las plántulas que permanecieron por más tiempo recibieron un efecto prolongado tanto de la combinación de los reguladores de crecimiento (ANA y GA3 [Acido Giberélico]) como del carbón activado. El efecto promotor del carbón activado en la morfogénesis puede deberse, principalmente, a la adsorción irreversible de compuestos inhibitorios en el medio de cultivo que disminuye la acumulación de metabolitos tóxicos y exudación fenólica (Thomas, 2008). Agarwal et al. (2004) explica que estos metabolitos inhiben estados de desarrollo específicos de los embriones somáticos y que al ser adsorbidos por el carbón activado pueden mejorar la maduración.
El carbón activado, además de adsorber sustancias inhibitorias, reduce la intensidad lumínica en la base de los vástagos, generando un ambiente adecuado para la acumulación de auxinas y/o cofactores (Thomas, 2008). Por otro lado, Von Arnold et al. (2002) afirman que generalmente un mes de tratamiento se considera adecuado, no obstante tiempos prolongados de exposición en el medio con carbón activado pueden incrementar el número de embriones maduros formados.
Varios autores han reportado el efecto positivo del carbón activado en la maduración de embriones somáticos, mejorando el crecimiento en altura y sistema radicular (Steinmacher et al., 2007; Groll et al., 2002; Zhang et al., 2000; Linington, 1991). No obstante, existen casos en los que el uso del carbón activado va en detrimento del desarrollo y la maduración embriogénica, tal es el caso de Myrciaria aureana y Phoenix canariensis (Thomas, 2008). Estas respuestas negativas podrían deberse a que el carbón activado en su papel adsorbente puede también retener sustancias importantes para la maduración. Este podría ser el caso para el clon ICS95, aunque varios reportes apuntan más bien a definir su genotipo como recalcitrante a la embriogénesis somática (Solano, 2008; Traore et al., 2003).
Con referencia a los ensayos realizados para mejorar el enraizamiento adventicio (tiempo prolongado en el medio de maduración y pulsos con IBA), un mayor tiempo en el medio de maduración resultó favorable también para el desarrollo radicular. El carbón activado solo o en combinación con auxinas ha sido reportado como beneficioso para el enraizamiento en varias especies. Esto es congruente con lo obtenido en este trabajo, debido a que se alcanzó en el medio que contenía ANA, GA3 y carbón activado, un mejor desarrollo radicular comparado a cuando se aplicaron pulsos de IBA.
Los resultados con los pulsos de IBA terminaron en un pobre desarrollo radicular en cuanto al tiempo de exposición. Esto es coherente con los resultados obtenidos por Traore et al. (2003), quienes evaluando diferentes periodos de inducción de enraizamiento en variedades de cacao, encontraron que periodos cortos (24 o 48 h) produjeron plántulas con una o dos raíces, en tanto que un mayor tiempo (16 días) producía un mayor número de raíces por planta, pero con frecuencia acompañado de la aparición de callo en el polo radical, lo que dificultaba el posterior desarrollo de las plántulas.
Embriogénesis somática secundaria
La ESS es el proceso regenerativo por el cual se desarrollan embriones somáticos a partir de embriones somáticos primarios (Da-Silva et al. 2005). En este ensayo se evaluaron como explantes dos estados de desarrollo de los embriones primarios, embriones tipo globular y embriones tipo cotiledonar. Aunque diferentes autores han reportado mejores resultados con explantes cotiledonares (Hernández et al. 2003; Muralidharan y Mascarenhas, 1995; Pinto et al. 2008; Shi et al. 2010), en este trabajo no se encontraron diferencias significativas en la inducción de embriones secundarios.
Es conocido el uso de auxinas en la inducción de ESS, ya que estos reguladores de crecimiento vegetal parecen ser cruciales no solo en las fases de inducción de la embriogénesis somática primaria, sino también en la inducción y mantenimiento de la ESS (Pinto et al., 2008). Durante la ESS se formaron embriones, unos directamente sobre la superficie del explante y otros sobre un escaso callo granular café claro, similar al callo embriogénico formado en la embriogénesis primaria. Se encontró una relación entre la formación del tejido calloso y la aparición de cluster de embriones secundarios.
En este trabajo se obtuvo un 23% de ESS en el medio suplementado con la auxina 2,4,5 T, un resultado superior al 5% obtenido por Oliveira et al. (2005) trabajando con el protocolo de Guiltinan et al. (2003). La capacidad de los embriones somáticos primarios de formar embriones somáticos secundarios o no, puede deberse a la variabilidad celular existente probablemente en su origen. Maximova et al. (2002) describieron el origen celular de embriones somáticos primarios de cacao como pluricelular, y el de los embriones somáticos secundarios como unicelular. Teniendo en cuenta la pluricelularidad en el explante original, es posible pensar que no todas las células tendrán la misma capacidad de formar embriones somáticos secundarios. A parte de ello se encuentra la variabilidad propia de cada clon discutida anteriormente.
Con respecto al mantenimiento de la embriogénesis secundaria, Muralidharan y Mascarenhas (1995) y Shi et al. (2010) conservaron el potencial embriogénico repetitivo por más de dos años para las especies Eucalyptus citriodora y Cinnamomum camphora L. respectivamente, empleando auxinas en el medio de cultivo.
La embriogénesis somática secundaria tiene gran potencial para la micropropagación a gran escala, la cual es especialmente importante para especies leñosas que tienen ciclos de generación largos (como el cacao) y con bajas frecuencias de embriogénesis somática. A parte de ser efectiva en la eliminación de virus como el CSSV, promueve la fidelidad genética en la criopreservación de cacao (Fang et al. 2009; Quainoo et al. 2008). Esta continua proliferación de embriones es tanto efectiva en costo como en tiempo, y representa resultados promisorios para la cadena productiva colombiana de cacao como sistema útil para la micropropagación y futura transformación genética.
Análisis histológico
La presencia de una epidermis definida y haces vasculares indican el grado de diferenciación obtenido con los embriones somáticos. La independencia del tejido madre y la bipolaridad de los embriones permitieron confirmar que el protocolo evaluado indujo la formación de embriones somáticos viables. Estas características también fueron descritas por Pinto et al. (2010), Vega et al. (2009) y Ramos et al. (2010).
Igualmente se observó la presencia de embriones fusionados. En especies como Capsicum se reportaron defectos como fusión de embriones cuando los embriones en estado torpedo no se aislaban del callo original (Ramos et al. 2010), lo que significa que la asincronía embriogénica presente en cacao da pie para que se pueda presentar este tipo de eventos. Con los resultados obtenidos no fue posible observar el origen celular de los embriones, no obstante las protuberancias (tipo suspensor) formadas en algunos embriones podrían sugerir un origen unicelular (Ramos et al., 2010).
Conclusión
En este trabajo se obtuvieron embriones somáticos en los clones colombianos ICS95 y BIOB, no obstante solo los embriones de este último clon se desarrollaron hasta la etapa cotiledonar empleando el protocolo de Fontanel et al. (2002). Posteriormente se desarrollaron hasta plántulas en el medio de maduración MM6 modificado. Un tiempo prolongado en este medio favoreció un buen desarrollo en altura y radicular, aspecto que permitió la adaptación ex vitro exitosa. Por otro lado, los pobres resultados obtenidos con el clon ICS95 reafirman el fuerte efecto genotípico en la embriogénesis somática de Theobroma cacao. Este es el primer reporte de conversión a plántula y adaptación ex vitro exitosa en un genotipo colombiano élite de cacao, sin embargo se requiere más investigación al respecto para superar la recalcitrancia asociada a otros genotipos como ICS95.
Agradecimientos
Agradecemos a las entidades Ministerio de Agricultura y Desarrollo Rural, Compañía Nacional de Chocolates y Universidad de Antioquia por financiar el desarrollo de este trabajo. Al Dr. Camilo Ramírez por su apoyo en la parte estadística.
Referencias bibliográficas
1 Agarwal, S., Kamlesh, K., Sharma, D. 2004. Factors affecting secondary somatic embryogenesis and embryo maturation in Morus alba L. Scientia Horticulturae, 102: 359-368. [ Links ]
2 Alemanno, L., Berthouly, M., Michaux-Ferriere, M. 1997. A comparison between Theobroma cacao L. Zygotic embryogenesis and somatic embryogenesis from floral explants. in vitro Cell Dev. Biol. Plant, 33: 163-172. [ Links ]
3 Anami, E., Mugutu, J., Taracha, C., Coussens, G., Mansour, K., Hilson, V., Lijsebettens, M., Machuka, S. 2010. Somatic embryogenesis and plant regeneration of tropical maize genotypes. Plant Cell Tiss Org Cult. 103: 285-295. [ Links ]
4 Azcón, J. y Talón, M. 2008. Fundamentos de Fisiología Vegetal. España: Universitat de Barcelona. pp. 103-119. [ Links ]
5 Chanatásig, V. 2004. Inducción de la embriogénesis somática en clones superiores de cacao (Theobroma cacao L.), con resistencia a enfermedades fungosas. Tesis de Maestría. Costa Rica: CATIE. pp. 86. [ Links ]
6 Chávez, A. y Mansilla, J. 2004. Manual del cultivo de cacao. Perú: Ministerio de Agricultura, Programa para el Desarrollo de la Amazonia. pp. 100. [ Links ]
7 Da- Silva J. 1999. Effect of activated charcoal on Brassica oleracea microspore culture embryogenesis. Euphytica, 108: 65 - 69. [ Links ]
8 Da-Silva, R., Gallardo, L., y Menéndez, A. 2005. Primary and secondary somatic enbryogenesis in leaf sections and cell suspensions of Coffea arabica cv. catimor. INCI, 30 (11): 694 - 698. [ Links ]
9 Despréaux, D., 2001. Overview on perennial cultures. Plantation Research and Development, pp: 95. [ Links ]
10 Driver, D., & Kuniyuki, D. 1984. in vitro propagation of Paradox walnut rootstock. HortScience, 19: 507-509. [ Links ]
11 Esan, B. 1977. Tissue culture studies on cocoa (Theobroma cacao L.). A supplementation of current research. Proceeding, Fifth International Conference on Cocoa Research. [ Links ]
12 Etienne, B., Bernard, B., Vasquez, N., Etienne, H. 1999. Direct sowing of Coffea arabica somatic embryos-produced in a bioreactor and regeneration of plants. Plant Cell Rep., 19: 111-117. [ Links ]
13 Fang, J., Wetten, A., Hadley, P. 2004. Cryopreservation of cocoa (Theobroma cacao L.) somatic embryos for long-term germplasm storage. Plant Science, 166:669-675. [ Links ]
14 Fang, J., Wetten, A., Adu, R., Wilkinson, M., Rodríguez, C. 2009. Use of secondary somatic embryos promotes genetic fidelity in cryopreservation of cocoa (Theobroma cacao L.). Agricultural and Food Science, 18: 152-159. [ Links ]
15 FEDECACAO, 2011. Disponible en http://www.fedecacao.com.co [Fecha de consulta: 17 de marzo de 2011]. [ Links ]
16 FEDECACAO, 2011. Noticia: Plan cacaoetero permitira al pais exportar cacao. Disponible en: http://www.fedecacao.com.co/cw/index.php?secinfo=18&Noticia=2888 [Fecha de consulta: 1.o de septiembre de 2011]. [ Links ]
17 Fisichella, M., Silvi, E., Morini, S. 2000. Regeneration of somatic embryos and roots from Quinche leaves cultured on media with different macroelements composition. Plant Cell, Tissue and Organ Culture, 63: 101-107. [ Links ]
18 Fontanel, A., Gire-Bobin, S., Labbé, G., Favereau, P., Álvarez, M., Rutte, S., Pétiard, V. 2002. in vitro multiplication and plant regeneration of Theobroma cacao L. via stable embryogenic calli. 10 IAPTC Congress, Plant Biotechnology. [ Links ]
19 Groll, J., Myles, V., Mycock, D. 2002. Development of Cassava (Manihot esculenta Crantz.) somatic embryos during culture with abscisic acid and activated charcoal. J. Plant Physiol, 159: 437-443. [ Links ]
20 Guiltinan, M., Young, A., Miller, C., Mayolo, G., Swanson, J., Pishak, S., Maximova, S. 2003. Cacao tissue culture protocol. Disponible en http://guiltinanlab.cas.psu.edu [Fecha de consulta: 15 de marzo de 2009]. [ Links ]
21 Han, K., y Park, Y. 1999. Somatic embryogenesis in black locust. Somatic embryogenesis in woody plants USA: Kluwer Academic Publishers. pp. 149-161. [ Links ]
22 Hernández, I., Celestino, C., Alegre, J., Toribio, M. 2003. Vegetative propagation of Quercus suber L. by somatic embryogenesis II Plant regeneration from selected cork oak trees. Plant Cell Report, 21: 765-770. [ Links ]
23 ICCO, 2010. Cocoa Anual Report Disponible en http://www.icco.org [13 de marzo de 2010]. [ Links ]
24 Janick J., Pence, V., Hasegawa, P. 1980. Initiation and Development of asexual Embryos of Theobroma cacao L. in vitro. Z. Pflanzenphysiol, 98: 1-14. [ Links ]
25 Janick J. 1993. Agricultural uses of somatic embryos. Acta Horticulturae, 336: 207-215. [ Links ]
26 Li, Z., Traore, A., Maximova, S. Guiltinan, M. 1998. Somatic embryogenesis and plant regeneration from floral explants of cacao (Theobroma cacao L.) using thidiazuron. in vitro Cell. Dev. Biol. Plant, 34: 293-299. [ Links ]
27 Linington, L. 1991. in vitro propagation of Dipterocarpus alatus and Dipterocarpus intricatus. Plant Cell Tissue Organ Cult, 27: 81-88. [ Links ]
28 Litz, E. 1986. Tissue culture studies with Theobroma cacao. Proc. Cacao Biotechnology Symposium. [ Links ]
29 Lloyd, G. & McCown, B. 1981. Woody Plant Medium: A mineral nutrient formulation for microculture of woody plant species. HortScience, 16: 453. [ Links ]
30 López-Báez, O., Bollon, H., Eskes, A., Pétiard, V. 1993. Embryogenése somatique de cacaoyer Theobroma cacao L. à partir de pièces florales. C.R. Acad. Sci, 316: 549-585. [ Links ]
31 López-Báez, O., Moreno, J., Pacheco, S. 2000. Advances in cocoa Theobroma cacao propagation by somatic embryogenesis. INGENIC Workshop on the New Technologies and Cocoa Breeding. [ Links ]
32 Maximova, S., Alemanno, L., Young, A., Ferriere, N., Traore, A., Guiltinan, M. 2002. Efficiency, genotypic variability, and cellular origin of primary and secondary somatic embryogenesis of Theobroma cacao L. in vitro Cell Development Biology Plant, 38: 252-259. [ Links ]
33 Maximova, S., Young, A., Pishak, S., Guiltinan, M. 2008. Field performance of Theobroma cacao L. plants propagated via somatic embryogenesis. In Vitro Cellular and Developmental Biology Plant, 44: 487-493. [ Links ]
34 Monsalve, L., García, C., Sigarroa, A. 2005. Obtención de embriones somáticos primarios de Theobroma cacao en clones de interés regional para el departamento Norte de Santander, Colombia. Revista Respuestas, 1: 21-28. [ Links ]
35 Muralidharan, E. & Mascarenhas, A. 1995. Somatic embryogenesis in Eucalyptus. USA: Kluwer Academic Publishers. pp. 63-79. [ Links ]
36 Murashige, T. & Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant, 15(3): 473-497. [ Links ]
37 Observatorio de Agrocadenas. 2008. La industria de Chocolates en Colombia. Disponible en http://www.agrocadenas.gov.co [Fecha de consulta: 30 de septiembre de 2008]. [ Links ]
38 Oliveira, M., , Romano, E., Yotoko, K., Penha, M., Barreto, B., Lima, J. 2005. Characterisation of the cacao somatic embryogenesis receptor-like kinase (SERK) gene expressed during somatic embryogenesis. Plant Science 168: 723-729. [ Links ]
39 Omokolo, N., Tsala, N., Niemenak, N. 1997. Phenol content, acidic peroxidase and IAA-oxidase during somatic embryogenesis in Theobroma cacao L. Biol. Plant, 39: 337-347. [ Links ]
40 Pence, V. 1995. Somatic Embryogenesis in Cacao (Theobroma cacao). Biotechnology in Agriculture and Forestry, 30:455-467. [ Links ]
41 Perán-Quesada R, Sánchez C, Barceló A y Pliego F. 2004. Factors affecting maturation of avocado somatic embryos. Scientia Horticulturae, 102: 61-73. [ Links ]
42 Pinto, G., Yill, P., Silva, S., Neves, L., Araújo, C., Santos, C. 2008. Factors affecting maintenance, proliferation, and germination of secondary somatic embryos of Eucalyptus globulus Labill. Plant Cell Tissue and Organ Culture, 95: 69-78. [ Links ]
43 Pinto, G., Silva, S., Neves, L., Araújo, C., Santos, C. 2010. Hystological changes and reseve acumulation during somatic embryogenesis in Eucalyptus globulus. Trees, 24: 763-769. [ Links ]
44 Pruski K, Astatkie T.,Nowak J. 2005. Tissue culture propagation of Mongolian cherry (Prunus fruticosa) and Nanking cherry (Prunus tomentosa) Plant Cell, Tissue and Organ Culture 82: 207-211. [ Links ]
45 Quainoo, AK., Wetten, A., Allainguillaume J. 2008. The effectiveness of somatic embryogenesis in eliminating the cocoa swollen shoot virus from infected cocoa trees. Journal of Virological Methods, 149: 91-96. [ Links ]
46 Quiroz, F., Méndez M., Larqué, A., Loyola, V. 2001. Picomolar concentrations of salicylates induce cellular growth and enhance somatic embryiogenesis in Coffea arabica tissue culture. Plant Cell Rep, 20: 679-684. [ Links ]
47 Ramos, L., Nahuath, S., Andrade, A., Barredo, F., González, T., Castaño, E. 2010. Indirect somatic embryogenesis and morphohistological analysis in Capsicum chinense. Biologia, 65 (3): 504-511. [ Links ]
48 Rivera, S. 2003. Respuesta de Clones de Cacao (Theobroma cacao L.) a la Embriogénesis Somática de Explantes Florales. Tesis Ingeniera. Costa Rica: Instituto Tecnológico de Costa Rica. pp.64. [ Links ]
49 Shi, X., Dai, X., Guofeng, L., Zhang, J., Guogui, N., Bao, M. 2010. Cyclic secondary somatic embryogenesis and efficient plant regeneration in camphor tree (Cinnamomum camphora L.). in vitro Cell Development Biology, . 46: 117-125. [ Links ]
50 Solano, W. 2008. Embriogénesis somática en clones superiores de cacao (Theobroma cacao L.) obtenidos en el programa de mejoramiento genético del CATIE. Tesis de Maestría. Costa rica: CATIE. pp. 86. [ Links ]
51 Söndahl, M., Sereduk, T., Chen, Z., Bellato, C. 1989. Somatic embryogenesis and plant regeneration of cacao. Patent no. 88/'3078, Jan. 25 1989, Republic of South Africa. [ Links ]
52 Söndahl, M. 1991. Tissue culture of cacao, coffee and oil palm. In: Abstr. 4th Conf. Int. Plant Biotechnology Network, Biotechnology for Tropical Crop Improvement in Latin America. [ Links ]
53 Söndahl, M., Liu, S., Bellato, C., Bragin, A. 1993. Cacao Somatic Embryogenesis. Acta Horticulturae, 336: 245-248. [ Links ]
54 Sreenath, H., Shanta, H., Harinath, K., Naidu, M. 1995. Somatic embryogenesis from integument (perisperm) cultures of coffee. Plant Cell Rep, 14: 670-673. [ Links ]
55 Steinmacher C., Clement, C., Guerra, M. 2007. Somatic embryogenesis from immature peach palm inflorescence explants: towards development of an efficient protocol. Plant Cell Tissue Organ Cult, 89: 15-22. [ Links ]
56 Taiz, L. & Zeiger, E. 2002. Plant Physiology. California: Oxford University Press. Capítulo 20. [ Links ]
57 Tan, C. & Furtek, D. 2003. Development of an in vitro regeneration system for Theobroma cacao from mature tissues. Plant Science, 164: 407-412. [ Links ]
58 Thomas, T. 2008. The role of activated charcoal in plant tissue culture. Biotechnology Advances, 26: 618-631. [ Links ]
59 Traore, A., Maximova, S., Guiltinan, M. 2003. Micropropagation the Theobroma cacao using somatic embryo-derived plants. In Vitro Cell Dev Biol Plant, 39: 332-337. [ Links ]
60 UNCTAD. 2008. United Nations Conference on Trade and Development. Disponible en http://www.unctad.org [Fecha de consulta: 30 de septiembre de 2008]. [ Links ]
61 Vega, R., Vásquez, N., Espinoza, A., Gatica, A., Váldez, M. 2009. Histology of somatic embryogenesis in rice (Oryza sativa cv. 5272). Rev. Biol. Trop, 57 (1):141-150. [ Links ]
62 Von Arnold, S., Sabala, I., Bozhkov, P., Dyachok, J., Filonova, L. 2002. Developmental pathways of somatic embryogenesis. Plant Cell Tissue and Organ Culture, 69: 233-249. [ Links ]
63 Zhang, B., Liu, F., Yao, C. 2000. Plant regeneration via somatic embryogenesis in cotton. Plant Cell, Tissue and Organ Culture, 60: 89-94. [ Links ]