Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.13 no.2 Bogotá July/Dec. 2011
ARTÍCULO DE INVESTIGACIÓN
Evaluación de marcadores moleculares asociados con resistencia a gota (Phytophthora infestans L.) en papas diploides y tetraploides
Evaluation of molecular markers associated with resistance to late blight (Phytophthora infestans L.) in diploid and tetraploid potatoes
Juyó, D. K.1 , Gerena, H. N.1 , Mosquera, T.2
1Estudiante Facultad de Agronomía, Universidad Nacional de Colombia.
2Profesora Titular Facultad de Agronomía, Universidad Nacional de Colombia. tmosquerav@unal.edu.co
Recibido: septiembre 22 de 2010 Aprobado: octubre 27 de 2011
Resumen
La papa, cultivo de importancia a nivel mundial es gravemente afectado por gota, enfermedad ocasionada por el oomycete Phytophthora infestans. Actualmente la forma más efectiva para combatir la enfermedad es mediante el desarrollo de cultivares resistentes al patógeno. Para esto, una estrategia es identificar genes que confieran resistencia al patógeno, para lo cual se buscan marcadores asociados con el carácter de resistencia. En este estudio se evaluaron marcadores moleculares tipo SCAR (Sequence Characterized Amplified Region): CosA, GP179, BA47f2 y Prp1 asociados con resistencia a P. infestans y el gen de resistencia R1, en 22 cultivares tetraploides pertenecientes a la subespecie andigena y cinco especies silvestres. Se evaluó el polimorfismo y se determinó si los alelos polimórficos permitían diferenciar genotipos resistentes de susceptibles. Se comparó el tamaño de los fragmentos obtenidos con los fragmentos esperados asociados con resistencia de acuerdo a reportes. El análisis se realizó considerando presencia/ausencia de los fragmentos: CosA210, CosA250, R11400, R11800, BA47f2500, GP179570, Prp1300, Prp1600, y Prp1900. Los resultados indicaron que en los cultivares tetraploides y silvestres, se presentaron polimorfismos en todos los marcadores evaluados, con excepción del marcador GP179. No se encontró correlación entre el rasgo de resistencia y los alelos. Los resultados de este estudio muestran que hay repuesta diferencial a los marcadores entre las subsp. tuberosum y subsp. Andigena.
Palabras clave: Phytophthora infestans, resistencia a gota, marcadores diagnóstico, Solanum tuberosum subsp. Andigena.
Abstract
Potato is an important worldwide crop seriously affected by late blight disease caused by the oomycete Phytophthora infestans. Currently, the most effective way to control the disease is developing resistant cultivars to the pathogen by identifying genes that confer resistance to the pathogen. For this purpose it is important to find molecular markers associated with the trait. In this study, the SCAR (Sequence Characterized Amplified Region) markers: CosA, GP179, BA47f2 y Prp1, associated with late blight and the resistant gen R1 were evaluated in 22 tetraploid cultivars from subspecie andigena and five wild potato species. Polymorphism was evaluated and it was evaluated if polymorphic alleles allow differentiating resistant from susceptible genotypes. The fragment length for each marker was compared to the allele size reported associated to resistance. The analysis considered the presence/absence of the fragments: CosA210, CosA250, R11400, R11800, BA47f2500, GP179570, Prp1300, Prp1600 and Prp1900. The results indicated that both, tetraploid cultivars and wild potatoes, showed polymorphisms with all these markers, except with the GP179 marker. It was not found correlation between resistance and the presence of specific alleles. Evidence found in this study indicates that results obtained with molecular markers differed between subsp. tuberosum and subsp. andigena.
Key words: Phytophthora infestans, late blight resistance, diagnostic markers, Solanum tuberosum subsp. andigena.
Introducción
La papa (Solanum tuberosum L.) es considerada el tercer alimento de mayor importancia a nivel mundial (Visser et al., 2009). En el año 2006, Colombia fue catalogado como el tercer productor de papa en América Latina (15 millones de ton anuales) y el vigésimo a nivel mundial (CEVIPAPA, 2008).
La especie tetraploide Solanum tuberosum L. (2n=4x=48) originaria de los Andes suramericanos, comprende dos subespecies: tuberosum y andigena (Estrada, 2004). Posiblemente el cruce entre las especies silvestres y diploides, Solanum stenotomun y S. sparcipilum, dieron origen a S. tuberosum subsp. andigena, especie precursora de S. tuberosum subsp. tuberosum, la cual está más adaptada a días largos, condición característica de algunas latitudes europeas y de algunos países suramericanos (Hawkes, 1990a). Esta especie se caracteriza por poseer altos contenidos de aminoácidos esenciales, presenta periodo vegetativo de tres a cuatro meses y tiempo de reposo del tubérculo corto. El tubérculo es de gran tamaño, tiene yemas superficiales y presenta resistencia parcial a gota (Estrada, 2004).
Los cultivares o híbridos de la subespecie andigena, se desarrollan preferiblemente en condiciones de días neutros o cortos y a una altura entre los 2000-4000 msnm (Hawkes, 1990b). Su periodo vegetativo es de cinco a siete meses, el tubérculo presenta un período largo de reposo, buena calidad para el consumo, alto porcentaje de almidón y resistencia parcial a gota. Estos cultivares son cultivados en la zona andina, en los países de: Bolivia, Colombia, Perú, Ecuador y Venezuela (Estrada, 2004).
La presencia de la enfermedad conocida como gota en Colombia es causada por el oomycete Phytophthora infestans, el cual es el patógeno más severo a nivel mundial para este cultivo. La estrategia de control de la enfermedad, adoptada por la mayoría de los agricultores, se basa en el uso y aplicación calendario de una amplia gama de agroquímicos, lo cual constituye cerca del 29,9% de los costos de producción (Agrocadenas, 2005).
La obtención de cultivares resistentes a gota ha sido acogida como una de las principales estrategias para combatir el ataque de esta enfermedad. La resistencia genética en papa es de dos tipos: resistencia de hipersensibilidad, denominada también específica, vertical o monogénica y la resistencia de campo, también denominada parcial, general, horizontal o poligénica (Gebhardt and Valkonen, 2001; Bormann, 2004; Estrada, 2004; Mosquera, 2007). Por un lado, la primera ha sido utilizada tradicionalmente para conferir resistencia a gota, por cruzamientos de cultivares comerciales con la especie silvestre Solanum demissum (L) (Oberhagemann et al., 1999). La segunda, confiere resistencia por disminución de la infección, la tasa de colonización del tejido y reducción de la esporulación. Los genes implicados en resistencia cuantitativa, son identificados mediante el análisis de locus segregantes para caracteres cuantitativos (QTL), en cruzamientos con materiales diploides que muestran resistencia de campo (Jaramillo y Rojas, 2003; Jacobs et al., 2010).
Para la identificación de QTL se ha recurrido al uso de marcadores genéticos, especialmente marcadores moleculares basados en PCR, que revelan diferencias genéticas entre organismos, individuos o entre especies. Por lo general, los marcadores no se encuentran dentro del gen de interés, pero si pueden estar cerca y actuar como señales, cuando se encuentran fuertemente ligados a genes o QTL que controlan la resistencia (Collard et al., 2005). Usualmente se localizan en regiones no codificantes del genoma y no se ven afectados por factores ambientales o del desarrollo de la planta.
La identificación de genes de interés agronómico ha sido posible gracias al uso de marcadores moleculares que se encuentran ligados a ellos y que permiten seleccionar genotipos que expresen rasgos de interés. En los programas de mejoramiento se conoce como Selección Asistida por Marcadores, MAS, (Marker Assisted Selection). Esta metodología involucra el uso de la presencia/ausencia de marcadores para asistir la selección fenotípica, haciéndola más eficiente comparada con la mayoría de metodologías de mejoramiento convencional (Collard et al., 2005).
En papa ya se ha empleado la selección asistida por marcadores. Son ejemplos: el empleo de marcadores para seleccionar material resistente al virus X de papa (PVX) (De-Jong et al., 1997; Ritter et al., 1991) y al virus M (Marczewski et al., 2006) y a los nemátodos Globodera rostochiensis y Globodera pallida (Meksem et al., 1995). Actualmente, se emplea también en mejoramiento el marcador StAOS2 que mapea en el cromosoma XI y hay cuatro alelos identificados que confieren cada uno de ellos resistencia y susceptibilidad a Erwinia carotovora y Phytophthora infestans (Pajerowska et al., 2008; Pajerowska et al., 2009). También se reportó el empleo del marcador GP94 que se asocia con resistencia duradera a gota, y que deriva su resistencia de Solanum phureja (Sliwka et al., 2010).
En la identificación de marcadores genéticos basados en la reacción en cadena de la polimerasa (PCR), se han desarrollado marcadores dependientes de la secuencia denominados SCAR (Sequence Characterized Amplified Region), los cuales suelen ser codominantes, monolocus y requieren el uso de primers específicos para amplificar la región de interés, son robustos, de bajo costo y de fácil manipulación (Collard et al., 2005). Estos marcadores se desarrollan a partir de la secuenciación y clonación de RAPDs (Random Amplified Polymorphic DNA) (Arnedo-Andrés et al., 2002; Ballvora et al., 2002; Bautista et al., 2003; Gedhardt et al., 2004; Koveza et al., 2001; Parasnis et al., 2000) o de AFLPs (Amplified Fragment Length Polymorphisms) (Vos et al, 1995; Negi et al., 2000; Xu and Korban, 2002).
De acuerdo con el estudio realizado por Gebhardt et al. (2004), mediante la evaluación de marcadores genéticos basados en PCR sobre cultivares mejorados de papa del Banco Genético Gatersleben of Leibniz Institute of Plant Genetics and Crop Plant Research de Alemania, los marcadores SCAR: CosA y BA47f2 se encuentran fuertemente asociados al gen R1, ratificando las distancias genéticas calculadas por Ballvora et al. (2002) de 0,2 cM y 0,1 cM, respectivamente.
Adicionalmente, el marcador Prp1 (Pathogenesis-related glutathione S-transferase) ocupa una posición distal en el grupo de ligamiento IX de papa (Taylor et al., 1990) y se encuentra flanqueando un QTL que controla la resistencia cuantitativa a gota (Gebhardt and Valkonen, 2001; Mosquera, 2007).
El objetivo del presente estudio fue la evaluación del polimorfismo en marcadores SCAR asociados con resistencia a gota, sobre diferentes genotipos tetraploides y genotipos silvestres de papa Solanum demissum, S. stoloniferum, S. andreanum, S. avilesii y S. tarijense, con miras a determinar la presencia de regiones genómicas asociadas con la resistencia en estos genotipos.
Materiales y métodos
Este estudio se llevó a cabo en el Laboratorio de Biotecnología Vegetal Antonio Angarita, de la Facultad de Agronomía de la Universidad Nacional de Colombia, sede Bogotá.
Material Vegetal
El material vegetal estudiado correspondió a los cultivares colombianos: Pastusa Suprema, Monserrate, Esmeralda, Betina, Parda Pastusa y Tuquerreña; a las introducciones del Centro Internacional de la Papa (CIP): 392745-7, 392820-1, 393084-31, 393536-13, 394034-65, 394611-112, 394614-117, 396286-6, 396286-7, 397030-31, 397035-26, 397060-19, 397073-7, 397077-16, 720071, Yungueñita y a las especies silvestres: Solanum demissum, S. stoloniferum, S. andreanum, S. avilesii y S. tarijense. La evaluación fenotípica relacionada con resistencia a Phytophthora infestans de este material, fue suministrada por el CIP (anexo 1).Extracción de DNA
El DNA genómico fue extraído a partir de 500 mg de tejido foliar fresco en buffer de extracción que contiene Tris-HCL pH 8,0; 5M NaCl; 0,5M EDTA; 1% CTAB y 5% de β-mercaptoetanol, siguiendo el procedimiento descrito por Doyle and Doyle (1987). La calidad y cantidad del DNA fue evaluada mediante dos metodologías. La primera fue de tipo cualitativo, se realizó en geles de agarosa al 1% usando tinción con bromuro de etidio y por comparación con un DNA estándar. En la segunda se empleó el NanoDrop® ND-100. La concentración final de DNA se ajustó a 20 ng/µl.
Análisis de marcadores tipo SCAR
Cinco marcadores SCAR con posición conocida en el genoma fueron analizados para determinar su polimorfismo (tabla 1 ). Estos marcadores fueron reportados por Gebhardt et al., (2004) y Taylor et al. (1990) como asociados y ligados a resistencia a P. infestans.
La reacción de PCR para los marcadores GP179, R1, BA47f2 y CosA fue realizada en un volumen final de 15 µl que contenía 20 ng de DNA genómico, buffer de reacción estándar 10x (Invitro Life Technologies, Karlsruhe, Germany), 0,2 mM de dNTP, 0,7 µM de cada oligonucleótido, 2,5 mM de MgCl2 y 1 Unidad de Taq polimerasa (Invitrogen). El programa de PCR para estos marcadores fue el siguiente: temperatura de denaturación 93 ºC por 90 segundos, seguido por 40 ciclos de 93 ºC por 45 segundos, 45 segundos a la respectiva temperatura de annealing (tabla 1 ), 90 segundos a 72 ºC y por último un ciclo de extensión de diez minutos a 72 ºC.
Para el marcador Prp1 se modificaron las condiciones de PCR y el volumen final fue de 15,5 µl, el cual contenía 20 ng de DNA genómico, buffer de reacción estándar 10x (Invitro Life Technologies, Karlsruhe, Germany), 0,26 mM de dNTP, 0,6 µM de cada oligonucleótido, 3,9 mM de MgCl2 y 1 Unidad de Taq polimerasa (Invitrogen). El programa de PCR correspondiente a este marcador fue: temperatura de denaturación 94 ºC por 120 segundos, seguido por 40 ciclos de 93 ºC por 45 segundos, 45 segundos a la respectiva temperatura de annealing (tabla 1 ), 72 ºC por 45 segundos y un ciclo de extensión de ocho minutos a 72 ºC.
En todos los casos, se utilizó un control negativo, donde el DNA fue reemplazado por agua. Para el marcador R1 el control positivo utilizado fue el BAC, BA87d17, que contiene el gen (Ballvora et al., 2002). Este BAC fue suministrado por Ballvora del Instituto Max Planck.
La electroforesis se realizó con buffer TAE 1x utilizando las condiciones de corrida específicas para cada marcador (tabla 1 ). Para estimar el tamaño de los fragmentos o alelos, se empleó marcador de peso de 100 pb de Fermentas y para la tinción se utilizó bromuro de etidio. Las imágenes fueron capturadas con el documentador de geles Molecular Imager ® Gel docTMXR.
Análisis de la caracterización genética
La presencia de los fragmentos obtenidos para cada marcador fue evaluada a través del programa Quantity One-4.6.7® (Biorad, 2007), obteniéndose una matriz binaria de presencia (1) y ausencia (0) (Ghislain et al., 2009; Mosquera, 2007). Los fragmentos que no se pudieron evaluar fueron declarados como perdidos (/). La similaridad de la distribución de los fragmentos de los marcadores asociados con resistencia a P. infestans, en los materiales de estudio, se calculó por medio de un análisis de distancias entre variables binarias, usando el índice de similaridad simple ó Simple Matching, utilizando el programa NTSYS-PC2.1.
Resultados
Análisis de los marcadores SCAR
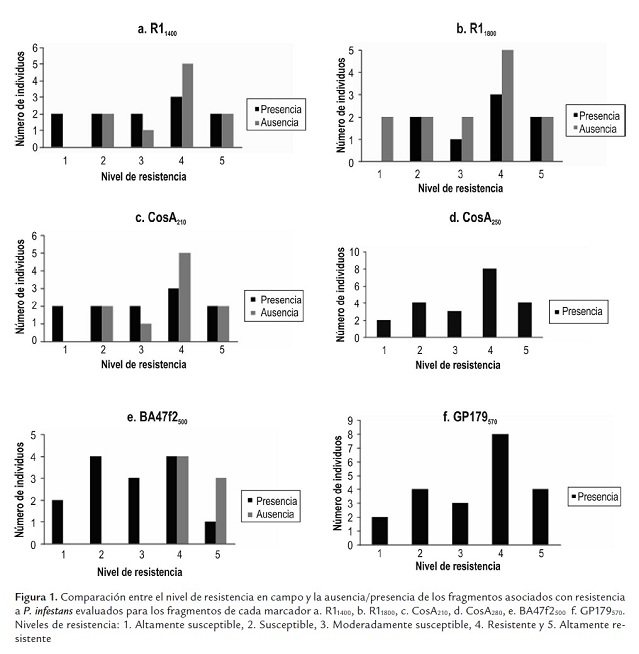
Gen marcador R1: se obtuvieron cinco fragmentos de diferente peso molecular, identificados como R1250, R1500, R1800, R11000 y R11800 junto con el principal producto, el fragmento 1400 pb, los cuales fueron polimórficos para los individuos estudiados.
Marcador CosA: se obtuvo la amplificación de dos fragmentos característicos, el primero de 250 pb, el cual fue monomórfico y el segundo de 210 pb, polimórfico entre los materiales estudiados.
Marcador BA47f2: para este marcador el fragmento asociado con resistencia a P. infestans, en cultivares de la subsp. tuberosum, corresponde a 650 pb (Gedhardt et al., 2004). En este estudio, se pudo determinar un fragmento polimórfico de 500 pb, entre los materiales evaluados. El alelo BA47f2500 se presentó en todos los niveles de resistencia y su ausencia fue característica en algunos de los individuos denominados como resistentes o altamente resistentes a gota (figura 1e).
Marcador GP179: se obtuvieron los fragmentos GP179100, GP179570 y GP1791000. Tanto GP179100 como GP179570 se presentaron en todos los individuos estudiados, mientras que el fragmento GP1791000 fue polimórfico. El fragmento asociado con la resistencia a gota para este marcador reportado por Gebhardt et al. (2004) es de 570 pb.
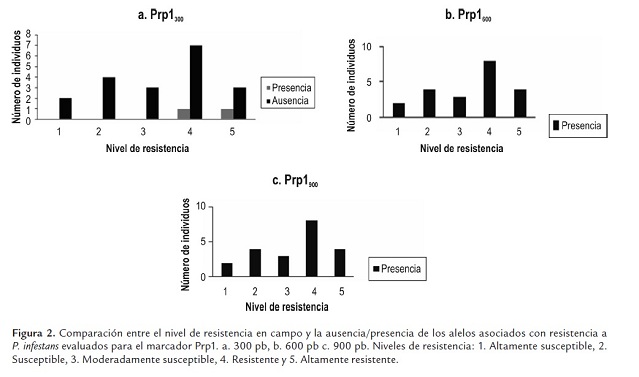
Marcador Prp1: presentó tres fragmentos característicos en todos los materiales evaluados, Prp1300, Prp1600 y Prp1900.
Similaridad entre los alelos marcadores
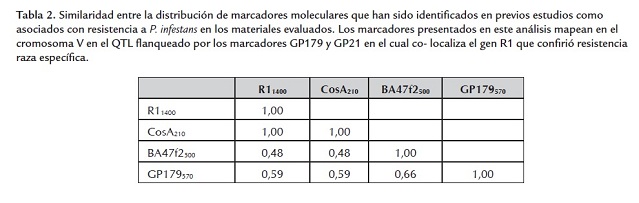
La presencia/ausencia de los alelos marcadores R11400 y CosA210 asociados con resistencia a P. infestans generaron una distribución similar entre el material de estudio, es decir, que la ocurrencia de estos fragmentos fue 100% similar para ambos marcadores (tabla 2 ). Con respecto al fragmento GP179570, su similaridad con los fragmentos R11400 y CosA210 fue del 59% (tabla 2 ) valor asociado con la distancia genética reportada entre los marcadores R1, CosA y GP179 equivalente a 0,8 cM (Ballvora et al., 2002).
Para el alelo BA47f2500 la similaridad fue del 48% con respecto a R11400 y CosA210. La relación entre BA47f2500 y los demás marcadores dista de lo reportado por Ballvora et al. (2002), quienes estimaron una distancia genética equivalente a 0,1 cM entre los marcadores mencionados.
Comparando el índice de similaridad calculado entre BA47f2500 y GP179570, se observó una semejanza del 66% (tabla 2 ).
Finalmente, el índice de similaridad para el marcador Prp1 con respecto a los demás no se calculó, ya que éste se encuentra en el cromosoma IX y sería un error inferir algún tipo de ligamiento.
Especies silvestres
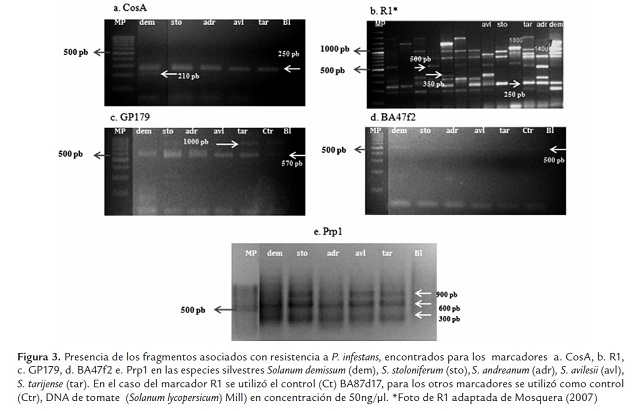
Se evaluó la presencia de los marcadores GP179, CosA, BA47f2 y Prp1 en las especies silvestres de papa Solanum demissum, S. stoloniferum, S. andreanum, S. avilesii y S. tarijense. Se pudo determinar que en todas se presenta el fragmento CosA250, mientras que el fragmento CosA210 se presentó únicamente en la especie S. demissum (figura 3a).
Respecto al marcador R1 (figura 3b), el fragmento R11400 únicamente se presentó en S. demissum, mientras que el fragmento R11800 aparece en S. demissum y S. tarijense especies catalogadas como resistente y susceptible respectivamente. Adicionalmente, con este marcador se observaron bandas polimórficas correspondientes a los alelos R1250, R1350, R1500, R1800, R11000.
La presencia de los fragmentos R11400 y CosA210 fue exclusiva para S. demissum. En el caso del marcador GP179 la banda asociada con resistencia de 570 pb se encontró en todas las especies silvestres evaluadas y además en el genotipo S. tarijense se presentó un alelo de 1000 pb (figura 3c).
El marcador BA47f2, presentó un fragmento difuso de 500 pb entre los genotipos silvestres evaluados. Por lo tanto, no fue posible determinar si este fragmento fue poli o monomórfico. Lo que sí es distinguible con este marcador, es la diferencia en tamaño entre el fragmento asociado con resistencia de 650 pb y el que se reporta en este estudio de 500 pb.
Con el marcador Prp1 todos los genotipos silvestres aquí evaluados presentaron bandas polimórficas correspondiente a 300, 600 y 900 pb (figura 3e ).
Discusión
Marcadores SCAR
La presencia de los fragmentos, R11400 y CosA210 está correlacionada con el incremento de resistencia a P. infestans tanto en tubérculo como a nivel foliar (Gebhardt et al., 2004). Sin embargo, en el presente estudio, se observó que no existe una relación clara entre el nivel de resistencia a P. infestans y la presencia de los fragmentos R11400 y CosA210 (figura 1a y 1c), es decir, que estos fragmentos se presentaron tanto en individuos catalogados como resistentes como en no resistentes.
El alelo R11800 fue asociado con la susceptibilidad a gota, tanto en follaje como en tubérculo en cultivares de S. tuberosum subsp. tuberosum (Gebhardt et al., 2004), no obstante al analizar la relación entre la presencia de este fragmento y la resistencia, no fue posible identificar relación ni con resistencia ni con susceptibilidad, debido a que en todos los casos, aproximadamente el 50% de los individuos que presentaron este alelo son susceptibles y el 50% son resistentes (figura 1b). Los demás fragmentos obtenidos polimórficos en este estudio no se analizaron por su asociación con resistencia, ya que el estudio se concentró en el análisis de alelos reportados en estudios previos e identificados a través de análisis de asociación genética para evaluar estos resultados en materiales de S. andigena. Es importante evaluar el grado de asociación de estos alelos polimórficos sea por su efecto positivo o negativo con resistencia a gota y diferenciado entre la resistencia en follaje y campo, tal como lo sugiere Danan et al., (2009).
Para el marcador BA47f2 Gebhardt et al. (2004) reportan el fragmento de 650 pb como asociado a resistencia a P. infestans, en cultivares de la subsp. tuberosum. En este estudio se presentó el alelo BA47f2500, en los diferentes niveles de resistencia, tanto en materiales susceptibles como resistentes. Sin embargo, su ausencia fue en su mayoría en algunos de los individuos que fueron catalogados como resistentes o altamente resistentes a gota (figura 1e). Esta diferencia en pares de bases, entre en fragmento reportado por Gebhardt et al. (2004) y el presentado en este estudio puede ser atribuida a la variabilidad alélica que se presenta en materiales genéticos sometidos a diferentes condiciones ambientales asociadas con el origen, la distribución geográfica y el ambiente donde se desarrollan estas especies (Raker and Spooner, 2002). La variabilidad alélica entre S. tuberosum subsp. tuberosum y S. tuberosum subsp. andigena ha sido reportada con anterioridad por Raker y Spooner (2002), quienes por medio del uso de microsatélites han podido determinar altos niveles de polimorfismo y heterocigosidad entre estas especies de papa.
El estudio realizado por Sukhotu et al. (2005), en el cual evaluaron la diversidad genética entre cultivares de las subespecies andigena y tuberosum, a través de la presencia o ausencia de fragmentos generados por marcadores tipo RFLPs (Restriction Fragment Length Polymorphis) de DNA nuclear y diferencias polimórficas entre microsatélites de DNA citoplasmático, se determinó la presencia de fragmentos con diferente peso molecular para el mismo marcador. Estas diferencias permitieron separar los cultivares tuberosum de los andinos.
Al comparar la resistencia en campo para clones de S. tuberosum, S. andigena y S. phureja se observaron diferencias en cuanto a penetración, velocidad de esporulación y tamaño de la lesión en los diferentes cultivares (Guzmán, 1964) citado por Estrada (2000), indicando claras diferencias entre el tipo de resistencia y el ataque del patógeno a nivel inter e intraespecífico.
El fragmento asociado con la resistencia a gota para el marcador GP179 reportado por Gebhardt et al. (2004) es de 570 pb; sin embargo, la presencia de este fragmento en los cultivares andinos evaluados, no pudo relacionarse de manera directa con la resistencia a P. infestans, debido a que se observó tanto en individuos resistentes como susceptibles, a diferencia de lo que ocurre en los cultivares europeos, aunque, para este estudio, la presencia de este fragmento fue más frecuente entre los individuos reportados como resistentes (figura 1f). Estos resultados poco concluyentes para GP179570 y opuestos en cuanto a su asociación con resistencia al patógeno, han sido reportados por Gebhardt et al. (2004), Oberthageman et al. (1999) y Díaz et al. (2003). Para aclarar esta discrepancia es necesario adelantar un estudio fenotípico detallado de respuesta ante la presencia del patógeno en los genotipos de interés o hacer uso de nuevas metodologías que se están empleando para identificar genes que confieran resistencia a P. infestans evaluando diferentes materiales genéticos (Mirjam et al., 2010). De la misma forma, la ocurrencia en común del fragmento GP179570 puede estar relacionada más específicamente con el hecho de que S. tuberosum subsp. tuberosum proviene de S. tuberosum subsp. andigena, observándose un fuerte solapamiento de caracteres, mas no necesariamente con la condición de resistencia a gota, la cual varía entre ambas especies (Huamán and Spooner, 2002).
El marcador Prp1 presentó tres fragmentos característicos en todos los materiales evaluados, Prp1300, Prp1600 y Prp1900 (figura 2 ). Estos resultados difieren de los encontrados por Taylor et al. (1990). Según estos autores e(1990)l marcador Prp1 flanquea un QTL para resistencia cuantitativa a gota, lo que explica la relación observada entre la presencia del marcador y la resistencia. Otros autores también han encontrado resultados contradictorios para este marcador (Gedhardt et al., 2004; Oberhagemann et al., 1999; Raker and Spooner, 2002).
Similaridad entre los alelos marcadores
La similaridad encontrada en los resultados de los marcadores R11400 y CosA210, coincide con el nivel de resistencia que presentaron los diferentes individuos evaluados (figura 1a y 1c). Esta similaridad entre los marcadores R1 y CosA sugiere que se encuentran fuertemente ligados, resultado esperado, teniendo en cuenta que la distancia genética entre ellos para S. tuberosum es de 0,2 cM (Ballvora et al., 2002).
La similaridad entre el fragmento GP179570 y los fragmentos R11400 y CosA210 en este estudio fue calculada en un 59% (tabla 2 ), valor asociado con la distancia genética calculada por Ballvora et al. (2002) de 0,8 cM entre los marcadores R1, CosA y GP179. Igualmente, se ha encontrado que aunque GP179 está flanqueando el QTL que contiene el gen R1 (Gebhardt et al., 1991; Meksem et al., 1995), en el caso de cultivares tetraploides colombianos los alelos del marcador GP179570 ligados a R1, fueron inespecíficos para identificar la presencia de este gen en dichos cultivares. Similar resultado fue reportado por Díaz et al. (2003) quienes no pudieron asociar el marcador R2 con resistencia, ya que dicho marcador fue encontrado en genotipos resistentes y susceptibles.
La similaridad calculada entre el alelo BA47f2500 y los alelos R11400 y CosA210 fue del 48% (tabla 2 ). Este valor dista de lo reportado por Ballvora et al. (2002) en donde estos calculan una distancia genética entre los marcadores mencionados, equivalente a 0,1 cM. Esta diferencia puede ser atribuida a que el alelo aquí reportado corresponde a un alelo de 500 pb para los cultivares de S. tuberosum subsp. andigena y no de 650 pb como lo reportaron Gebhardt et al. (2004) para los cultivares de S. tuberosum subsp. tuberosum. Esto permite concluir, que no se pueden aplicar de manera directa los resultados obtenidos en S. tuberosum subsp. tuberosum a los demás materiales de papa. Esto implica que se deben hacer mayores esfuerzos para encontrar marcadores moleculares diagnósticos que apoyen los trabajos de mejoramiento genético en Colombia.
Para el índice de similaridad calculado entre BA47f2500 y GP179570, se observó una semejanza del 66% (tabla 2 ), acorde con la distancia genética aproximada de 0,9 cM y la ubicación de estos dos marcadores dentro del cromosoma V.
Especies silvestres
En el análisis de las especies silvestres se determinó que en todos los materiales estudiados el fragmento CosA250, estuvo presente, mientras que el fragmento CosA210 se presentó únicamente en la especie S. demissum (figura 3a), este resultado está en consonancia con lo reportado por Gebhardt et al. (2004), en donde, el fragmento CosA210 está presente en cuatro accesiones de S. demissum y en S. dulcamara, especies silvestres, que presentan resistencia a P. infestans.
La presencia de los fragmentos R11400 y CosA210 fue exclusiva para S. demissum, indicando co-segregación de estos alelos, debido a su alto grado de ligamiento. Aunque la resistencia generada por el gen R1 derivada de S. demissum fue quebrada por el patógeno, se ha encontrado en materiales que presentan el gen R1, que genera un grado de resistencia de tipo cuantitativo (comunicación personal, Ballvora, 2009). El fragmento R11800 aparece en S. demissum y S. tarijense especies catalogadas como resistente y susceptible respectivamente (figura 3b).
El alelo GP179570 se encontró en todas las especies silvestres evaluadas (figura 3c ). El marcador BA47f2, presentó un fragmento difuso de 500 pb sin llegarse a definir como fragmento polimórfico o monomórfico, debido a la pobre resolución que presentó este marcador. Es importante resaltar que aunque este marcador mapea a 0,1 cM del gen R1 (Gebhardt et al., 2004), y podría constituirse al igual que el marcador CosA210 en importante herramienta para selección, su baja resolución, la cual se evidencia también en este estudio, no permite hacer extensivo su uso.
Con el marcador Prp1 todos los genotipos silvestres aquí evaluados presentaron bandas polimórficas correspondiente a 300, 600 y 900 pb (figura 3e ). Por lo tanto, es necesario tener en cuenta, para estudios posteriores, las interacciones epigenéticas y de genotipo por ambiente que puedan estar asociadas con cambios en el nivel de resistencia y la presencia de estas bandas.
De acuerdo a los resultados de esta investigación tanto en los cultivares tetraploides y silvestres estudiados, se identificaron polimorfismos con todos los marcadores evaluados, específicamente en los fragmentos que han sido reportados por su asociación con resistencia a P. infestans, exceptuando al marcador GP179 en el fragmento de 570 pb que fue monomórfico. Adicionalmente, no se encontraron los mismos resultados reportados para S. tuberosum subsp. tuberosum en la totalidad de los marcadores evaluados, indicando que no es posible aplicar directamente la presencia de marcadores moleculares asociados con resistencia a gota, entre las subsp. tuberosum y subsp. andigena.
Con base en este estudio se recomienda realizar caracterizaciones fenotípicas de la resistencia a P. infestans más precisas que permitan estimar la resistencia a nivel de tallo y follaje, ya que en campo se observan manifestaciones de resistencia y susceptibilidad que no han podido ser bien evaluadas con la escala que se ha aplicado y posiblemente esto dificulta la convergencia de los datos moleculares con las evaluaciones fenotípicas.
Agradecimientos
Los autores agradecen al Instituto Max Planck para Mejoramiento Genético por su apoyo y especialmente al Dr. Agim Ballvora por la donación del control positivo para el gen R1 y al CIP por los datos de caracterización fenotípica.
Referencias bibliográficas
1 AGROCADENAS, 2005. La cadena de la papa en Colombia una mirada global de su estructura y dinámica1991-2005. En: www.agrocadenas.gov.co consulta: abril de 2009. [ Links ]
2 Arnedo-Andrés, M. S., Gil-Ortega, R., Arteaga, M. and Hormaza, J. L. 2002. Development of RAPD and SCAR markers linked to the Pvr4 locus for resistance to PVY in pepper (Capsicum annuum L.). Theoretical and Applied Genetics 105: 1067-1071. [ Links ]
3 Ballvora, A., Ercolano, M. R., Weiss, J., Meksem, K., Bormann, C. A., Oberhagemann, P., Salamini, F. and Gerbhardt, C. 2002. The R1 Gene for potato resistance to late blight (Phytophthora infestans) belongs to the leucine Zipper/NBS/LRR class of plant resistance genes. Plant Journal 30: 361-371. [ Links ]
4 Bautista, R., Crespillo, R., Canovas, F. M. and Claros, M. G. 2003. Identification of olive-tree cultivars with SCAR markers. Euphytica 129: 33-1. [ Links ]
5 Biorad. 2007. Quantity One Software, 21f Ed. [ Links ]
6 Bormann, C. A., Rickert, A. M., Castillo, R. A., Paal, J., Lübeck, J., Strahwald, J., Buhr, K., and Gebhardt, C. 2004. Tagging quantitative trait loci for maturity-corrected late blight resistance in tetraploid potato with PCR-based candidate gene markers. Molecular Plant-Microbe Interactions 17 (10): 1126-1138. [ Links ]
7 CEVIPAPA. 2008. Año internacional de la papa Diario económico Portafolio. Centro virtual de investigación de la cadena agroalimentaria de la papa, Bogotá. [ Links ]
8 Collard, B. C. Y., Jahufer, M. Z. Z., Brouwer, J. B. and Pang, E. C. K. 2005. An introduction to markers, quantitative trait loci (QTL) mapping and marker-assisted selection for crop improvement: The basic concepts. Euphytica 142: 169-196. [ Links ]
9 Collins, A., Milbourne, D., Ramsay, L., Meyer, R., Chatot-Balandras, C., Oberhagemann, P., de Jong, W., Gebhardt, C., Bonnel, E., and Waugh, R. 1999. QTL for field resistance to late blight in potato are strongly correlated with maturity and vigour. Molecular Breeding 5: 387-398. [ Links ]
10 Danan, S., Chauvin, J-E., Caromel, B., Moal, J-D., Pellé, R. and Lefebvre, V. 2009. Major-effect QTLs for stem and foliage resistance to late blight in the wild potato relatives Solanum sparsipilum and S. spegazzinii are mapped to chromosome X. Theoretical and Applied Genetics 119: 705-719. [ Links ]
11 De Jong, W., Forsyth, A., Leister, D., Gebhardt, C. and Baulcombe, D. C. 1997. A potato hypersensitive resistance gene against potato virus X maps to a resistance gene cluster on chromosome V. Theoretical and Applied Genetics 95: 153-162. [ Links ]
12 Díaz, M., Fajardo, D., Moreno, J., García, C. y Núñez, V. 2003. Identificación de genes R1 y R2 que confieren resistencia a Phytophthora infestans en genotipos colombianos de papa. Revista Colombiana de Biotecnología 5: 40-50. [ Links ]
13 Doyle, J. J and Doyle, J. L. 1987. A rapid DNA isolation procedure from small quantities of fresh leaf tissue. Phytochemical Bulletin 19: 11-15. [ Links ]
14 Estrada, R. N. 2004. La biodiversidad en el mejoramiento genético de la papa. (Ed: Bill Hardy, CIP; Emma Martínez, CIP). PROINPA, CID, CIP. ISBN: 84-89891-68-0. Bolivia. 372 p. [ Links ]
15 Fermentas. GeneRulerTM 100 bp DNA Ladder Plus. In: F. L. Sciences (Ed.). [ Links ]
16 Gebhardt, C., Ritter, E., Barone, A., Debener, T., Walkemeier, B., Schachtschabel, U., Kaufmann, H., Thompson, R. D., Bonierbale, M. W., Ganal, M. W., Tanksley, S. D. and Salamini, F. 1991. RFLP maps of potato and their alignment with the homoeologous tomato genome. Theoretical and Applied Genetics 83: 49-57. [ Links ]
17 Gebhardt, C. and Valkonen, J. P. T. 2001. Organization of genes controlling disease resistance in the potato genome. Annual Review of Phytopathology 39: 79-102. [ Links ]
18 Gebhardt, C., Ballvora, A., Walkemeier, B., Oberhagemann, P., and Schüler, K. 2004. Assessing genetic potential in germplasm collections of crop plants by marker-trait association: a case study for potatoes with quantitative variation of resistance to late blight and maturity type. Molecular Breeding 13: 93-102. [ Links ]
19 Ghislain, M., Nuñez, J., Herrera, M. R., Pignataro, J., Guzman, F., Bonierbale, M. and Spooner, D. M. 2009. Robust and highly informative microsatellite-based genetic identity kit for potato. Molecular Breeding 23: 377-388. [ Links ]
20 Hawkes, J. G. 1990a. The evolution of cultivated potatoes and their tuber-bearing wild relatives. Kulturpflance 36: 189-298. [ Links ]
21 Hawkes, J. G. 1990b. The potato-evolution, biodiversity and genetic resources. London, UK. [ Links ]
22 Huamán, Z and Spooner, D. M. 2002. Reclassification of landrace populations of cultivated potatoes (Solanum sect. Petota). American Journal of Botany 89: 947-965. [ Links ]
23 Jaramillo, S y Rojas, D. 2003. Aspectos Bioquímicos de la resistencia de la papa (Solanum tuberosum) al ataque del hongo Phytophthora infestans. Revista Papa. Grupo de Biotecnología- Universidad Nacional, Medellín. [ Links ]
24 Jacobs, M. M. J., Vosman, B., Vleeshouwers, V. G. A. A., Visser, R. G. F., Henken, B. and van den Berg R. G. 2010. A novel approach to locate Phytophthora infestans resistance genes on the potato genetic map. Theoretical and Applied Genetics 120: 785-796. [ Links ]
25 Koveza, O. V., Kokaeva, Z. G., Gostimsky, S. A., Petrova, T. V. and Osipova, E. S. 2001. Creation of a SCAR marker in pea Pisum sativum L. Using RAPD analysis. Russian Journal of Genetics 37: 464-470. [ Links ]
26 Leonards-Schippers, C., Gieffers, W., Salamini, F. and Gebhardt, C. 1992. The R1 gene conferring race-specific resistance to Phytophthora infestans in potato is located on chromosome V. Molecular & General Genetics 233: 278-283. [ Links ]
27 Marczewki, W., Strzelezyk-Zyta, D., Hennig, J., Witek, K. and Gebhardt, C. 2006. Potato Chromosomes IX and XI carry genes for resistance to potato virus M. Theoretical and Applied Genetics 112: 1232-1238. [ Links ]
28 Meksem, K., Leister, D., Peleman, J., Zabeau, M., Salamini, F. and Gebhardt, C. 1995. A high resolution map of the vicinity of the R1 locus on chromosome V of potato based on RFLP and AFLP markers. Molecular and General Genetics 249: 74-81. [ Links ]
29 Mirjam, M., Jacobs, J., Vosman, B., Vleeshouwers, V. G. A. A., Visser, R. G. F., Henken, B., and van den Berg, R. 2010. A novel approach to locate Phytophthora infestans resistance genes on potato genetic map. Theoretical ans Applied Genetics 120: 785-796. [ Links ]
30 Mosquera, T. 2007. Análisis Genético y Molecular de la Resistencia Cuantitativa a Tizón Tardío (Phytophthora infestans) en Solanum phureja. Tesis de Doctorado. Facultad de Agronomía. Universidad Nacional de Colombia, Bogotá. [ Links ]
31 Negi, M. S., Devic, M., Delseny, M. and Lakshmikumaran, M. 2000. Identification of AFLP fragments linked to seed coat colour in Brassica juncea and conversion to SCAR markers for rapid selection. Theoretical and Applied Genetics 101: 146-150. [ Links ]
32 Oberhagemann, P., Chatot-Balandras, C., Schäfer-Pregl, R., Wegener, D., Palomino, C., Salamini, F., Bonnel, E., and Gebhardt, C. 1999. A genetic analysis of quantitative resistance to late blight in potato: towards marker-assisted selection. Molecular Breeding 5: 399-415. [ Links ]
33 Parasnis, A. S., Gupta, V. S., Tamhankar, S. A., and Ranjekar, P. K. 2000. A highly reliable sex diagnostic PCR assay for mass screening of papaya seedling. Molecular Breeding 6: 337-341. [ Links ]
34 Pajerowska, K., Shahid, M., Guex, N., Halim, V., Rosahl, S., Somssich, I., and Gebhardt, C. 2008. Natural variation of potato allene oxide synthase 2 causes differential levels of jasmonates and pathogen resistance in Arabidopsis. Planta 228: 293-306. [ Links ]
35 Pajerowska, K., Stich, B., Achenbach, U., Ballvora, A., Lübeck, J., Strahwald, J., Tacke, E., Hofferbert, H., Ilarionova, E., Bellin, D., Walkemeier, B., Basekow, R., Kersten, B., and Gebhardt, C. 2009. Single nucleotide polymorphisms in the Allene Oxide Synthase 2 gene are associated with field resistance to late blight in populations of tetraploid potato cultivars. Genetics 181: 1115-1127. [ Links ]
36 Raker, M. C. and Spooner, D. M. 2002. Chilean tetraploid cultivated potato, Solanum tuberosum, is distinct from the Andean populations: Microsatellite data. Crop Science 42: 1451-1458. [ Links ]
37 Ritter, E., Debener, T., Barone, A., Salamini, F., and Gebhardt, C. 1991. RFLP mapping on potato chromosomes of two genes controlling extreme resistance to potato virus X (PVX). Molecular and General Genetics 227: 81-85. [ Links ]
38 Sliwka, J., Jakuczun, H., Kaminski, P. and Zimnoch-Guzowska, E. 2010. Marker-assisted selection of diploid and tetraploid potatoes carrying Rpi-phu1, a major gene for resistance to Phytophthora infestans. Journal of Applied Genetics 51: 133-140. [ Links ]
39 Sukhotu, T., Kamijima, O. and Hosaka, K. 2005. Genetic diversity of the Andean tetraploid cultivated potato (Solanum tuberosum L. subsp. andigena Hawkes) evaluated by chloroplast and nuclear DNA markers. NRC Research Press. 48: 55-64. [ Links ]
40 Taylor, J. T., Fritzemeier, H., Häuser, I., Kombrink, E. and Rohwer, F. 1990. Structural analysis and activation by fungal infection of a gene encoding a pathogenesis-related protein in potato. Molecular Plant-Microbe Interactions 3: 72-77. [ Links ]
41 Visser, R. G. F., Bachem, C. W. B., de Boer, J. M., Bryan, G. J., Chakrabati, S. K., Feingold, S., Gromadka, R., van Ham, R. C. H. J., Huang, S., Jacobs, J. M. E., Kuznetsov, B., de Melo, P. E., Milbourne, D., Orjeda, G., Sagredo, B. and Tang, X. 2009. Sequencing the potato genome: Outline and first results to come from the elucidation of the sequence of the world´s third most important food crop. American Journal of Potato Research DOI 10.1007/s12230-009-9097-8. [ Links ]
42 Vos, P., Hogers, R., Bleeker, M., Reijans, M., van de Lee, T., Hornes, M., Frijters, A., Pot, J., Peleman, J., Kuiper, M. and Zabeau, M. 1995. AFLP: a new technique for DNA fingerprinting. Nucleic Acid Research 23: 4407-4417. [ Links ]
43 Xu, M and Korban, S. S. 2002. AFLP-derived SCARs facilitate construction of a 1.1 Mb sequence ready map of a region that spans the Vf locus in the apple genome. Plant Molecular Biology 50: 803-811. [ Links ]