Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.13 no.2 Bogotá July/Dec. 2011
ARTÍCULO DE INVESTIGACIÓN
Multiplicación en sistema de inmersión temporal del clon de malanga "Viequera" (Xanthosoma spp.)
Multiplication in temporary immersion system cocoyam clone "Viequera" (Xanthosoma spp.)
Arletys Santos Pino1 , Manuel Cabrera Jova1 , Rafael Gómez Kosky2 , Jorge López Torres1 , Aymé Rayas Cabrera1 , Milagros Basail Pérez1 , Víctor Medero Vega1 , Yoel Beovides García1.
1Instituto Nacional de Investigaciones en Viandas Tropicales (INIVIT), Apartado 6, Santo Domingo CP. 53000, Villa Clara, Cuba
2Instituto de Biotecnología de las Plantas, Universidad Central "Marta Abreus" de Las Villas, Carretera a Camajuaní km 5, Santa Clara, Villa Clara, Cuba (*MSc. Autor para correspondencia: e-mail: asantos@inivit.cu)
Recibido: agosto 30 de 2011 Aprobado: noviembre 30 de 2011
Resumen
El Sistema de inmersión temporal (SIT) constituye una alternativa en la micropropagación de plantas. El presente trabajo se realizó con el objetivo de establecer un protocolo para la multiplicación en SIT del clon de malanga "Viequera". Se evaluó el efecto de tres tiempos de inmersión (7, 14 y 21 minutos), tres frecuencias de inmersión (2, 4 y 6 horas por día), cuatro volúmenes de medio de cultivo (5, 10, 15 y 20 ml por brote inicial) y cuatro tiempos de cultivo (15, 18, 21 y 25 días) en la multiplicación de los brotes de yemas axilares. Con tiempo de inmersión de 14 minutos cada 4 horas, un volumen de 15 ml de medio de cultivo por brote inicial y 18 días de cultivo, se logró el mejor comportamiento en la multiplicación de los brotes de yemas axilares, con un coeficiente de multiplicación de 10,50. El protocolo propuesto aumenta la productividad del material propagado en comparación con los desarrollados en medios de cultivo semisólidos, lo que representa una reducción en los costos de producción al introducir la multiplicación del cultivo en laboratorios comerciales de propagación.
Palabras clave: tiempo y frecuencia de inmersión, volumen de medio de cultivo, tiempo de cultivo.
Abstract
Temporary Immersion System (TIS) is a alternative in the micropropagation of plants. This work was carried out to establish a protocol for the multiplication of clone TIS cocoyam "Viequera". The effect of three immersion times (7, 14 and 21 minutes), three immersion frequencies (2, 4 and 6 hours per day), four volumes of culture medium (5, 10, 15 and 20 mL per shoot initial) and four times of cultivation (15, 18, 21 and 25 days) in the multiplication of shoots from axillary buds. With immersion time of 14 minutes every 4 hours, a volume of 15 ml of culture medium for initial outbreak and 18 days of culture, achieved the best performance in the multiplication of shoots from axillary buds, with a coefficient of multiplication 10.50. The proposed protocol increases the productivity of propagated material compared to those developed in semisolid culture media, representing a reduction in production costs by introducing the increase in cultivation in commercial laboratories.
Key words: immersion time and frequency, volume of culture medium, culture time.
Introducción
La malanga (Xanthosoma spp.) es de origen americano, se la encuentra desde México hasta Brasil, y fue cultivada por los aborígenes de Las Antillas y del resto del continente antes del descubrimiento (López et al., 1995). Su producción mundial se estima en 5 000 000 t y se concentra en la zona central y occidental de África Tropical, Las Antillas, Venezuela y Oceanía (FAOSTAT, 2006).
Diversos clones de malanga son propagados usando la técnica del cultivo in vitro vía organogénesis directa, a través de yemas axilares. Este sistema de regeneración reporta los menores índices de variación genética (García et al., 1999; Dottin, 2000; Chien-Ying et al., 2008) y es el método más confiable para lograr un proceso de proliferación repetible y libre de agentes contaminantes (Orellana, 1998; Jiménez y De Feria, 1998).
Sin embargo, la organogénesis directa está limitada como metodología eficiente de aplicabilidad comercial, principalmente por su intensa labor y altos costos de producción, a causa del elevado número de operaciones manuales que requiere (Jeong et al., 1995; Wang et al., 1999; Ziv, 1999). Esta característica según Vasil (1991), ha determinado un incremento de los costos por mano de obra entre un 50 y 85% en el ámbito internacional. Además, desde el punto de vista biológico, la proliferación por yemas axilares ofrece bajos coeficientes de multiplicación en este cultivo (Chien-Ying et al., 2008).
Una alternativa en la micropropagación de plantas es el empleo del Sistema de inmersión temporal (SIT), basado en el contacto intermitente del medio de cultivo con los explantes, lo cual facilita el desarrollo de los procesos a gran escala, reduce los costos de producción y genera un aumento de la productividad del material propagado (Berthouly and Etienne, 2005).
De esta forma, el cultivo en inmersión temporal puede constituir una alternativa de micropropagación a corto plazo, mientras a largo plazo se logran vencer los obstáculos biológicos que permitan la obtención eficiente de plantas y embriones somáticos en biorreactores (Escalona, 2006). Teniendo en cuenta el incremento de la demanda de semilla de alta calidad de malanga Xanthosoma en Cuba, se realizó esta investigación con el objetivo de evaluar la multiplicación de esta especie en SIT como una alternativa para su propagación.
Materiales y Métodos
La investigación se realizó en el Laboratorio de cultivos de tejidos de plantas del Instituto de Investigaciones en Viandas Tropicales (INIVIT); ubicado en Santo Domingo, Villa Clara, Cuba.
Material vegetal
Se utilizó el clon de malanga “Viequera” (Xanthosoma spp.) procedente del Banco de germosplasma del INIVIT, ya que los hábitos de consumo y el potencial productivo de este cultivo han despertado el interés del Programa de producción de semillas (Milián, 2001).
Establecimiento y multiplicación in vitro del material vegetal
Para su establecimiento fueron seleccionadas plantas típicas del clon objeto de estudio, según los descriptores de la especie (Milián, 2001), sin la presencia de síntomas visuales de enfermedades. Se cortó el pseudotallo de las plantas a un tamaño aproximado de cuatro cm de diámetro, se lavaron con detergente y agua corriente, luego se enjuagaron con agua estéril.
Bajo condiciones de asepsia (cabina de flujo laminar) se sumergieron en Etanol (70%) con tres gotas de Tween 20 por un minuto y luego se colocaron en una solución de hipoclorito de sodio al 2,5% (v/v), durante 15 min. Posteriormente se enjuagaron con agua desionizada estéril tres veces según García et al. (1999).
Para la extracción de los meristemos de las yemas axilares, se procedió a eliminar las vainas foliares del pseudotallo y extraer el meristemo de cada yema axilar con la ayuda de un microscopio estereoscópico modelo STEMI SV 11. El establecimiento de los meristemos se realizó en un medio de cultivo constituido por el 80% de las sales y vitaminas “MS” (Murashige and Skoog, 1962); 30 g/L-1 de sacarosa; 0,1 mg/L-1 de 6-BAP; 0,1 g/L-1 de mioinositol, el pH fue ajustado a 5,7 con NaOH 0,5 N y/o HCL 0,5 N antes de la esterilización en autoclave. La duración de esta fase fue de 21 días de cultivo (García et al., 1999). Una vez emitidas las primeras hojas se procedió a realizar el análisis de diagnóstico mediante la metodología de Inmunoensayo ligado a enzima a partir del kit DAS ELISA for Dasheen Mosaic Virus, comercializado por la compañía AGDIA (2002) para la certificación de materiales libres del DMV (Hernández et al., 2000).
Para la multiplicación de los brotes de yemas axilares, certificados como libres de virus, se empleó el medio de cultivo constituido por las sales y vitaminas “MS” (Murashige and Skoog, 1962) suplementado con 30 g/L-1 de sacarosa; 3 mg/L-1 de 6-BAP; 1 mg/L-1 de AIA; 0,1 g/L-1 de mioinositol (García et al., 1999).
Las condiciones de cultivo utilizadas para el establecimiento y multiplicación de los brotes de yemas axilares fueron las siguientes: cámara de cultivo con temperatura de 25±2,0 °C e iluminación artificial mediante tubos fluorescentes de 40 W, con un régimen de fotoperiodo de 16 h luz y una densidad de flujo de fotones fotosintéticos de 42,0-48,0 µmol/m-2/s-1.
Sistema de Inmersión Temporal (SIT)
El SIT estuvo compuesto por dos frascos de cultivo de vidrio de 250 ml de capacidad, uno para el crecimiento de los brotes de yemas axilares y el otro como reservorio de medio de cultivo. Estos frascos de cultivo se conectaron entre sí por una manguera de silicona de 6 mm de diámetro mediante conectores de vidrio que atravesaron el tapón de goma. En la parte interna se colocó una manguera que desciende hasta el fondo en ambos recipientes. El medio de cultivo circuló de un frasco de cultivo a otro de acuerdo con la apertura o cierre de dos electroválvulas de tres vías, las cuales estaban conectadas a un temporizador programable para determinar la frecuencia y duración de la inmersión. A la entrada de los frascos de cultivo se colocaron filtros hidrofóbicos (0,22 µm, MIDISART 2000, SARTORIUS Co.) para garantizar la esterilidad del aire. La presión del aire generada por el compresor con encendido automático, fue regulada por un manómetro.
1. Efectos del tiempo y de la frecuencia de inmersión en el SIT
1.1 Efecto del tiempo de inmersión
Con el objetivo de determinar el tiempo de inmersión de los brotes de yemas axilares en el medio de cultivo se estudiaron tres tiempos: 7, 14 y 21 minutos cada dos horas (12 inmersiones por día). En este experimento se utilizó el medio de cultivo y las condiciones de cultivo descritas en los procedimientos generales.
Se colocaron cuatro brotes de yemas axilares y un volumen de 10 ml de medio de cultivo por cada explante utilizado en el SIT. En el experimento se realizaron cuatro repeticiones por tratamiento.
A los 21 días de cultivo se seleccionaron al azar tres brotes de yemas axilares en cada una de las repeticiones por tratamiento y se evaluaron los siguientes indicadores del desarrollo de los brotes de yemas axilares:
- Número de hojas de los brotes de yemas axilares. Se contaron las hojas que estaban abiertas.
- Altura de los brotes de yemas axilares (cm). Se realizó con el auxilio de una regla graduada y se midió desde la base del pseudotallo hasta la inserción de la primera hoja.
- Grosor de los brotes de yemas axilares (cm). Se realizó con el auxilio de una regla graduada y se midió el diámetro de la base del pseudotallo
- Coeficiente de multiplicación de los brotes de yemas axilares. Se determinó por el número de brotes finales sobre el número de brotes iniciales.
- Masa fresca de los brotes de yemas axilares (gMF).
- Masa seca de los brotes de yemas axilares (gMS).
- Número total de brotes de yemas axilares con síntomas de hiperhidricidad.
Los datos se procesaron estadísticamente mediante análisis de varianza de clasificación simple (completamente al azar) y la comparación múltiple de media se realizo según Tukey cuando se encontró homogeneidad de varianza, en los casos contrarios se aplicó Dunnett´s C con un nivel de significación de p<0,05 lo cual se específica en cada uno de los resultados.
1.2 Efecto de la frecuencia de inmersión
Con el objetivo de evaluar el efecto de la frecuencia de inmersión de los explantes en el medio de cultivo sobre el crecimiento de los brotes de yemas axilares, se estudiaron tres frecuencias de inmersión cada 2, 4 y 6 horas por día, con el mejor tiempo de inmersión obtenido en las variables evaluadas en el apartado 1.1.
Se utilizó el medio de cultivo y las condiciones de cultivo descritas en los procedimientos generales. Se colocaron cuatro brotes de yemas axilares y un volumen de 10 ml de medio de cultivo por brote de yema axilar en el SIT.
Las condiciones experimentales, el número de repeticiones por tratamiento realizadas en el experimento, el momento de las evaluaciones, el número de brotes de yemas axilares evaluados por cada tratamiento, las variables evaluadas, así como el procesamiento estadístico realizado fueron similares a los descritos en el apartado 1.1.
2. Influencia del volumen de medio de cultivo por brote de yema axilar
Este experimento se desarrolló con el objetivo de determinar el volumen de medio de cultivo por brote de yema axilar. Para el desarrollo del experimento se evaluó el efecto de cuatro volúmenes: 5, 10, 15 y 20 ml de medio de cultivo por brote.
Se empleó el medio de cultivo y las condiciones de cultivo descritas en los procedimientos generales. Se utilizó el mejor tiempo y frecuencia de inmersión obtenidos para las variables evaluadas en los experimentos anteriores. Además se colocaron 8 brotes de yemas axilares por SIT.
Las condiciones experimentales, el número de repeticiones por tratamiento realizadas en el experimento, el momento de las evaluaciones, el número de plantas evaluadas por cada tratamiento, las variables evaluadas, así como el procesamiento estadístico realizado fueron similares a los descritos en el apartado 1.1.
3. Efecto del tiempo de subcultivo sobre la multiplicación de los brotes de yemas axilares
Con el objetivo de evaluar el efecto del tiempo de subcultivo durante la fase de multiplicación de los brotes en el SIT, se estudiaron los tratamientos siguientes: 15, 18, 21 y 25 días de cultivo.
Se utilizó el medio de cultivo y las condiciones de cultivo descritas en los procedimientos generales. Se utilizó el mejor tiempo y frecuencia de inmersión obtenidos para las variables evaluadas en los apartados 1.1 y 1.2 respectivamente. Se colocaron 8 brotes de yemas axilares por SIT, con el volumen de medio de cultivo por brote de yema axilar seleccionado en el apartado 2.
Las condiciones experimentales, el número de repeticiones por tratamiento realizadas en el experimento, el número de plantas evaluadas por cada tratamiento, las variables evaluadas, así como el procesamiento estadístico realizado fueron similares a los descritos en el apartado 1.1.
Resultados y Discusión
1. Efectos del tiempo y de la frecuencia de inmersión en el SIT
1.1 Efecto del tiempo de inmersión
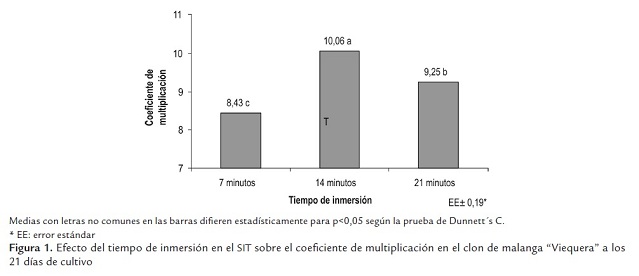
El tiempo de inmersión en el SIT influyó de forma significativa en el coeficiente de multiplicación. Con 14 minutos de inmersión se alcanzó los mejores resultados, con diferencias significativas respecto al resto de los tratamientos (figura 1 ).
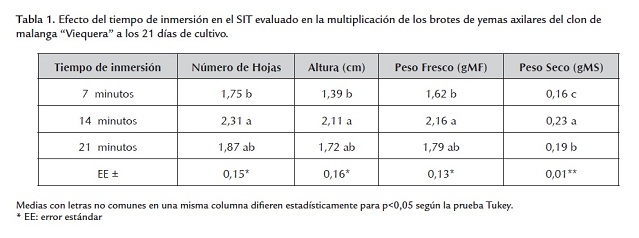
Con tiempos de inmersión de 14 y 21 minutos se obtuvieron los mejores resultados en la multiplicación de los brotes de yemas axilares en las variables de número de hojas, altura y peso fresco, sin diferencias significativas entre ellos (tabla 1 ), en cambio, sí las hubo en el peso seco y en el coeficiente de multiplicación.
El tiempo de inmersión de 14 minutos favoreció el coeficiente de multiplicación de los brotes de yemas axilares debido a que propició mayor disponibilidad de nutrientes a los mismos en comparación con un tiempo de inmersión de 7 minutos. Al parecer, un tiempo prolongado de inmersión de 21 minutos provocó deficiencias de oxígeno en los tejidos de los brotes de yemas axilares, lo cual pudo haber sido una de las causas en las diferencias en la multiplicación de los mismos. Escalona (1999) y Berthouly and Etienne (2005) señalaron la necesidad de determinar el tiempo de inmersión para cada una de las fases de cultivo de la micropropagación.
En la multiplicación en este sistema del clon de malanga “México 8” se logró un coeficiente de multiplicación de 13,8 con el empleo de un tiempo de inmersión de 7 minutos en frascos Clerboys (Nalgene, USA) de 10 L de capacidad (Dottin, 2000).
Basail (2005) obtuvo el mejor resultado para la variable de coeficiente de multiplicación (9,10) cuando utilizó 10 minutos de inmersión de los explantes en el medio de cultivo, en el cultivar híbrido de plátano vianda “FHIA 21” (AAAB).
Es muy importante establecer el tiempo de inmersión en la multiplicación en SIT, ya que este determina la absorción de nutrientes por los brotes y el control de la hiperhidricidad (Berthouly and Etienne, 2005).
1.2 Efecto de la frecuencia de inmersión
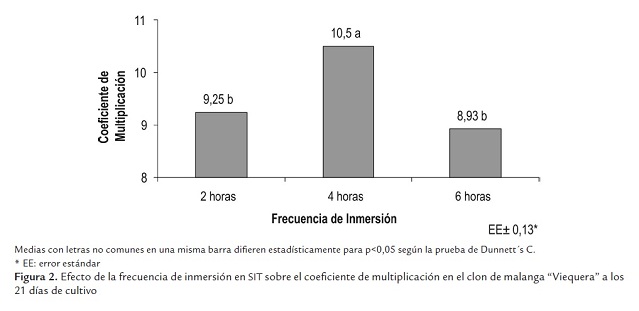
Al evaluar el coeficiente de multiplicación con frecuencia de inmersión cada 4 horas se obtuvieron los mejores resultados con diferencias significativas en relación con el resto de los tratamientos (figura 2 ).
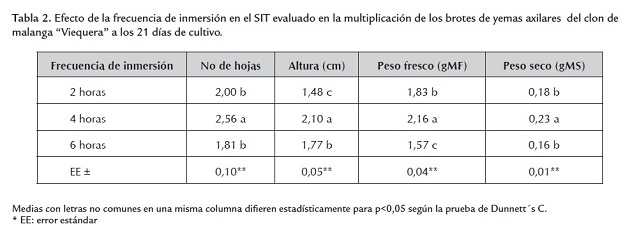
Al utilizar la frecuencia de inmersión cada 4 horas se alcanzaron los mejores resultados en la multiplicación de los brotes de yemas axilares en las variables evaluadas (tabla 2). Estos brotes se caracterizaron por su coloración verde y desarrollo foliar.
Además, con la frecuencia de inmersión cada 4 horas quizá se logró un mejor suministro de nutriente, al estar los brotes de yemas axilares más tiempo en contacto con el medio de cultivo, y una renovación más sistemática de la atmósfera interna del recipiente, que contribuyó a obtener explantes de mayor calidad en comparación con la frecuencia de inmersión cada 6 horas. Las condiciones de cultivo creadas en el SIT con el empleo de esa frecuencia de inmersión influyeron de forma positiva en los resultados obtenidos en la multiplicación de los brotes (Teisson et al., 1996, Kozai et al., 1997 y McAlister et al., 2005).
Dottin (2000), en la multiplicación del clon “México 8” [Xanthosoma sagittifolium (L) Schott], al emplear una frecuencia de inmersión cada 4 horas, logró también un mejor desarrollo de los brotes de yemas axilares e incrementó el coeficiente de multiplicación a 14,50 en frascos de cultivo Clerboys (Nalgene, USA) de 10 L de capacidad, lo cual apoya los resultados obtenidos en este trabajo.
El tiempo y la frecuencia de inmersión influyeron en la eficacia del empleo de este sistema para la multiplicación de los brotes de yemas axilares. A través del control de estos parámetros se reguló la absorción de los nutrientes y la hiperhidricidad de los materiales cultivados. Quiala et al. (2006) en el cultivo de la caña santa [Cymbopogon citratus (D.C.) Staff] obtuvieron los mejores resultados para el peso fresco y el coeficiente de multiplicación al utilizar 6 inmersiones por día (cada 4 horas) en SIT de un litro de capacidad.
La mejor respuesta para el crecimiento de los brotes de yemas axilares se obtuvo cuando se empleó un tiempo de inmersión de 14 minutos y una frecuencia de inmersión cada 4 horas. Basado en los resultados alcanzados en este apartado, se definió emplear en los próximos experimentos este tiempo y esta frecuencia de inmersión.
2. Influencia del volumen de medio de cultivo por brote de yema axilar
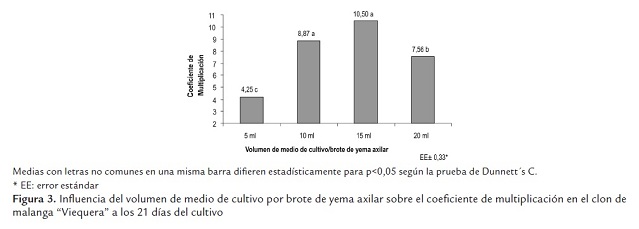
Los brotes de yemas axilares cultivados con un volumen de 10 y 15 ml de medio de cultivo mostraron los mejores coeficientes de multiplicación (figura 3 ), con diferencia significativa respecto a los volúmenes de 5 y 20 ml de medio de cultivo.
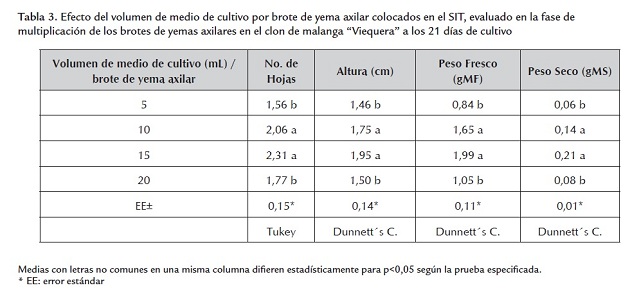
Cuando se emplearon volúmenes de 10 y 15 ml de medio de cultivo por brote de yema axilar se obtuvieron los mejores resultados en la fase de multiplicación de los brotes de yemas axilares en las variables evaluadas, sin diferencias significativas entre ellas, en cambio, sí se dieron con el volumen de 5 y 20 ml de medio de cultivo (tabla 3).
Con estos volúmenes de medio de cultivo se obtuvieron los mejores resultados en la multiplicación de los brotes de yemas axilares, debido a que se garantizó durante esta fase de cultivo un adecuado equilibrio entre las necesidades de nutrientes de los brotes de yemas axilares y la disponibilidad de los mismos en el medio de cultivo. Estas condiciones no se dieron en los volúmenes de 5 y 20 ml de medio de cultivo. Des esta manera se demuestra la necesidad de ajustar el volumen de medio de cultivo por explantes cultivados en el SIT, sin renovación del medio de cultivo (Berthouly and Etienne, 2005).
Además, cuando se utilizaron 10 y 15 ml de medio de cultivo por brote, se logró una adecuada renovación de la atmósfera interna en el recipiente de cultivo a diferencia del empleo del volumen de 20 ml de medio cultivo, en el cual quizá se limitó la renovación de la atmósfera interna, pues el volumen de medio de cultivo (160 mL) ocupó en gran medida el volumen del frasco de cultivo y restringió el intercambio de gases. El volumen de medio de cultivo por explante utilizado en los frascos de cultivo de inmersión temporal es uno de los principales factores que se debe tener en consideración para mejorar la eficiencia del empleo del SIT (Berthouly and Etienne, 2005).
En la bibliografía consultada no se encontró ninguna referencia sobre esta temática en malanga, por lo que se discuten los resultados con otros cultivos.
Lorenzo et al. (1998) observaron un incremento en el crecimiento y la multiplicación de brotes de caña de azúcar (Sacchharum sp.), desde 8,3 hasta 23,9, en 30 días de cultivo, cuando aumentaron el volumen de medio de cultivo de 5,0 ml a 50 ml por brotes en el SIT.
Por su parte, Escalona (1999) determinó que para el crecimiento y multiplicación de brotes de piña (Ananas comosus L. Merr), es necesario 200 ml de medio de cultivo por brote, además comprobó que los volúmenes de medios de cultivo superiores a 200 m por brote limitan el coeficiente de multiplicación.
A partir de los resultados obtenidos en este apartado se definió emplear en los próximos experimentos de multiplicación de los brotes de yemas axilares de malanga en SIT, un volumen de 15 ml de medio de cultivo por brote de yema axilar.
3. Efecto del tiempo de subcultivo sobre la multiplicación de los brotes de yemas axilares
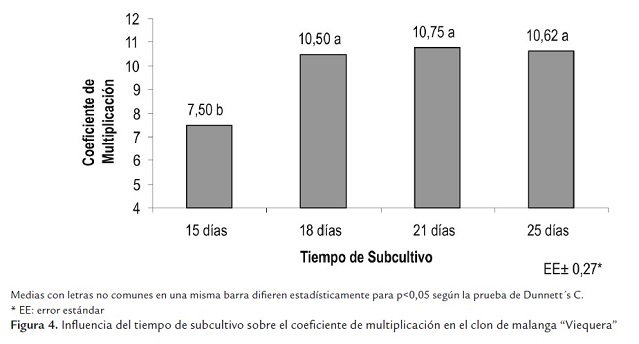
Cuando se utilizaron los tiempos de subcultivo de 18, 21 y 25 días, se obtuvieron los más altos coeficientes de multiplicación, sin diferencias significativas entre ellos, en cambio, sí se presentaron cuando se realizó el subcultivo a los 15 días (figura 4 ).
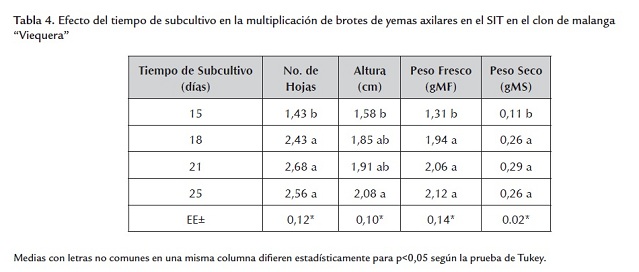
Cuando se emplearon tiempos de subcultivo de 18, 21 y 25 días se obtuvieron los mejores resultados en la fase de multiplicación de los brotes de yemas axilares en las variables de número de hojas, peso fresco y peso seco, sin diferencias significativas entre ellos, en cambio, sí se presentaron con el tiempo de subcultivo de 15 días (tabla 4). Con respecto a la variable de altura no hubo diferencias significativas entre los tratamientos estudiados.
Al utilizar un tiempo de subcultivo de 18 días en los SIT se logró realizar un máximo aprovechamiento de los frascos de cultivo y mejorar la eficiencia en la fase de multiplicación.
El tiempo de subcultivo es uno de los factores que deben tenerse en cuenta en la multiplicación en SIT. Dottin (2000), en la multiplicación del clon de malanga “México 8”, realizó los subcultivos de los brotes de yemas axilares a los 21 días de cultivo en multiplicación. Sin embargo, con los resultados obtenidos en este trabajo, para la multiplicación de los brotes de yemas axilares del clon de malanga “Viequera”, fue posible realizar el subcultivo a los 18 días. Lo que demuestra la importancia de estudiar el tiempo de subcultivo en la multiplicación en el SIT.
Escalona (1999), para el cultivo de la piña, demostró que los períodos prolongados promueven la deformación de los brotes y, por lo tanto, afectan el número de brotes que se puede obtener.
En la multiplicación del clon de ñame “Pacala Duclos” (Dioscorea alata L.) Cabrera et al. (2004) lograron los resultados más favorables cuando los segmentos nodales fueron cultivados a los 49 días sin diferencias significativas con respecto a 45 y 63 días.
Basail (2005), en la multiplicación en SIT del cultivar de plátano híbrido “FHIA-21” (AAAB), obtuvo los mejores resultados al realizar los subcultivos a los 18 días, sin diferencia significativa con respecto a tiempos más prolongados como de 21 y 25 días.
García et al, (1999) alcanzaron coeficientes de 1,4 en la multiplicación del clon de malanga “Viequera” en medio semisólido.
Dottin (2000), en la multiplicación del clon de malanga “México 8” (morada), obtuvo con el empleo del medio de doble capa coeficientes de multiplicación de 3,02 brotes, mientras que Rodríguez et al. (2004), en la multiplicación del clon de malanga “Viequera” en medio de cultivo semisólido, obtuvieron coeficientes de multiplicación de 2 brotes.
Conclusiones
Se logró establecer un protocolo mas eficiente para la multiplicación de malanga (Xanthosoma spp.) clon “Viequera” en Sistema de inmersión temporal, conformado por frasco de cultivo de 250 ml de capacidad.
El mejor comportamiento del material y el coeficiente máximo de multiplicación alcanzado de 10,50, se lograron con un tiempo de 14 minutos de inmersión cada 4 horas, una densidad de ocho brotes de yemas axilares, con un volumen de 15 ml de medio de cultivo por brote y un tiempo de cultivo de 18 días.
Referencias Bibliográficas
1 Basail, M. 2005. Multiplicación en sistema de inmersión temporal del cultivar híbrido ´FHIA 21´ (AAAB). Tesis de Maestría. Universidad Central de Las Villas, Instituto de biotecnología de las plantas, Cuba. 85 p. [ Links ]
2 Berthouly, M. and Etienne, H. 2005. Temporary immersion systems: a new concept for use liquid medium in mass propagation. En: Hvoslef-Eide, A. K. and Preil, W. (Ed). Liquid Culture Systems or in vitro Plant Propagation. pp. 165-195. [ Links ]
3 Cabrera, M., Basail M., Torres, Y., Robaina, A., Santos A., Medero, V., Rayas, A., López, J., García, M., Ventura, J. C. y Oliva, M. 2004. Empleo del Sistema de inmersión temporal en la multiplicación de segmentos nodales de Dioscorea alata L. en el clon Pacala Duclos. Biotecnología Vegetal. 4 (1): 3-8. [ Links ]
4 Chien-Ying, K., Ji-Ping, K. and McDonald, R. 2008. In vitro micropropagation of white dasheen (Colocassia esculenta). African Journal of Biotechnology. 7 (1): 41-43. [ Links ]
5 Dottin, M. 2000. Propagación in vitro de la malanga (Xanthosoma sagittifolium (L) Schott). Tesis presentada para optar por el grado científico de Doctor en Ciencias Agrícolas. Universidad Central de Las Villas. Santa Clara, Cuba. [ Links ]
6 Escalona, M. 1999. Propagación de la piña [Ananas comosus (L.) Merr.] en sistemas de inmersión temporal. Tesis para aspirar al grado científico de Doctor en Ciencias Agrícolas. Universidad de Ciego de Ávila, Centro de Bioplantas. Cuba. 102 p. [ Links ]
7 Escalona, M. 2006. Temporary inmersion beats traditional techniques on all fronts. Prophyta annual. pp 48-50. [ Links ]
8 FAOSTAT. 2006. http://apps.fao.org/cgi-bin/nph-db.pl? Subset=agriculture. [ Links ]
9 García, M., Mederos, V., Rodríguez, S., López, J., Ventura, J., Cabrera, M., Hernández, R., González, J. E., 10 Bermúdez, D., Gálvez, D., Gutiérrez, V. y Gálvez, J. R. 1999. Generalización de la metodología para la micropropagación de la malanga (Xanthosoma spp.) en Cuba. En: 5.o Coloquio internacional de biotecnología vegetal, pp. 167-169. [ Links ]
10 Hernández, R., Bermúdez, D., González, J. E., Machado, J. M., Pairol, A. y García, M. 2000. Establecimiento de un sistema de diagnóstico por UM-ELISA para DMV en Aráceas. Certificación de vitroplantas de géneros comerciales para la introducción en biofábricas. Centro Agrícola 27 (1): 24-28. [ Links ]
11 Jeong, B., Fujiwara, K. and Kozai, T. 1995. Environmental control and photoautotrophic micropropagation. En: Horticutural reviews, vol. 17. Janick, J. (Ed). pp 125-171. [ Links ]
12 Jiménez, E. y De Feria, M. 1998. Empleo de biorreactores para la propagación masiva. En: Pérez, J. (Ed) Propagación y mejora genética de plantas por biotecnología. Instituto de biotecnología de las plantas. Universidad Central de Las Villas. Santa Clara, Cuba. pp. 207-222. [ Links ]
13 Kozai, T., Kubota, C. H. and Jeong, B. 1997. Environmental control for the large-scale production of plants through in vitro techniques. Plant Cell Tissue and Organ Culture. 51: 49-56. [ Links ]
14 López, M., Vázquez, E. y López, R. 1995. Raíces y tubérculos. Ciudad de La Habana. Ed. Pueblo y Educación. Cuba. 312 p. [ Links ]
15 Lorenzo, J., González, B., Escalona, M., Teisson, C., Espinosa, P. and Borroto, C. 1998. Sugarcane shoot formation in an improved temporary immersion system. Plant Cell Tissue and Organ Culture. 54: 197-200. [ Links ]
16 McAlister, B., Finnie, J., Watt, M. P. and Blakeway, F. 2005. Use of the temporary immersion bioreactor system (RITA) for production of commercial Eucalyptus clones Mondi Forests. Plant Cell Tissue and Organ. 81: 347-358. [ Links ]
17 Milián, M. 2001. Caracterización de la variabilidad del género Xanthosoma en Cuba, con el uso de descriptores morfoagronómicos, citogenéticos e isoenzimáticos. Tesis de Maestría. Universidad de La Habana, Facultad de Biología. Cuba. 61 p. [ Links ]
18 Murashige, T. and Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15: 473-497. [ Links ]
19 Orellana, P. 1998. Introducción a la propagación masiva. En: Pérez, J. (Ed) Propagación y mejora genética de plantas por biotecnología. Instituto de biotecnología de las plantas. Universidad Central de Las Villas. Santa Clara, Cuba. pp. 125-133. [ Links ]
20 Quiala, E., Barbón, R., Jiménez, E., De Feria, M., Chávez, M., Capote, A. and Pérez, N. 2006. Biomass production of Cymbopogon citratus (D.C.) Stapf., a medicinal plant, in temporary immersion systems. In vitro Cell. Dev. Biol. Plant 42: 298-300. [ Links ]
21 Rodríguez, A. J., Rodríguez, A., Quintero S., Torres, M. A. y Fundora, Zoila. 2004. Influencia de los medios de cultivo en la micropropagación de plátano (Musa spp.) y malanga (Xanthosoma sagittifolium Schott.). Cultivos Tropicales. 25 (1): 23-26. [ Links ]
22 Teisson, C., Alvard, D., Berthouly, M., Cote, F., Escalant, J., Etienne, H. and Lartand, M. 1996. Simple apparatus to perform plant tissue culture by temporary immersion. Acta Hort. 440: 521-526. [ Links ]
23 Vasil, I. 1991. Cell culture and somatic cell genetics of plants. Vol. 8: Scale-Up and automation in plant propagation. Academic Press. [ Links ]
24 Wang, Z., Heinemann, P., Walker, P. and Heuser, C. 1999. Automated micropropagated sugarcane shoot separation by machine vision. Transactions of the American Society of Agricultural Engineers. 42 (1): 247-254. [ Links ]
25 Ziv, M. 1999. Plant propagation and mechanized separation of organogenic clusters from bioreactor cultures. Resúmenes del taller internacional de biotecnología vegetal. BioVeg´99. Ciego de Ávila, Cuba. 22 p. [ Links ]