Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.13 no.2 Bogotá July/Dec. 2011
ARTÍCULO CORTO
Optimización de un medio de cultivo para plantas micropropagadas de Dioscorea alata L.
Optimization of a culture medium for micropropagated plants of Dioscorea alata L.
Misterbino Borges García1 , Reisel Destrade Batista2 , Silvio Meneses Rodríguez1 , Rafael Gómez Kosky3 Bernard Malaurie4 Perla Hamon4 y Louis Charles Demenorval5
1 Centro de estudios de biotecnología vegetal. Facultad de Ciencias Agrícolas. Universidad de Granma. mborgesg@udg.co.cu.).
2 Biofábrica Granman
3 Instituto de biotecnología de las plantas. Universidad Central "Marta Abreu" de Las Villas.
4 Institut de Recherche pour le Développement (IRD), UMR DIAPC, F-34 000 Montpellier, France.
5 UMR-5253 ICGM Université de Montpellier 2, Montpellier, France
Resumen
La propagación de material de ñame de buena calidad es esencial para incrementar la producción sostenible de este cultivo. El presente trabajo tuvo como propósito optimizar el medio de cultivo de micropropagación de Dioscorea alata L. clon Caraqueño a través de los siguientes objetivos: determinar el efecto de diferentes antioxidantes (carbón activado 0,5 g/L-1 ; carbón activado 1,0 g/L-1 ; cisteína 10 mg/L-1 , 20 mg/L-1 y 30 mg/L-1 ) y concentraciones de sales de Murashige y Skoog (MS) (25, 50, 75 y 100 %) en el medio de cultivo durante el establecimiento y la multiplicación de las plantas in vitro, y evaluar la utilización de distintas combinaciones de ácido naftalenacético (0,01; 0,1 mg/L-1 ) y bencilaminopurina (0,01; 0,1 mg/L-1 ) en el mejor medio de cultivo de multiplicación obtenido en el experimento anterior. A los 35 días se seleccionaron 40 plantas in vitro, a las cuales se les determinaron las siguientes variables: longitud en cm del vástago; número de nudos de novo por explantes; número de hojas por explante y porcentaje de fenolización. Se evaluó además, en el experimento con los reguladores de crecimiento, el número de raíces y longitud de la raíz de mayor tamaño. Se aplicó un diseño experimental completamente aleatorio con análisis de varianza bifactorial y clasificación simple. Se realizó la prueba de comparación de medias de Tukey para un nivel de significación del 5%. Los resultados obtenidos mostraron que las sales MS al 75% de su concentración, el carbón activado (0,5 g/L-1 ) o la cisteína (10 mg/L-1 ), en combinación con los reguladores de crecimiento ANA/BAP (0,01/0,01 mg/L-1 ) en el medio de cultivo MS, incrementaron los indicadores de desarrollo de las plantas in vitrol tales como número de nudos de novo (3,5), longitud del vástago (4,1 cm), número de hojas (3,8), número de raíces (5,7) y longitud de las raíces (6 cm).
Palabras clave: ácido naftalenacético, bencilaminopurina, carbón activado, cisteína, ñame
Abstract
The material propagation of good quality yam is essential to increase the sustainable production of this cultivation. In the present work the optimization of culture medium of Dioscorea alata L. clone Caraqueño micropropagation was carried out through the following objectives: to determine the effect of different anti-oxydants (activated charcoal 0,5 g.L-1 ; activated charcoal 1,0 g.L-1 ; cysteine 10 mg.L-1 , 20 mg.L-1 and 30 mg.L-1 ) and Murashige and Skoog salts concentrations (25, 50, 75 and 100%) in the culture medium during the in vitrol plants establishment and the multiplication, and to evaluate the use of different combinations of naftalenacetic acid (0,01; 0,1 mg.L-1 ) and benzylaminopurine (0,01; 0,1 mg.L-1 ) in the best multiplication medium obtained in the above experiment. At 35 days, 40 in vitro plants were selected. The following vari- ables were determined in these plants: shoot length, cm; leaf and bud explant number; and oxydation phenolic percentage. In the experiment of plant growth regulators was also evaluated, the roots number and greater size root length. A totally randomized experimental design with one and two factor variance analysis and the Tukey test for means comparison at 5% significance level were applied. The obtained results showed that the salts MS at 75% concentration, the activated charcoal (0,5 g. L-1 ) or the cysteine (10 mg. L-1 ), in combination with the growth regulators ANA/BAP (0,01/0,01 mg.L-1 ) in the MS culture medium, increase the development of the in vitro plants, number of novo buds (3,5), shoot length (4,1 cm), number of leaves (3,8), number of roots (5,7) and greater size root length (6 cm).
Key words: activated charcoal, benzylaminopurine, , naftalenacetic acid, cysteine, yam.
Introducción
Los ñames representan el 12% de la alimentación básica de los pueblos de las regiones intertropicales húmedas (Malaurie, 2001). El occidente de África suministra más del 90% de la producción mundial de ñame. Las zonas de cultivo y de la civilización del ñame se extienden desde Costa de Marfil hasta Camerún. Con una producción estimada de alrededor de 50 millones de toneladas por año, los ñames se sitúan en el cuarto rango en importancia a nivel mundial entre las plantas de raíces y tubérculos. Otras regiones productoras de importancia son el Sudeste de Asia, las islas tropicales en el Pacífico occidental y el Caribe. La producción mundial en el año 2008 se estimó en alrededor de 56,4 millones de toneladas (FAOSTAT, 2009).
En Cuba en los últimos años ha habido una tenden- cia a la disminución de la producción debido a que sobre el género Dioscorea ha incidido un alto riesgo de erosión genética a causa de diversos factores bióticos y abióticos, lo que ha ocasionado una drástica reducción del área cultivada donde casi la totalidad de la producción se deriva de agricultores individuales, mientras que la misma en el sector estatal es casi inexistente. De manera que una política agrícola inteligente y audaz basada en la combinación de métodos tradicionales con técnicas modernas podrían detener el deterioro de este género. En este sentido, una respuesta rápida puede ofrecerla la introducción de la micropropagación in vitro aplicada con éxito en diversos clones de ñame (Borges et al., 2009).
Los primeros trabajos de micropropagación por segmentos nodales se llevaron a cabo con la formación de tubérculos aéreos a partir de segmentos nodales de D. opposita (Sawada et al., 1958). De los ñames comestibles, D. alata ha sido empleada en la mayor parte de los trabajos (Mantell et al., 1978; Arnolin, 1980; Mantell and Hugo, 1989; Belarmino and Rosario, 1991), después le siguen D. rotundata (Mantell et al., 1978; Arnolin, 1980; Belarmino and Rosario, 1991), D. bulbifera (Uduebo, 1971; Mantell and Hugo, 1989), y D. esculenta (Belarmino and Rosario, 1991).
En Cuba a partir de 1990, dada la necesidad de incrementar el material de plantación de ñame de buena calidad, se comenzó a desarrollar la propagación acelerada de los principales clones comerciales de D. alata, a través de las técnicas de cultivo de tejidos vegetales mediante la utilización de segmentos nodales. Se obtuvieron dos metodologías: De la Cruz et al. (1998) y Medero et al. (1999). La metodología de De la Cruz et al. (1998) utiliza básicamente el medio de cultivo D-571 (concentración media de sales), vitaminas de Murashige y Tucker (MT), 20 mg/L-1 de cisteína, 30 g/L-1 de sacarosa y sin hormonas, mientras que la metodología de Medero et al. (1999) usa el medio de Murashige y Skoog (MS) (concentración alta de sales), vitaminas de Morell, 0,1 mg/L-1 de tiamina, 1 g/L-1 de carbón activado, 30 g/L-1 de sacarosa y reguladores del crecimiento, 1 mg/L-1 de BAP y 0,1 mg/L-1 de ANA. Con el empleo de estas metodologías se obtienen bajos coeficientes de multiplicación (2,5), sin embargo, deben ser optimizadas para su implementación en otros clones de interés agrícola y valor comercial en la región Oriental del país como el clon Caraqueño. Sobre este clon en los últimos 30 años ha incidido una alta erosión genética, debido al ataque de plagas y enfermedades mortales como los nemátodos y la antracnosis, que ha conducido a una disminución de los rendimientos agrícolas hasta 70% y a la desaparición del mismo en muchas localidades de la región (Borges et al., 2009).
Teniendo en consideración lo antes expuesto, el presente trabajo tuvo como objetivos optimizar el medio de cultivo de micropropagación de Dioscorea alata L. en el clon Caraqueño a través de la evaluación de diferentes antioxidantes y concentraciones de sales MS en el medio de cultivo durante el establecimiento y la multiplicación de las plantas in vitro, y la utilización de distintas concentraciones de ácido naftalenacético (ANA) y becilaminopurina (BAP) en el mejor medio de cultivo obtenido del experimento anterior para la propagación del material vegetal con altos índices de multiplicación.
Materiales y métodos
Infuencia de diferentes antioxidantes en el medio de cultivo en el establecimiento y multiplicación de plantas in vitro
Este experimento tuvo como objetivo evaluar la influencia de diferentes antioxidantes y sus concentraciones en el medio de cultivo durante el establecimiento y la multiplicación de plantas in vitro, debido a que en las metodologías anteriores unos autores utilizan cisteína y otros carbón activado, no existe entonces un estudio integral al respecto.
Como material vegetal se utilizó en la fase de establecimiento segmentos uninodales primarios con una longitud de 15 mm, obtenidos de plantas donantes de ñame (D. alata L.) clon Caraqueño. Estas fueron cultivadas durante 35 días en condiciones semicontroladas (temperatura de 33 ± 2 °C, humedad relativa del 70-80% e iluminación natural con fotoperiodo de 12 horas). En la fase de multiplicación se emplearon segmentos uninodales con una longitud de 15 mm, procedentes de plantas in vitrol cultivadas durante 35 días en la fase de establecimiento (primer subcultivo). Se utilizó un diseño completamente aleatorio con 100 plantas in vitro por tratamiento, los cuales consistieron en la utilización de distintos antioxidantes en el medio de cultivo Murashige and Skoog (1962) basal (MSB): 1: carbón activado 0,5 g/ L-1 ; 2: carbón activado 1,0 g/ L-1 ; 3: cisteína 10 mg/ L-1 ; 4: cisteína 20 mg/ L-1 ; 5: cisteína 30 mg/ L-1 y 6: sin antioxidante (control).
A los 35 días, tanto en fase de establecimiento como en fase de multiplicación, se seleccionaron 40 plantas in vitro (de un total de 100 plantas in vitro por tratamiento con cuatro réplicas), a las cuales se les determinaron las siguientes variables: longitud del vástago en cm; número de nudos de novo por plantas; número de hojas por plantas (hojas extendidas totalmente) y porcentaje de fenolización (número de plantas con emisión de sustancias fenólicas).
Infuencia de diferentes concentraciones de sales MS en el medio de cultivo en el establecimiento y multiplicación de plantas in vitro
Este experimento se realizó con la finalidad de determinar la influencia de distintas concentraciones de sales MS en el medio de cultivo MSB en el establecimiento y la multiplicación de plantas in vitro. Estudios similares no han sido realizados con anterioridad para el cultivo del ñame, donde el medio de cultivo de uso general hasta la fecha ha sido el MS al 100% de sus sales.
El material vegetal, el diseño, el muestreo y las evaluaciones realizadas, excepto la fenolización, se correspondieron con 2.1. Los tratamientos consistieron en distintas concentraciones de sales MS utilizadas en el medio de cultivo: 25, 50, 75 y 100% (control).
Efecto de diferentes concentraciones en el medio de cultivo MSB1C de ANA y BAP sobre la multiplicación de plantas in vitro
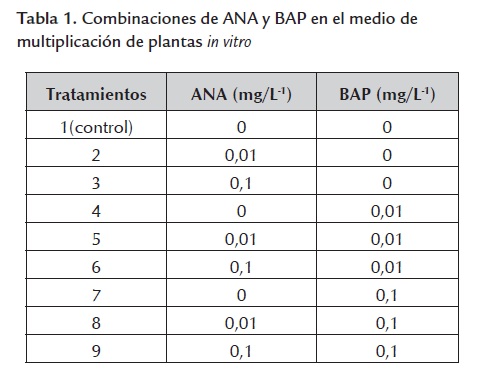
Como en las metodologías anteriores algunos autores no utilizan reguladores de crecimiento en el medio de cultivo del ñame y otros sí lo usan, no existe entonces un estudio definitivo al respecto. Por ello el presente experimento tuvo como propósito determinar el efecto en el mejor medio de cultivo obtenido de los experimentos anteriores 2.1 y 2.2 (MS al 75% de sus sales con cisteína 10 mg/L-1 , MSB1C) de diferentes concen- traciones de ácido naftalenacético (ANA) y bencilaminopurina (BAP) en la multiplicación de las plantas in vitro (tabla 1 ).
Se utilizó un diseño completamente aleatorio con arreglo bifactorial. El material vegetal, el muestreo y las evaluaciones coincidieron con lo descrito en el experimento anterior, excepto que se incorporaron el número de raíces y longitud en cm de la raíz de mayor tamaño (desde la base hasta el ápice).
Análisis estadístico
Se aplicó un análisis de varianza bifactorial, para determinar la influencia de diferentes concentraciones de ácido naftalenacético (ANA) y bencilaminopurina (BAP) en la multiplicación de plantas in vitro, y de varianza simple, para evaluar el efecto de diferentes antioxidantes y concentraciones de sales MS en el medio de cultivo durante el establecimiento y la multiplicación de plantas in vitro, con tres repeticiones por tratamiento. Para la comparación de las medias de los distintos tratamientos se utilizó la prueba de Tukey. Todos los análisis estadísticos se procesaron con el paquete Statistica para WINDOWS, versión 8 (StatSoft, 2008).
Resultados y discusión
Influencia de diferentes antioxidantes en el medio de cultivo en el establecimiento y multiplicación de plantas in vitro
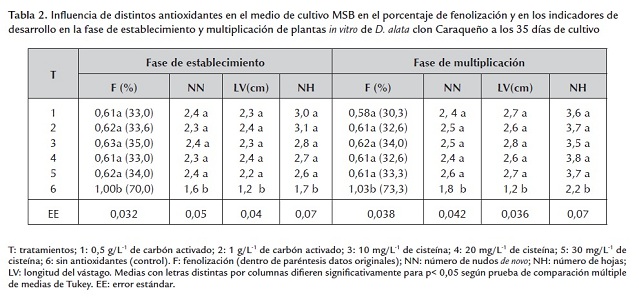
Los menores valores del porcentaje de fenolización y los mayores para la longitud del vástago, el número de nudos de novo y de hojas (tabla 2 ) se alcanzaron en el medio de cultivo donde se utilizaron diferentes antioxidantes, tanto en la fase de establecimiento como la de multiplicación de plantas in vitro, con relación al control (sin antioxidantes).
Estos resultados evidenciaron que los diferentes antioxidantes evaluados ejercieron un efecto fisiológico importante en el cultivo in vitro de ñame, ya que disminuyeron de manera efectiva la emisión de sustancias fenólicas dañinas para el material vegetal (Gratão et al. 2005; Azofeifa, 2007, 2009) y favorecieron significativamente el desarrollo de las plantas in vitro obtenidas de segmentos uninodales.
Resultados similares fueron alcanzados por Borges et al. (1999) durante el estudio de la adición de diferentes antioxidantes (cisteína 20 mg/L-1 , ácido cítrico, ácido ascórbico y polivinilpirrolidona 100 mg/L-1 ) en el medio de micropropagación de ñame (D. alata ). En los tratamientos donde se utilizaron las sustancias antioxidantes no se encontraron diferencias significativas para el porcentaje de fenolización, la longitud del vástago, el número de nudos de novoy de hojas.
Distintos autores han utilizado satisfactoriamente en el medio de micropropagación de ñame (D. alata ), cisteína a razón de 20 mg/L-1 (De la Cruz et al., 1998; Salazar y Hoyos, 2007), 100 mg/L-1 (Royero et al., 2007) y carbón activado a concentraciones de 0,5 g/L-1 (Borges y Sosa, 2007), 1 g/L-1 (Medero et al., 1999).
Influencia de diferentes concentraciones de sales MS en el medio de cultivo en el establecimiento y multiplicación de plantas in vitro
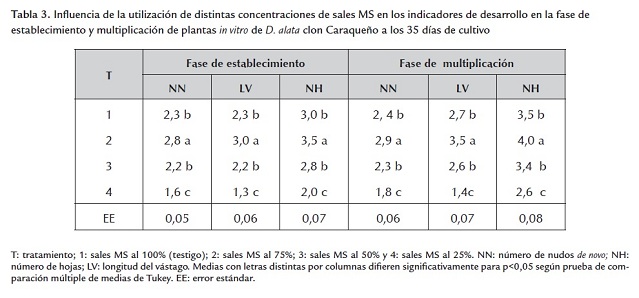
El efecto de diferentes concentraciones de sales MS en el medio de cultivo sobre el establecimiento y multiplicación de plantas in vitro de ñame se ilustra en la tabla 3 . El mejor tratamiento, significativamente diferente de los demás, correspondió al medio con una concentración de sales MS de 75% (tratamiento 3), a partir del cual se presentó una tendencia a la disminución de los parámetros de desarrollo a medida que disminuyó la concentración. Este resultado indicó, no solo una influencia negativa de las bajas concentraciones, muy probablemente por insuficiencia de nutrientes, sino también, que la concentración máxima resultó excesiva, lo cual permitió la preparación del medio de cultivo para la micropropagación de este clon con menor cantidad de reactivos que la recomendada en las metodologías anteriores.
Según la literatura revisada al respecto no se encontró ningún estudio similar para el cultivo del ñame. La mayoría de los autores han empleado el medio MS al 100% de sus sales para la micropropagación in vitro del ñame: Mantell et al., (1978), Medero et al., (1999), Royero et al., (2007) y Cabrera et al. (2010), en D. alata ta; Mbanaso et al. (2007) en la tuberización in vitro de D. rotundata ; Ondo Ovono et al. (2007) en la proliferación de yemas axilares y tuberización in vitro del complejo D. cayenensis - D. rotundata ; Poornima and Ravishankar (2007) en la propagación in vitro de las especies silvestres D. oppositifolia and D. pentaphylla y Santacruz et al. (2005), en el uso, manejo y conservación in vitro de Dioscorea spp.
En general, Murashige (1982) planteó que el manejo de la concentración de las sales minerales es ampliamente recomendado para estimular el enraizamiento, formación de yemas, hojas y la longitud de las plantas in vitro, mientras que Piqueras and Debergh (2000) señalaron que la concentración de sales minerales puede afectar la morfología de las plantas micropropagadas mediante cambios en la presión osmótica, los cuales afectan principalmente el desarrollo de las raíces in vitro.
Efecto de diferentes concentraciones de ANA y BAP en el medio de cultivo en la multiplicación de plantas in vitro
Los resultados mostraron que hubo un efecto sinérgico significativo de la interacción ANA/BAP. Adeniyi et al. (2008) obtuvieron resultados coincidentes al evaluar la interacción de estos reguladores de crecimiento en el medio MS durante la micropropagación de D. alata a partir de meristemos. Segura (2008) planteó que las interacciones sinérgicas entre auxinas y citoquininas son la base para explicar una serie de procesos fisiológicos, entre ellos la regulación de la división celular.
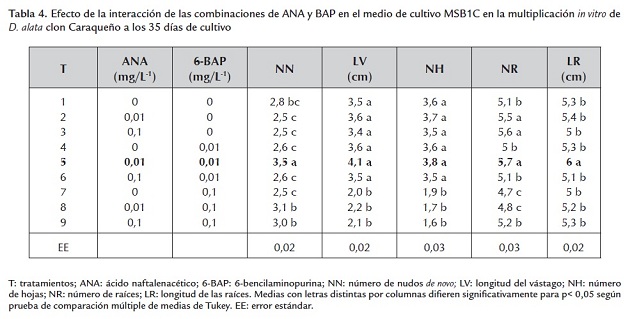
La mejor combinación fue 0,01 mg/L -1 de ANA y 0,01 mg/L -1 de BAP (tratamiento 5) (figura 1), que difirió significativamente para el número de nudos de novo, de raíces y la longitud de estas. Se presentó un efecto inhibitorio a partir de la concentración de 0,1 mg/L -1 de BAP, sola y en combinación con ANA (tratamientos 7, 8 y 9) (tabla 4 ).
El valor de 2,8 nudos de novo obtenidos en el tratamiento 1 (sin adición de reguladores de crecimiento) es ligeramente superior al alcanzado en los trabajos de De la Cruz et al. (1998), Medero et al. (1999) y Saborit et al. (2001), en la micropropagación in vitro de D. alata, en un medio de cultivo sin la adición de reguladores de crecimiento, donde alcanzaron valores entre 2,5 a 2,6 para este indicador a los 35 días de cultivo.
Estos resultados no coinciden con los de Polo et al. (2003) en D. alata quienes al evaluar la influencia de tres concentraciones de BAP (0,1; 0,2 y 0,3 mg/L -1 ) en la formación de nudos de novo por plántulas, no encontraron diferencias estadísticas para las tres dosis y el testigo. Sin embargo, hay semejanzas con los resultados de Royero et al. (2007) en la micropropagación de D. alata basado en el uso de distintas combinaciones de ANA y BAP en el medio de cultivo, ellos obtuvieron los mayores valores para la longitud del vástago en el tratamiento sin la adición de reguladores de crecimiento en el medio de cultivo. También demostraron que el tamaño promedio de los brotes disminuyó cuando se aumentó la concentración de BAP.
La longitud del vástago conjuntamente con el número de nudos de novoconstituyen los indicadores fundamentales en la micropropagación in vitro del ñame, lo que fue corroborado por Medero et al. (1999) y Saborit et al. (2001) en el monitoreo de la propagación in vitro de este cultivo a escala comercial.
Los mejores valores alcanzados para el número de raíces de las plantas in vitro de ñame a los 35 días de cultivo correspondieron a los tratamientos 2 (0,01 mg/L -1 de ANA), 3 (0,1 mg/L -1 de ANA) y 5 (0,01 mg/L -1 de ANA + 0,01 mg/L -1 de BAP), los cuales difieren significativamente del resto. Como se evidencia, los niveles de 0,01 y 0,1 mg/L -1 de ANA y la más baja combinación de ANA/ BAP (0,01 y 0,01 mg/L -1 ) fueron los más adecuados para estimular el enraizamiento y la formación de nuevas raíces. Por otro lado, la longitud de las raíces mostró valores significativamente superiores con la combinación 0,01 mg/L -1 de ANA y 0,01 mg/L -1 de BAP.
Resultados similares fueron logrados por Royero et al. (2007) en la micropropagación de -1 con la utilización de distintas combinaciones de ANA y BAP en el medio de cultivo, donde se lograron un mayor número y longitud de las raíces con la disminución de la concentración de las sales del medio MS y la adición de 0,02 mg/L -1 de ANA al medio de cultivo.
Por otra parte, otros autores han obtenido resultados no coincidentes en la utilización de la combinación más apropiada de ANA y BAP en el medio de cultivo de micropropagación in vitro del ñame, tales como: Mantell et al. (1991) (1 mg/L -1 de ANA y 0,2 mg/L -1 de BAP); Royero et al. (2007) (0,5 mg/L -1 de ANA y 1 mg/L -1 de BAP); Adeniyi et al. (2008) (0,001 mg/L -1 de ANA; 0,05 mg/L -1 de BAP y 0,1 mg/L -1 de Kinetine) en D. alata, y Cabrera et al. (2003) (0,01 mg/L -1 de ANA y 1 mg/L -1 de BAP); Ezeibekwe et al (2009) (0,5 mg/L -1 de ANA y 0,2 mg/L -1 de BAP) en D. rotundata, y Yan et al. (2010) (0,1 mg/L -1 de ANA y mg/Lg -1 de BAP) en D. fordii.
En general, los resultados de la presente investigación pudieran deberse a un contenido endógeno de hormonas de las yemas de segmentos uninodales de ñame, que unido a la adición de concentraciones muy bajas de los reguladores del crecimientos ANA y BAP (tratamiento 5), son suficientes para mejorar significativamente los indicadores fundamentales de la multiplicación y los demás indicadores de desarrollo de las plantas in vitro, como el número y longitud de las raíces, permiten prescindir de la fase de enraizamiento y, de esta forma, hacer más rápido y eficiente la micropropagación comercial de esta especie. En este sentido, Acosta et al. (2008) señalaron que los fitoreguladores constituyen un grupo de sustancias que, añadidas en cantidades muy pequeñas, modifican las pautas normales de desarrollo de las plantas y pueden ayudar a incrementar la productividad y mejorar la calidad del cultivo.
Conclusiones
Los resultados obtenidos mostraron que las sales MS al 75% de su concentración, el carbón activado o la cisteína, en combinación con los reguladores de crecimiento ANA/BAP (0,01/0,01 mg/L -1 ) en el medio de cultivo MS, incrementaron los indicadores de desarrollo de las plantas in vitro, tales como: número de nudos de novo (3,5); longitud del vástago (4,1 cm); número de hojas (3,8); número de raíces (5,7) y longitud de las raíces (6 cm). Este incremento es un aspecto esencial en la optimización de la fase de micropropagación de las plantas, pues redunda favorablemente a las fases subsiguientes de transferencia de las mismas a condiciones naturales, aclimatización y establecimiento en campo.
Agradecimientos
Esta investigación fue ejecutada exitosamente gracias al proyecto internacional Fomento de la agricultura urbana y periurbana para la producción de alimentos en la provincia Granma, República de Cuba financiado por la Diputación Foral de BizKaia y la asociación Euskadi-Cuba. También fue posible por la capacitación científico-técnica recibida por el equipo de investigación IRD/CIRAD/UM II de Montpellier, Francia. A todos nuestros más sinceros agradecimientos.
Referencias bibliográficas
1 Acosta, M., Sánchez, J. y Bañon, M. 2008. Auxinas. En: J. Azcón-Bieto y Talón M. (eds). Fundamentos de Fisiología Vegetal. Segunda edición. McGraw-Hill, S.A. Cartagena, Madrid, p. 377. [ Links ]
2 Adeniyi, O. J., Adetimirin, V. O., Ingelbrecht, I. and Asiedu, R. 2008. Shoot and plantlet regeneration from meristems of Dioscorea rotundata Poir and Dioscorea alata L. African Journal of Biotechnology 7 (8): 1003-1008. [ Links ]
3 Arnolin, R. 1980. Culture in vitro et amélioration de I´Igname (Dioscorea spp.). L´igname, Séminaire Intemational, Pointe-á-Pitre, INRA 255-268. [ Links ]
4 Azofeifa, A. 2007. Desarrollo de metodologías para la caracterización de materiales promisorios de jocote (Spondias purpurea L.) por medio de marcadores moleculares, para el rescate de embriones y para el cultivo de yemas in vitro. Tesis Mg.Sc., Sistema de Estudios de Posgrado, Universidad de Costa Rica. 134 p. [ Links ]
5 Azofeifa, A. 2009. Problemas de oxidación y oscurecimiento de explantes cultivados in vitro. Agronomía mesoamericana 20 (1): 153-175. [ Links ]
6 Belarmino, M. and Rosario, A. G. 1991. Callus induction and organogenesis in Dioscorea Species. Japanese Journal of Breeding 41: 561-569. [ Links ]
7 Borges, M., Aguilera, N., Saborí, G. y Vázquez, J. 1999. Influencia de distintos antioxidantes en la micropropagación del ñame (Dioscorea alata L.). Centro Agrícola 26 (2): 69-71. [ Links ]
8 Borges, M., Alarcón, Y., Malaurie, B., Hernandez, Y. y Silva, J. J. 2009. Conservación in vitro de Dioscorea alata L. clon Caraqueño. Revista Peruana de biología 16 (2): 20-25. [ Links ]
9 Borges, M. y Sosa, Y. 2007. Efecto de la adición de diferentes concentraciones de carbón activado sobre la multiplicación in vitro de ñame. Biotecnología Vegetal 8 (2): 87-90. [ Links ]
10 Cabrera, M., Gómez, R., Rayas, A., De Feria, M., López, J., Medero, V., Basail, M., Rodríguez y G., Santos A. 2010. Evaluación en campo de plantas de ñame (Dioscorea alata L.) obtenidas de los microtubérculos formados en Sistema de Inmersión Temporal. Revista Colombiana de biotecnología 12 (1): 6 p. [ Links ]
11Cabrera, M., Torres, Y., Santos, A., Basail, M., Rayas, A., Medero, V., Robaina, A., López, J., García, M., Ventura, J. C., Gutiérrez, V., Otero, E. y Bauta, M. M. 2003. Establecimiento y multiplicación in vitro del clon de Ñame blanco de Guinea (Dioscorea rotundata Poir). INIVIT. Villa Clara, Cuba. 7 p. [ Links ]
12 De la Cruz, G., Borges, M., Aguilera, N., Saborit, G. y Labrada, M. 1998. Multiplicación acelerada del ñame (Dioscorea alata L.) en condiciones in vitro . Resúmenes. III Encuentro Latinoamericano de Biotecnología Vegetal, La Habana, Cuba, p. 8. [ Links ]
13 Ezeibekwe, I. O., Ezenwaka, C. L., Mbagwu, F. N. and Unamba, C. I. N. 2009. Effects of combination of different levels of Auxin (NAA) and Cytokinin (BAP) on in vitro propagation of Dioscorea rotundata L. (White Yam). Journal of Molecular Genetics 1 (2-4): 18-22. [ Links ]
14 FAOSTAT. 2009. Disponible en: http://www.fao.org. Conectado el 7 de julio del 2009. [ Links ]
15 Gratão, P. L., Polle, A., Lea, P. J. and Azevedo, R. A. 2005. Making the life of heavy metal-stressed plants a little easier. Functional Plant Biology 32: 481-494. [ Links ]
16 Malaurie, B. 2001. Medium and long term conservation and safe international exchange of germplasm from food and cash tropical crops. Acta Horticulturae 560: 69-77. [ Links ]
17 Mantell, S. H., Haque, S. Q. and Whitehall, A. P. 1978. Clonal multiplication of Dioscorea alata L. and Dioscorea rotundata Poir. yams by tissue culture. Horticultural Science 53 (2): 95-98. [ Links ]
18 Mantell, S. H., Hague, S. Q. y Chandler, F. L. 1991. Cultivo de tejidos y material de propagación libre de enfermedades en el ñame. En: Roca, W. M. y L. A. Mroginski (eds): Cultivo de tejidos en la agricultura: Fundamentos y Aplicaciones. CIAT, Colombia 2 p. [ Links ]
19 Mantell, S. H. and Hugo, S. A. 1989. Effect of photoperiod, mineral medium strengh, inorganic ammonium, sucrose and cytokinin on root, shoot and microtuber development in shoot cultures of Dioscorea alata L. and D. bulbífera L. yams. Plant Cell, Tissue and Organ Culture 16: 23-37. [ Links ]
20 Mbanaso, E. N. A., Chukwu, L. I. and Opara, M. U. A. 2007. in vitro basal and nodal microtuberization in yam shoot cultures (Dioscorea rotundata Poir, cv. Obiaoturugo). under nutritional stress conditions. African Journal of Biotechnology 6 (21): 2444- 2446. [ Links ]
21 Medero, V., Del Sol, L. y García, M. 1999. Metodología para la propagación del clon de ñame [ Links ]
22´Blanco o Pelú´. Resúmenes del BioCat 99, Granma Cuba 5-7 de Octubre p. 12. [ Links ]
23 Murashige, T. and Skoog, F. 1962. A revised medium for rapid growth and biossays with tobacco tissue cultures. Physiological Plantarum 15: 473-497. [ Links ]
24 Murashige, T. 1982. Regeneration of plants. California Agriculture 36 (8): 19-20. [ Links ]
25 Ondo Ovono, P., Kevers, C. and Dommes, J. 2007. Axillary proliferation and tuberisation of Dioscorea cayenensis - D.rotundata complex. Plant Cell, Tissue and Organ Culture 91: 107-114. [ Links ]
26 Piqueras, A. and Debergh, P. C. 2000. Morphogenesis in micropropagation. In: Morphogenesis in Plant Tissue Cultures. Edited by Soh, W.-Y. and Bhojwani, S. S. Kluwers Academics Publishers pp. 443-462. [ Links ]
27Polo, J. M., Quintero, I. y Jarma, A. J. 2003. Efecto de bencilaminopurina en medio líquido sobre la tasa de multiplicación in vitro en Dioscorea alata. Revista de divulgación científica. Universidad de Cordoba 8 (1): 21-26. [ Links ]
28 Poornima, G. N. and Ravishankar Rai, V. 2007. in vitro propagation of wild yams, Dioscorea oppositifolia (Linn) and Dioscorea pentaphylla (Linn). African Journal of Biotechnology 6 (20): 2348- 2352. [ Links ]
29 Royero, M., Vargas, T. E. y Oropeza, M. 2007. Micropropagación y organogénesis de Dioscorea alata (ñame). Interciencia 32 (4) 11 p. [ Links ]
30 Saborit, G. F., De la Cruz G., Meneses S. y Estrada, J. 2001. Efecto de algunos factores del ambiente in vitro en la multiplicación del ñame. Revista alimentaria OCT XXXVIII (326): 109-130. [ Links ]
31 Salazar, R. y Hoyos, R. A. 2007. Multiplicación y tuberización in vitro de ñame (Dioscorea alata L.) en sistema de inmersión temporal. Revista Facultad Nacional de Agronomía-Medellín 60 (2): 3907- 3921. [ Links ]
32Santacruz F., Casas, J. F., Pérez, R., Rodríguez, E. y Torres, M. I. 2005. Conservación, manejo y aprovechamiento de camote del Cerro (Dioscorea spp.) en el Estado de Jalisco. México. Avances en la Investigación Científica en el CUCBA pp. 179-183. [ Links ]
33 Segura, J. 2008. Citoquininas. En: J. Azcón-Bieto y Talón M. (eds). Fundamentos de Fisiología Vegetal. Segunda edición. McGraw- Hill, S.A. Cartagena, Madrid, p. 421. [ Links ]
34 StatSoft Inc. 2008. Statistica for Windows. Release 8. Tulsa. OK. [ Links ]
35 Uduebo, A. E. 1971. Effect of external supply of growth substances on axillary proliferation and development in Dioscorea bulbifera. Annals of botany 25: 159-163. [ Links ]
36 Yan, H., Yang, L. and Li, Y. 2010. Axillary shoot proliferation and tuberization of Dioscorea fordii. Plant Cell, Tissue and Organ Culture 6 p. [ Links ]