Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.14 no.1 Bogotá Jan./June 2012
ARTÍCULO DE INVESTIGACIÓN
Multiplicación del clon de banano 'FHIA-18' (AAAB) en Sistema de Inmersión Temporal
Multiplication of banana clone 'FHIA-18' (AAAB) in Temporary Immersion System
Milagros Basail Pérez1, Victor Medero Vega2, José de La Caridad Ventura Martín2, Eneida Otero Gálvez2, Marlenys Torres Delgado2, Jorge López Torres2, Manuel Cabrera Jova2, Arletys Santos Pino2, Aymé Rayas Cabrera2, Maricel Bauta Toledo2, Yoel Beovidez García2.
1 Instituto Nacional de Investigaciones en Viandas Tropicales (INIVIT), Apartado 6, Santo Domingo CP. 53000, Villa Clara, Cuba 1 MSc. Autor para correspondencia: e-mail: milagrosb@inivit.cu
2 Instituto Nacional de Investigaciones en Viandas Tropicales (INIVIT), Apartado 6, Santo Domingo CP. 53000, Villa Clara, Cuba
Recibido: diciembre 16 de 2011 Aprobado: junio 06 de 2012
Resumen
Con el propósito de desarrollar un protocolo para la multiplicación del clon de banano 'FHIA-18' (AAAB) en sistema de inmersión temporal, se definieron como objetivos del trabajo determinar el efecto del tiempo (5, 10 y 15 minutos) y la frecuencia de inmersión (3, 6 y 8 horas por día), así como la influencia de diferentes combinaciones de reguladores del crecimiento (2,0; 3,0 y 4,0 mg.L-1 de 6-BAP y 2,0; 2,5; 3,0; 3,5 y 4,0 mg.L-1 de 6 AIA), el efecto del volumen de medio de cultivo por planta (20, 30, 40 y 50 ml/explante) y la densidad de explantes por frasco de cultivo (30, 50, 70 y 90 explantes/frasco) para incrementar el coeficiente de multiplicación. Con el empleo de un tiempo de 10 minutos y una frecuencia de inmersión cada tres horas, se alcanzaron los mejores resultados en cuanto al número de explantes obtenidos. Con este tiempo y frecuencia de inmersión los explantes presentaron el mayor diámetro del pseudotallo. Para cada frasco de 10,0 L se inocularon 70 explantes y la renovación con 2800 ml de medio de cultivo (40 ml/explante) con un tiempo de cultivo de 21 días permitió alcanzar la mayor productividad del material en fase de multiplicación. Además al utilizar las sales MS suplementadas con 3,0 mg.L-1 de 6-BAP; 2,0 mg.L-1 de AIA; 10,0 mg.L-1 de ácido ascórbico, se logró disminuir el crecimiento innecesario de los tallos y hojas de los brotes en la fase de multiplicación y por lo tanto un mayor número de explantes.
Palabras clave: coeficiente, densidad de explantes, tiempo, frecuencia, volumen de medio de cultivo.
Abstract
In order to develop a protocol for multiplication of Banana clone 'FHIA-18' (AAAB) in temporary immersion systems, the following working objectives were defined: to determine the effect of immersion time (5, 10 and 15 minutes) and frequency (3, 6 and 8 hours per day), as well as, the influence of different combinations of growth regulators (2,0; 3,0 and 4,0 mg.L-1 de 6-BAP and 2,0; 2,5; 3,0; 3,5 and 4,0 mg.L-1 de 6 AIA), the volume effect of culture medium plants (20, 30, 40 and 50 ml/explant) and explants density per culture flask (30, 50, 70 y 90 explants/flask) to increase the multiplication coefficient. With 10 minutes immersion time and an immersion frequency every three hours, the best results were achieved in relation to the number of explants obtained. With this immersion time and frequency, explants showed the highest pseudostem diameter. Seventy explants were inoculated in each 10,0 L culture flask. The highest productivity at the multiplication phase was achieved with a culture medium renewal of 2800 ml (40 ml/explants), and a 21 day culture time. In addition to using MS salts supplemented with 3.5 mg.L-1 of 6-BAP, 1.30 mg.L-1 of IAA, 10.0 mg.L-1 ascorbic acid, the unnecessary growth of stems and leaves of shoots in the multiplication phase was reduced and; therefore, a greater number per explant.
Key words: coefficient, explants density, time, frequency, culture medium volume.
Introducción
En Cuba los bananos constituyen un cultivo estratégico de elevada prioridad dentro del programa alimentario nacional debido a su capacidad de producir todos los meses del año, su elevado potencial de rendimiento, arraigados hábitos de consumo y diversidad de usos (Rodríguez, 2000).
En el 2008 las áreas cultivadas con Musa spp en Cuba tenían la siguiente composición clonal: plátanos tipo vianda AAB (65.6%), plátanos burros ABB (3,9%) y plátanos fruta AAA (30,5%). Sin embargo, con la aparición de la enfermedad de la Sigatoka negra (Mycosphaerella fijiensis Morelet) en noviembre de 1990, lo cual afectó grandemente los plátanos de tipo vianda, se redujeron considerablemente los rendimientos, provocando la desaparición de la producción en las grandes empresas (Orellana, 1994).
Dentro de las técnicas de cultivo de tejidos, la micropropagación es una alternativa desarrollada para la producción a gran escala de plantas, que ha sido utilizada con éxito desde los años 60 del siglo pasado, pero sus principales desventajas son: bajos coeficientes de multiplicación, alto costo por mano de obra y la escasa posibilidad de automatización que brinda el proceso (Kitto, 1997).
En los últimos tiempos se han desarrollado investigaciones sobre la automatización en la propagación de plantas, que incluyen el diseño de nuevos sistemas para la micropropagación, ya que reducen el costo por explantes, permiten una mayor optimización biológica por los altos coeficientes de multiplicación que se obtienen y un mejor comportamiento de las vitroplantas ex vitro (Aitken-Christie et al., 1995).
Los Sistemas de Inmersión Temporal (SIT) además de solucionar las dificultades de los cultivos en medios líquidos estáticos, abren la posibilidad de semiautomatizar algunas etapas del cultivo in vitro (Alvard et al., 1993), permiten mayor facilidad de escalado y aumentan la eficiencia biológica y productiva del material propagado (Jiménez et al., 1999; Castro, 2001). Al mismo tiempo la morfología y el comportamiento fisiológico de los cultivos en los sistemas de inmersión temporal son muy semejantes a los que presentan las plantas en condiciones ex vitro, lo que permite una mayor tasa de supervivencia (Escalona et al., 1999; Berthouly y Etienne, 2005).
Teniendo en cuenta lo anterior el presente trabajo se realizó con el objetivo de desarrollar un protocolo para la multiplicación del clon de banano 'FHIA-18' (AAAB) utilizando el sistema de inmersión temporal.
Materiales y métodos
La investigación se realizó en el laboratorio de Cultivos de tejidos de plantas del Instituto de Investigaciones en Viandas Tropicales (INIVIT); ubicado en Santo Domingo, Villa Clara, Cuba.
Material vegetal
Se utilizó el clon de banano 'FHIA-18' (AAAB), procedente del banco de germoplasma de plátanos y bananos del Instituto de Investigaciones en Viandas Tropicales (INIVIT). Las plantas presentan una altura de 2,10 a 3,50 m, la forma del racimo es asimétrica de tipo cilíndrico, el color del pseudotallo es verde con tonalidades rosadas y el color de los frutos es verde. El peso neto de los racimos sin raquis oscila entre 17,0 y 35,0 kg con un número de dedos de 120 a 170. Es medianamente resistente a la Sigatoka negra y resistente al Mal de Panamá así como a los nemátodos Radopholus similis.
Establecimiento y multiplicación in vitro del clon de banano 'FHIA-18' (AAAB).
Se realizó una primera desinfección con hipoclorito de sodio (NaOCl) al 3% durante 20 minutos, seguido por tres lavados con agua desionizada estéril durante 3-5 minutos cada uno. En condiciones asépticas en una cámara de flujo laminar se redujo el tamaño del material vegetal hasta 2-3 cm de alto con una base cuadrada de 1,5 cm aproximadamente, seguido de una segunda desinfección por 10 minutos con NaOCl al 3% y tres lavados de dos minutos cada uno con agua destilada estéril (Montano et al., 2004). Luego se redujo el tamaño hasta obtener un ápice de aproximadamente 0,50 cm2 para su incubación en el medio de cultivo MS (sales minerales y vitaminas), suplementado con sacarosa (30,0 g.L-1); tiamina (1,0 mg.L-1); cisteína (40,0 mg.L-1); 6-BAP (2,70 mg.L-1); AIB (0,30 mg.L-1) con pH 5,7. (López et al., 1998). Pasados 21 en el medio de cultivo antes mencionado, los ápices fueron seccionados a la mitad y se colocaron en el medio de multiplicación MS suplementado 2,0 mg.L-1 de 6-BAP; 3,5 mg.L-1de AIA; 30,0 g.L-1 de sacarosa; 10,0 mg.L-1 de ácido ascórbico (control) propuesto por Ventura et al. (1998) donde se le realizaron dos subcultivos seguidos. A partir del siguiente subcultivo se comenzó la multiplicación de los explantes en medio de cultivo líquido en sistema de inmersión temporal.
Las condiciones de cultivo utilizadas para el establecimiento y multiplicación de los brotes de yemas axilares fueron las siguiente: cámara de cultivo con temperatura de 27,0±2,0°C e iluminación artificial mediante tubos fluorescente de 40 W, con un fotoperíodo de 16 horas luz y una densidad de flujo de fotones fotosintéticos (DFFF) de 62,0-68,0 µmol.m-2.s-1.
Sistema de Inmersión Temporal (SIT)
Este tipo de sistema de cultivo estuvo compuesto por dos frascos de cultivo tipo Clearboys (Compañía Nalgene, E.U.A) de 10,0 L de capacidad, uno para el crecimiento de los segmentos nodales y el otro como reservorio de medio de cultivo. Estos frascos de cultivo se conectaron entre sí por una manguera de silicona de seis milímetros de diámetro mediante conectores que atravesaron la tapa. En la parte interna se colocó una manguera, la cual descendió hasta el fondo en ambos recipientes. El medio de cultivo circuló de un frasco de cultivo a otro en dependencia de la apertura o cierre de dos electroválvulas de tres vías, las cuales estaban conectadas a un temporizador programable para determinar el tiempo y frecuencia de la inmersión. A la entrada de los frascos de cultivo se colocaron filtros hidrofóbicos (0,22 µm, MIDISART 2000, de la compañía SARTORIUS) para garantizar la esterilidad del aire. La presión del aire de 2,0 atm proveniente de un compresor, fue regulada por un manómetro.
Efecto del tiempo y frecuencia de inmersión en el sistema de inmersión temporal
Efecto del tiempo de inmersión
Con el objetivo de evaluar el efecto del tiempo de inmersión de los brotes de yemas axilares se evaluaron tres tiempos de inmersión: 5,0; 10,0 y 15,0 minutos cada seis horas (cuatro inmersiones por día) según resultados obtenidos en otros clones de plátanos y bananos. En este experimento se utilizó el medio de cultivo de multiplicación MS suplementado 2,0 mg.L-1 de 6-BAP; 3,5 mg.L-1de AIA; 30,0 g.L-1 de sacarosa; 10,0 mg.L-1 de ácido ascórbico (control) y las condiciones de cultivo descritas anteriormente. Se adicionaron 2000 ml de medio de cultivo por frasco.
Efecto de la frecuencia de inmersión
Con el objetivo de determinar el efecto de la frecuencia de inmersión de los brotes de yemas axilares en el clon de banano 'FHIA-18' (AAAB) se evaluaron tres frecuencias de inmersión, cada 3,0; 6,0 y 8,0 horas por día según resultados obtenidos en otros clones de plátanos y bananos, con el mejor tiempo de inmersión obtenido como resultado del experimento anterior.
Se utilizaron las mismas condiciones experimentales del primer experimento, así como el medio de cultivo. Se adicionaron 2000 ml de medio de cultivo por frasco.
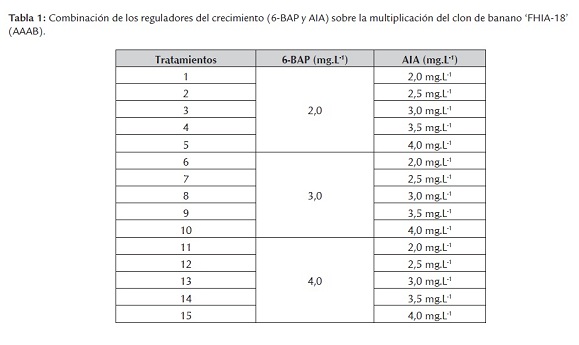
Influencia de diferentes combinaciones de reguladores del crecimiento
Se utilizó como control el medio de cultivo de los experimentos anteriores, así como las condiciones experimentales. Los diferentes medios de cultivo se conformaron a partir de la combinación de los reguladores del crecimiento 6-BAP y AIA (tabla 1), según resultados obtenidos en otros clones de plátanos y bananos.
Determinación del volumen de medio de cultivo en el sistema de inmersión temporal
Para la realización de este experimento se empleó el mejor resultado del experimento anterior. Se evaluó el efecto de cuatro volúmenes de medio de cultivo (cantidad de nutrientes) por explantes: 20; 30; 40 y 60 ml. El volumen de medio de cultivo fue de 1000; 1500; 2000 y 3000 ml. Se emplearon las mismas condiciones del experimento anterior excepto la cantidad de nutrientes por explante.
Determinación de la densidad de explantes por frasco
A partir de los resultados obtenidos en el sistema de inmersión temporal con condiciones predeterminadas por las experiencias en el manejo de los mismos, se estudió la densidad de inóculo con el objetivo de mejorar las condiciones de cultivo, así como la calidad del proceso. Se evaluó la influencia de cuatro densidades de inóculo: 30,0; 50,0; 70,0 y 90,0 explantes por frasco y un volumen de medio de cultivo por batería de 1200 ml; 2000 ml; 2800 ml y 3600 ml en la producción de explantes, según resultados obtenidos en otros clones de plátanos y bananos. Para determinar la densidad de inóculo se utilizó el mejor resultado obtenido en el experimento anterior así como las condiciones experimentales.
En todos los experimentos las evaluaciones se realizaron a los 21 días de cultivo y se colocaron 50 brotes de yemas axilares por frasco de cultivo excepto en el experimento de densidad de explantes y se realizaron tres repeticiones por tratamiento y se evaluó:
- Coeficiente de multiplicación (unidades). Se determinó por el número de brotes finales con respecto al número de brotes iniciales.
- Altura de los brotes de yemas axilares (cm). Se realizó con una regla graduada y se midió desde la base del pseudotallo hasta la inserción de la primera hoja.
- Grado de oxidación según escala de Novak et al. (1994)
Grado 0: no hubo oxidación, coloración del explante de blanco-amarillo crema.
Grado 1: Incipiente coloración carmelita sin llegar a la necrosis del tejido.
Grado 2: 25% de tejido necrótico en la base del explante.
Grado 3: 50% de tejido necrótico en la base del explante.
Grado 4: 75% de tejido necrótico en la base del explante con penetración.
Grado 5: 100% de tejido necrótico en la base del explante con penetración y se necesitan cortes profundos para lograr que la asimilación de nutrientes sea efectiva. - Diámetro del pseudotallo de los brotes de yemas axilares (cm). Se realizó con el auxilio de una regla graduada y se midió el diámetro de la base del pseudotallo.
- Número de hojas de los brotes de yemas axilares (unidades). Se contaron las hojas que estaban abiertas.
Procesamiento estadístico
Con los criterios de estadística descriptiva se realizaron las tablas que expresan los resultados procesados con estadística inferencial paramétrica (análisis de varianza de clasificación simple). La comparación múltiple de media se realizó según Tukey cuando se encontró homogeneidad de varianza, (Lerch,1977). Se utilizó el paquete estadístico MSTAT-C de la Universidad de Micchigan (Bricker, 1993, citado por Guzmán y Castaño, 2002).
Resultados y Discusión
Efecto del tiempo y frecuencia de inmersión en el sistema de inmersión temporal
Efecto del tiempo de inmersión
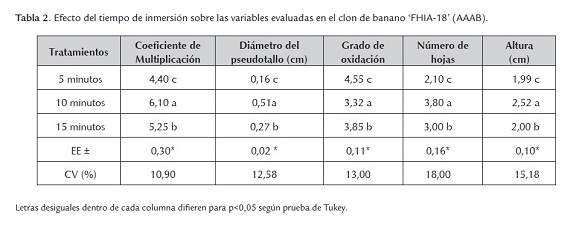
El mejor resultado se obtuvo al aplicar un tiempo de inmersión de 10 minutos (tabla 2) donde se obtienen los mejores resultados en todas las evaluaciones realizadas para el coeficiente de multiplicación, diámetro del pseudotallo, grado de oxidación, número de hojas y altura del explante con diferencias significativas respecto al resto.
El tiempo de inmersión es considerado un factor importante en la respuesta morfogenética del material vegetal a micropropagar. Al respecto, Escalona (1999) para el cultivo de la piña (Ananas comosus (L) Merr.) encontró que con un tiempo de inmersión de dos minutos/hora con una frecuencia de tres horas se logró los mayores incrementos en el coeficiente de multiplicación y por lo tanto se facilitó una mayor eficiencia en la asimilación de nutrientes por los explantes.
La duración del tiempo de inmersión se ha modificado en diferentes ocasiones en dependencia de la especia, cultivar y método de propagación que se emplee y ha sido de gran importancia dentro de las distintas especies. Berthouly et al. (1995) al evaluar el desarrollo de esquejes de Coffea arabica, observaron poca hiperhidricidad con 15 minutos de inmersión, mientras que con tiempos largos de inmersión está sintomatología apareció en gran medida en los tejidos.
Según Teisson et al. (1996) en el caso de Coffea canefora cuando se emplearon cuatro inmersiones al día de 15 minutos cada hora, las cuales se aplicaron también en Coffea arábica, hubo un alto porcentaje de hiperhidricidad, el cual se redujo cuando se cambiaron dos inmersiones de un minuto por día.
Dottin (2000) con el empleo de siete minutos de inmersión de los explantes obtuvo un elevado coeficiente de multiplicación (13,80) en el cultivo de la malanga (Xanthosoma sagittifolium (L) Schott) con respecto al clon de Malanga INIVITMC-2001 (10,45) en sistema de inmersión temporal.
Determinar el tiempo de inmersión en la multiplicación en SIT, es muy importante, ya que este determina la absorción de nutrientes por los brotes (Berthouly y Etienne, 2005).
Efecto de la frecuencia de inmersión
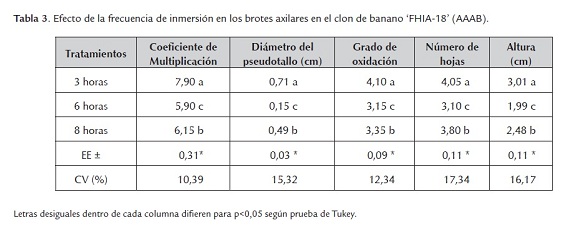
Al utilizar una frecuencia de 3 horas y 10 minutos se obtienen los máximos valores para el coeficiente de multiplicación, diámetro del pseudotallo, grado de oxidación, número de hojas y altura del explante, con diferencias significativas respecto al resto de los tratamientos sin la presencia de brotes hiperhidratados ni la presencia de multiyemas (tabla 3).
Colmenares y Jiménez (2003) en el banano 'Gran Enano' (AAA) con inmersiones de dos minutos cada cuatro horas obtuvieron un coeficiente de multiplicación de 7,5 y para veinte minutos cada cuatro horas un índice de multiplicación de 8,0 en frascos de 10,0 L.
La frecuencia y el tiempo de inmersión constituyen factores importantes en la respuesta morfogénica de las diferentes especies de plantas. En la multiplicación axilar de brotes de piña, se lograron coeficientes de multiplicación de 12,0 en seis semanas con el empleo de un tiempo y frecuencia de inmersión de dos minutos cada tres horas (Escalona, 1999).
Los tiempos de inmersión son cortos, por lo tanto los explantes están recubiertos de una película de medio de cultivo líquido y de esta forma se evita la desecación de los mismos. La resistencia a la difusión de gases es baja y existe una mínima ruptura de intercambio gaseoso entre los tejidos y la atmósfera interna del frasco de cultivo, por tal razón esta se renueva en intervalos regulares de tiempos (Etienne et al., 1997).
Cabrera et al. (2005) emplearon un tiempo de inmersión de diez minutos y una frecuencia de 6 horas y obtuvieron 4,7 microtubérculos de ñame en SIT en el clon Pacala Duclos (Dioscorea alata (L) Point) en frascos de inmersión temporal de cinco litros.
Castro (2001) señaló que durante la fase de multiplicación de brotes de Eucaliptus grandis, al emplear una frecuencia de 24 horas con una duración de tres minutos el número de brotes por explantes fue significativamente superior al obtenido con un minuto de inmersión, sin embargo, en ambos se observó la presencia de brotes hiperhidratados.
Los efectos del tiempo de inmersión en la respuesta morgenética de los tejidos deben estar relacionados con las relaciones hídricas y el intercambio gaseoso que se logra en está formación de cultivo según Escalona (1999).
Dottin (2000) en el cultivo de la malanga (Xanthosoma sagittifolium (L) Schott) al utilizar una frecuencia de cuatro horas obtuvo un coeficiente de multiplicación (14,50) con el empleo del sistema de inmersión temporal ''Nalgene Co''.
Quiala et al. (2006) en el cultivo de la caña santa (Cymbopogon citratus (D.C.) Staff) obtuvieron los mejores resultados para el peso fresco y el coeficiente de multiplicación al utilizar seis inmersiones por día (cada cuatro horas) en sistemas de inmersión temporal de un litro de capacidad.
Los tiempos y frecuencias de inmersión que se ensayaron según las posibilidades de automatización, demostraron que con diez minutos de inmersión y tres horas empleados en los experimentos, se obtuvieron los mejores resultados en cuanto a la producción y calidad de los brotes.
Influencia de diferentes combinaciones de reguladores del crecimiento
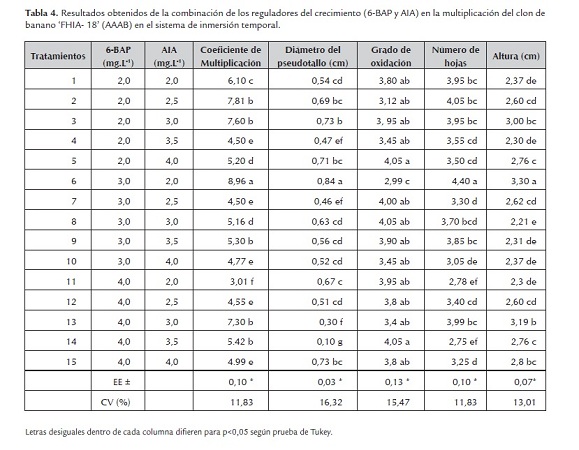
A partir de los resultados obtenidos el tratamiento seis mostró la mejor respuesta en cuanto a las variables estudiadas para el diámetro del pseudotallo, grado de oxidación, número de hojas activas y altura del explante con diferencias significativas con respecto a los restantes (tabla 4).
El 6-BAP ha sido hasta el momento, la citoquinina más empleada y de mayor efectividad para la micropropagación de varias especies vegetales de interés económico como la Teca (Tectona Grandis Linn. F) y el guayabo (Psidium guajava L.), (Daquinta et al., 2000 y Vilchez, 2001).
Según Colmenares y Jiménez (2003) para bananos del cv. 'Gran Enano' (AAA) del subgrupo Cavendish multiplicados en 2,5 mg.L-1 de 6-BAP, señalaron un índice de multiplicación de 2,1 para el medio semisólido y 5,2 en sistema de inmersión temporal en 10 subcultivos.
Estos resultados coinciden con lo sugerido por Torres (1995), quien planteó que en el cultivo de tejidos las citoquininas son necesarias para la división celular en las plantas y en ausencia de ellas, la metafase de la mitosis, es más prolongada. Dottin (2000) al emplear 1,0 y 3,0 mg.L-1 de 6-BAP y 1,2 mg.L-1 de AIA obtuvo los máximos valores en el cultivo de la malanga (Xanthosoma sagittifolium (L) Schott) en frascos de sistemas de inmersión temporal.
El incremento en el coeficiente de multiplicación se debe principalmente a los niveles de citoquininas endógenas (3,5 mg.L-1 de 6-BAP y 1.8 mg.L-1 de AIA. Los patrones del metabolismo del 6-BAP varían considerablemente entre especies. Este regulador se acumula solo o en forma de sus conjugadas, y por lo tanto estimula la formación de brotes (Glendening y Sjolund, 1996; Kane y Philman., 1996 y Jiménez, 1997).
En los protocolos de propagación los explantes se mantienen con los reguladores del crecimiento durante todo el subcultivo, sin embargo, distintos autores han llegado a la conclusión de que la absorción de estás sustancias en la fase de multiplicación se produce mayoritariamente en las primeras horas de cultivo (Feito et al., 1995 y Moncaleán et al., 1999), lo que condiciona totalmente la respuesta morfogénica de los cultivos es mediante la alteración del balance endógeno de los reguladores del crecimiento (Dantas et al., 1997).
Los explantes propagados con el tratamiento dos mostraron características superiores a las producidas con el resto de los demás tratamientos obteniéndose un coeficiente de multiplicación de 7,81.
Determinación del volumen de medio de cultivo en el sistema de inmersión temporal
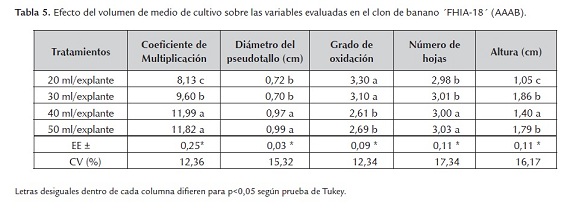
El volumen de medio de cultivo tuvo influencias en el sistema de inmersión temporal "Nalgene Co'' de 10,0 L de volumen total con la adición de 50 explantes sobre el coeficiente de multiplicación de los brotes. El mayor valor se alcanzó cuando se empleó una relación de 40 ml de medio de cultivo (11,99) por explante sin diferencias significativas con el tratamiento de 50 ml por explante y sí con los tratamientos de 20 y 30 ml por explante.
Los tratamientos de 40 y 50 ml/explante presentaron el comportamiento más favorable (tabla 5), sin diferencias significativas entre ellos en cuanto a las variables diámetro del pseudotallo, grado de oxidación y número de hojas activas, no siendo así en cuanto a la variable altura del explante, donde si existe diferencia significativa del tratamiento (40 ml/explante), con los demás.
Con los volúmenes de medio de cultivo (40 y 50 ml/explante) se obtuvieron los mejores resultados en la multiplicación de los brotes de yemas axilares, debido a que se garantizó durante esta fase de cultivo un adecuado equilibrio entre las necesidades de nutrientes de los brotes de yemas axilares y la disponibilidad de los mismos en el medio de cultivo, en comparación con los volúmenes de 20 y 30 ml/explante de medio de cultivo. Lo que demuestra la necesidad de ajustar el volumen de medio de cultivo por explantes cultivados en el SIT, sin renovación del medio de cultivo (Berthouly y Etienne, 2005).
Además cuando se utilizaron 40 y 50 ml/explante de medio de cultivo por brote se logró una adecuada renovación de la atmósfera interna en el recipiente de cultivo a diferencia del empleo de los volúmenes de 20 y 30 ml/explante de medio cultivo, en el cual se pudo haber limitado la renovación de la atmósfera interna. El volumen de medio de cultivo por explante utilizado en los frasco de cultivo de inmersión temporal es uno de los principales factores que se debe tener en consideración para mejorar la eficiencia del empleo del SIT (Berthouly y Etienne, 2005).
El contenido de nutrientes en el medio de cultivo puede variar producto de cambios en la concentración o por cambios en el volumen de medio de cultivo a una concentración fija de nutrientes (Kozai et al., 1995).
Según autores como Simonton et al. (1995) y Teisson y Alvard (1995) emplearon volúmenes de 5000 y 250 ml para frascos de 10,0 L y Erlenmeyer de 500 ml de medio de cultivo, respectivamente.
El efecto del volumen de medio de cultivo en los sistemas de inmersión temporal debe estar relacionado con la cantidad de nutrientes, así como con la dilución de determinados compuestos que excretan los brotes en el cultivo in vitro. En la inmersión temporal por el nivel de dilución que alcanzan en el volumen de medio de cultivo, parecen ser favorables, según los niveles de proliferación y de la calidad de los brotes antes analizados (Kozait et al., 1995).
En la nutrición in vitro se establece un equilibrio entre la asimilación de nutrientes por los explantes y la excreción de compuestos al medio de cultivo provenientes de estos, este estado de equilibrio influye en la respuesta morfogenética (Williams, 1993 y 1995).
Ziv (2005) al utilizar 1250 ml de medio de cultivo en biorreactores de 2500 ml de volumen total obtuvo un coeficiente de multiplicación (15,10) con la adición de 20 explantes de bananos.
Escalona et al. (1999) en el cultivo de la piña (Ananas comosus (L) Merr.) en sistema de inmersión temporal (frascos "Nalgene Co'' de 10 litros de volumen total) emplearon 200 ml de medio de cultivo por explante con la adición de 2000 ml por sistema y 5 explantes por cada litro de medio de cultivo, de modo que volúmenes por encima afectaron la asimilación de nutrientes, con la consiguiente disminución de los coeficientes de multiplicación. Al respecto, Lorenzo et al. (1998) estudiaron el efecto del volumen de medio de cultivo por explante en la formación de brotes de caña de azúcar (Saccharum officinarum) en sistemas de inmersión temporal, encontrando una mayor tasa de multiplicación con 50 ml por explante. Estos autores señalaron que al aumentar la cantidad de medio de cultivo por explante se incrementa la disponibilidad de nutrientes; sin embargo, elevadas cantidades de medio de cultivo disminuyeron el número de brotes y esto posiblemente se debe a que la secreción de algunas sustancias en el medio de cultivo promueve la formación de nuevos brotes.
Según Castro y González (2002) para lograr un mismo desarrollo en las técnicas de cultivo de tejidos es necesario proveer a las plantas con suficientes cantidades de nutrientes esenciales (incluyendo la sacarosa y carbono como fuentes de energía bajo condiciones heterotróficas y mesotróficas), de tal manera que los nutrientes no sean un factor limitante para la multiplicación en el desarrollo de las plantas. De acuerdo con los resultados obtenidos (Eucalyptus grandis Hill ex Maiden) demostraron que con el empleo de un volumen de 500 mL de medio de cultivo con 9 explantes se logró un coeficiente de multiplicación de 10,5 brotes y la mejor calidad de los brotes en términos de una mayor producción de masa seca. Es importante notar que en la medida que se incrementó el volumen de medio de cultivo se obtuvo un mayor coeficiente de multiplicación, sin embargo, la calidad de los brotes constituyó un factor importante, el cual permitió definir un volumen adecuado de medio de cultivo, que minimiza el estrés hídrico en los brotes, particularmente en las primeras etapas del cultivo.
Basail et al. (2003) demostraron que para el clon de yuca 'CMC-40' (Manihot esculenta Crantz (L.), un volumen de medio de cultivo de 40 ml por explante, en frascos de sistema de inmersión temporal incrementó el coeficiente de multiplicación a 6,5 por cada explante inoculado.
Determinación de la densidad de explantes por frasco
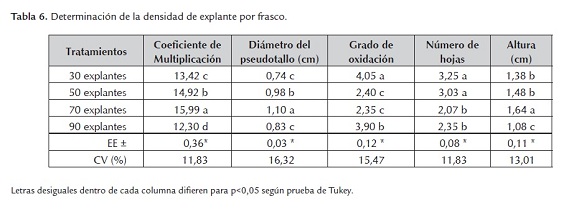
El mejor resultado se obtuvo con 70 explantes por frasco de 10 litros de capacidad (tabla 6), con los mayores valores numéricos en cuanto al coeficiente de multiplicación, diámetro del pseudotallo y altura del explante con diferencias significativas con todos los demás tratamientos. En cuanto al grado de oxidación se obtiene el menor valor sin diferencias significativas con el tratamiento dos (50 explantes) al igual que con el número de hojas activas sin diferencias con el tratamiento cuatro (90 explantes) pero sí con el resto.
Teniendo en cuenta estos resultados se seleccionó la densidad de 70 explantes por frasco de cultivo, pues hay una mayor asimilación de los nutrientes que componen el medio de cultivo y por tanto un mejor aprovechamiento de los frascos de cultivo de 10,0 L de capacidad (figura 1).
En el cultivar 'Gran Enano' (AAA), empleando los sistemas de inmersión temporal de 5,0 litros de capacidad, Albany (2001) señala que la variable que determina un incremento en el coeficiente de multiplicación, peso de los brotes, peso final y peso útil, es la densidad de inóculo, obteniendo los mejores resultados con 25 explantes.
Según Posada et al. (2003) los mejores resultados para la multiplicación de los cultivares de banano 'FHIA-01' y 'FHIA-18' se alcanzaron con la densidad de cinco explantes y una frecuencia de inmersión de tres veces durante un minuto cada 24 horas, en frascos de inmersión temporal (sistema RITA).
Orellana (1998), puntualizó la necesidad de valorar experimentalmente la densidad de explantes por frasco porque este parámetro pudiera ocasionar deficiencias en el sistema; ya que una baja densidad ocasionaría pérdidas de espacio y de medio de cultivo, y con ello la subutilización de los recipientes; mientras que una alta densidad propicia un crecimiento limitado de los brotes e insuficiente proliferación con subcultivos más frecuentes.
de Feria et al. (1998), recomendaron para los recipientes de los sistemas de inmersión temporal una densidad de 40 brotes de caña de azúcar (Saccharum officinarum), la cual les permitió obtener mayor coeficiente de multiplicación (10,92) y un peso promedio de 5,74 mg por brote.
Basail et al. (2003) obtuvieron que para el cultivo de la yuca (CMC-40) (Manihot esculenta Crantz (L.) en frasco de sistema de inmersión temporal de cinco litros de volumen total utilizar una densidad de 40 explantes por sistema.
De forma general los experimentos desarrollados permitieron establecer una metodología que incrementa de forma significativa el coeficiente de multiplicación en el clon de banano 'FHIA-18' (AAAB), basada en la inmersión temporal de los explantes. La superioridad del nuevo método entre otros aspectos está dada por el empleo del medio de cultivo en estado líquido, que a diferencia del medio de cultivo en estado semisólido, facilita la asimilación de los nutrientes por los explantes. Además, en estos sistemas los explantes no están constantemente en contacto con el medio de cultivo, sino, sólo a determinada frecuencia y un período corto de tiempo que permite la renovación constante de la atmósfera interna de los frascos y evita la acumulación de gases nocivos como el etileno, así como, facilita la regulación de la concentración de CO2 y mejora la oxigenación de los tejidos. Los explantes retienen una película del medio de cultivo que evita la desecación e incrementa la disponibilidad y asimilación de los nutrientes, lo cual se traduce en un crecimiento más vigoroso y mejor desarrollo. Además, estos aspectos positivos del SIT, favorecen un incremento en la fotosíntesis de las plantas (Escalona et al., 1999; Lemos et al., 2001 y Castro et al., 2001).
Conclusiones
Se logró multiplicar el clon de banano 'FHIA-18' (AAAB) en sistema de inmersión temporal con un tiempo de inmersión de 10 minutos y una frecuencia de inmersión cada 3 horas en el medio basal MS, suplementado con 3,0 mg.L-1 de 6-BAP; 2,0 mg.L-1 de AIA con 40 ml de medio de cultivo por explante y 70 explantes por frasco de cultivo donde se obtuvieron los mejores resultados. El coeficiente de multiplicación y la calidad del material vegetal permitirán su introducción en la producción en biofábricas.
Referencias bibliográficas
1 Alvard, D., Cote, F., Teisson, C. 1993. Comparison of methods of liquids medium culture for banana micropropagation. Effects of temporary inmersion of explants. Plant Cell Tissue and Organ Culture 2: 55-61. [ Links ]
2 Aitken-Christie, J., Davies, H.E., Kubota, C., Kosai, T. 1995. Automation in Plant Tissue Culture. General introduction overview: Automation and environment control in Plant Tissue Culture Kluwer, Academic Publisher, Dordrech, pp.1-19. [ Links ]
3 Albany, N. 2001. Efectos de retardantes del crecimiento en la micropropagación de bananos en medios de cultivo líquidos en agitador orbital y sistemas de inmersión temporal. Tesis para optar por el Grado Científico de Master en Biotecnología Vegetal. Instituto de Biotecnología de las Plantas. Santa Clara, pp. 34-36. [ Links ]
4 Basail, M., Mederos, V., Martínez, M., López, J., Cabrera, M., Santos, A., Ventura, J., García, M., Rayas, A., Pons, C., Bauta, M., Álvarez, M., García, J. 2003. Efecto de la densidad de explantes y el volumen de medio de cultivo en la micropropagación de la yuca en sistema de inmersión temporal. Biotecnología Vegetal. 3(2): 93-96. [ Links ]
5 Berthouly, M., Dufor, M., Alvard, D., Carasco, C., Alemano, L., Teisson, C. 1995. Coffee micropropagation in a liquid médium using the temporary immersion technique. In: ASIC Publishers (Eds) 16th International Scientific Colloquium on Coffee, Kyoto, Japon, pp. 514-519. [ Links ]
6 Berthouly, M., Etienne, H. 2005. Temporary immersion systems: a new concept for use liquid medium in mass propagation. En: Hvoslef-Eide A. K. y Preil W. (Ed). Liquid Culture Systems or in vitro Plant Propagation, pp. 165-195. [ Links ]
7 Cabrera, M., Gómez, R., Basail, M., Santos, A., Mederos, V., López, J., Rayas, A., García, M., Ventura, J. 2005. Production of yam microtubers using a temporary immersion system. Plant Cell, Tissue and Organ Culture 83(1): 103-107. [ Links ]
8 Castro, D. 2001. Propagación mixotrófica de Eucalipto grandis Hill ex Maide en biorreactores de inmersión temporal. Tesis para aspirar al Grado Científico de Doctor en Ciencias Agrícolas. Universidad de Ciego de Ávila, Centro de Bioplantas. Cuba. [ Links ]
9 Castro, D., Díaz, J., Montoya, N. 2001. Clonal propagation of bananas by biorreactors of temporary immersion. In : Acrobat. Memorias XV Reunión: Realizada en Cartagena de Indias, Colombia. [ Links ]
10 Castro, D. R., González, J. 2002. Eucalyptus (Eucalyptus grandis Hill ex Maiden) micropropagation in a temporary immersion system. Agricultura sostenible, 62(1): 68-78. Colombia. [ Links ]
11 Colmenares, M., Jiménez, C. 2003. Multiplicación in vitro Musa spp mediante el sistema de inmersión temporal. www.revfacagronluz.org.ve. Venezuela, pp. 468-477. Consultada el 22 de Julio/2011 [ Links ]
12 Dantas, K. A., Cañal, M., Centeno, M., Feito, I., Fernández, B. 1997. Endogenous plant growth regulatores in carnation Tissue Cultures Ander different condition of ventilation, Plant Cell Reports 22: 169-174. [ Links ]
13 Daquinta, M., Ramos L., Lezcano, Y. 2000. Algunos elementos en la micropropagación de la Teca. Revista de Biotecnología Vegetal, 1: 39-44. [ Links ]
14 De Feria, M., Jiménez, E., Chávez, M. 1998. Influencia de la densidad de inóculo y la renovación del medio de cultivo en la propagación in vitro de la caña de azúcar (Saccharum officinarum) utilizando sistema de inmersión temporal. III Encuentro Latinoaméricano de Biotecnología Vegetal. REBIO'98. 1-5 Junio, La Habana, Cuba. Libro de Resúmenes, 42 p. [ Links ]
15 Dottin, M. 2000. Propagación in vitro de la malanga (Xanthosoma sagittifolium (L) Schoott). Tesis presentada para optar por el grado científico de Doctor en Ciencias Agrícolas. Universidad Central de Las Villas. Santa Clara, Cuba. [ Links ]
16 Escalona, M. 1999. Tesis para optar por el grado científico de Doctor en Ciencias Agrícolas, Universidad de Ciego de Ávila, Centro de Bioplantas de Ciego de Ávila, 94p. [ Links ]
17 Escalona, M., Cid, M., Lezcano, Y., Capote, I., Yánez, E., González, J. 1999. Propagación de la piña (Ananas comosus (L.) Merr.) en biorreactores de inmersión temporal. Efecto de la frecuencia de inmersión y el paclobutrazol. BioVeg'99. Ciego de Avila, Cuba. Libro de resúmenes, 28p. [ Links ]
18 Etienne, H. P., Lartaud, M., Michauxferriere, N., Carron, M., Berthouly, M., Teisson, C. 1997. Improvement of somatic embryogenesis in Hevea brasiliensis (Mull Aug) using the temporary immersion tecnique. In vitro Cell Dev. Biol. Plant, 33(2): 81-89. [ Links ]
19 Feito, I., Centeno, A., Sánchez, M., Tamés, R., Fernández, B. 1995. Effect of applied benziladenine on endogenous cytokinin content during the early stages of bud development of Kiwifruit, Physiol. Plant, 95: 241-246. [ Links ]
20 Glendening, T., Sjolund, T. 1996. In vitro propagation of Kohlbifrom leaf explants. Hort Science, 23: 772-775. [ Links ]
21 Guzmán, O. A., Castaño, J. 2002. Reconocimiento de nemátodos fitopatógenos en plátanos 'Dominico hartón' (Musa AAB, Simmonds), 'Africa', 'FHIA-20' y 'FHIA-21' en Colombia. InfoMusa, 11 (2): 34-35. [ Links ]
22 Jiménez, G. E. 1997. Curso teórico-técnico de propagación masiva de plantas. Santa Clara, pp. 25-30. [ Links ]
23 Jiménez, E., Pérez N., de Feria, M., Barbón, R., Capote, A., Chávez, M., Quila, E., Pérez, J. C. 1999. Improved production of patato microtubersusing a temporary inmersión system. Plant Cell, Tissue and Organ Culture 59: 19-23. [ Links ]
24 Kane, M. E., Philman, N. L. 1996. A micropropagation protocol using Fraser photinia for mutation induction and new cultivar selection. Proc Fla State Hortic Soc 100: 334-337. [ Links ]
25 Kitto, J. M. 1997. Commercial Micropropagation HorScience, 32(6): 1-3. [ Links ]
26 Kozait, T., Smith, M., Aitken-Christie, J., Kozai, T., Smith, M. A. 1995. Enviromental control in Plant Tissue Culture. General introduction. Automation and environmental control in Plant Tissue Culture. Kluwer Academic Publishers, Dordrecht pp. 301-319. [ Links ]
27 Lemos, O. F., Ferreira, M. S., Alentar, L. M., Oliveira, J. G., Magalha, V. S. 2001. Micropropagación de clones de banana cv. Terra en Biorreactor de inmersión temporal. Rev. Bras. Frutic. 23( 3): 482-487. Brasil. [ Links ]
28 Lerch, G. 1977. La experimentación en las Ciencias Biológicas y Agrícolas. Ed. Científica y Técnica. La Habana, 288 p. [ Links ]
29 López, J., Ventura, J.C., Pino, J.A. 1998. Genetic Improvement of Musa spp. by in vitro mutational plant breeding. Report of the Second Research Co-ordination Meeting of FAO/IAEA/BADC Co-ordinate Research Project, held in Kuala Lumpur, Malaysia, 13-17 October, 1997.IAEA, Vienna, Austria, pp. 63-64. [ Links ]
30 Lorenzo, J., González, B., Escalona, M., Teisson, C., Espinosa, P., Borroto, C. 1998. Sugarcane shoot formation in an improved temporary immersion system. Plant Cell Tissue and Organ Culture 54: 197-200. [ Links ]
31 Moncaleán, P., Cañal, J., Feito, I., Rodríguez, A. 1999. Cytokinins and mineral nutrition in shorts of Actividia deliciosa culured in vitro, J. Plants Physiol 2: 12-14. [ Links ]
32 Montano, N., Reynaldo, D., López, J., Torres, M., Otero, E., Gutiérrez, V., Martínez, M. 2004. Nueva metodología para la implantación in vitro del plátano y el banano en biofábricas. XVI Forum de Ciencia y Técnica Municipal. Santo Domingo, Villa Clara, pp. 2-8. [ Links ]
33 Novak, F., Afza, R., Duren, M. 1994. Fiel evaluation of tissue-culture bananas in grade oxidation. Australian Journal of Experimental Agriculture, 30: 569-574. [ Links ]
34 Orellana, P. 2009. Metodología para la micropropagación in vitro de clones de Musa spp. Curso teórico-técnico de propagación masiva de plantas. Santa Clara, pp. 46-57 [ Links ]
35 Orellana, P. 1998. Introducción a la propagación masiva. En: Pérez, J. N. 1998. Propagación y mejora genética de plantas por Biotecnología (Eds), Instituto de Biotecnología de las plantas, Universidad Central de Las Villas, J. N. Pérez Ponce (Ed.), Santa Clara, Cuba, pp. 83-295. [ Links ]
36 Posada, P. L., Gómez, R., Reyes, M., Álvarez, L. 2003. Empleo de los sistemas de inmersión temporal (RITA) en la propagación de plantas vía organogénesis en caña de azúcar y bananos. Biotecnología Vegetal, 3(1): 6-8. [ Links ]
37 Quiala, E., Barbón, R., Jiménez, E., De Feria, M., Chávez, M., Capote, A., Pérez, N. 2006. Biomass production of Cymbopogon citratus (D.C.) Stapf., a medicinal plant, in temporary immersion systems. In vitro Cell. Dev. Biol. Plant 42: 298-300. [ Links ]
38 Rodríguez, S., Folgueras, M., Medero, V. 2000. La Yuca en Cuba. Continente Yuquero. Informativo del Consorcio Latinoamericano y del Caribe de Apoyo a la Investigación y Desarrollo de la Yuca, Clayuca. Colombia. No 2. Agosto, 5 p. [ Links ]
39 Simonton, W., Robacker, C., Krueger, S. 1995. Micropropagation using medium liquid. Plant Cell Culture. Volume 3, Chapter 21 pp. 23-28. [ Links ]
40 Teisson, C., Alvard, D. 1995. A new concept of plant in vitro cultivation, in temporary immersion. IN: M. Terzi.; R. Ceea; A. falavigna (Eds). Current Tissues in Plant Molecule and Cellular Biology. Kluwer Academic Publishers pp. 95-105. [ Links ]
41 Teisson, C., Alvard, D., Berthouly, B., Cote, F., Escalant, J., Etienne, H., Lartaud, M. 1996. Simple apparatus to perform Plant Tissue Culture by temporary immersion. Acta Horticulturae, 440: 521-526. [ Links ]
42 Torres, G. S. 1995. Fisiología Vegetal. Editorial, Pueblo y Educación. Playa. Cuidad de La Habana. pp. 19-37. [ Links ]
43 Ventura, J., Medero, V., López, J., García, M., Rodríguez, S., García, J., Reynaldo, D. 1998. Manejo de los explantes en inmersion temporal, clon de Plátano 'FHIA-18'. III Encuentro Latinoamericano de Biotecnología Vegetal. Palacios de Convenciones de La Habana. FAO. Cuba, 64 p. [ Links ]
44 Vilchez, J. A. 2001. Embriogénesis somática y regeneración de plantas de guayabo (Psidium guajavo L. ) cv. Enana Roja Cubana EEA. Tesis de Maestría. Instituto de Biotecnología de las Plantas, 60 p. [ Links ]
45 Williams, R. R. 1993. Mineral nutrition in vitro. A mechanistic approach. Aust. J. Bot. 41: 237-251. [ Links ]
46 Williams, R.R. 1995. The chemical microenviroment In: Jaitken-Christie., T. Kozait., M. A. L. Smith (Eds). Automation and Environmental control in Plant Tissue Culture. Kluwer Academic Publishers pp. 405- 438. [ Links ]
47 Ziv, M. 2005. Simple bioreactor for mass propagation of plant. Plant Cell, Tissue and Organ Culture 81: 277-285. [ Links ]