Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.14 no.1 Bogotá Jan./June 2012
ARTÍCULO DE INVESTIGACIÓN
Biooxidación de concentrados de arsenopirita por Acidithiobacillus ferrooxidans en erlenmeyer agitados
Biooxidation of arsenopyrite concentrates by Acidithiobacillus ferrooxidans in shake flasks
Juan David Ospina 1, Erica Mejía Restrepo 2, Laura Osorno Bedoya 3, Marco Antonio Márquez 4, Alvaro Luis Morales5
1Grupo de Investigación e Innovación en Medio Ambiente. Institución Universitaria Pascual Bravo - AA 6564. Calle 73 No. 73A-226. Ed. Administrativo, segundo piso. Medellín, Colombia, móvil (0754) 3014486299, Fax (0754) 4480520, e-mail juan.ospina@pascualbravo.edu.co
2 Grupo de Investigación e Innovación en Medio Ambiente. Institución Universitaria Pascual Bravo - AA 6564. erika.mejia@pascualbravo.edu.co
3 Grupo de Investigación e Innovación en Medio Ambiente. Institución Universitaria Pascual Bravo - AA 6564. laura.osorno@pascualbravo.edu.co
4 Grupo de Mineralogía Aplicada y Bioprocesos, Universidad Nacional de Colombia, Medellín AA 1027. mmarquez@unal.edu.co
5 Grupo de Estado Sólido, Sede de Investigación Universitaria, Universidad de Antioquia, AA 1226. amoral@fisica.udea.edu.co
Recibido: agosto 03 de 2011 Aprobado: junio 29 de 2012
Resumen
Se evaluó el proceso de biooxidación de concentrados de arsenopirita por A. ferrooxidans ATCC 23270, previa adaptación de los microorganismos al mineral y dos tamaños de partícula, pasante malla Tyler 200 (~75μm) y 325 (~45μm). También, se determinó el grado de concentración del mineral mediante DRX y MOLPP/LR, bajo norma ASTM D 2799 de 2009. Los microorganismos fueron adaptados mediante disminución gradual, en etapas sucesivas, de sulfato ferroso y posterior aumento en el contenido de arsenopirita. Finalmente, se llevó a cabo el proceso de biooxidación del mineral sin adición de Fe2+. Después de treinta días de proceso, la disolución de arsénico para la malla Tyler 200 fue de 7550 mgL-1 (18,7%) y para la malla Tyler 325 fue de 2850 mgL-1 (7,1%). Por otra parte, la curva de crecimiento bacteriano mostró que entre los días 6 y 21 de proceso la población bacteriana promedio fue de 1,70x108 cel.mL-1 y de 8,00x107 cel.mL-1 para las mallas Tyler 200 y 325, respectivamente.
Por lo tanto, el tamaño de partícula jugó un papel fundamental en la cinética de adaptación de los microorganismos, sugiriendo que a menor tamaño del sustrato empleado mayor dificultad se le presenta al microorganismo para oxidar el mineral.
Palabras clave: arsénico, lixiviación, quimiolitótrofos, ATP.
Abstract
Arsenopyrite biooxidation process was evaluated with A. ferrooxidans ATCC 23270. The microorganisms were previously adapted to mineral and two different Tyler mesh sizes, 200 (~75μm) and 325 (~45μm). Also, the mineral concentration was made by DRX and MOLPP/LR under ASTM D 2799. The microorganisms were adapted through gradual decreasing of ferrous sulphate in successive state and subsequent arsenopyrite concentration increase. Finally, biooxidation process was carried out without Fe2+. After thirty days of process, Arsenic bioleaching was 7550 mgL-1(18,7%) and 2850 mgL-1 (7,1%) for the 200 and 325 Tyler meshes, respectively.
On the other hand, bacterial growth curve showed, between 6 and 21 days of process that the average bacterial population was 1,70x108 cel.mL-1 y de 8,00x107 cel.mL-1 for 200 and 325 Tyler mesh respectively. For this reason, the particle size played an important role in the adaption kinetics of microorganism. The results showed that the microorganism oxide the larger particle size of the mineral easier.
Key words: arsenic, lixiviation, chemolithoautotrophic, ATP.
Introducción
La arsenopirita (FeAsS) es la fuente mineral de arsénico más común en la superficie terrestre. Se puede encontrar en una variedad de sistemas tales como depósitos magmáticos, hidrotermales y pórfidos, entre otros. Es por esto que es comúnmente asociada a la aparición de oro, generando su amplia explotación y posterior descarga como desechos sólidos en los procesos mineros (Corkhill y Vaughan, 2009).
La biooxidación es un método utilizado en el pre-tratamiento oxidante de menas refractarias (Gilbert et al., 1988; Bozdemir et al., 1997; Rawlings et al., 1999; Daoud y Karamanev, 2006; Corkhill y Vaughan, 2009), algunas veces como una alternativa a los procesos de calcinación y oxidación por presión (Neale et al., 1991) o en la viabilización para la explotación de menas de bajo tenor (Brierley y Luinstra, 1993). La capacidad de las bacterias para oxidar sulfuros metálicos está dada por su condición quimiolitótrofa, es decir, la obtención de su fuente de energía de compuestos inorgánicos, por lo tanto, ellas crecen a expensas de la liberación u obtención de electrones a partir de la oxidación de minerales, proceso que se aprovecha en la minería aurífera para la oxidación de especies minerales, permitiendo así la liberación del oro, ocluido ó en forma de solución sólida, en la estructura de algunos minerales. Tornándolo disponible para los procesos subsecuentes, como la lixiviación con cianuro (Gilbert et al., 1988; Neale et al., 1991; Brierley y Luinstra, 1993; Nordstrom y Southam, 1997).
Dentro de los microorganismos más importantes en los procesos biohidrometalúrgicos esta Acidithiobacillus ferrooxidans, bacteria gram-negativa, que presenta forma de bacilo, con diámetro entre 0.,4-0.8μm y longitud entre 0.9-2.0 μm (Rossi, 1990). Hay reportes donde se sugiere que la exposición de éste tipo de microorganismos a ambientes ricos en sulfuros metálicos puede resultar en la disminución o inhibición de la actividad metabólica de éstos. Las razones para dichas aseveraciones han sido diversas; entre las principales se encuentran la reducción de la cantidad de oxígeno disuelto, daño a la pared celular como resultado de la fricción entre las partículas minerales y los microorganismos, y al efecto nocivo de los iones metálicos como el As3+, As5+ y Fe3+, entre otros (Gomez et al., 1999; Akcil et al., 2007; Mousavi et al., 2007; Marhual et al., 2008). Sin embargo, A. ferrooxidans puede ser adaptado para incrementar su tolerancia a estos ambientes y disminuir los efectos inhibitorios; mejorando notablemente los procesos de beneficio mineral (Mason y Rice, 2002; Xia et al., 2008a,b).
Uno de los principales factores a tener en cuenta en procesos de biooxidación son las altas concentraciones de arsénico provenientes de la disolución de la arsenopirita, responsables en gran medida de la disminución de la actividad bacteriana por la interferencia en el proceso de formación de ATP, debido a la formación de un complejo ADP-arsénico inestable, generando la inhibición en la velocidad de crecimiento (Harvey y Crundwell, 1996). Tuovinen et al. (1971), encontraron que para A. ferrooxidans el arsénico es tóxico entre 50 y 100 mg.L-1. Braddock et al. (1984), determinaron que el As3+ no puede ser oxidado, en presencia de A. ferrooxidans, hasta As5+ y en etapas sucesivas de crecimiento, con concentraciones entre 97.4 y 200 mg.L-1 de As3+, no se observaron variaciones en las velocidades de crecimiento. Collinet y Morin (1990), determinaron que la velocidad de crecimiento de A. ferrooxidans se ve inhibida a concentra-ciones de 5000 mg.L-1 de As3+ y 40000 mg.L-1 de As5+. Barret et al. (1993), encontraron que concentraciones de As3+ cercanas a 2248 mg.L-1 limitaba el crecimiento de microorganismos mesófilos y concentraciones cercanas a 6743 mg.L-1 de As3+ resultaba ser nocivo. Attia y Zeky (1995), trabajando con minerales refractarios, principalmente pirita y arsenopirita, previa adaptación de A. ferrooxidans sobre el mineral, encontraron que el proceso de adaptación, previo al proceso de biooxidación, aumenta la velocidad de lixiviación hasta cuatro órdenes de magnitud con relación a los microorganismos sin adaptación en el proceso de disolución. Shahverdi et al. (2001) y Xia et al. (2008b) también reportaron que la eficiencia en el proceso de disolu-ción de un concentrado pirítico por A. ferrooxidans, después de un proceso de adaptación, se ve favorecido. Datos reportados por Shi y Fang (2005), sobre A. ferrooxidans, previa adaptación sobre un concentrado de marmatita, muestran como la velocidad de disolución del mineral se ve favorecida comparada con los microorganismos sin adaptar.
La metodología comúnmente empleada en los procesos de adaptación de A. ferrooxidans a la presencia de iones metálicos pesados consiste en una serie de cultivos sucesivos en los cuales los microorganismos son crecidos progresivamente, incrementándose en el medio la concentración de iones metálicos pesados. El principal inconveniente de esta metodología es que no se sigue un protocolo determinado, siendo necesarios periodos de adaptación de hasta años en algunos casos (Brahmaprakash et al., 1988; Natarajan et al., 1994; Das et al., 1998). Durante estos procesos, las densidades de pulpa juegan un papel importante en el proceso de adaptación de microorganismos a los concentrados de arsenpirita, puros o en consorcios, aunque algunos investigadores no han testeado este parámetro en sus experimentos (Third et al., 2000; Sampson et al., 2005; Mousavi et al., 2006b; Mousavi et al., 2007; Zhen et al., 2009). Los intervalos pueden variar desde 1 hasta 5% W/V (Mason y Rice, 2002; Deveci et al., 2004; Shi et al., 2005, Shi et al., 2006; Astudillo y Acevedo, 2008).
Otro punto importante es determinar cuándo los microorganismos están adaptados a una determinada densidad de pulpa o concentración de iones metálicos pesados. En los trabajos antes mencionados, el criterio empleado para esto fue la velocidad de oxidación del hierro ferroso, cuando éste alcanzaba valores aproximados a los obtenidos en medios de cultivo libres de iones metálicos pesados, se consideraba que los microorganismos estaban adaptados. Algunos criterios diferentes empleados en los procesos de adaptación son los empleados por Xia et al. 2008b para A. ferrooxidans sobre un concentrado de calcopirita, el cual consistió en la medición de la concentración celular durante el proceso, considerando una buena población bacteriana cuando se tenía una concentración de 107 cel.mL-1. Astudillo y Acevedo (2008), para un proceso de biooxidación de un concentrado pirítico relacionaron la eficiencia en la adaptación y el proceso cuando la razón Fe3+/Fe2+ era más baja que uno.
De otro lado, aunque las investigaciones en el área han venido incrementándose (Olson et al., 2003; Rawlings, 2005), en Colombia existen pocos trabajos publicados en esta área. Cabe resaltar los trabajos de Pérez y Velásquez (1998), Duque y Noguera (2001), Muñoz, (2002), Ossa (2004), Ossa et al. (2005), Cardona y Márquez (2009), Mejía (2010) y Ospina (2010), y en el área de caracterización mineralógica de procesos los cuales contribuyen al entendimiento de los mecanismos de biooxidación los trabajos de Zapata et al. (2007), Márquez et al. (2006); Cardona y Márquez (2009), Mejía (2010) y Ospina (2010). Por lo tanto, el objetivo de este estudio fue evaluar el proceso de biooxidación de concentrados de arsenopirita por A. ferrooxidans ATCC 23270, previa adaptación de los microorganismos a concentrados del mineral para dos tamaños de partícula, pasante malla Tyler 200 (~75μm) y 325 (~45μm). Los microorganismos fueron adaptados mediante la disminución gradual, en etapas sucesivas, de sulfato ferroso y posterior aumento en el contenido de arsenopirita en solución, para finalmente realizar la biooxidación del mineral sin adición de Fe2+.
Materiales y métodos
Caracterización inicial del mineral
Las muestras de arsenopirita (Aspy) fueron obtenidas de la mina El Violín, en el municipio de Anorí, departamento de Antioquia. Posteriormente, fue necesario hacer un proceso de trituración y molienda con el objetivo de separar el mineral de interés de la ganga (cuarzo y otros sulfuros acompañantes como galena, esfalerita, entre otros) antes de las operaciones de concentración, incrementando la superficie específica de las partículas para garantizar dos distribuciones de tamaños de partícula: pasante malla Tyler 200 (~75μm) y 325 (~45μm). De ahora en adelante se emplearan las palabras malla Tyler 200 y malla Tyler 325 para referirse al mineral comprendido en esas dos distribuciones. El concentrado mineral, antes de ser sometido al proceso de biooxidación, fue esterilizado en autoclave a 18 psi por 20 minutos. La caracterización mineralógica inicial fue realizada mediante la técnica de conteo de puntos utilizando un microscopio óptico de luz plana polarizada, modo luz reflejada (MOLPP/LR), marca Leitz Laborolux® 11POL, con objetivos de aumento de 10X y 20X en aire y 32X y 50X de inmersión en aceite, según norma ASTM D 2799 de 2009, determinando la concentración volumétrica de los componentes acompañantes del sustrato de interés. Los análisis de difracción de rayos-X (DRX) se realizaron empleando un difractómetro Bruker D8ADVANCE® con una velocidad de barrido de 2° por minuto, modo continuo y radiación Cu Λ = 1.5406 Å, radiación generada 35kV y 30mA. Los espectros se analizaron por medio del software Diffrac Plus Eva, haciendo uso de la base de datos PDF 2.0
Microorganismos
La cepa de A. ferrooxidans ATCC 23270 fue usada a través de todo el estudio. Los microorganismos fueron cultivados en medio T&K a pH 1.8 (Tuovinen y Kelly, 1973; Fowler et al., 1999; Kelly y Wood, 2000).
Adaptación de microorganismos a concentrados de Aspy
Todos los experimentos se desarrollaron en erlenmeyer de 300 mL, conteniendo 80 mL de medio T&K (Tuovinen y Kelly, 1973; Fowler et al., 1999; Kelly y Wood, 2000) con 10% v/v de inoculo bacteriano con una concentración celular entre 107-108 cel.mL-1. Las bacterias fueron contadas en cámara de Neubaüer. El medio T&K presentó las siguientes proporciones de sales basales: (NH4)SO4: 0.5g.L-1; MgSO4.7H2O: 0.5g.L-1; K2HPO4: 0.5g.L-1, ajustando el pH a 1.8 con ácido sulfúrico (H2SO4); esta solución fue esterilizada en autoclave a 18 psi por 20 minutos. Adicionalmente, se preparó una solución de sulfato ferroso, FeSO4.7H2O al 33,33% p/v, la cual fue previamente esterilizada por filtración con membrana 0.2 μm. Todos los erlenmeyer se montaron en un agitador orbital a 180 rpm y 30±2°C. Durante los experimentos de adaptación, el medio T&K fue suplementado progresivamente con cantidades crecientes de con-centrados de arsenopirita y se fue disminuyendo, progresivamente, la cantidad de sulfato ferroso. Una vez que los cultivos presentaban una dinámica determinada, caracterizada por potenciales redox ~500 mV (vs Ag°/AgCl) y pH ~2, y era constante, se tomaba una muestra de éste inoculo y se pasaba a medio fresco con una cantidad menor de sulfato ferroso y una cantidad mayor de concentrado mineral. Controles estériles fueron conducidos bajo las mismas condiciones y todos los experimentos se hicieron por duplicado.
Ensayos de biooxidación
Posterior a la etapa de adaptación de A. ferrooxidans a los concentrados de Aspy, se realizaron los ensayos de biooxidación a nivel de laboratorio en un agitador orbital, usando erlenmeyer de 500 mL, utilizando un volumen final de 350 mL y un porcentaje de pulpa de 10% (p/v). El medio de cultivo empleado fue el T&K a pH 1.8. Para estos ensayos no se empleó sulfato ferroso. Todos los ensayos se hicieron por duplicado. Diariamente, in situ, se hicieron medidas de pH, con un equipo HACH HQ40d multi PHC30103, y potencial redox con un equipo Shot Handylab® 1 Pt 6880. La concentración de arsénico en la fracción líquida fue determinada por espectrofotometría de absorción atómica empleando un equipo marca AA Spectrometer S Series Thermo Electron Corporation®.
Resultados y discusión
Caracterización inicial del mineral
En la figura 1, se presentan las imágenes correspondientes al análisis petrográfico. Se pudo observar que los cristales muestran finas inclusiones de pirita (Py) y pirrotita (Po) y en muy pocos de los casos cuarzo (Qz) rellenando fracturas; el cuarzo también se observó en forma de pequeñas inclusiones y granos individuales. Los granos de Aspy se observaron totalmente angulosos y regulares, con formas romboedrales, diámetros máximos entre 1000 µm a 2000 µm y mínimos menores de 10 µm (medición antes del proceso de tamizaje). Se observaron algunas veces fragmentos de minerales de la ganga con inclusiones de Aspy, no expuestos o parcialmente expuestos. El grado de liberación de la arsenopirita fue alto (>90%) evidenciado por la observación pre-dominante de granos mono-mineralicos.
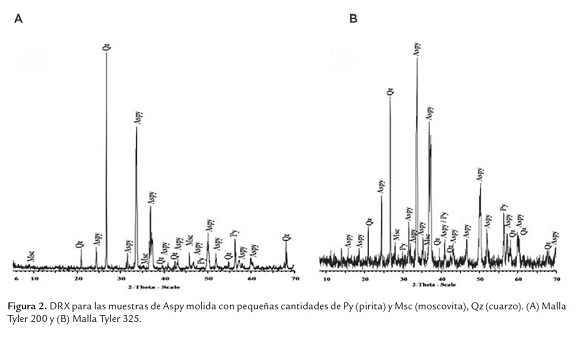
En la figura 2, se aprecian los difractogramas de rayos-X de las muestras molidas, pasante malla Tyler 200 y 325, como material de partida para el proceso de adaptación, fueron identificados como principales fases minerales cristalinas: Aspy (monoclínica); Po (hexagonal) y Py (cúbica), siendo la Aspy la fase cristalina predominante en ambos concentrados, pero en mayor proporción en la malla Tyler 325. Los minerales de la ganga identificados fueron: silicatos (principalmente cuarzo) en cantidades mayores, y moscovita en cantidades menores.
Adaptación de A. ferrooxidans sobre la malla Tyler 200
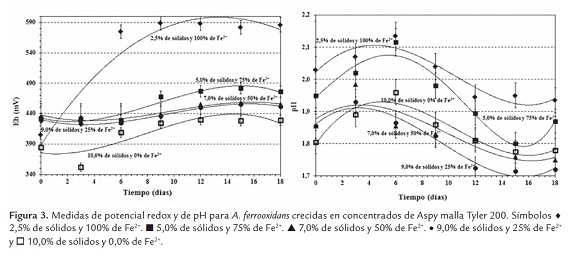
El potencial de Redox (Eh) alcanzó valores altos para el porcentaje de pulpa inicial, 2.5%, mostrando un crecimiento hasta el día seis para luego estabilizarse alrededor de 590 mV. Al incrementar el porcentaje de pulpa y disminuir la concentración de fuente externa de energía, se observó una disminución en los valores de potencial, siendo más bajo para 10% de pulpa sin adición de fuente de energía, alrededor de 400 mV (figura 3).
Sin embargo, la coloración y turbidez de las muestras dio indicios de una buena actividad oxidativa, también la concentración celular en solución alcanzada luego de 15 días para cada etapa del proceso, ~108 cel.mL-1. Los valores de pH mostraron un incremento hasta el día 6 del proceso, para descender y estabilizarse alrededor del día 12 (figura 3).
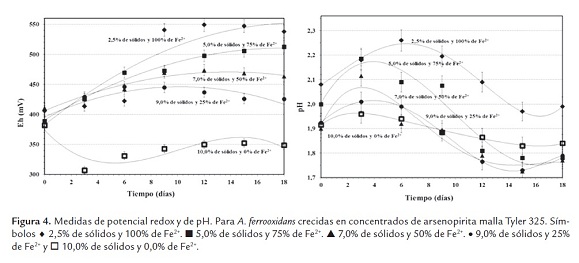
Adaptación de A. ferrooxidans malla Tyler 325
El comportamiento de este sustrato fue muy similar al alcanzado en la malla Tyler 200, sin embargo, al dis-minuir totalmente la fuente de energía adicional y aumentar a 10% el contiendo de pulpa se observa que el potencial de óxido-reducción no alcanza valores muy altos, solo alrededor de 350 mV (figura 4). Además, la turbidez observada en los medios de cultivo (datos no mostrados) fue menor a la observada en la malla Tyler 200 y la concentración celular alcanzada luego de 15 días de proceso fue un orden de magnitud menor a la alcanzada por el sustrato de mayor tamaño de partícula ~107 cel.mL-1.
El pH es un factor determinante en el proceso de adaptación de A. ferrooxidans al sustrato mineral e influye de forma significativa en su velocidad de crecimiento, debido a que afecta a los grupos ionizables presentes en las enzimas, situadas en el citoplasma y periplasma de la célula (Das et al., 1997; Das et al., 1998; Gómez y Cantero, 2005). El aumento inicial en el pH pudo deberse a factores como: (i) La presencia de carbo-natos y fases silicatadas en contacto con la solución lixiviante (Sampson et al., 2005; Arroyave, 2007); (ii) El consumo de protones generado principalmente la disolución de monosulfuros como calcopirita, esfalerita y galena (García et al., 1995; Da Silva, 2004; Ballester, 2005); y (iii) A la oxidación del Fe2+ presente en la solución (Bevilaqua et al., 2002; Meruane y Vargas, 2003).
El aumento inicial de pH en todos los subcultivos de adaptación es aparentemente debido a la oxidación del Fe2+ presente en la solución, ya que el mineral no contenía cantidades apreciables de ganga y los monosulfuros acompañantes fueron casi nulos. El aumento constante durante las primeras etapas de crecimiento pudo disminuir el adecuado crecimiento de los mi-croorganismos y por tanto retardar la adaptación, lo que concuerda con los trabajos de Das et al. (1997), Das et al. (1998), haciéndose más evidente para la malla Tyler 325.
En general, el incremento en el pH fue mayor para las muestras más finas, lo cual pudo deberse a que un menor tamaño de partícula se traduce en mayor área superficial y, por lo tanto, una mayor reactividad, generando un consumo de protones más elevado; lo que concuerda con lo propuesto por Silverman (1961), Meruane (2003), Deveci (2004), Haghshenas et al., (2009a) y Haghshenas et al. (2009-b) en sus trabajos sobre A. ferrooxidans y Fe2+. Por otra parte, Deveci (2002), encontró que a menor tamaño de partícula hay mayor posibilidad de colisiones, las cuales son responsables, en gran medida, del daño celular o incluso la muerte de los microorganismos.
El potencial de óxido reducción puede relacionarse con el crecimiento y la actividad bacteriana. Los rápidos incrementos pueden ser atribuidos a buenos procesos de adaptación de los microorganismos al mineral, indicando indirectamente que los iones solubili-zados no inhiben la capacidad bacteriana de oxidar el ion ferroso (Xia et al., 2008a; Xia et al., 2008b).
El tamaño de partícula más fino presentó menores niveles de oxidación comparados con la malla Tyler 200 (Eh más bajo), lo que puede explicarse debido a que los iones de arsénico presentan altos niveles de toxicidad, por lo tanto, a menor tamaño de partícula en el mineral, mayor área superficial, y su reactividad au-menta (más iones arsénico por volumen de mineral). Además, a bajas concentraciones de pulpa los daños en la pared celular de los microorganismos debidos a las colisiones entre las partículas son menores (Deveci, 2004). Lo que explica el continuo descenso de los niveles de Eh durante el proceso de adaptación. Esto también podría estar relacionado con la reactividad del mineral en función del tamaño de partícula.
Al disminuir el acceso a una fuente de energía como el Fe2+, el comportamiento del Eh presentó una disminución marcada durante los tres primeros días de proceso (para la malla Tyler 200), luego el incremento fue constante pero más lento que en las etapas anteriores, indicando que aunque los microorganismos se adaptaron al sistema, les costó más tiempo tolerar las condiciones adversas.
Además, como los microorganismos no contaban con fuente de energía extra, se vieron obligados a crecer a expensas de la disolución en medio ácido del mineral, proceso que tiene una cinética más lenta (Zapata et al., 2007). El comportamiento para la malla Tyler 325 fue similar en cuanto a la forma de la curva de la malla Tyler 200, pero los valores fueron mucho menores. La evolución del potencial de óxido-reducción está fuerte-mente relacionada con la tasa de crecimiento bacteriano y la capacidad de oxidación del Fe2+ (Prayuenyong, 2002; Acevedo y Gentina, 2005; Ballester, 2005). De acuerdo con Tuovinen et a. (1971), la tolerancia que adquieren microorganismos como A. ferrooxidans a los iones metálicos pesados se logra durante su fase lag de crecimiento y ésta se ve favorecida a medida que se incrementa la concentración de dichos iones.
Ensayos de biooxidación
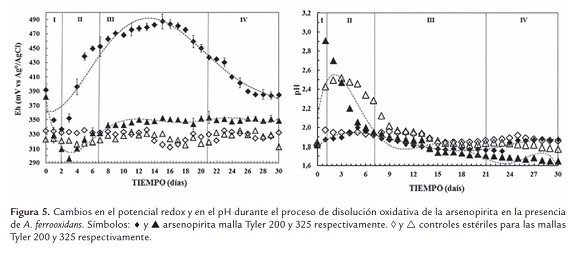
Para la malla Tyler 200 (figura 5), los valores de pH correspondientes a los ensayos de biooxidación, muestran pequeños incrementos al principio del proceso para luego estabilizarse en valores cercanos a 1.8 durante los 30 días de proceso. El potencial redox máximo alcanzado es relativamente bajo, ~470 mV. Para la malla Tyler 325 (figura 5) los valores de pH presentaron un incremento drástico en las primeras etapas del proceso, al sistema le tomó aproximadamente 5 días en controlar este incremento, para luego mostrar una paulatina tendencia hacia la baja, sugiriendo una continua producción de ácido en esta malla. El potencia redox, para estas condiciones, presenta un descenso fuerte al mismo tiempo que el pH se incrementa, para luego aumentar y estabilizarse en valores que no difieren de los observados en los controles ~350 mV (figura 5).
En resumen, para los dos casos se pueden diferenciar cinco tipos de fases, fase I: lag o de adaptación, donde los microorganismos se adaptaron su metabolismo a las nuevas; fase II: pre-exponencial, en esta los microorganismo continúan su proceso de adaptación; fase ex-ponencial III, la velocidad de crecimiento es máxima y el tiempo de generación mínimo; y finalmente la fase IV ó fase estacionaria, donde no es común observar el crecimiento del número de bacterias.
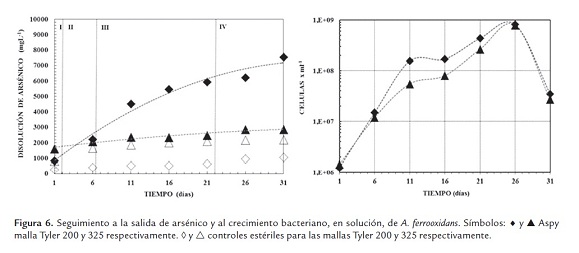
Las variaciones en las concentraciones de arsénico (Astotal) y en el crecimiento de microorganismos no adheridos al sustrato mineral se muestran en la figura 6, la cual presentó un comportamiento similar a las fases descritas anteriormente. La curva de concentración celular para la malla Tyler 200 presentó una velocidad de crecimiento mayor comparada con la malla Tyler 325, aunque el total de la población alcanzada no difiere mucho para ninguna de las condiciones evaluadas, el cambio de la dinámica de crecimiento poblacional fue evidente.
Para los ensayos con la malla Tyler 200, luego de 24 horas de iniciado el proceso, la concentración de arsénico en solución fue de 840 mg.L-1, es decir, 2% del total, y para la malla Tyler 325 fue de 1635 mg.L-1, es decir, 4% del total, lo que implica el doble de la cantidad de arsénico en solución. La concentración de arsénico se igualó en ambas mallas para el día seis del proceso, 2150 mg.L-1, es decir, 5% del total de arsénico. Después de treinta días de proceso, la concentración de arsénico para la malla Tyler 200 fue de 7550 mg.L-1, lo que implica un 18,7% del total de arsénico lixiviable, y para la malla Tyler 325 fue de 2850 mg.L-1, es decir un 7,1% del arsénico total lixiviable. Los controles estériles mostraron pequeños cambios durante el curso del proceso, con una concentración de arsénico máxima de 1060 mg.L-1 y 2190 mg.L-1, es decir, 2.6% y 5.4% del total lixiviable para las mallas Tyler 200 y 325, respectivamente.
Para ambas distribuciones de tamaño de partícula evaluadas, se dio un aumento inicial del pH, al igual que una caída inicial y posterior aumento progresivo en los valores de Eh, así como de As en solución. Este tipo de comportamiento es característico, reflejando, de una manera indirecta, las fases típicas de crecimiento microbiano, fase lag o de adaptación, fase de crecimiento exponencial y fase de estabilidad (Shahverdi et al., 2001; Das et al., 1997; Das et al., 1998; Third et al., 2000).
Es bien sabido que minerales como los carbonatos o algunas fases silicatadas en contacto con la solución lixiviante, pueden causar consumo de ácido inicial (Tuovinen et al., 1971; Attia y Elzeky, 1995); sin embargo, para las condiciones utilizadas en los ensayos, los carbonatos no afectaron de forma importante el proceso, ya que por las técnicas de caracterización inicial de los concentrados minerales no fueron detectados. Por lo tanto, el aumento inicial en los valores de pH puede ser atribuido, en gran medida, tanto al consumo inicial de H+ propio de la actividad metabólica de las bacterias, como al consumo de H+ durante la reacción de oxidación del Fe2+ proveniente de la disolución superficial del sustrato (Tuovinen et al., 1971; Natarajan et al., 1994; Fowler et al., 1999; Sampson et al., 2005).
El hecho de que el arsénico se solubilice, en mayor o menor grado, por el ataque inicial de protones puede verse también reflejado en las curvas de concentración de arsénico, en donde se observa un aumento gradual en la concentración desde el inicio del proceso sin que, necesariamente, haya un incremento marcado en la concentración celular de los microorganismos empleados o el potencial de oxidación (Fowler et al., 1999; Sampson et al., 2005).
Una vez satisfecho el consumo de protones, tanto por los microorganismo como por el Fe2+, la continua disminución del pH es el resultado del balance entre el consumo simultaneo de protones en la oxidación del Fe2+ y la liberación de protones relacionada con la hidrólisis y precipitación del hierro férrico generado, sumado a la generación de ácido producto de la oxidación de compuestos reducidos de azufre (Daoud y Karamanev, 2006; Corkhill y Vaughan, 2009). Otra reacción que puede contribuir al decrecimiento gradual del pH es la oxidación de la pirita, ya quedurante las reacciones de oxidación del mineral, son generadas cantidades importantes de ácido sulfúrico (Fowler et al., 1999), pero las cantidades de este mineral detectadas fueron muy pequeñas.
El potencial redox, la solubilización de arsénico y los valores de pH para los tratamientos abióticos del proceso mostraron pequeños cambios a través del proceso. En todos los casos, tanto para el ensayo con la malla Tyler 200 como con la malla Tyler 325, el tamaño de partícula más fino mostró un incremento mayor en los valores de pH en las etapas tempranas del proceso, sugiriendo un proceso controlado por el área superficial y, posiblemente, por la disolución por esta vía de algunos elementos acompañantes del mineral, que como carbonatos, pueden generar la disminución en los valores de acidez del sistema.
Para el sustrato Aspy, pasante malla Tyler 325, que por su proceso de obtención presentó una menor proporción de pirita como fase acompañante, se observó una menor eficiencia durante el proceso de biooxidación, un máximo de 7%, en comparación con el sustrato Aspy, pasante malla Tyler 200, (18%); éste hecho también se refleja en las curvas de potencial redox donde se observa una disminución de los valores en comparación con la malla Tyler 200. Este comportamiento puede ser explicado como que la pirita favorece el proceso de disolución de los sulfuros acompañantes, favoreciendo la disminución del pH y aumentando el potencial redox mediante pares galvánicos (Fowler et al., 1999).
Conclusiones
Los resultados de este trabajo sugieren que luego de una serie de etapas de adaptación sucesivas en medios de cultivo T&K, ricos en arsénico, debido a la disolución de la arsenopirita, la tolerancia de los microorganismos empleados se incrementó pero las cinéticas de crecimiento se vieron afectadas debido a la disminución gradual de una fuente de energía de fácil acceso, como el sulfato ferroso, lo que se ve representado en las caídas de potencial y en la dispersión de los datos de Eh y pH durante todas las etapas de adaptación y el proceso de oxidación.
La adaptación de A. ferrooxidans a concentrados de arsenopirita en etapas sucesivas, mediante la disminución gradual de fuente de energía y aumento en el contenido del mineral, resultó ser un método eficaz para este tipo de procesos. Esta metodología provee una adecuada solución para la adaptación de los microorganismos a concentraciones de metales pesados en solución.
Agradecimientos
Los autores agradecen al Programa de Biotecnología de COLCIENCIAS; a los laboratorios de Biomineralogía y Carbones de la Universidad Nacional de Colombia, Sede Medellín; al CODI de la Universidad de Antioquia. También, y muy especialmente, a la Dirección Operativa de Investigación de la Institución Universitaria Pascual Bravo, a su director el Dr. William Alzate Segura y su profesional especializado Luz Eugenia Alzate.
Referencias bibliográficas
1 Acevedo F., Gentina J. C. 2005. Biolixiviación de minerales de cobre. En: Fernando Acevedo y Juan Carlos Gentina (Editores). Fundamentos y Perspectivas de las Tecnologías Biomineras. p 25-43. [ Links ]
2 Akcil A., Ciftci H., Deveci H. 2007. Role and contribution of pure and mixed cultures of mesophiles in bioleaching of a pyritic chalcopyrite concentrate. Minerals Engineering. 20: 310-318. [ Links ]
3 Arroyave D. M. 2007. Evaluación del proceso de biooxidación a escala de laboratorio del mineral de la mina el Zancudo, Titiribí, Antioquia. Tesis de Maestría. [ Links ]
4 Astudillo C., Acevedo F. 2008. Adaptation of Sulfolobus metallicus to high pulp densities in the biooxidation of a flotation gold concentrate. Hydrometallurgy. 92: 11-15. [ Links ]
5 Attia Y.A., Elzeky M. 1995. Effect of bacterial adaptation on kinetics and mechanisms of bioleaching ferrous sulfides. Chemical Engineering Journal. 56: 115-124. [ Links ]
6 Ballester A. 2005. Mecanismos de la Biolixiviación, capitulo 1 en: Fundamentos y Perspectivas de las Tecnologías Biomineras. p 924. [ Links ]
7 Barrett J., Ewart D.K., Hughes M.N., Poole R.K. 1993. Chemical and biological pathways in the bacterial oxidation of arsenopyrite. FEMS Microbiol Rev. 11: 57-62. [ Links ]
8 Bevilaqua D., Leite A.L.L.C., Garcia O., Touvinen O.H. 2002. Oxidation of Chalcopyrite by Acidihiobacillus ferrooxidans and Acidithiobacillus thiooxidans in shake flasks. Process Biochemistry. 38(4): 587-592. [ Links ]
9 Braddock J.F., Luong H.V., Brown E.J. 1984. Growth kinetics of Thiobacillus ferrooxidans isolated from arsenic mine drainage. Appl. Environ. Microbiol. 48: 48-55. [ Links ]
10 Brahmaprakash G.P., Devasia P., Jagadish K.S., Natarajan K.A., Rao G.R. 1988. Development of Thiobacillus ferrooxidans ATCC 19859 strains tolerant to copper and zinc. Bulletin of Materials Science. 10:461-465. [ Links ]
11 Brierley J.A., Luinstra L. 1993. Biooxidation-heap concept for pretreatment of refractory gold ore. En: Biohydrometallurgical Technologies, A.E. Torma, J.E. Wey & V.L. Lakshmanan Eds., The Minerals, Metals & Materials Society. pp 437-448. [ Links ]
12 Cardona I.C., Márques, M.A. 2009. Biodesulfurization of two Colombian coals with native microorganisms. Fuel Processing Technology. 90: 1099-1106. [ Links ]
13 Collinet M.N., Morin D. 1990. Characterization of arsenopyrite oxidizing Thiobacillus. Tolerance to arsenite, arsenate, ferrous and ferric iron. Antonie van Leewenhoek. 57: 237-244. [ Links ]
14 Corkhill C.L., Vaughan D.J. 2009. Arsenopyrite oxidation - A review. Applied Geochemistry. doi:10.1016/j.apgeochem.2009.09.008. [ Links ]
15 Da Silva G. 2004. Kinetics and mechanism of the bacterial and ferric sulphate oxidation of galena. Hydromatallurgy. 75(1-4): 99-110. [ Links ]
16 Daoud J., Karamanev D. 2006. Formation of jarosite during Fe2+ oxidation by A. ferrooxidans. Minerals Engineering. 19(9): 960-967. [ Links ]
17 Das A., Modak J.M., Natarajan K.A. 1998. Surface chemical studies of Thiobacillus ferrooxidans with reference to copper tolerance. Antonie van Leeuwenhoek. 73(3): 215-222. [ Links ]
18 Das A., Modak J.M., Natarajan, K.A. 1997 Studies on multi-metal ion tolerance of Thiobacillus ferrooxidan. Minerals Engineering. 10: 743-749. [ Links ]
19 Deveci H., Akcil A., Alp I. 2004. Bioleaching of complex zinc sulphides using mesophilic and thermophilic bacteria: comparative importance of pH and iron. Hydrometallurgy. 73: 293-303. [ Links ]
20 Duque, B., Noguera, H., 2001. Estudio de prefactibilidad técnica y financiera del proceso de biolixiviación para el mineral de la mina El Silencio (Segovia, Antioquia). Tesis Ingeniería Química. Universidad Nacional de Colombia- Sede Medellín. [ Links ]
21 Durusoy T., ÖzbasBozdemir T., Erincin E., Yürüm Y. 1997. Biodesul-furization of Turkish lignites: 2. Microbial desulfurization of Mengen lignite by the mesophilic microorganism Rhodococcus rhodochrous. Fuel. 76(4): 341-344. [ Links ]
22 Fowler T.A., Holmes P.R., Crundwell F.K. 1999. Mechanism of pyrite dissolution in the presence of Thiobacillus ferrooxidans. Applied And Environmental Microbiology. 65: 2987-2993. [ Links ]
23 Garcia O., Tuovinen O.H., Bigham, J.M. 1995. Oxidation of galena by Thiobacillus ferrooxidans and Thiobacillus thiooxidans. Canadian Journal Microbiology. 41(6):508-514. [ Links ]
24 Gilbert S.R., Bounds C.O., Ice R.R. 1988. Comparative economics of bacterial oxidation and roasting as a pre-treatment step for gold recovery from an auriferous pyrite concentrate. CIM Bulletin. 81: 89-94. [ Links ]
25 Gomez C., Blazquez M.L., Ballester A. 1999. Bioleaching of a Spanish complex sulphide ore bulk concentrate. Minerals Engineering. 12: 93-106. [ Links ]
26 Gómez J .M., Cantero D. 2005. Biooxidación del ión ferroso. En: Fernando Acevedo y Juan Carlos Gentina (Editores). Fundamentos y Perspectivas de las Tecnologías Biomineras. p 2543. [ Links ]
27 Harvey P.I., Crundwell F.K. 1996. The effect of As (III) on the growth of Thiobacillus ferrooxidans in an electrolytic cell under controlled redox potentials. Minerals Engineering. 9(10): 1059-1068. [ Links ]
28 Kelly D.P., Wood A.P. 2000. Reclassification of some species of Thiobacillus to the newly designated genera A. ferrooxidans gen. nov., Halothiobacillus gen. nov. and Thermithiobacillus gen. nov. International Journal of Systematic and Evolutionary Microbiology. 50: 511-516. [ Links ]
29 Marhual N.P., Pradhan N., Kar R.N., Sukla L.B., Mishra B.K. 2008. Differential bioleaching of copper by mesophilic and moderately thermophilic acidophilic consortium enriched from same copper mine water sample. Bioresource Technology. 99: 8331-8336. [ Links ]
30 Márquez M., Gaspar J., Bessler K., Magela G. 2006. Process mineralogy of bacterial oxidized gold ore in São Bento Mine (Brasil). Hydrometallurgy. 83: 114-123. [ Links ]
31 Mason L.J., Rice N.M. 2002. The adaptation of Thiobacillus ferrooxidans for the treatment of nickel-iron sulphide concentrates. Minerals Engineering. 15: 795-808. [ Links ]
32 Mejía R.E. 2010. Mineralogía del proceso de oxidación bacteriana de la calcopirita (CuFeS2), esfalerita (ZnS) y galena (PbS). Tesis de Maestría en Ingeniería - Materiales y Procesos. Universidad Nacional de Colombia-Sede Medellín. [ Links ]
33 Meruane G., Vargas T. 2003. Bacterial oxidation of ferrous iron by A. ferrooxidans in the pH range 2.5-7.0. Hydrometallurgy. 71(12): 149-158. [ Links ]
34 Mousavi S.M., Yaghmaei S., Vossoughi M., Jafari A., Roostaazad R., Turunen I. 2007. Bacterial leaching of low-grade ZnS concentrate using indigenous mesophilic and thermophilic strains. Hydrometallurgy. 85: 59-65. [ Links ]
35 Mousavi S.M., Yaghmaei S., Vossoughi M., Jafari A., Roostaazad R. 2006b. Zinc extraction from Iranian low-grade complex zinc-lead ore by two native microorganisms: A. ferrooxidans and Sulfobacillus. International Journal of Mineral Processing. 80: 238-243. [ Links ]
36 Muñoz, A. 2002. Oxidación de concentrados de sulfuros metálicos provenientes de la mina La Maruja de Marmato, Caldas, mediante una cepa nativa de A. ferrooxidans. Tesis de Maestría en Bio-tecnología. Universidad Nacional de Colombia-Sede Medellín. [ Links ]
37 Natarajan K.A., Sudeesha K., Rao G.R. 1994. Stability of copper tolerance in Thiobacillus ferrooxidans. Antonie van Leeuwenhoek. 66: 303-306. [ Links ]
38 Neale J.W., Pinches A., Muller H.H., Hannweg N.H., Dempsey P. 1991. Long-term bacterial oxidation pilot plant operation at Mintek and Vaal Reefs. En: Presented at the South African Institute of Minning and Metallurgy Colloquium on Bacterial Oxidation, Johannesburg. p 25. [ Links ]
39 Nordstrom D., Southam G. 1997. Geomicrobiology of sulfide mineral oxidation. Reviews in mineralogy. 35: 361-390. [ Links ]
40 Olson G., Brierley J., Brierley C. 2003. Bioleaching review part B: Progress in bioleaching: applications of microbial processes by the minerals industries. Appl Microbiol Biotechnol. 63: 249-257. [ Links ]
41 Ospina J.D. 2010. Mineralogía del proceso de oxidación bacteriana de la arsenopirita (FeAsS) y pirita (FeS2). Tesis de Maestría en Ingeniería - Materiales y Procesos. Universidad Nacional de Colombia-Sede Medellín. [ Links ]
42 Ossa M. 2004. Biolixiviación de sulfuros (pirita-arsenopirita) utilizando cepas nativas de acidófilos como pretratamiento, para el beneficio de metales preciosos, mina El Zancudo, Titiribí, Antioquia. Tesis de Maestría, Biotecnología. Universidad Nacional de Colombia- Sede Medellín. [ Links ]
43 Ossa M., Márquez M., Zapata D. 2005. Ensayos de biolixiviación de esfalerita variedad marmatita. Memorias XII Congreso Colombiano de Minería. Medellín. [ Links ]
44 Pérez J., Velásquez J. 1998. Biolixiviación de un mineral refractario procedente de la mina El Zancudo (Titiribí, Antioquia). Tesis Ingeniería Química. Universidad Nacional de Colombia- Sede Medellín. [ Links ]
45 Prayouenyong P. 2002. Coal biodesulphurization. Journal Science Technology. 24: 493-507. [ Links ]
46 Rawlings D.E., Tributsch H., Hansford G.S. 1999. Reasons why 'Leptospirillum'-like species rather than Thiobacillus ferrooxidans are the dominant iron-oxidizing bacteria in many commercial processes for the biooxidation of pyrite and related ores. Microbiology. 145: 5-13. [ Links ]
47 Rawlings, D.E. 2005. Review. Characteristics and adaptability of iron - and sulfur - oxidizing microorganisms used for the recovery of metals from minerals and their concentrates. Microbial Cell Factories. 4: 13. doi:10.1186/1475-2859-4-13 [ Links ]
48 Rossi Giovani. (Eds), 1990. Biohydrometallurgy. McGraw-Hill Book Company GmbH, Hamburg. pp 136-157. [ Links ]
49 Sampson M.I., Van der Merwe J.W., Harvey T.J., Bath M.D. 2005. Testing the ability of a low grade sphalerite concentrate to achieve autothermality during biooxidation heap leaching. Minerals Engineering. 18: 427-437. [ Links ]
50 Shahverdi A.R., Yazdi M.T., Oliazadeh M., Darebidi M.H. 2001. Biooxidation of mouteh refractory gold-bearing concentrate by an adapted Thiobacillus ferrooxidans. Journal of Science Islamic Republic of Iran. 12(3): 209-212. [ Links ]
51 Shi S., Fang Z. 2005. Bioleaching of marmatite flotation concentrate by adapted mixed mesoacidophilic cultures in an air-lift reactor. International Journal of Mineral Processing. 76: 3-12. [ Links ]
52 Shi S., Fang Z., Ni J., 2006. Comparative study on the bioleaching of zinc sulphides. Process Biochemistry. 41: p 438-446. [ Links ]
53 Third K.A., Cord-Ruwisch R., Watling H.R. 2000. The role of iron-oxidizing bacteria in stimulation or inhibition of chalcopyrite bioleaching. Hydrometallurgy. 57: 225-233. [ Links ]
54 Tuovinen O., Kelly D. 1973. Studies on the growth of Thiobacillus ferrooxidans. Arch. Microbiol. 88: 285-298. [ Links ]
55 Tuovinen O.H., Niemela S.I., Gyllenberg H.G. 1971. Tolerance of Thiobacillus ferrooxidans to some metals. Antonie van Leewenhoek. 37: 489-496. [ Links ]
56 Xia L., Liu J., Xiao L., Zeng J., Li B., Geng M. and Qiu G. 2008a. Single and cooperative bioleaching of sphalerite by two kinds of bacteria-A. ferrooxidans and Acidithiobacillus thiooxidans. Trans. Nonferrous Met. Soc. China. 12: 190-195. [ Links ]
57 Xia L., Liu X., Zeng J., Yin C., Gao J., Liu J., Qiu G. 2008b. Mechanism of enhanced bioleaching efficiency of A. ferrooxidans after adaptation with chalcopyrite. Hydrometallurgy. 92: 95-101. [ Links ]
58 Zapata D.M., Márquez M.A., Ossa D.M. 2007. Sulphur product layer in sphalerite biooxidation: Evidences for a mechanism of formation. Advanced Materials Research. 20-21:134-138. DOI 10.4028/www.scientific.net/AMR.20-21.134 [ Links ]
59 Zhen S., Yan Z., Zhang Y., Wang J., Campbell M., Qin W. 2009. Column bioleaching of a low grade nickel-bearing sulfide ore containing high magnesium as olivine, chlorite and antigorite. Hydrometallurgy. 96: 337-341. [ Links ]