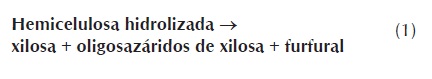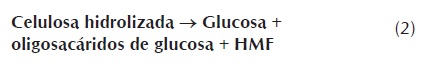Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.14 no.1 Bogotá Jan./June 2012
ARTÍCULO DE INVESTIGACIÓN
Evaluación del pretratamiento con ácido sulfúrico diluido del pasto maralfalfa (Pennisetum glaucum x Pennisetum purpureum) para la producción de etanol.
Dilute sulfuric acid pretreatment of goliath grass (Pennisetum glaucum x Pennisetum purpureum) for ethanol cellulosic.
Lady Mateus1, Orlando Hernández2, Mario Velásquez3, José de Jesús Díaz4.
1 Departamento de Ingeniería Química y Ambiental, Universidad Nacional de Colombia Sede Bogotá. lmateusf@gmail.com
2 Departamento de Química, Universidad Nacional de Colombia Sede Bogotá. ohernandezf@unal.edu.co
3 Departamento de Ingeniería Química y Ambiental, Universidad Nacional de Colombia Sede Bogotá. mevelasquezl@gmail.com
4 Departamento de Química, Universidad Nacional de Colombia Sede Bogotá. jddiazv@unal.edu.co
Recibido: mayo 5 de 2011 Aprobado: junio 29 de 2012
Resumen
Evaluar la producción de etanol a partir de cultivos lignocelulósicos, específicamente pastos de rápido crecimiento en la región, constituye una alternativa a la demanda de biocombustibles. En la presente investigación se seleccionó el pasto Maralfalfa (Pennisetum glaucum x Pennisetum purpureum) utilizando el pretratamiento con ácido sulfúrico diluido a diferentes temperaturas (110, 130, 150, 170 y 190 °C) y concentraciones de ácido (0.8, 1.2 y 2.0% (p/p)), seguido de un proceso de hidrólisis enzimática utilizando celulasas y celobiosas comerciales y un proceso de hidrólisis y fermentación simultanea. La máxima producción de etanol obtenido fue 117 mg etanol/ g biomasa pretratada a 190 °C y 1,2 %(p/p) de ácido sulfúrico. El líquido hidrolizado fue caracterizado calculando el porcentaje de glucosa, xilosa y lignina solubilizadas y degradadas durante el pretratamiento.
Palabras clave: etanol lignocelulósico, celulosa, hemicelulosa.
Abstract
The goliath grass (Pennisetum glaucum x Pennisetum purpureum) was pretreated with different sulfuric acid concentrations (0.8, 1.2 y 2.0% (w/w)) from low to high temperatures (110, 130, 150, 170 y 190 °C) followed by enzymatic hydrolysis and SSF of remaining solids. The maximum yield was 117 mg of ethanol/g biomass to 190 °C and 1.2 % (w/w) of sulfuric acid.
Key words: lignocellulosic ethanol, hemicellulose, cellulose.
Introducción
La producción de etanol a partir de biomasa lignocelulósica ha sido ampliamente investigada, utilizando diversas fuentes de biomasa, tales como desechos agrícolas, cultivos sin aplicaciones alimenticias, papel reciclado y residuos sólidos urbanos, entre otros. La habilidad de convertir los carbohidratos de los materiales lignocelulósicos con una relación costo - beneficio comercialmente factible, es el reto tecnológico de la actualidad. (Lau y Dale, 2009).
Las biomasas lignocelulósicas están constituidas por extraíbles como ceras y lípidos; carbohidratos, como el almidón, la celulosa y hemicelulosa; lignina y minerales (Dien, 2009). La producción de etanol se realiza en cuatro etapas: primero, un pretratamiento que altere la estructura y composición de la biomasa, seguido de la hidrólisis, que fracciona los carbohidratos en monosacáridos, y la posterior fermentación de estos carbohidratos en etanol y concentración del mismo por destilación (Mosier et al., 2005).
El objetivo del pretratamiento es alterar la estructura de la biomasa lignocelulósica para mejorar la accesibilidad de la celulosa a las enzimas que convierten los carbohidratos estructurales en monosacáridos fermentables. El éxito del pretratamiento se mide en función de la degradación total ó parcial de la lignina y la hemicelulosa como un indicador de la disociación de la matriz celulosa-lignina, la disminución de la cristalinidad y el aumento de la porosidad de la celulosa. El pretratamiento es considerado como una etapa con un impacto significativo en la factibilidad comercial del proceso, lo que justifica la necesidad de explorar y balancear las ventajas con los costos del procedimiento (Sun y Cheng, 2002; Mosier et al.., 2005; Dien, 2007).
Los pretratamientos se pueden clasificar en biológicos, químicos y físicos. Los biológicos ofrecen ventajas importantes como el bajo consumo energético debido a la utilización de hongos que degradan la lignina y la hemicelulosa, pero son procesos que requieren más tiempo que los pretratamientos químicos y físicos. Entre tanto, los pretratamientos físicos, están basados en la reducción del tamaño de la biomasa, logrando bajos rendimientos a costos elevados. Los pretratamientos con adición de solventes químicos son los más efectivos; sin embargo, no todos los pretratamientos químicos presentan un balance adecuado entre las ventajas ofrecidas y el costo de operación (Yang y Wyman, 2008).
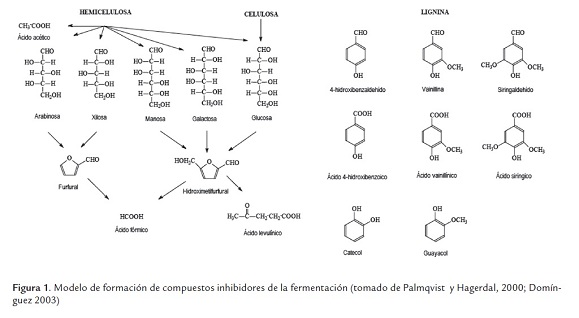
El pretratamiento con ácido sulfúrico diluido ha sido ampliamente estudiado y el National Renewable Energy Laboratory (NREL) de los Estados Unidos, es la entidad que ha desarrollado los mayores avances tecnológicos, encontrando ventajas como la recuperación del 80 al 90 % de los monosacaridos provenientes de la hemicelulosa. Aunque pequeños porcentajes de lignina se disuelven durante el proceso, algunos estudios señalan el aumento significativo del porcentaje de celulosa hidrolizada. Entre las desventajas asociadas a este pretratamiento están la acción corrosiva del ácido sobre los equipos empleados en el procedimiento y la degradación de los carbohidratos hidrolizados a compuestos derivados del furano, como el furfural proveniente de la hidrólisis de las pentosas y el 5-hidroximetilfurfural (5-HMF) por hidrólisis de las hexosas, como se muestra en la figura 1, donde se esquematiza la formación de compuestos que inhiben la fermentación provenientes de la degradación de los componentes principales de las biomasa lignocelulósicas (Palmqvist y Hagerdal, 2000; Yang y Wyman, 2008).
Las investigaciones de la aplicación del pretratamiento con ácido sulfúrico diluido se han realizado sobre diferentes biomasas herbáceas como el pasto Switchgrass (Esteghlalian et al., 1997; Dien et al., 2006; Yat et al., 2008; Yang y Wyman, 2008; Morinelly et al., 2009), el pasto Silvergrass (Guo et al., 2008) y residuos agrícolas de maíz (Schell et al., 2003; Weiss et al., 2010) entre otros, utilizando condiciones de reacción muy similares, con temperaturas mayores a 120 °C y soluciones de ácido sulfúrico entre el 0.5 y el 3.0 % (p/p).
El pasto maralfalfa (Pennisetum glaucum x Pennisetum purpureum) es un pasto tropical con alta productividad en numerosos países de Latinoamérica (Colombia, Brasil, Venezuela, entre otros) debido a su potencial como forraje para rumiantes (Clavero, 2009). Este pasto se caracteriza por presentarse como tallos cilíndricos de 3,5 m de altura con una producción de 60 a 80 ton materia seca/ha·año. Entre sus fortalezas se encuentra el alto rendimiento de materia seca, la tolerancia a las sequías y a suelos ácidos (Mármol, 2006).
El objetivo de este trabajo fue estudiar el pretratamiento con ácido sulfúrico diluido del pasto maralfalfa (Pennisetum glaucum x Pennisetum purpureum) considerando diversas temperaturas y concentraciones de ácido. Cuantificando luego el contenido de celulosa y hemicelulosa en el material pretratado, y el porcentaje de glucosa y xilosa obtenidos en la hidrólisis enzimática de los mismos.
Materiales y métodos
Preparación de la biomasa
El pasto maralfalfa (Pennisetum glaucum x Pennisetum purpureum) fue cortado transversalmente en trozos de 5 cm y posteriormente molido en un molino de cuchillas hasta un tamaño de 1 mm. Se almacenó en bolsas plásticas herméticamente cerradas.
Caracterización de la biomasa
La biomasa fue caracterizada según la metodología publicada por el National Renewable Energy Laboratoy (NREL), determinando el contenido de sólidos totales, cenizas, extractos, lignina soluble en ácido sulfúrico, lignina Klason y carbohidratos estructurales ( Sluiter et al., 2008a), ( Sluiter et al., 2008b) ( Sluiter et al., 2008c). Este procedimiento se realizó por duplicado.
Pretratamiento con ácido sulfúrico
El pretratamiento se realizó en el Laboratorio de Investigación en Combustibles y Energía (LICE) adscrito al Departamento de Química de la Universidad Nacional de Colombia, en un reactor Parr con capacidad de 1 L, presión máxima de 2000 psi, calentado con resistencia eléctrica, controlando la temperatura de operación con un controlador marca Temp Variac que tiene una temperatura de operación máxima de 350°C. El reactor fue cargado con 15 g de biomasa protegidos dentro de una canasta de acero inoxidable fabricada en malla Nº 60, la cual se colocó dentro del reactor con 90 a 100 ml de la solución de ácido sulfúrico a la concentración requerida (0.8, 1.2 y 2.0 % (p/p)), manteniendo constante la proporción de sólidos en el reactor en 15 % (p/p) y el tiempo de reacción en 60 min para todos los ensayos. Los sólidos pretratados fueron lavados con agua desionizada y secados a 50 °C durante 12 h.
Análisis de productos de reacción
Los sólidos pretratados son caracterizados con la metodología NREL. Mientras que la fracción líquida obtenida del pretratamiento, fue analizada con cromatografía liquida de alta eficiencia-HPLC, cuantificando el contenido de carbohidratos con una columna Biorad Aminex® HPX-87H (7,8 x 300 mm), empleando como fase móvil una solución de ácido sulfúrico 5 mM a flujo de 0,6 mL/min y una temperatura de 60 °C en el horno. También se realizó el análisis de los carbohidratos degradados y la lignina hidrolizada durante el pretratamiento, utilizando una columna Chromolite® RP C-18 (4,6 x 100 mm), con una solución de agua, metanol y ácido acético al 1% (89 - 7 - 4 % (v/v)) como fase móvil, 30 °C de temperatura en el horno y un detector de arreglo de diodos. Los analitos de interés fueron furfural, 5-HMF, ácido hidroxibenzoico, 4-hidroxibenzaldehido, ácido vainillínico, vanillina, ácido siríngico, ácido p-cumárico, siringaldehido y ácido ferúlico. Cada procedimiento analítico se realizó por duplicado.
Hidrólisis enzimática
Los sólidos pretratados con ácido sulfúrico diluido fueron hidrolizados utilizando una combinación de enzimas comerciales de celulasa de Trichoderma resei con una actividad de 30 UPF/g celulosa y ß-glucosidasa de Aspergillus niger con una actividad de 400 UI/g celulosa. La hidrólisis enzimática se realizó en el Centro Nacional de Investigación en Utilizaciones Agrícolas del Departamento de Agricultura de Estados Unidos en Peoria, IL. La biomasa pretratada fue diluida en 30 mL de agua desionizada y una solución amortiguadora de citrato 1 M para mantener el pH en 4.8. Adicionalmente, se agregaron 0.3 mL de timol (con una concentración de 50 g/l en 70% (v/v) de etanol) como agente bactericida y la mezcla de enzimas. El procedimiento se realizó a 50 °C y 100 rpm durante 72 h. La hidrólisis enzimática de cada pasto pretratado se realizo por duplicado.
Hidrólisis y fermentación simultánea
El pasto maralfalfa (Pennisetum glaucum x Pennisetum purpureum) pretratado con ácido sulfúrico con mayor porcentaje de glucosa y xilosa hidrolizados, fue sometido a un procedimiento de hidrólisis y fermentación simultánea para evaluar la producción de etanol. Este procedimiento se realizó en un proceso batch, conservando las mismas condiciones de la hidrolisis enzimática adicionando la levadura Saccharomyces cerevisiae D5A en YPD a 35 °C y 100 rpm, durante 72 h. La hidrólisis y fermentación simultánea se realizó por duplicado.
Resultados y discusión
Composición del pasto
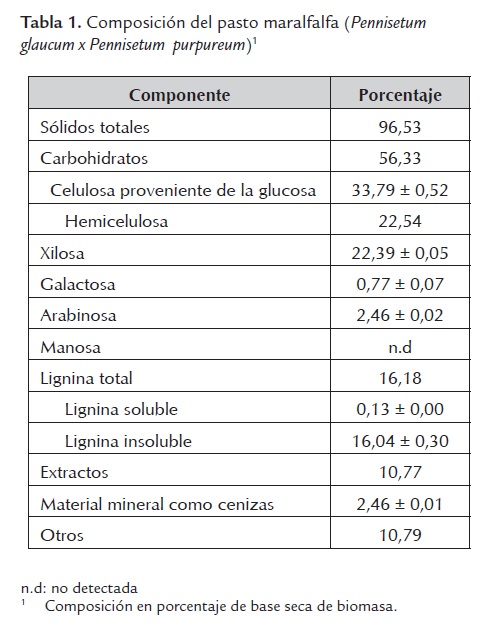
La caracterización del pasto maralfalfa (Pennisetum glaucum x Pennisetum purpureum) (Tabla 1) revela que los componentes principales son la celulosa y la hemicelulosa, sumando el 56.33 % de la biomasa seca, mientras que la lignina representa el 16.18 %. El contenido de celulosa y lignina están en el rango de valores reportados para los pastos, correspondiente del 25 al 40 % de celulosa y del 10 al 15 % de lignina; mientras que el contenido de hemicelulosa es más bajo que el 35 al 50 % reportado (Sun y Cheng, 2002). La hemicelulosa está compuesta principalmente por xilosa (87,41 %), galactosa (2,98 %) y arabinosa (9,60 %). El máximo potencial de recuperación de glucosa y xilosa es 0,375 g y 0,232 g, respectivamente, por g de pasto maralfalfa seco, es decir, un total de 0,607 g de carbohidratos por g de biomasa seca.
El bajo contenido de lignina de la biomasa y la baja solubilidad de está en ácido, permite inferir que en el pretratamiento con ácido sulfúrico no se presentará una alta producción de inhibidores fenólicos en la fracción líquida hidrolizada.
Todos los monosacáridos son susceptibles de convertirse en etanol, dependiendo de los microorganismos utilizados en la fermentación. De acuerdo con el software del NREL (http://www1.eere.energy.gov/biomass/ethanol_yield_calculator.html), que usa la fracción en peso seco de azúcares poliméricos para calcular el rendimiento teórico de etanol, se obtiene un rendimiento de 66,2 y 44,0 gal/ton a partir de las hexosas y pentosas, respectivamente, para un total de 110,2 gal/ton de biomasa seca. El rendimiento teórico de etanol a partir de pasto maralfalfa es ligeramente menor al calculado para el maíz (124,4 gal/ton) y bagazo de caña (111,5 gal/ton), lo cual es especialmente importante considerando el rendimiento y la flexibilidad de las condiciones de cultivo de la especie.
Pretratamiento con ácido sulfúrico
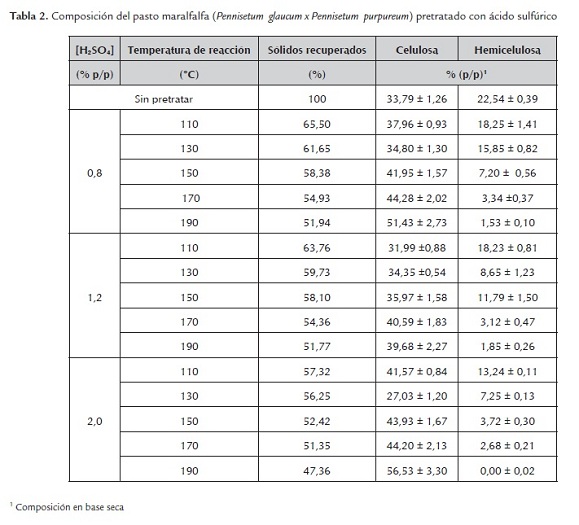
La caracterización de los pastos pretratados con ácido sulfúrico mostrado en la tabla 2, demuestra que el pretratamiento aplicado hidroliza principalmente la hemicelulosa, disminuyendo su composición desde 22.54 % en la biomasa sin pretratar hasta su totalidad, en la reacción llevada a cabo a 190°C y 2.0 % (p/p), logrando con estas condiciones de operación el máximo porcentaje de celulosa en el material pretratado, correspondiente a 56.53 % (p/p).
El aumento de la fracción porcentual de celulosa en el material pretratado, se explica debido a la degradación de la hemicelulosa, porque al disminuir el porcentaje de esta, el producto sólido se enriqueció en los componentes menos hidrolizados durante el pretratamiento, celulosa y lignina, lo cual favorece un proceso selectivo de hidrólisis con celulasas, dirigida a la producción de glucosa, para su posterior fermentación con Saccharomyces cerevisiae.
La disminución del contenido de hemicelulosa en los sólidos pretratados, es uno de los indicadores más importantes de la efectividad del pretratamiento, debido a que refleja la desaparición de enlaces entre la lignina y la celulosa, sugiriendo el aumento de la porosidad del material lignocelulósico y la digestibilidad enzimática en la hidrólisis (McMillan, 1994).
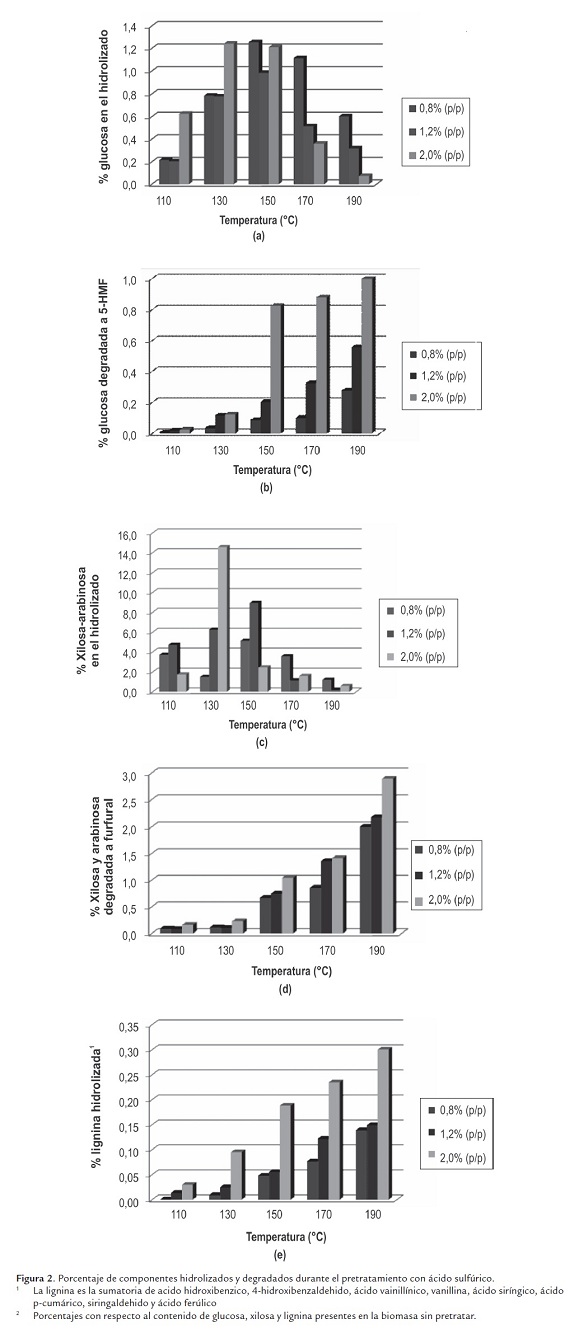
En el producto líquido se encuentra la hemicelulosa solubilizada durante el pretratamiento, correspondiente teóricamente a la suma de la xilosa, oligosacaridos de xilosa y furfural (ecuación 1), mientras que la celulosa hidrolizada corresponde a la suma de la glucosa, oligosacaridos de glucosa y 5-HMF (ecuación 2) (Dien, 2007). En esta investigación no se cuantificaron los oligosacaridos de xilosa y glucosa, por lo tanto el análisis se realiza para los monosacaridos y productos de degradación. Los resultados se presentan en la figura 2 .
En lo concerniente al contenido de carbohidratos, glucosa, xilosa y arabinosa, en el producto líquido de la reacción, estos alcanzan su máxima concentración a los 150°C para las reacciones realizadas a 0.8 y 1.2 % y 130°C para la realizada al 2.0 %. La degradación de los carbohidratos se potencializa con el aumento de la temperatura y concentración de ácido, hallando el máximo contenido de furfural y 5-HMF a 190°C y 2.0 % (p/p). El porcentaje de degradación de la xilosa y glucosa es de 2.18 y 1.00 %, respectivamente.
Igualmente, se observa que la lignina aumenta su porcentaje de hidrólisis con respecto a la temperatura y concentración de ácido en el pretratamiento, obteniendo el 0.30 %, correspondiente a 36.30 % de la lignina soluble de la biomasa sin pretratar.
La sumatoria del porcentaje de xilosa, arabinosa y carbohidratos degradados a furfural, no corresponde al total de la hemicelulosa hidrolizada calculada con la ecuación 1, lo que se puede explicar a la luz de dos posibles situaciones, la primera es la presencia de altas concentraciones de oligosacáridos de xilosa - arabinosa y la segunda es la degradación del furfural a ácido fórmico.
Acudiendo al estudio de la cinética de hidrólisis de la hemicelulosa del Switchgrass (Canettieri et al., 2007; Morinelly et al., 2009), se sabe que a concentraciones bajas de ácido sulfúrico (0.25 - 0.75 % (p/p)) y temperatura de 150°C, se produce del 33 al 60 % de oligosacáridos de xilosa y que la degradación de xilosa a furfural no supera el 15 %, con respecto al contenido inicial. Por lo anterior, es posible que la primera situación, alta concentración de oligosacaridos en el producto líquido de la reacción, sea la más probable. Esta hipótesis es respaldada con el hecho de observar contaminación con hongos en el producto líquido de las reacciones de estudio preliminar, que se realizaron a las mismas condiciones de temperatura y concentración de ácido y mayores tiempos de reacción.
La suma del porcentaje de glucosa y glucosa degradada a 5-HMF no supera el 2.04 %, pero al igual que en la hidrólisis de la hemicelulosa, se sospecha la presencia de oligosacáridos de glucosa en el producto líquido de la reacción.
La máxima producción de carbohidratos glucosa y xilosa en el hidrolizado no se puede lograr simultáneamente, porque la máxima producción de glucosa se presenta a temperaturas mayores que la de xilosa. Para este estudio la máxima producción de glucosa se presenta en las reacciones realizadas a 150°C, mientras que la máxima producción de xilosa se presenta en los pretratamientos realizados a 130°C. Este resultado es similar en la investigación reportada por Dien et al. (2005), Dien et al. (2006) y Marzialetti et al. (2008).
El estudio del modelo cinético de la hidrólisis de la xilosa durante el pretratamiento con ácido sulfúrico diluido en biomasas herbáceas (Esteghlalian et al., 1997), indica que el pretratamiento realizado a 180°C y 0.9 % (p/p) de ácido sulfúrico, logra el 90 % de hidrólisis de la xilosa presente en el material vegetal sin pretratar. Este resultado se diferencia principalmente del obtenido en el presente estudio, en la concentración de ácido sulfúrico empleada en el pretratamiento, lo cual puede estar relacionado con la capacidad de neutralización característica de la biomasa (Torget et al., 1990; Dien et al., 2005)
Considerando que los porcentajes de 5-HMF y furfural presentados en la figura 2 b ) y d ), son inferiores a los reportados en algunas publicaciones (Guo et al., 2008; Marzialetti et al., 2008) que estudian el pretratamiento con ácido sulfúrico diluido sobre biomasas herbáceas y, adicionalmente se obtiene un bajo porcentaje de compuestos fenólicos presentes en el producto líquido del pretratamiento, es posible generar la hipótesis de la utilización del hidrolizado o producto líquido del pretratamiento, en la producción de carbohidratos celulósicos y no celulósicos a través de hidrólisis enzimática (Chang y Holtzapple, 2000; Domínguez, 2003).
1La lignina es la sumatoria de acido hidroxibenzico, 4-hidroxibenzaldehido, ácido vainillínico, vanillina, ácido siríngico, ácido p-cumárico, siringaldehido y ácido ferúlico
2 Porcentajes con respecto al contenido de glucosa, xilosa y lignina presentes en la biomasa sin pretratar.
Hidrólisis enzimática
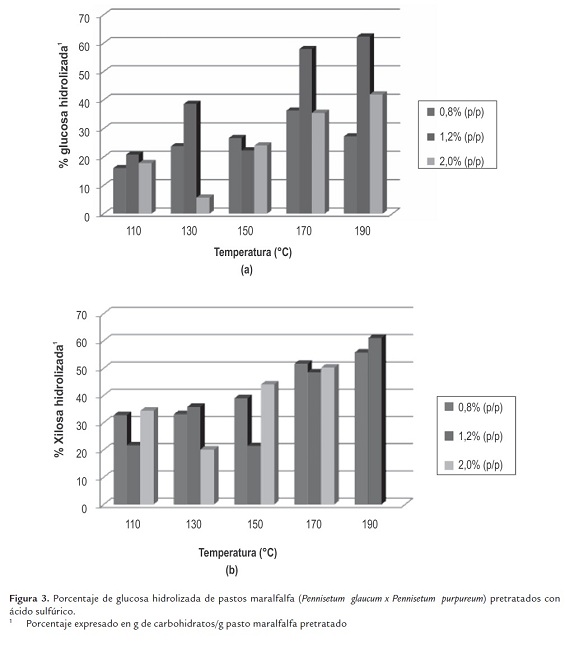
Comparando los porcentajes de glucosa y xilosa hidrolizados del pasto pretratado mostrados en la figura 3 , se observa la importancia de la temperatura a la cual se realizó el pretratamiento, indicando que es una variable altamente influyente en el porcentaje de glucosa hidrolizada. Para cualquier concentración de ácido sulfúrico, el porcentaje más bajo de hidrólisis se obtiene a la menor temperatura de pretratamiento, para este estudio 110°C.
La hidrólisis enzimática del pasto sin pretratar produjo el 12.90 % de glucosa y el 18.94 % de la xilosa presente en el pasto, equivalente a 0.044 g de glucosa y 0.043 g de xilosa por g de pasto maralfalfa. Mientras que los pastos pretratados con ácido sulfúrico, previamente a la hidrólisis enzimática, reportaron rendimientos de hidrólisis de glucosa y xilosa mayores. Los rendimientos más bajos corresponde al pasto pretratado a la menor temperatura y concentración de ácido (110°C y 0.8 % (p/p)), logrando el 16.07 y 32.83 % de glucosa y xilosa hidrolizada, respectivamente.
El pasto pretratado a 190°C y 1.2 % (p/p) fue el de mayor rendimiento, dando lugar a la hidrólisis del 62.34% de glucosa y 61.09 % de xilosa presentes en el material pretratado, equivalente a 0.128 g de glucosa y 0.006 g de xilosa por g de pasto maralfafa.
Los resultados obtenidos demuestran la importancia del pretratamiento para aumentar la hidrólisis de glucosa a partir del pasto maralfalfa, logrando incrementar la hidrolisis de glucosa 2.9 veces, con respecto al pasto sin pretratar.
El máximo porcentaje de glucosa hidrolizada del pasto maralfalfa, es inferior al resultado reportado por Dien et al. (2006), quienes investigaron el efecto del pretratamiento con ácido sulfúrico diluido y la hidrólisis utilizando la misma combinación de enzimas, sobre otras especies de pastos, tales como el Switchgrass y el Reed canarygrass, obteniendo 83.8 % y 75.4 % de recuperación de glucosa, respectivamente.
Según lo reportado en la literatura, el contenido de lignina insoluble en ácido, puede ser utilizado en la predicción del porcentaje de carbohidratos estructurales en el material pretratado, con un coeficiente de correlación superior al 80%. También, que el procesamiento de pastos menos maduros es más eficiente en la hidrólisis de glucosa (Torget et al., 1990; Dien et al., 2006)
Hidrólisis y fermentación simultánea
La concentración de celulosa por acción del pretratamiento con ácido sulfúrico en pasto pretratado favorece la producción de etanol, logrando el 60.7 % del rendimiento teórico esperado, lo que indica una producción de 0.117 g de etanol por g de pasto pretratado.
El efecto de pretratamiento con ácido sulfúrico sobre el pasto maralfalfa se evidenció en la diferencia entre la producción de etanol en un proceso de hidrólisis y fermentación del pasto sin pretratar y pretratado. En el proceso de hidrólisis y fermentación del pasto sin pretratar se obtuvo un rendimiento de 0.002 g de etanol por g de pasto, lo cual es 58.5 veces menos que con el pasto pretratado a 190ºC y 1.2 % (p/p) de ácido sulfúrico.
Conclusiones
El pasto maralfalfa (Pennisetum glaucum x Pennisetum purpureum) contiene 0.375 g de glucosa y 0.232 g de xilosa, por g de materia seca, es decir, un total de 0.607 g de carbohidratos por g de biomasa seca. Las mejores condiciones de operación para realizar el pretratamiento son 190°C y 1.2 % (p/p) de ácido sulfúrico, con las cuales se obtiene sólidos con 39.68 % de celulosa y 1.85 % de hemicelulosa, el cual al ser hidrolizado con Trichoderma resei y Aspergillus niger produce 0.128 g de glucosa y 0.006 g de xilosa por g de pasto maralfalfa. El proceso de hidrólisis y fermentación simultánea del pasto pretratado a estas condiciones produce 0.117 g de etanol por g de pasto pretratado.
Los pretratamientos realizados a temperaturas intermedias, entre 130 y 150ºC, producen el mayor porcentaje de monosacáridos hidrolizados en la fracción líquida obtenida, predominando la xilosa - arabinosa. En tanto que en los pretratamientos realizados a altas temperaturas se presenta la formación de componentes inhibitorios de la fermentación, logrando la degradación del 2.89 % de la xilosa - arabinosa a furfural y la degradación del 1.00 % de la glucosa a 5 - HMF. El porcentaje de lignina degradada corresponde al 0.30 %.
Referencias bibliográficas
1 Canettieri E., Rocha G., Carvalho J., Silva J. 2007. Evaluation of the kinetics of xylose formation from dilute sulfuric acid hydrolysis of forest residues of Eucalyptus grandisr. Industrial & Enginnering Chemistry Research. 46(7): 1938-1944. [ Links ]
2 Chang V.; Holtzapple M. 2000. Fundamental factors affecting biomass enzymatic reactivity. Applied Biochemistry and Biotechnology. 84-86: 5 - 37. [ Links ]
3 Clavero T., Razz R. 2009. Valor nutritivo del pasto maralfalfa (Pennisetum Purpureum x Pennisetum Glaucum ) en condiciones de defoliación. Revista de la Facultad de Agronomía de la Universidad del Zulia. 26: 78-87. [ Links ]
4 Dien B. 2010. Mass balances and analytical methods for biomass pretreatment experiments. En: Biomass to biofuels: strategies for global industries. Blackwell Publishing Ltd., Oxford, UK. Chapter 11. doi: 10.1002/9780470750025.ch11 [ Links ]
5 Dien B., Bothast, R. 2009. A primer for lignocellulose biochemical conversion to fuel ethanol. En: Industrially robust enzymes and microorganisms for production of sugars and ethanol from agricultural biomass. National Center for Agricultural Utilization Research. pp.73-93. [ Links ]
6 Dien B., Jung H., Vogel K., Casler M., Lamb J., Iten L., Mitchell R., Sarath G. 2006. Chemical composition and response to dilute-acid pretreatment and enzymatic saccharification of alfalfa, reed canarygrass, and switchgrass. Biomass and Bioenergy. 30(10): 880-891. [ Links ]
7 Dien B, Jung H., Vogel K., Casler M., Lamb J., Iten L., Mitchell R., Sarath G. 2005. Converting herbaceous energy crops to bioethanol; a review with emphasis on pretreatment processes. En: Handbook of Industrial Biocatalysis. Capítulo 23. Boca Raton, FL: Taylor & Francis Group. pp. 1-11. [ Links ]
8 Domínguez J. M. 2003. Efecto de los productos de degradación originados en la explosión por vapor de biomasa de chopo sobre Kluyveromyces marxianus. Madrid, Universidad Complutense de Madrid. Tesis doctoral. [ Links ]
9 Esteghlalian A., Hashimoto A., Fenske J., Penner M. 1997. Modeling and optimization of the dilute sulfuric acid pretreatment of corn stover, poplar and switchgrass. Bioresource Technology. 59 (2-3): 129-136. [ Links ]
10 Guo G., Chen W., Chen W., Men L., Hwang W. 2008. Characterization of dilute acid pretreatment of silvergrass pretreatment of silvergrass. Bioresource Technology. 99 (14): 6046-6053. [ Links ]
11 http://www1.eere.energy.gov/biomass/ethanol_yield_calculator.html.Consultado noviembre 20, 2010. [ Links ]
12 Lau M., Dale B. 2009. Cellulosic ethanol production from AFEX-treated corn stover using Saccharomyces cerevisiae 424A(LNH-ST). PNAS. 106(5): 1368-1373. [ Links ]
13 McMillan J.D. 1994. Pretreatment of Lignocellulosic Biomass. En: Enzymatic Conversion of Biomass for Fuels Production. Chapter 15. pp. 292-324. [ Links ]
14 Mármol J. 2006. Manejo de pastos y forrajes en la ganadería de doble propósito. En: Memorias del X Seminario Manejo y Utilización de Pastos y Forrajes en Sistemas de Producción Animal. FUNDAPASTO y Facultad de Ciencias Veterinarias de la Universidad de Zulia Maracaibo (Venezuela). [ Links ]
15 Marzialetti T., Valenzuela M., Sievers C., Hoskins T., Agrawal P., Jones C. 2008. Dilute Acid Hydrolysis of Loblolly Pine: A Comprehensive Approach. Industrial & Enginnering Chemistry Research. 47(19): 7131-7140. [ Links ]
16 Morinelly J., Jesen J., Browne M., Co T., Shonnard D. 2009. Kinetic Characterization of Xylose Monomer and Oligomer Concentrations during Dilute Acid Pretreatment of Lignocellulosic Biomass from Forests and Switchgrass. Industrial & Enginnering Chemistry Research. 48: 9877-9884. [ Links ]
17 Mosier N., Wyman C., Dale B., Elander R., Lee Y., Holtzapple M., Ladisch M. 2005. Features of promising technologies for pretreatment of lignocellulosic biomass. Bioresource Technology. 96: 673-686. [ Links ]
18 Palmqvist E., Hagerdal B. 2000. Fermentation of lignocellulosic hydrolysates. II: inhibitors and mechanisms of inhibition. Bioresource Technology. 74(1): 25-33. [ Links ]
19 Schell D., Farmer J., Newman M., McMillan J. 2003. Dilute-Sulfuric Acid Pretreatment of Corn Stover in Pilot-Scale Reactor. Applied Biochemistry and Biotechnology. 105(1): 69-85. [ Links ]
20 Sluiter A.D., Hames B.R., Ruiz R.O., Scarlata C.J., Sluiter J.B., Templeton D.W. 2008a. Determination of Ash in Biomass: Laboratory Analytical Procedure (LAP).NREL/TP-510-42622. Golden, CO: National Renewable Energy Laboratory. [ Links ]
21 Sluiter A.D., Hames B.R., Ruiz R.O., Scarlata C., Sluiter J.B., Templeton, D.W., Crocker, D. 2008b. Determination of Structural Carbohydrates and Lignin in Biomass: Laboratory Analytical Procedure (LAP). NREL/TP-510-42618. Golden, CO: National Renewable Energy Laboratory. [ Links ]
22 Sluiter A.D., Ruiz R.O., Scarlata C.J., Sluiter, J.B., Templeton D.W. 2008c. Determination of Extractives in Biomass: Laboratory Analytical Procedure (LAP).NREL/TP-510-42619. Golden, CO: National Renewable Energy Laboratory. [ Links ]
23 Sun Y., Cheng J. 2002. Hydrolysis of lignocellulosic materials for ethanol production: a review. Bioresource Technology. 83(1): 1-11. [ Links ]
24 Sun Y., Cheng J. 2002. Hydrolysis of lignocellulosic materials for ethanol production: a review. Bioresource Technology. 83(1): 1-11. [ Links ]
25 Yang Y. 2008. Ethanol Production Potential of Acid Pretreated Switchgrass Varieties. Biological and Agricultural Engineering. Raleigh, NC, North Carolina State University. Master of Science. [ Links ]
26 Yang B., Wyman C. 2008. Pretreatment: the key to unlocking low-cost cellulosic ethanol. Biofuels, Bioproducts & Biorefining. 2: 26-40. [ Links ]
27 Yat S., Berger A., Shonnard D. 2008. Kinetic characterization for dilute sulfuric acid hydrolysis of timber varieties and switchgrass. Bioresource Technology. 99: 3855-3863. [ Links ]
28 Weiss N., Farmer J., Schell D. 2010. Impact of corn stover composition on hemicellulose conversion during dilute acid pretreatment and enzymatic cellulose digestibility of the pretreated solids. Bioresource Technology.101: 674-678. [ Links ]