Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.14 no.1 Bogotá Jan./June 2012
ARTÍCULO DE INVESTIGACIÓN
Evaluación de microorganismos con potencial de promoción de crecimiento vegetal y biocontrol de Spongospora subterranea
Evaluation of microorganisms with potential for plant growth promotion and biological control of Spongospora subterranea
Juliana Soler Arango1, Elizabeth Gilchrist Ramelli2, Juan Carlos Pérez Naranjo3.
1 Ingeniera Biológica, Universidad Nacional de Colombia, sede Medellín. Laboratorio de Microbiología del suelo19A - 311, (57) (4) 4309389, Calle 59A No 63 - 20 Núcleo El Volador, Medellín, Colombia. E-mail: jsoler@unal.edu.co
2 Doctora en Ciencias Agrarias Universidad Nacional de Colombia, sede Medellín. Laboratorio de Microbiología del suelo y Corporación Universitaria Lasallista elygilchrist@hotmail.com
3 Ph.D. Profesor asociado Escuela de Geociencias, Universidad Nacional de Colombia, sede Medellín. Laboratorio de Microbiología del suelo. jcperez@unal.edu.co
Recibido: marzo 29 de 2012 Aprobado: junio 29 de 2012
Resumen
La sarna polvosa de la papa es causada por el patógeno Spongospora subterranea, que disminuye la calidad y producción de tubérculos y facilita la entrada de otros patógenos. Esta enfermedad afecta las principales zonas productoras del mundo, debido a la falta de tratamientos efectivos contra el patógeno y al comercio de tubérculos-semilla infectados. Algunas investigaciones indican que los agentes biocontroladores podrían contribuir a reducir la actividad de S. subterranea a través de efectos sobre la viabilidad de sus quistosoros o mediante efectos estimulantes del crecimiento de la planta. En este estudio se emplearon bacterias aisladas del interior de raíz, rizósfera y superficie de tubérculos de un cultivo de papa ( Solanum tuberosum variedad Diacol Capiro) y seleccionadas por su capacidad para producir indoles totales y quitinasas. En estudios paralelos se determinó su capacidad para promover la velocidad de germinación en brotes de tubérculos o para controlar S. subterranea en raíces y promover el crecimiento vegetal de plántulas en invernadero. La mayoria de los aislamientos evaluados incrementraron la longitud de brotes de tubérculos en el laboratorio. En el invernadero, en suelo no estéril y en presencia del patógeno, se encontró que 2 de los 10 aislamientos seleccionados por su capacidad para producir indoles totales y quitinasas, presentaron promoción de crecimiento vegetal y posible biocontrol del patógeno. Estos resultados sugieren un gran potencial para la selección de microorganismos biocontroladores y desarrollo de bioproductos a partir de recursos microbiológicos locales.
Palabras clave: sarna polvosa de la papa, indoles totales, quitinasas, control biológico.
Abstract
The powdery scab of potato is caused by the pathogen Spongospora subterranea which reduces the quality and yield of tubers and facilitates the establishment of other pathogens. This disease affects main potato production zones in the world, because there is not a completely effective and available control method against the disease, and due to the trading of infested seed tubers. Some research suggests that biological control agents could reduce the activity of S. subterranea through effects on the viability of their cystosoris or zoospores or by stimulating plant growth. In this research, bacteria previously isolated, from inside the roots, the rhizosphere and tuber peel of potato plants (Solanum tuberosum var. Diacol Capiro), were used, and then selected according to their capacity for producing total indoles and chitinases. Here was tested in parallel studies the capacity of nine bacterial isolates differing in total indole and chitinase production, for its capacity at increasing tuber sprout length and in promoting plant growth and biocontrol of S. subterranea. Inoculated in excised minitubers in laboratory most indole producing isolates tested resulted in increased tuber sprout length. In the greenhouse assay, in non-sterile soil and under a high pathogen pressure, two of the ten isolates selected because for their ability to produce total indoles and chitinases, showed plant growth promotion and possible biocontrol of the pathogen. These results suggest a great potential for the selection of biocontrol microorganisms and the development of new bioproducts from local microbial resources.
Key words: powdery scab of potato, total indole, chitinases, biological control, PGPR.
Introducción
La sarna polvosa de la papa es causada por el patógeno Spongospora subterranea f. sp. subterranea , que depende de la presencia de raíces y tubérculos de papa para completar su ciclo de vida (Harrison et al., 1997; van de Graaf et al., 2007). El patógeno disminuye la calidad y producción de los tubérculos hasta en un 40% (Merz y Falloon 2009; Gilchrist et al., 2009, 2011), facilita la entrada de otros patógenos (Karling 1942; Montero-Astúa y Vasquéz 2008; Falloon 2008) y afecta su calidad cosmética (Merz y Falloon 2009). Actualmente, esta enfermedad afecta las principales zonas productoras de papa del mundo, debido a la falta de tratamientos efectivos contra este patógeno y al comercio de tubérculos-semilla infectados (Harrison et al., 1997; Merz 2008), alarmando tanto a productores como a investigadores. S. subterranea forma estructuras de resistencia llamadas quistosoros, que pueden permanecer latentes en el suelo durante años hasta encontrar condiciones adecuadas (Harrison et al., 1997; Merz et al., 2005; Qu y Christ 2006; Merz y Falloon 2009). Algunas investigaciones indican que los agentes de control biológico reducirían la actividad de S. subterranea , posiblemente a través de efectos sobre la viabilidad de los quistosoros y las zoosporas o mediante efectos estimulantes en el crecimiento de la planta (Nielsen y Larsen 2004; Hoyos et al., 2008; Restrepo et al., 2009). Sin embargo, la eficacia del control biológico de la sarna polvosa en el campo aún no se ha demostrado (Merz y Falloon 2009). Los métodos de biocontrol pueden presentarse por interacciones directas entre el patógeno y los agentes biocontroladores, como por la síntesis de enzimas líticas tales como las quitinasas, o puede presentarse estimulación del crecimiento vegetal por interacción entre los agentes y la planta, como en el caso de la producción de fitohormonas. Ambos casos resultan en efectos positivos en el crecimiento y desarrollo vegetal (Jollè y Muzzarelli 1999; Benítez et al., 2004; Gohel et al., 2006; Bhattacharya et al., 2007; Paul 2007). Los organismos quitinolíticos son capaces de degradar la quitina por producción de enzimas de tipo quitinasas. Las quitinasas están involucradas en el control biológico de patógenos como hongos e insectos, debido a que son capaces de degradar estructuras vitales como la membrana de insectos y la pared celular de hongos o de liberar compuestos que desencadenan respuestas de defensa (Jollè y Muzzarelli 1999; Singh et al., 1999; Compant et al., 2005; Gohel et al., 2006; Bhattacharya et al., 2007); en este caso de estudio se espera que las quitinasas degraden la quitina presente en las estructuras de resistencia de S. subterranea (Down et al., 2002). Por otra parte, el ácido 3-indol acético (AIA) es un indol producido por algunas bacterias que promueve el desarrollo de raíces, estimula el crecimiento vegetal, es responsable de la división, expansión y diferenciación de las células y tejidos de las plantas y estimula la germinación de semillas (Koshiba y Matsuyama 1993; Tsavkelova et al., 2006; Martínez-Viveros et al., 2010).
En estudios anteriores (Soler, 2012) se aislaron microorganismos del interior de la raíz, la rizósfera, la superficie de tubérculos o del suelo de un cultivo de papa (Solanum tuberosum variedad Diacol Capiro), encontrando microorganismos con una producción diferencial de indoles o quitinasas según el sitio de aislamiento de éstos. Los microorganismos del interior de la raíz presentaron la mayor producción de indoles totales y quitinasas, comparados con los aislados de tubérculos y suelo. Debido a que los aislamientos con potencial biocontrolador se pueden seleccionar preliminarmente según su actividad productora de indoles o quitinasas, esta investigación tuvo como objetivo incluir nueve aislamientos bacterianos productores de indoles totales en un experimento para evaluar el posible efecto en la velocidad de germinación de tubérculos de papa Solanum tuberosum variedad Diacol Capiro. En un estudio paralelo se realizó un experimento en invernadero con plántulas de papa Diacol Capiro sembradas en suelo no estéril e infestado naturalmente con el patógeno e inoculadas con bacterias productoras de indoles totales y quitinasas, para determinar el potencial biocontrolador de dichas bacterias sob Spongospora subterranea y para promover el crecimiento vegetal.
Metodología
Aislamiento previo de los microorganismos
Para la preparación de los medios y el aislamiento de los microorganismos, se muestrearon nueve plantas al azar de un cultivo de papa Solanum tuberosum variedad Diacol Capiro, sembrado en un suelo tipo Andisol, en la vereda la Madera del municipio de la Unión en el departamento de Antioquia, Colombia, de las que se tomaron raíces (raíz principal y raíces finas), suelo adherido a las raíces (suelo rizosférico), suelo y tubérculos. Las plantas muestreadas estaban en floración, estadío principal 6 (Meier 2001) y las muestras se almacenaron a 4 °C hasta su procesamiento posterior. Para aislar microorganismos se prepararon cuatro tipos de medios de cultivo: agar nutritivo al 50% (AN); papa glucosa agar (PGA) y agar extracto de raíz a dos concentraciones diferentes (ER1 y ER2). El PGA se preparó modificando el protocolo de Johnson et al., (1959), se hirvieron 200g de papa Diacol Capiro (con cáscara y cortada en cuadrados pequeños) en 1000 ml de agua destilada por 10 minutos, se filtró y se llevó a 1 l con agua destilada, se añadieron 20g de agar y 20g de glucosa. El agar extracto de raíz se preparó esterilizando 15g agar, 1g sacarosa comercial y 0.5g de K2HPO4 en 990 ml de agua destilada. Luego se agregaron 10 ml de extracto estéril de raíces con concentraciones de 1 o 10 g/l (ER1 y ER2, respectivamente). Para preparar el extracto de raíz se esterilizó previamente la superficie de la raíz por inmersiones sucesivas de 30 seg en etanol (70%), agua destilada estéril, 3 min en hipoclorito de sodio al 5% y agua destilada estéril. Luego se pesaron 1 ó 10g de raíces desinfectadas, se licuaron en 100 ml de agua estéril y se esterilizaron a través de un filtro de 0.2µm previamente autoclavado. En cada medio se aislaron microorganismos del interior de raíz, suelo rizosférico, suelo y superficie de tubérculos.
A los aislamientos bacterianos se les determinó la capacidad de producción de indoles totales. Los aislamientos se sembraron en medio TSA (agar tripticasa de soya) por 24 horas a 30°C con el fin de obtener colonias individuales. Se seleccionaron tres colonias de cada aislamiento y se transfirieron a un tubo con medio TSB suplementado con 500 ug/mL de L-triptofano y se incubaron en agitación constante (150 rpm, 48 horas, 30°C). Luego se centrifugaron a 4500 rpm por 15 minutos. A 1 mL del sobrenadante se adicionaron 4 mL de solución de Salkowsky (150 mL de H2SO4 al 99%, 250 mL de agua destilada y 7.5 mL de FeCl3*6H2O 0.5 M), se agitó hasta obtener una suspensión homogénea y se midió absorbancia en un espectrofotómetro a 530 nm. La concentración de indoles totales se determinó con una curva de referencia preparada con 10, 20, 30, 40 y 50 ug/mL de AIA diluido en etanol en una concentración 1 M. Se repitió el procedimiento a cada muestra para verificar los resultados.
Para evaluar la producción de quitinasas los aislamientos bacterianos se sembraron en un medio preparado con quitina como única fuente de carbono. La producción de quitinasas se evaluó de forma cuantitativa registrando el tamaño del halo de hidrólisis de la quitina de cada colonia diariamente por 10 días. El medio con quitina como única fuente de carbono se preparó modificando los métodos de Atlas (2005) y Cattelan (1999): 20.0 g/L de agar, 4.0 g/L de quitina coloidal, 0.7 g/L de K2HPO4, 0.5g/L de MgSO4·7H2O, 0.3 g/L de KH2PO4, 0.01 g/l de FeSO4·7H2O, 1.26 g/l de MnSO4, 0.001g/l de ZnSO4·7H2O; el pH se ajustó a 8.0 ± 0.2. La quitina se preparó por digestión de hojuelas de quitina en HCl durante 24 horas y realizando un lavado diario con agua destilada durante tres días para retirar los residuos del ácido.
Efecto de la inoculación de aislamientos bacterianos en la velocidad de germinación de tubérculos de papa
Para el incremento del inóculo se utilizó los medios descritos anteriormente para el aislamiento de cada microorganismo, agar nutritivo (AN), papa glucosa agar (PGA) o agar extracto de raíz (ER). Se inocularon en el respectivo medio de cultivo 25µl de la suspensión de microorganismos almacenados en solución salina a una concentración de 0.85%. A las 48 horas el inóculo se preparó agregando 3 ml de solución salina 0.85% sobre el cultivo, realizando un raspado de las unidades formadoras de colonia (UFC) y la suspensión recuperada se disolvió en 100 ml de solución salina 0.85%. Se tomó una muestra de 1 ml para estimar mediante conteos en microscopio el número de células inoculadas por ml.
Se cortaron fragmentos de aproximadamente 3.5 g de tubérculo de papa que incluían un brote, se sumergieron durante 30 min en 100 ml de la suspensión del inóculo bacteriano. Los fragmentos del control se sumergieron en solución salina 0.85% durante el mismo tiempo (testigo absoluto). Cada fragmento constituyó una repetición y se realizaron 8 repeticiones por aislamiento. Luego de la inoculación los fragmentos se almacenaron protegidos de la luz con papel absorbente y a temperatura ambiente.
Al inocular los fragmentos de tubérculo se midió la longitud inicial de los brotes, procedimiento que se repitió los días 3, 5 y 8, para determinar el porcentaje de incremento en su longitud.
El efecto de la inoculación se estimó mediante un análisis de medidas repetidas y se realizó una prueba de Dunnett para comparar los promedios de cada tratamiento con el del testigo absoluto. Para los análisis se empleó una versión de prueba del software Statistic10.0.
Promoción de crecimiento y biocontrol del patógeno Spongospora subterránea
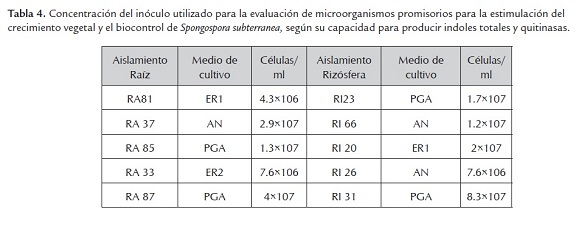
Se seleccionaron 10 aislamientos bacterianos aislados del interior de raíces y de suelo de la rizósfera, entre las que se encontraban productoras de indoles totales y/o quitinasas. El incremento del inóculo se realizó igual que en experimento de evaluación de incremento en la velocidad de germinación. Se tomó una muestra de 1 ml para realizar conteo de células inoculadas por ml.
Para obtener plántulas bajo condiciones de invernadero, se desarrolló un experimento en el Centro de Investigación y Desarrollo Tecnológico Paysandú, Universidad Nacional de Colombia, sede Medellín, localizado en el corregimiento de Santa Elena-Medellín (Antioquia), a una altitud de 2550 msnm. Se sembraron tubérculos tallados que crecieron durante 15 días en arena previamente tratada con agua hirviendo. Luego se separaron las plántulas de cada brote con sus raíces para ser inoculadas, para lo cual las raíces de cada planta se sumergieron en 200 ml del inóculo por 30 minutos; las raíces del control (testigo absoluto) se sumergieron en 200 ml de solución salina 0.85% durante el mismo tiempo. Posteriormente se sembraron 10 plantas por cada aislamiento en materas con 600 g de suelo naturalmente infectado con Spongospora subterranea en condiciones de invernadero.
La cantidad de inóculo de S. subterranea se estimó en 100 g de suelo secado durante 48 horas a 25 ± 3 ºC y tamizado sucesivamente en tres tamices de 600, 150 y 53 µm. Del tamizado resultante se tomó 0.1 g, se suspendió agregando agua corriente hasta 10 ml con agua de red y se agitó fuertemente; inmediatamente, 50 µl de esta suspensión se montaron en una cámara de Neubauer para contar los quistosoros utilizando un microscopio óptico. El resultado del conteo se expresó como quistosoros por gramo de suelo. En total se realizaron cinco conteos y se determinó el error estándar. Los quistosoros fueron reconocidos por su forma esférica irregular, por su estructura porosa y por su color ocre oscuro (Beltrán et al., 2009).
Se utilizó suelo derivado de cenizas volcánicas clasificado como Andisol. Las plantas fueron regadas dos veces por semana y cada maceta se fertilizó aplicando una vez por semana 40 ml de una solución preparada agregando a un litro de agua 1 gramo de un fertilizante foliar comercial (2% N-NO3, 5% N-NH4, 28% P2O5, 18% K2O, 2% MgO, 2% S-SO4, 0.2% B, 0.26 Cu, 0.2% Fe, 0,3% Mn, 0.3% Zn).
Se realizó un muestreo destructivo un mes después de la inoculación y se determinó el peso fresco foliar y de raíz, y el llenado de tubérculos al pesar los tubérculos en formación de cada tratamiento. Los datos fueron analizados por ANOVA después de probar los supuestos de normalidad y homocedasticidad, seguido por una prueba de Dunnett para comparar el promedio de cada variable con el tratamiento testigo.
Colonización de raíces y rizósfera por bacterias biocontroladoras
Para evaluar el establecimiento de los microorganismos inoculados, se determinó la colonización de raíces o rizósfera de los tratamientos más promisorios en la prueba de estimulación de crecimiento. Los microorganismos se re-aislaron de 4 plantas tomadas al azar inoculadas y del control. Para el suelo rizosférico se transfirió 1 g a un tubo con 9 ml de agua estéril, se mezcló y se transfirieron 100 µl a un tubo con 9.9 ml de agua estéril. Para aislar los microorganismos de la raíz se removió el suelo adherido y se lavaron con agua corriente, se pesaron 3 g y se esterilizaron por inmersión en etanol al 70 % por 30 seg, luego en hipoclorito de sodio al 3-5 % por 3 min y finalmente se realizaron lavados sucesivos con agua destilada estéril y un secado en papel toalla estéril; se maceraron las raíces en 3 ml de agua destilada estéril y se transfirió 1 ml del macerado a un tubo con 9 ml de agua estéril. Finalmente se transfirieron 20 µl de las diluciones a cajas de Petri con los medios de cultivo correspondiente a cada aislamiento y se distribuyeron uniformemente con asa de Digralsky. La incubación se realizó a temperatura ambiente y en oscuridad y se revisó el crecimiento diariamente para identificar los aislamientos según sus características morfológicas (forma, color, textura y elevación) y registrar el número colonias formadas.
Biocontrol del patógeno Spongospora subterranea
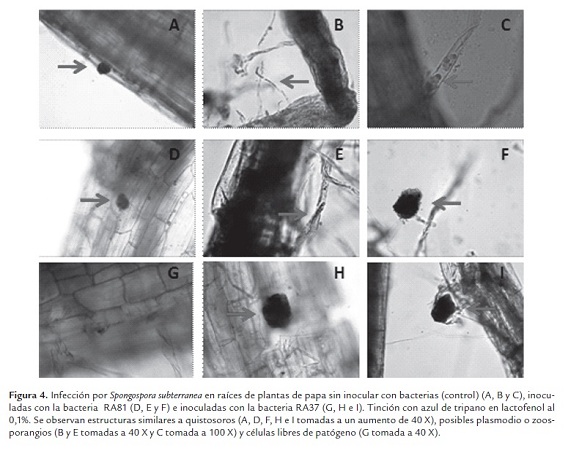
Para determinar si se presentó infección por Spongospora subterranea en las plantas inoculadas con los aislamientos mas promisorios, las raíces de las plantas muestreadas se lavaron con agua de red, a muestras de raíces finas se les adicionó azul de tripano en lactofenol al 0,1% durante 5 min y luego se lavaron con agua destilada, las raíces fueron examinadas usando un microscopio óptico en busca de quistosoros, plasmodios o zoosporangios (formas del ciclo de vida del patógeno) (Harrison et al., 1997; Falloon et al., 2003). El colorante tiñe de azul todos los tejidos de la planta y las estructuras dentro de las células vegetales. Con esta técnica se espera que las estructuras de S. subterranea se tiñan de un azul más intenso porque son más densas. Esta técnica no permite diferenciar entre las estructuras de S. subterranea con las de otros patógenos o simbiontes de las raíces y ya que requiere mucho tiempo solamente una parte del sistema radicular puede ser evaluada, por lo que esta técnica se utilizó solo para confirmar si se presentó infección y no para cuantificarla (van de Graaf et al., 2003).
La prueba serológica se realizó al suelo, a las plantas del control (sin inocular) y a las plantas inoculadas con las bacterias más promisorias para la estimulación de crecimiento y el biocontrol del patógeno. La prueba se basa en la técnica de inmunocromatografía de flujo lateral, utilizando anticuerpos monoclonales específicos para Spongospora subterranea f. sp. subterranea (Kit Sss-AgriStrip, BIOREBA®). Se siguieron las instrucciones del fabricante. Las muestras que contienen una alta concentración de patógenos generalmente producen tanto una línea de prueba fuerte como una línea de control fuerte, mientras que las pruebas con baja concentración de antígenos (patógenos) producen una línea de prueba más débil que la línea de control. Si solo aparece la línea de control, no existe ningún antígeno detectable presente en la muestra (BIOREBA, 2012).
Resultados
Efecto de la inoculación de aislamientos bacterianos en la velocidad de germinación de tubérculos de papa
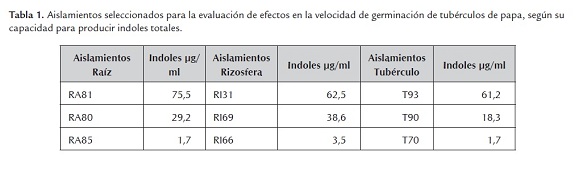
Se evaluaron aislamientos de bacterias con producción variable de indoles totales según su capacidad para incrementar la longitud de brotes de tubérculos de papa Diacol Capiro en tres tiempos diferentes. Se seleccionaron bacterias, aisladas del interior de la raíz, la rizósfera y la superficie de los tubérculos, productoras de diferentes concentraciones de indoles totales/ml (tabla 1).
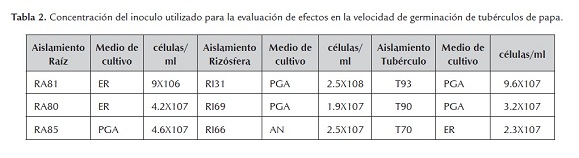
Para el incremento del inóculo se utilizaron los mismos medios con los que se aislaron los microorganismos. Se estimó mediante conteos en microscopio el número de células inoculadas por ml (tabla 2).
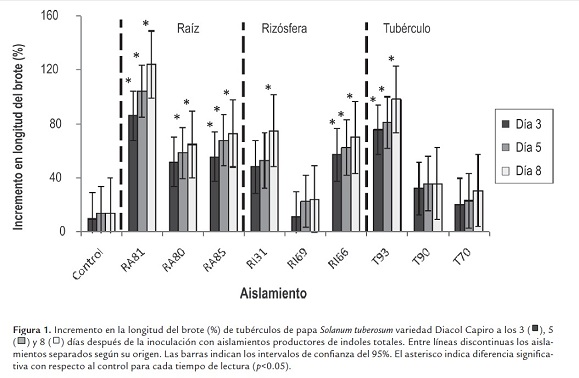
Los aislamientos RA81, RA85, RI66 y T93 presentaron un incremento significativo en la longitud del brote a partir del tercer día; el RA80 a partir del quinto día y el RI31 al octavo día de inoculación de los aislamientos (figura 1 ). No se presentó disminución en el número de brotes por efecto de la inoculación con las bacterias RA81 y T93 productoras de 75.5 y 61.2 µg/ml de indoles totales, respectivamente. Para los aislamientos RA81, RA85, RI66 y T93 no se presentaron diferencias significativas según el día de evaluación.
Promoción de crecimiento y biocontrol del patógeno Spongospora subterranea
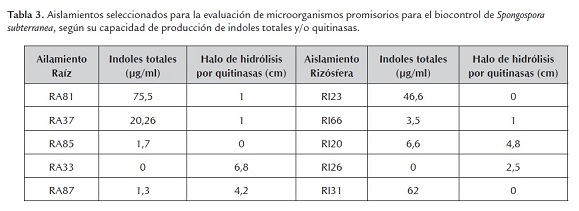
Se seleccionaron 10 aislamientos bacterianos aislados del interior de raíces y de suelo de la rizósfera, entre las que se encontraban productoras de indoles totales y/o quitinasas (tabla 3).
El incremento del inoculo se realizó igual que en experimento de evaluación de incremento en la velocidad de germinación. Se estimó mediante conteos en microscopio el número de células inoculadas por ml (tabla4).
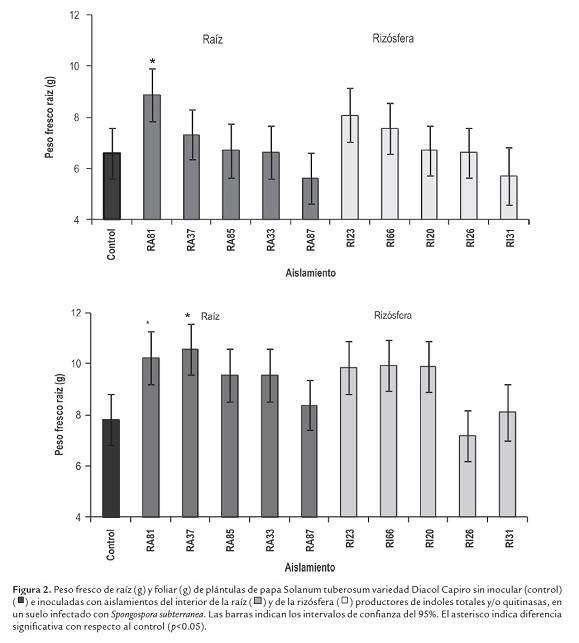
El peso fresco de raíces, foliar y de tubérculos (g) y el incremento en la longitud foliar (%) se determinaron mediante un muestreo destructivo a las cuatro semanas después de la siembra e inoculación. Para el peso fresco de raíz se encontró efecto significativo al inocular el aislamiento RA81, y para el peso fresco foliar al inocular los aislamientos RA81 y RA37 (figura 2 ).
Las plantas inoculadas con aislamiento RA37 presentaron mayor llenado de tubérculos, los otros tratamientos no presentaron diferencia significativa con el control (plantas sin inocular) (figura 3 ).
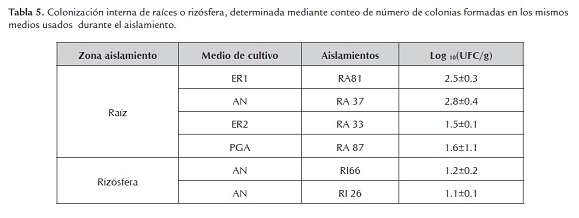
Para verificar el establecimiento de los microorganismos inoculados se determinó la colonización de las raíces de las plantas inoculadas con los aislamientos RA81, RA37, RA33 y RA87, y se determinó el establecimiento de los aislamientos RI66 y RI26 en la rizósfera, según sus características morfológicas. Se pudo determinar que cada aislamiento se estableció en el interior de la raíz o en la rizósfera (tabla 6).
Para mirar la infección del patógeno en las plantas inoculadas con los aislamientos más promisorios, se realizó una tinción de raíces en cuatro plantas del control, del aislamiento RA81 y del RA37 para detectar estructuras relacionadas con Spongospora subterranea indicó la presencia de quistosoros y posibles zoosporangios (figura 4 ).
La prueba serológica se realizó al suelo infectado con el patógeno donde fueron sembradas las plantas, a las raíces de las plantas del control (sin inocular) y a las plantas inoculadas con los aislamientos RA81 o RA37. En las raíces del control (plantas sin inocular y en presencia del patógeno) se presentó una línea de prueba tenue y una línea de control fuerte, mientras que en las plantas inoculadas con los aislamientos RA81 o RA37 solo se presentó la línea de control negativo (figura 5 ).
Discusión
Se determinó el incremento en la longitud de brotes de tubérculos de papa por efecto de la inoculación con bacterias productoras de diferentes concentraciones de indoles totales. Al inocular brotes de tubérculos de papa con las bacterias aisladas del interior de la raíz se presentó un incremento en la longitud del brote con respecto al control (tubérculos sin inocular), mientras que dos aislamientos de la rizósfera y solo uno de tubérculo presentaron incremento (figura 1 ). No se encontraron efectos deletéreos por altas concentraciones de indoles totales, por el contrario los mayores incrementos en la longitud del brote se encontraron al inocular aislamientos productores de altas concentraciones de indoles totales. En cuatro de los seis aislamientos que presentaron incremento en la longitud de los brotes, el efecto se detectó desde el tercer día y el incremento a través del tiempo no fue significativo.
Al llevar los microorganismos a condiciones de invernadero e interactuar con la planta y el patógeno, se encontró que de los 10 aislamientos bacterianos seleccionados por su capacidad para producir indoles totales y quitinasas, solo dos aislamientos presentaron promoción de crecimiento vegetal, la aplicación del aislamiento RA81 indujo al incremento del peso fresco de la raíz y de la parte foliar de la planta, y la aplicación del aislamiento RA37 al aumento en el peso fresco foliar y a un mayor llenado de tubérculos (figuras 2 y 3 ). Ambos aislamientos presentaron una alta producción de indoles totales/ml y tienen producción media de quitinasas (tabla 3), estos microorganismos fueron aislados del interior de las raíces de las plantas de papa. Otros aislamientos aunque presentaron alta producción de indoles o quitinasas no promovieron el crecimiento de la planta en presencia del patógeno. Ninguno de los aislamientos presentó alta producción simultánea de indoles y quitinasas, debido posiblemente al costo metabólico que implica expresar ambas funciones al mismo tiempo (Lang et al., 2009). Es posible que emplear microorganismos biocontroladores individualmente y en forma inundativa sea menos efectivo que emplearlos en conjunto con base en actividades biocontroladoras complementarias. Adicionalmente este enfoque en la identificación y caracterización de mecanismos individuales no ha permitido entender la naturaleza multifactorial del control biológico y la complejidad de la interacción planta-microorganismo (Kim et al., 2011). Se podrían emplear mezclas complementarias de microorganismos productores de actividades diferentes, de tal manera que los efectos conjuntos de los microorganismos actúen sobre la planta y el patógeno.
La cantidad de quistosoros detectada al inicio del experimento en suelo, se considera como un nivel de inóculo alto del patógeno, puesto que se ha estimado que con un inoculo mayor a 500 quistosoros/g de suelo es donde se presenta la mayor incidencia de la enfermedad en raíces (Merz 1993). La detección de quistosoros a nivel microscópico y la línea intensa en la prueba serológica confirman la alta concentración del patógeno en el suelo, la línea tenue en las raíces de las plantas del control garantizan el proceso de infección bajo las condiciones del experimento mientras que la ausencia de la doble línea en las raíces de las plantas tratadas con las bacterias RA81 y RA37 reflejan que éstas realizaron una función inhibitoria en el proceso de infección o mitigando la enfermedad.
El papel del AIA en el crecimiento y protección de las plantas, así como el de la inoculación en ellas de microorganismos productores de AIA o sus precursores han sido suficientemente documentados, pero no existe una estrategia bien definida para seleccionar y usar efectivamente estos microorganismos. Hernández et al., (2004) determinaron la actividad antagónica y la capacidad para producir AIA de las rizobacterias Pseudomonas fluorescens, Burkholderia sp. y Burkholderia cepacia, y encontraron estimulación del crecimiento del maíz con una producción entre 5.93 y 21.53 µg/ml de AIA. Barazani y Friedman (1999) midieron los efectos fitotóxicos y promotores de crecimiento de fracciones se AIA separadas por cromatografía de capa fina en raíces de plántulas de lechuga, se asumió que el efecto inhibitorio por bacterias deletéreas (DRB) o promotor por rizobacterias (PGPR) fue mediado por auxinas, donde el promedio de la concentración de AIA producido por las DRB fue 4,7 veces más alto que el producido por las PGPR. Encontraron altos niveles de AIA (76,6 µM o 132 µg/ml de AIA) en cuatro DRB que suprimieron el crecimiento de las raíces y cuatro aislamientos de PGPR produjeron concentraciones más bajas de AIA (16,4 µM o 28,3 µg/ml de AIA), pero no encontraron relación entre la concentración de AIA y el efecto en las raíces para algunos aislamientos. En nuestro trabajo se encontraron aislamientos productores de altas concentraciones de indoles totales en raíz y en la rizósfera que no fueron deletéreas, por el contrario, el aislamiento con la mayor producción de indoles totales (75.5 µg/ml) fue el único que presentó promoción de crecimiento foliar y de raíces, sin embargo no se encontró ninguna relación entre la concentración de indoles totales producidos por las bacterias y la promoción de crecimiento de la planta. A la fecha no se ha reportado la concentración de AIA que pueda llegar a ser deletérea para plantas de papa Solanum tuberosum. Ya que la medición colorimétrica de la técnica de Salkowski no es específica solo para el AIA, sino también a la medición de otros indoles como el ácido indolpirúvico y la indolacetamida (Glickmann y Dessaux 1995), es dificil encontrar una relación entre las medidas indirectas de las actividades y la promoción del crecimiento vegetal. Las pruebas de indoles totales y de halo de hidrólisis por quitinasas permiten tener una idea del contenido de estos compuestos y de su activiad en los microorganismos que se encuentran dentro o cerca de las raíces de la planta de papa, lo que puede dilucidar nuevas ideas para su uso dentro de las estrategias de control de enfermedades y estimulación de crecimiento.
Mientras que la mayoría de los aislamientos presentó promoción en la longitud de los brotes del tubérculo, los aislamientos promisorios productores de indoles totales y quitinasas no presentaron efecto en la promoción del crecimiento vegetal, lo que se puede deber a la influencia del patógeno, a la interacción con la planta y/o a la competencia dentro de la planta con otros microorganismos nativos, ya que un aislamiento no actúa solo en un espacio vacío, tiene que coexistir con una gran diversidad de microorganismos que pueden contribuir o antagonizar al biocontrol. En plantas, poblaciones microbianas interactúan con el hospedero que secreta metabolitos, sin embargo el efecto de la combinación de diversos organismos y sus diferentes metabolitos en la salud de la planta no se entiende en su totalidad y solo en pocos microorganismos productores de AIA in vitro se ha demostrado el impacto sobre la planta (Kim et al., 2011). Es necesario entender la distribución, la funcionalidad y las relaciones plantas microorganismo, es así como Reiter et al., (2002) establecieron que la estructura de la comunidad de bacterias endófitas de papa, esta correlacionada con la ausencia o presencia de un fitopatógeno. Sería necesario evaluar la producción de indoles totales y de quitinasas por microorganismos aislados desde el interior de la raíz hasta el suelo en plantas de papa Solanum tuberosum variedad Diacol Capiro sin la presencia del patógeno Spongospora subterranea, para establecer la influencia de éste en las comunidades microbianas.
Las dos bacterias promotoras de crecimiento vegetal encontradas en este trabajo son provenientes del interior de la raíz de plantas de papa. Sturz et al., (1999), sugieren que el funcionamiento de comunidades de bacterias endófitas contribuye a la resistencia de tubérculos de papa (Solanum tuberosum) a patógenos como Fusarium sambucinum, Fusarium avenaceum, Fusarium oxysporum Phytophthora infestans. Algunos estudios indican que el potencial de promoción del crecimiento es mayor en endófitos comparados con rizobacterias (Sessitsch et al., 2004), esta capacidad como agentes biocontroladores posiblemente se puede atribuir a que las bacterias endófitas colonizan un nicho ecológico similar al que colonizan los patógenos por lo que se adaptan mejor que bacterias de la rizósfera ya que están en contacto directo con las células del hospedero (Hallmann et al., 1997; Reiter et al., 2002; Sessitsch et al., 2004; Rosenblueth y Martínez-Romero 2006; Khan y Doty 2009). En conjunto los resultados sugieren que en este estado de desarrollo inicial de la enfermedad causada por S. subterranea , los efectos de los biocontroladores sobre la planta podrían ser más relevantes que los efectos directos sobre el patógeno o sus estructuras de infección o de resistencia.
Se ha demostrado que el establecimiento de las poblaciones bacterianas y la producción de los metabolitos son importantes para el éxito del control biológico de patógenos, es necesario un umbral de densidad poblacional de bacterias para tener una supresión de la enfermedad significativa y una pequeña disminución en el tamaño de la población podría reducir dramáticamente los niveles de protección (Johnson 1994; Kim et al., 2011). En este estudio se encontró que todos los aislamientos colonizaron el interior de la raíz y la rizósfera, pero no todos los aislamientos presentaron promoción del crecimiento vegetal. En general, las bacterias que más colonizaron fueron aisladas del interior de la raíz en comparación con las de la rizósfera (tabla 5), esto podría deberse a que el interior de la raíz provee un ambiente mucho más estable que la rizósfera, donde las bacterias sufren cambios fuertes de pH, T y humedad (Hallmann et al., 1997). No se encontró ninguna relación entre la concentración del inoculo inicial (células/ml) y la colonización de las bacterias (tabla 4 y 5), ya que las bacterias que más colonizaron (RA81 y RA37) no fueron las que mayor concentración de inóculo recibieron. Se ha observado que la producción de metabolitos secundarios in vitro en medios enriquecidos es inestable ya que en estos medios aparecen mutantes espontáneos, con mutaciones en los genes responsables de la producción de metabolitos secundarios que puede influenciar el metabolismo primario y secundario de la bacteria, estos mutantes presentan pérdidas en la capacidad de inhibición del patógeno y algunas actividades antimicrobianas (Duffy y Défago 2000; Chancey et al., 2002; Kim et al., 2011). La ocurrencia de mutantes en medios enriquecidos puede reducir la eficacia del controlador biológico o los mutantes pueden desplazar los aislamientos nativos. Chancey et al., (2002) encontraron que los mutantes desplazan a los nativos en el medio enriquecido y en suelo estéril, pero no en la rizósfera donde tiene que competir con la microflora nativa. Mientras que Natsch et al., (1994) encontraron que la supervivencia de los mutantes no difiere de la de los nativos en la rizósfera de varios suelos. Duffy y Défago (2000) encontraron que la eficiencia del inoculo biocontrolador fue reducido por la contaminación de mutantes durante la producción del inoculo en medios enriquecidos y que la aparición de estos mutantes se puede disminuir si se utilizan medios con bajas concentraciones de nutrientes, que reflejan mejor las condiciones naturales del entorno donde se aíslan los microorganismos, donde los nutrientes son a menudo limitados. Es posible que al intentar aumentar el inoculo para las pruebas en invernadero se hayan generado mutantes espontáneos y se haya perdido la capacidad de producción de indoles totales o de quitinasas y se pudo presentar un desplazamiento de las comunidades nativas productoras de la actividad. El aislamiento RA81 presentó la mayor colonización de las raíces, presentó promoción de crecimiento vegetal y es un posible biocontrolador del patógeno Spongospora subterranea, esta bacteria fue aislada e incrementada en condiciones pobres de nutrientes, en un medio con extractos de la raíz de la papa, es posible que este medio de cultivo haya limitado la aparición de mutantes deficientes en la producción de ambas actividades, es necesario estudiar más a fondo la producción de estos metabolitos y el posterior establecimiento y actividad de los aislamientos en la planta.
Conclusiones
Se encontraron dos bacterias promotoras de crecimiento vegetal que posiblemente permitan mitigar los efectos de la enfermedad causada por el patógeno Spongospora subterranea, las cuales fueron aisladas del interior de la raíz de una planta de papa Solanum tuberosum variedad Diacol Capiro y seleccionadas por su capacidad de producción de indoles totales y de quitinasas. El aislamiento RA81 incrementó el peso foliar y de raíces de las plantas inoculadas con éste, mientras que el RA37 presentó un aumento en la formación de tubérculos que podría resultar en una mayor producción respecto a las plantas infectadas con el patógeno y sin inocular con estos aislamientos. La prueba serológica de raíces tratadas con ambas bacterias y en presencia del patógeno fue negativa. Es necesario evaluar estos aislamientos en condiciones de campo y su especificidad en cuanto al patosistema Spongospora subterranea- papa.
Agradecimientos
Los autores agradecen el apoyo logístico o económico del posgrado en ciencias-Biotecnología y los laboratorios de microbiología del suelo y control biológico de la Universidad Nacional de Colombia y al laboratorio de biotecnología de la Universidad EAFIT, sede Medellín. Colciencias otorgó la beca Jóvenes Investigadores e Innovadores a Juliana Soler. Agradecemos a la Doctora Sonia Jaramillo por su motivación para trabajar con Spongospora subterranea. La versión final del manuscrito se enriqueció con las recomendaciones de los tres evaluadores anónimos.
Bibliografía
1 Barazani O., Friedman J. 1999. Is IAA the major root growth factor secreted from plant-growth-mediating bacteria?. Journal of Chemical Ecology. 25 (10): 2397-2406. [ Links ]
2 Beltrán E., Gilchrist E., Jaramillo S., Reynaldi S. 2009. Influencia de las condiciones de incubación sobre la activación de zoosporas de Spongospora subterranea, en busca de un inóculo para el estudio de la sarna polvosa. Revista Facultad Nacional de Agronomía Medellín. 62 (2): 5055-5062. [ Links ]
3 Benítez T., Rincón A.M., Limón M.C., Codón A.C. 2004. Biocontrol mechanisms of Trichoderma strains. International Microbiology. 7: 249- 260. [ Links ]
4 Bhattacharya, D., Nagpure A., Gupta R.K. 2007. Bacterial Chitinases: Properties and Potential. Critical Reviews in Biotechnology. 27 (1): 21- 28. [ Links ]
5 BIOREBA. 2012. En: AgriStrip Product Information: Spongospora subterranea (Sss). http://www.bioreba.com/popup.php?docFile=http://www.bioreba.ch/files/Product_Info/AgriStrip/Sss_AgriStrip_edf.pdf. Visitada Enero 2012. [ Links ]
6 Cattelan, A.J. 1999. Métodos cuantitativos para determinação de características bioquímicas e fisiológicas associadas com bactérias promotoras do crescimento vegetal. Embrapa, Londrina, 36 p. [ Links ]
7 Chancey S.T., Wood D.W., Pierson E.A., Pierson L.S. 2002. Survival of GacS/GacA mutants of the biological control bacterium Pseudomonas aureofaciens 30-84 in the wheat rhizosphere. Applied and Environmental Microbiology. 68 (7): 3308-3314. [ Links ]
8 Compant S., Duffy B., Nowak J., Clément C., Barka E.A. 2005. Use of Plant Growth-Promoting Bacteria for Biocontrol of Plant Diseases: Principles, Mechanisms of Action, and Future Prospects. Applied and Environmental Microbiology. 71 (9): 4951-4959. [ Links ]
9 De Leij F.A.A.M., Whipps J.M., Lynch J.M. 1994. The use of colony development for the characterization of bacterial communities in soil and on roots. Microbial Ecology 27:81-97. [ Links ]
10 Di Mattia E., Grego S., Cacciari I. 2002. Eco-physiological characterization of soil bacterial populations in different states of growth. Microbial Ecology 43: 34-43. [ Links ]
11 Down G.J., Grenville L.J., Clarkson J.M. 2002. Phylogenetic analysis of Spongospora and implications for the taxonomic status of the plasmodiophorids. Mycological Research. 106 (9): 1060-1065. [ Links ]
12 Duffy B.K., Défago G. 2000. Controlling instability in gacS-gacA regulatory genes during inoculant production of Pseudomonas ?uorescens biocontrol strains. Applied and Environmental Microbiology. 66 (8): 3142-3150. [ Links ]
13 Falloon R.E., Genet A.R., Wallace A.R., Butler R.C. 2003. Susceptibility of potato (Solanum tuberosum) cultivars to powdery scab (caused by Spongospora subterranea f. sp. subterranea), and relationships between tuber and root infection. Australasian Plant Pathology. 32 (3): 377-385. [ Links ]
14 Falloon R.E. 2008. Control of Powdery Scab of Potato: Towards Integrated Disease Management. American Journal of Potato Research. 85: 253-260. [ Links ]
15 Gilchrist E., Jaramillo S., Reynaldi S. 2009. Efecto sobre la sarna polvosa de cuatro aislamientos del hongo Trichoderma asperellum en tres tipos de suelo. Revista Facultad Nacional de Agronomía Medellín. 62 (1): 4783-4792. [ Links ]
16 Gilchrist E., Soler J., Merz U., Reynaldi S. 2011. Powdery scab effect on the potato Solanum tuberosum ssp. Andigena growth and yiel. Tropical Plant Pathology. 36 (6): 350-355 [ Links ]
17 Glickmann E., Dessaux Y. 1995. A critical examination of the specificity of the Salkowski reagent for indolic compounds produced by phytopathogenic bacteria. Applied and Environmental Microbiology. 61 (2): 793-796. [ Links ]
18 Gohel V., Singh A., Vimal M., Ashwini P., Chhatpar H.S. 2006. Bioprospecting and antifungal potential of chitinolytic microorganisms. African Journal of Biotechnology. 5: 54-72. [ Links ]
19 Hallmann J., Quadt-Hallmann A., Mahaffee W.F., Kloepper J.W. 1997. Bacterial endophytes in agricultural crops. Canadian Journal of Microbiology. 43: 895-914. [ Links ]
20 Harrison J.G., Searle R.J., Williams N.A. 1997. Powdery Scab Disease of Potato- A Review. Plant Pathology. 46: 1-25. [ Links ]
21 Hernández A., Rives N., Caballero A., Hernández A.N., Heydrich M. 2004. Caracterización de rizobacterias asociadas al cultivo del maíz en la producción de metabolitos del tipo AIA, sideróforos y ácido salicílico. Revista Colombiana de Biotecnologia. 6 (1): 6-13. [ Links ]
22 Hoyos L.M., Jaramillo S., Orduz S. 2008. Evaluación de Trichoderma asperellum como biorregulador de Spongospora subterranea f. sp. subterranea. Revista Facultad Nacional de Agronomía Medellín. 61 (2): 4496-4502. [ Links ]
23 Johnson K.B. 1994. Dose-response relationships and inundative biological control. Phytopathology. 84: 780-784. [ Links ]
24 Johnson L.F., Curl E.A., Bond J.H., Fribourg H.A. 1959. Methods for studing soil microflora plant disease relationships. Burgess publishing company. 178 p. [ Links ]
25 Jollè P., Muzzarelli R.A.A. 1999. Chitin and Chitinases. Boston, Birkhauser Verlag. p 171-179. [ Links ]
26 Karling J.S. 1942. The Plasmodiophorales. New York. Published by John S. Karling. p 144. [ Links ]
27 Khan Z., Doty S.L. 2009. Characterization of bacterial endophytes of sweet potato plants. Plant Soil. 322:197-207. [ Links ]
28 Kim Y.C., Leveau J., McSpadden-Gardener B.B., Pierson E.A., Pierson L.S., Ryu C.M. 2011. The multifactorial basis for plant health promotion by plant- associated bacteria. Applied and Environmental Microbiology. 77 (5): 1548-1555. [ Links ]
29 Koshiba T., Matsuyama H. 1993. An in vitro System of Indole-3-Acetic Acid Formation from Tryptophan in Maize (Zea mays) Coleoptile Extracts. Plant Physiology. 102: 1319-1324. [ Links ]
30 Lang G.I., Murray A.W., Botstein D. 2009. The cost of gene expression underlies a fitness trade-off in yeast. Proceedings of the National Academy of Sciences. 106 (14): 5755-5760. [ Links ]
31 Martínez-Viveros O., Jorquera M.A., Crowley D.E., Gajardo G., Mora M.L. 2010. Mechanisms and practical considerations involved in plant growth promotion by rhizobacteria. Journal of soil science and plant nutrition. 10 (3): 293-319. [ Links ]
32 Merz U. 1993. Epidemiological aspects of powdery scab of potatoes caused by Spongospora subterranea. In: Hiruki C (ed) Proceedings of the 2nd symposium of the International Working Group on Plant Viruses with Fungal Vectors, Montreal, Canada, July 25-27. p 104-106. [ Links ]
33 Merz U., Walsh J.A., Bouchek-Mechiche K., Oberhansli Th., Bitterlin W. 2005. Improved immunological detection of Spongospora subterranea. European Journal of Plant Pathology. 111: 371-379. [ Links ]
34 Merz U. 2008. Powdery Scab of Potato-Occurrence, Life Cycle and Epidemiology. Symposium paper. American Journal Potato Research. 85:241-246. [ Links ]
35 Merz U., Falloon R.E. 2009. Review: Powdery Scab of Potato-Increased Knowledge of Pathogen Biology and Disease Epidemiology for Effective Disease Management. Potato Research. 52: 17-37. [ Links ]
36 Montero-Astúa M., Vasquéz V. 2008. Incidence, Distribution, and Association of Spongospora subterranea and Potato mop-top virus in Costa Rica. Plant Disease. 92 (8): 1171-1176. [ Links ]
37 Natsch A., Keel C., Pfirter H. A., Hass D., Défago G. 1994. Contribution of the global regulator gene gacA to persistence and dissemination of Pseudomonas fluorescens biocontrol strain CHAO introduced into soil microcosms. Applied and Environmental Microbiology. 60 (7): 2553-25. [ Links ]
38 Nielsen S.L., Larsen J. 2004. Two Trichoderma harzianum -based bio-control agents reduce tomato root infection with Spongospora subterranea (Wallr.) Lagerh., f. sp. subterranea , the vector of Potato mop-top virus. Journal of Plant Diseases and Protection. 111(2): 145-150. [ Links ]
39 Paul E.A. 2007. Soil Microbiology, Ecology, and Biochemistry. Tercera Edición. USA, Academic Press. 535 p [ Links ]
40 Qu X., Christ B.J. 2006. The Host Range of Spongospora subterranea f. sp subterranea in the United States. American Journal of Potato Research. 83: 343-347. [ Links ]
41 Reiter B., Pfeifer U., Schwab H., Sessitsch A. 2002. Response of endophytic bacterial communities in potato plants to infection with Erwinia carotovora subsp. atroseptica. Applied and Environmental Microbiology. 68: 2261-2268. [ Links ]
42 Restrepo A.F., Jaramillo S., Cotes J.M. 2009. Efecto de dos microorganismos y un consorcio de micorrizas en combinación con viruta de pino sobre el control de sarna polvosa (Spongospora subterranea) en papa. Revista Facultad Nacional de Agronomía Medellín. 62 (2): 5047-5054. [ Links ]
43 Rosenblueth M., Martínez-Romero E. 2006. Bacterial endophytes and their interactions with hosts. Molecular Plant-Microbe Interactions. 19 (8): 827-837. [ Links ]
44 Sarwar M., Kremer R.J. 1995. Enhanced suppression of plant growth through production of L-tryptophan-derived compounds by deleterious rhizobacteria. Plant Soil. 172: 261-269 [ Links ]
45 Sessitsch A., Reiter B., Berg G. 2004. Endophytic bacterial communities of field-grown potato plants and their plant-growth-promoting and antagonistic abilities. Canadian Journal of Microbiology. 50: 239-249. [ Links ]
46 Singh P.P., Shin Y.C., Park C.S., Chung Y.R. 1999. Biological control of Fusarium wilt of cucumber by chitinolytic bacteria. Phytopathology. 89: 92-99. [ Links ]
47 Soler J. 2012. Selección y evaluación de microorganismos promisorios para el biocontrol del patogeno Spongospora subterranea, causante de la sarna polvosa de la papa. Medellín, Colombia. Trabajo de grado para optar al titulo de magister en Biotecnología. Universidad Nacional de Colombia sede Medellín. 97 p. [ Links ]
48 Sturz A.V., Christie B.R., Matheson B.G., Arsenault W.J., Buchanan N.A. 1999. Endophytic bacterial communities in the periderm of potato tubers and their potential to improve resistance to soil-borne plant pathogens. Plant Pathology. 48: 360-369. [ Links ]
49 Tsavkelova E.A., Klimova S.Y., Cherdyntseva T.A., Netrusov A.I. 2006. Microbial producers of plant growth stimulators and their practical use: a review. Applied Biochemistry and Microbiology. 42: 117-126. [ Links ]
50 Van de Graaf P., Lees A.K., Cullen D.W., Duncan J.M. 2003. Detection and quantification of Spongospora subterranea in soil, water and plant tissue samples using real-time PCR. European Journal of Plant Pathology. 109: 589-597. [ Links ]
51 Van de Graaf P., Wale S.J., Lees A.K. 2007. Factors affecting the incidence and severity of Spongospora subterranea infection and galling in potato roots. Plant Pathology. 56: 1005-1013 p. [ Links ]
52 Vaun McArthur J. 2006. Microbyal Ecology and Evolutionary approach. Academic Press. Primera edición p 146-148. [ Links ]