Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.14 no.2 Bogotá jul./dez. 2012
ARTÍCULO DE INVESTIGACIÓN
Cultivo de tejidos de Piper sp. (Piperaceae): Propagación, organogénesis y conservación de germoplasma in vitro
Tissue culture of Piper sp. (Piperaceae): in vitro propagation, organogenesis and germplasm conservation
Guillermo E. Delgado-Paredes1 , Massuo J. Kato2 , Nancy Vásquez-Dueñas3 , Julia Minchala-Patiño4 , Consuelo Rojas-Idrogo5.
1 Ph.D. Facultad de Ciencias Biológicas, Universidad Nacional Pedro Ruiz Gallo, Ciudad Universitaria, Juan XXIII 391, Lambayeque, Perú. guidelg2001@yahoo.es
2 Ph.D. Instituto de Química, Universidade de São Paulo, Av. Prof. Lineu Prestes, 748 - Bloco 11T, 05508-900, São Paulo, Brasil. majokato@iq.usp.br
3 Bióloga. Facultad de Ciencias Biológicas, Universidad Nacional Pedro Ruiz Gallo, Ciudad Universitaria, Juan XXIII 391, Lambayeque, Perú. dremys74@hotmail.com
4 Ing. Agr. Laboratorio de Micropropagación Vegetal, Área Agropecuaria y de Recursos Naturales Renovables, Universidad Nacional de Loja, Ecuador. jminchala@gmail.com
5 M.Sc. Facultad de Ciencias Biológicas, Universidad Nacional Pedro Ruiz Gallo, Ciudad Universitaria, Juan XXIII 391, Lambayeque, Perú. crojasi2001@yahoo.es
Recibido: mayo 15 de 2012 Aprobado: noviembre 21 de 2012
Resumen
En el Nuevo Mundo el género iPiper (Piperaceae) comprende al menos 500 especies en las que muchos compuestos biológicamente activos fueron identificados; es por ello que el estudio sobre la química y biosíntesis de los miembros de este género son de gran interés, donde el cultivo de tejidos in vitro juega un rol fundamental. El propósito de este trabajo fue desarrollar varios sistemas de cultivo in vitro, en diferentes especies de Piper, con la finalidad de propagarlas clonalmente y regenerarlas por organogénesis directa para el establecimiento de plantas en campo, y la conservación y transferencia internacional de germoplasma. La germinación de semillas alcanzó aproximadamente entre el 20 y el 99% después de 4 semanas de cultivo. La micropropagación fue realizada en medio de cultivo MS suplementado con sacarosa 3%, AIA 0,02 mg L-1 y AG3 0,02 mg L-1. El potencial morfogenético de explantes de raíz, peciolo, hoja, nudo y entrenudo fue investigado con la finalidad de desarrollar un protocolo confiable de regeneración de plantas. La conservación e intercambio internacional de germoplasma in vitro también fue realizado, entre Perú, Brasil y Ecuador.
Palabras clave: Germinación de semillas in vitro, intercambio internacional de germoplasma, morfogénesis, reguladores de crecimiento, semillas recalcitrantes.
Abstract
In the New World the genus Piper (Piperaceae) contains at least 500 species in which many biologically active compounds were identified; is why the study of the chemistry and biosynthesis in members of this genus are of interest, and here techniques in vitro tissue culture plays a fundamental role. The aim of this work was to establish several in vitro culture systems in different Piper species in order to propagate clonally and regenerate by direct organogenesis for the establishment the field plants, the conservation and international germoplasm exchange. The seed germination achieved approximately 20 - 99% after 4 weeks of culture. The micropropagation was performed on MS culture medium supplemented with sucrose (3%), IAA (0,02 mg L-1) and GA3 (0,02 mg L-1). Callus induction and morphogenetic potential of root, petiole, leaf, node and internode explants was investigated to develop a reliable plant regeneration protocol. The in vitro germplasm conservation and international germplasm exchange also was realized, between Perú, Brazil and Ecuador.
Key words: Germplasm international exchange, growth regulators, in vitro seeds germination, morphogenesis, recalcitrant seeds.
Introducción
La familia Piperaceae es considerada una de las más complejas y diversas entre las angiospermas basales, razón por la cual la definición del número de géneros y especies que la componen, su filogenia y modelo de diversidad floral es, en la actualidad, motivo de grandes controversias (Jaramillo y Manos, 2001). Para algunos autores, incluye 14 géneros y alrededor de 1950 especies (Mabberley, 1997), ampliamente distribuidas en ambos hemisferios. Comprende plantas herbáceas, arbustivas, algunas veces trepadoras y árboles. Conjuntamente con las Chlorantaceae y Saururaceae forman un grupo taxonómicamente aislado (Orden Piperales) de plantas relativamente arcaicas (Taylor y Hickey, 1992). Las especies americanas de Piperaceae se clasificaron en los géneros Lepianthes Raf. (Pothomorphe Miq.), Peperomia R. & P., Piper L., Sarcorhachis Trel. y Trianaeopiper Trel. (Tebbs, 1989), aunque en el Perú se han descubierto únicamente los géneros Peperomia, Piper y Sarcorhachis y 811 especies, de las cuales 528 son consideradas endémicas (Brako y Zarucchi, 1993); en el Ecuador los géneros Peperomia, Piper, Sarcorhachis y Trianaeopiper y 441 especies, con 134 especies endémicas (Callejas, 1999) y en el Brasil los géneros Ottonia, Peperomia, Piper, Pothomorphe y Sarcorhachis y 479 especies, sin precisarse el número de endémicas (Yuncker, 1972); posteriormente, las especies de Ottonia fueron incorporadas a Piper (Tebbs, 1989).
Las especies del género Piper tienen importancia comercial, económica y medicinal. Las semillas de P. nigrum constituyen la conocida "pimienta negra", utilizada como condimento en la preparación de alimentos. Otras especies son consideradas remedios para el dolor de estómago, para aliviar dolores de pecho, fiebre y afecciones hemorroides, como antiinflamatorio, en el tratamiento del asma, bronquits; igualmente se les reconocen actividad insecticida y fungicida (Parmar et al., 1997). Recientemente, extractos de varias especies de Piper, colectadas en Antioquia (Colombia), han mostrado una moderada actividad antiplasmodial y baja actividad citotóxica (Mesa et al., 2012), y en el Perú, varias especies de Piper conocidas con el nombre popular de "matico", "nudillo" o "palo soldado", son empleadas en la medicina tradicional en el tratamiento de constipados y neumonía, como antiinflamatorio, antiséptico, en el tratamiento de infecciones vaginales, dolencias digestivas y bronquiales (Brack, 1999).
La familia Piperaceae contiene metabolitos secundarios como los fenilpropanoides (Orjala et al., 1993), lignanos y neolignanos (Benevides et al., 1999), amidas alifáticas y aromáticas (Silva et al., 2002), alcaloides (Dodson et al., 2000), policétidos (Cheng et al., 2003) y cromenes (Lago et al., 2004). La mayoría de estos estudios se realizaron en el género Piper y en pocos casos en el género Peperomia (Kato y Furlan, 2007). La importancia de los compuestos químicos aislados en Piperaceae es notable, por ejemplo, el interés de los lignoides (lignanos, neolignanos y sustancias relacionadas) se debe a su amplia diversidad de actividades biológicas: antitumorales, antifúngicas, bactericidas, anti PAF y anti HIV (Ayres y Loike, 1990), así como las amidas, con destacado potencial como agentes insecticidas, moluscicidas y fungicidas (Dyer y Palmer, 2004).
En comparación con especies de importancia económica, los estudios en Piper han sido relativamente escasos. Trabajos pioneros como el de Mathews y Rao (1984) tuvieron escaso éxito debido a problemas de contaminación endógena y oxidación de los explantes. Posteriormente, se describió la inducción de diversas respuestas morfogénicas en P. auritum (Domínguez et al., 2006), P. betle, P. longum y P. nigrum (Philip et al., 1992; Bhat et al., 1995; Aminuddin-Johri et al., 1993; Soniya y Das, 2002; Sujatha et al., 2003; Hussain et al., 2011; Rani y Kumar, 2012), P. colubrinum (Kelkar et al., 1996; Kelkar y Krishnamurty, 1998), P. methysticum (Zhang et al., 2008; Maju y Soniya, 2012), P. solmsianum (Balbuena et al., 2009; Vásquez et al., 2010) y Pothomorphe umbellata (= Piper umbellatum) (Cesty et al., 2007). Asimismo, se indujo embriogénesis somática en alta frecuencia en P. nigrum y P. colubrinum (Yusuf et al., 2001; Nair y Gupta, 2006) y de manera esporádica en P. methysticum (Maju y Soniya, 2012), así como el establecimiento de suspensiones celulares y la biosíntesis de diversos metabolitos secundarios en P. aduncum (Delgado et al., 2002), P. cernuum y P. crassinervium (Danelutte et al., 2005) y P. solmsianum (Balbuena et al., 2009).
Teniendo en cuenta que los especímenes de Piper son esporádicos en su ambiente natural, el endemismo de numerosas especies, la pérdida rápida de viabilidad de las semillas, la recalcitrancia en la conservación de las semillas por largos periodos de tiempo, la escasa regeneración natural, la importancia creciente por sus propiedades farmacológicas, entre otros factores, se adelantó el presente trabajo, que comprende un conjunto de investigaciones iniciadas en Piperaceas en 1998 y que continúan en la actualidad, con el objetivo de inducir diversos procesos morfogénicos como la propagación clonal y la organogénesis, así como la conservación y el intercambio internacional de germoplasma de varias especies de Piper de Perú, Brasil y Ecuador, haciendo uso de diversas técnicas del cultivo de tejidos in vitro, que permitan la superviviencia y aprovechamiento de sus especies. La conservación de germoplasma in vitro aseguraría la preservación de los mejores genotipos en tanto que el intercambio de germoplasma minimizaría la transferencia de plagas y enfermedades de una región geográfica a otra y posibilitaría el amplio uso de éstas especies en diversas investigaciones.
Materiales y métodos
Material vegetal.
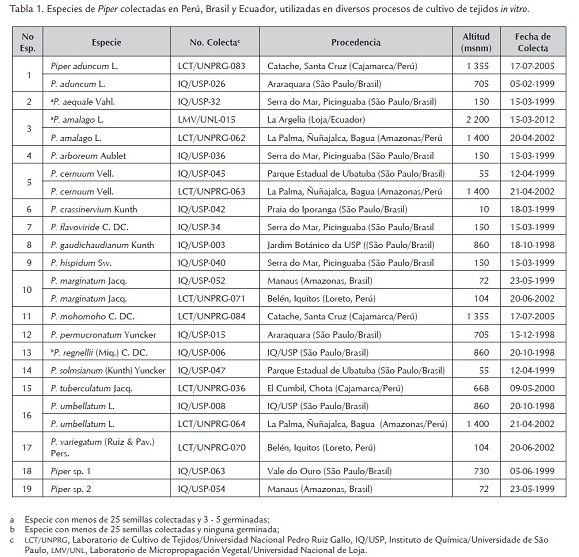
El material vegetal estuvo conformado por espigas maduras de 19 especies de Piper, colectadas en localidades de Perú, Brasil y Ecuador, y únicamente en el caso de P. cernuum y P. regnellii de hojas jóvenes de 5 cm de largo de plantas adultas sembradas en invernadero (tabla 1). Las espigas se colectaron en diferentes épocas del año y a lo largo de varios años, seleccionándose de la región media de varias plantas adultas mayores de 5 años de edad. Se consideraron espigas maduras porque tenían color negro y eran muy blandas al tacto. Las especies fueron identificadas por el Dr. Guillermo E. Delgado Paredes de la Universidad Nacional Pedro Ruiz Gallo (UNPRG) de Lambayeque, Perú, en base a las descripciones realizadas por Trelease (1936), Yuncker (1972, 1973) y Tebbs (1989, 1990, 1993). Los experimentos de cultivo in vitro se realizaron en el Laboratorio de Cultivo de Tejidos del Instituto de Química de la Universidade de São Paulo (Brasil), Laboratorio de Micropropagación Vegetal de la Universidad Nacional de Loja (Ecuador) y el Laboratorio de Cultivo de Tejidos Vegetales y Recursos Genéticos de la UNPRG. Únicamente para las especies de las que se colectaron más de 25 semillas maduras se ensayó la germinación in vitro.
Germinación de semillas
En el laboratorio, las semillas se separaron de los frutos y fueron esterilizadas superficialmente en grupos de 50 unidades, con alcohol etílico 70% durante 1 min e hipoclorito de sodio concentrado (Clorox® 5,25% de cloro activo) con tres gotas de Tween®20 durante 10 min y posteriormente se enjuagaron con agua destilada esterilizada por tres veces consecutivas con permanencia del agua durante 1 min. El medio de cultivo se conformó con las sales minerales MS (Murashige y Skoog, 1962), las vitaminas m-inositol 100 mg L-1 y tiamina.HCl 1 mg L-1, sacarosa 2% y agar 0,8%. El pH del medio de cultivo se ajustó en 5,8 ± 0,1 con HCl 0,1N y NaOH 0,1N, antes de dispensarlo en tubos de ensayo de 150 x 18 mm, que después de sellados, se esterilizaron a 121 oC y 15 libras/pulgada2 de presión durante 20 min. Se cultivaron 5 - 8 semillas por tubo de ensayo, distribuyéndose uniformemente para evitar la competencia, teniendo en cuenta que la semilla tiene una longitud promedio de 1,3 mm. Las condiciones ambientales de incubación se ajustaron a 24 - 26 oC, 80 - 85 % de humedad relativa y oscuridad total.
Propagación clonal
Plantas de 2-3 meses de edad, provenientes de semillas germinadas in vitro, se propagaron mediante el cultivo de ápices caulinares y segmentos nodales, en medio de cultivo conformado por las sales minerales MS, vitaminas, sacarosa 3%, agar 0,8% y los reguladores de crecimiento ácido indol-3-acético (AIA) y ácido giberélico (AG3) ambos a 0,02 mg L-1, el mismo que resultó de varios ensayos previos realizados en la micropropagación de diversas especias de Piper. En efecto, éstos ensayos sobre elongación y desarrollo de brotes realizados en P. aduncum (Delgado et al., 2002), con interacción AIA - AG3 - BAP en varias concentraciones y en P. solmsianum (Vásquez et al., 2010), con interacción AIA - AG3, suplementado con varios niveles de sacarosa y el fertilizante NPK Plant Prod 25 mg L-1, posibilitaron definir a la interacción AIA - AG3 0,02 mg L-1, respectivamente, y sacarosa 3%, como el medio de cultivo a utilizar en la propagación clonal de varias especies de Piper. Los explantes se cultivaron en el medio de cultivo contenido en tubos de ensayo de 150 x 25 mm y los subcultivos se realizaron cada 6 - 10 meses. En los ensayos de propagación clonal se utilizaron 10 explantes por especie repitiéndose el ensayo dos veces. Los cultivos se incubaron a 70 - 80 µmol m-2 s-1 de irradiancia y con un fotoperiodo de 16/8 h, con luz blanca proveniente de lámparas fluorescentes de 40 w.
Organogénesis
En la inducción de respuestas organogénicas se utilizaron diversos explantes como peciolos, raíces y entrenudos de 10 mm de largo y segmentos de hojas (limbos) de 10 mm de lado, provenientes de plantas in vitro de 45 - 60 días de edad y segmentos de hojas jóvenes de 10 mm de lado, removidos de plantas adultas en crecimiento activo en condiciones de invernadero. La asepsia de los explantes de plantas in vitro se consideró per se en tanto que, para las plantas de invernadero la desinfección se realizó siguiendo el protocolo utilizado para la desinfección de semillas. Los explantes se cultivaron horizontalmente y, en el caso de las hojas, con la superficie abaxial en contacto con el medio de cultivo, el que estuvo conformado por las sales minerales MS, vitaminas, sacarosa 3% y diversas interacciones entre auxinas y citocininas. Entre las auxinas se utilizó ácido indol-3-acético (AIA), ácido naftaleneacético (ANA), ácido 3,6-dicloro-o-anísico (DICAMBA) y ácido 2,4-diclorofenoxiacético (2,4-D), y entre las citocininas se utilizó la benzilaminopurina (BAP), kinetina (KIN) y tidiazurón (TDZ), en concentraciones de 0 - 2 mg L-1. En algunos tratamientos a las interacciones auxinas - citocininas se suplementó AG3 0,02 mg L-1. Los explantes se cultivaron en medio de cultivo contenido en frascos de vidrio transparente de 100 x 50 mm. Se utilizaron 15 explantes por tratamiento y cada tratamiento fue repetido dos veces. Los cultivos se incubaron a 50 - 70 µmol m-2 s-1 de irradiancia y con un fotoperiodo de 16/8 h.
A los valores de las diferentes variables obtenidas, tanto en los ensayos de propagación clonal como de organogénesis, se les realizó un análisis de varianza bifactorial y en los casos en que se observaron diferencias significaticas se aplicó la prueba de Rangos Múltiples de Duncan al 5%, para la comparación de medias, mediante el programa Statgraphics® (Statistical Graphics Corporation,1999).
Conservación de germoplasma
En el proceso de conservación de germoplasma, explantes de 1,5 cm de altura, conformados por el ápice caulinar y un nudo, se establecieron en el mismo medio de cultivo de propagación clonal contenido en tubos de ensayo de 150 x 25 mm a razón de un explante por recipiente y de 10 repeticiones por especie. El método utilizado fue el de "limitación del crecimiento a tasas mínimas" (Roca et al., 1991) donde el factor limitante fue la irradiancia puesto que los cultivos se sometieron a un régimen de 20 - 40 µmol m-2 s-1 con el mismo fotoperiodo (16/8 h), en tanto que el medio de cultivo fue el mismo utilizado en la propagación clonal, MS suplementado con AIA y AG3 0,02 mg L-1.
Resultados y discusión
Germinación de semillas
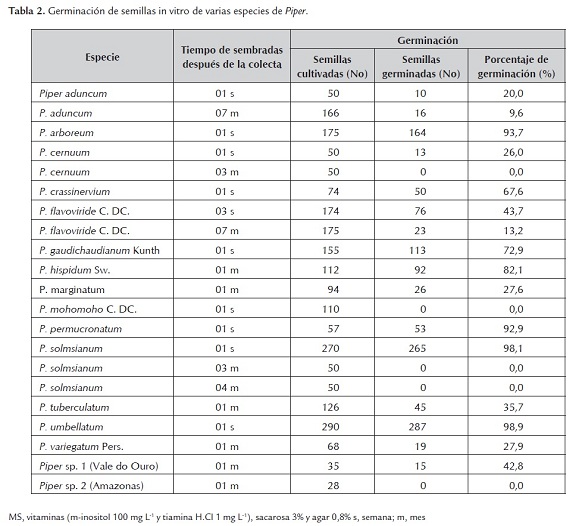
En la tabla 2 se muestran los resultados sobre germinación de semillas la misma que alcanzó tasas tan altas como 98,9 y 98,1% en Piper umbellatum y P. solmsianum, respectivamente, así como tan bajas como 20,0 y 26,0% en P. aduncum y P. cernuum, respectivamente, después de cuatro semanas de cultivo, cuando se utilizaron semillas de una semana de colectadas. Estos datos guardan cierta relación con los mostrados para P. solmsianum donde la tasa de germinación fue 35 y 80%, después de cuatro y ocho semanas de cultivo, respectivamente (Balbuena et al., 2009). Por otro lado, semillas cultivadas a las tres semanas de colectadas alcanzaron tasas de germinación de 43,7% como en P. flavoviride, y a los tres meses de colectadas 0,0% de germinación como en P. cernuum. Con excepción de P. aduncum y P. flavoviride, que aún conservaron un porcentaje de germinación de semillas de 9,6 y 13,2, respectivamente, cuando fueron cultivadas después de siete meses de colectadas. En el resto de especies de Piper no hubo germinación después de tres meses de colectadas las semillas. Un caso particular resultó P. mohomoho cuyas semillas colectadas en la localidad de Catache (Cajamarca, Perú) no germinaron, aún sometidas a tratamientos con ácido giberélico (AG3).
Una clasificación muy aceptada sobre la viabilidad de las semillas es en ortodoxas y recalcitrantes (Roberts, 1973). Las semillas ortodoxas preservan su viabilidad durante periodos muy largos bajo condiciones de almacenamiento con temperaturas bajas (-10 a -20 oC) y un contenido de humedad de las semillas por debajo de 10%; en tanto que las semillas recalcitrantes no toleran las condiciones de almacenamiento y mueren. En el caso de las semillas de Piper, debido a que pierden rápidamente su viabilidad se les puede clasificar como semillas recalcitrantes puesto que aún conservadas en refrigeración (10oC) o en condiciones de temperatura ambiente, pierden totalmente su viabilidad después de 3 meses de colectadas. En ensayos de germinación de semillas de varias especies de Piper, (Vásquez-Yanes, 1974) y en P. hispidium (Ludlow y Vázquez-Yanes, 1979), realizados en cajas de Petri, demostraron que el proceso era fuertemente influenciado por la luz, resultando favorables las condiciones de longitud de onda roja, azul y blanca.
El conocimiento que se tiene sobre la viabilidad y germinación de las semillas de Piper, es aún escaso. Varios factores, como la colecta estocástica de las semillas, la posición de los frutos en el tallo, los factores ambientales y el método de polinización, la edad de la planta, el contenido de reservas en los tejidos nutricios, los mecanismos que conllevan a la dormición ya sea impuesta o innata, estarían influenciando la viabilidad y germinación, que si bien resultan de carácter general para las semillas de las angiospermas (Barceló et al., 2000), merecerían una detallada investigación en el caso de Piper.
Por otro lado, algunos autores han enfatizado sobre la contaminación endógena de las semillas de Piper por hongos, bacterias, fitoplasmas y patógenos virales (Mathews y Rao, 1984). En el caso de P. nigrum y en P. colubrinum la contaminación endógena de bacterias provocó contratiempos en el establecimiento in vitro de las semillas (Mathews y Rao, 1984; Philip et al., 1992; Kelkar et al., 1996). Sin embargo, en P. solmsianum la tasa de contaminación fue 10% (Balbuena et al., 2009) mientras en este trabajo sólo se presentó 2 al 5%, debido al uso de alcohol etílico e hipoclorito de sodio, sin necesidad de recurrir a desinfestantes altamente tóxicos como cloruro de mercurio, tal como reportó Philip et al. (1992) para P. nigrum.
Propagación clonal
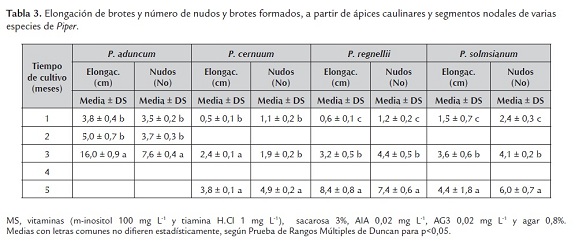
En el ensayo realizado, P. aduncum en sólo tres meses de evaluación alcanzó una altura de 16,0 cm y 7,6 nudos formados; en tanto que P. regnellii, P. solmsianum y P. cernuum, en cinco meses de cultivo, alcanzaron una altura de 8,4; 4,4 y 3,8 cm, y 7,4; 6,0 y 4,9 nudos formados, respectivamente (tabla 3). Es posible que estas diferencias significativas en el crecimiento obedezcan, además de los factores genéticos intrínsecos, al efecto de las condiciones ambientales del cultivo, resultando favorables para P. aduncum respecto al resto de las especies ensayadas. P. aduncum tiene una distribución cosmopolita y crece muy bien en temperaturas altas, en tanto que las otras especies tienen una distribución restringida a determinadas regiones de América y crecen mejor en temperaturas templadas a frías.
El modelo general de propagación clonal establecido por Murashige (1974) y para el caso de P. longum por Bhat et al. (1995), abarcó dos etapas: elongación del brote e inducción de raíces, en dos medios de cultivo distintos, tal como se observó en P. auritum donde brotes regenerados de hojas se elongaron en medio de cultivo con 2,4-D - KIN, 0,1 y 1,0 mg L-1, respectivamente, en tanto que el enraizamiento se alcanzó en medio de cultivo con AIA 2,0 mg L-1 (Domínguez et al., 2006) y en P. nigrum donde la regeneración y elongación de brotes se observó en medio de cultivo con BAP 0,5 mg L-1 y el enraizamiento en medio de cultivo con AIB (ácido indolbutírico) 1,5 mg L-1 (Hussain et al., 2011). Sin embargo, en este estudio, ambas etapas fueron alcanzadas en un único medio de cultivo. Dicho procedimiento permitió obtener tasas elevadas de plántulas a ser utilizadas en investigación sobre morfogénesis, establecimiento de suspensiones celulares, conservación e intercambio de germoplasma y aclimatación de plantas a condiciones de suelo.
Organogénesis
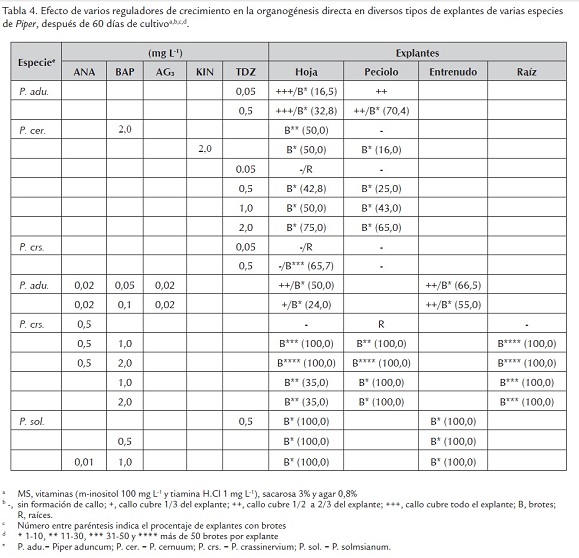
El potencial morfogénico de varias especies de Piper en medio de cultivo MS suplementado con diferentes concentraciones e interacciones de ANA, BAP, AG3, KIN y TDZ se resume en la tabla 4. En P. aduncum, se ensayó TDZ 0,05 y 0,5 mg L-1, alcanzando una mayor respuesta de regeneración de brotes con TDZ 0,5 mg L-1, tanto en hojas como en peciolos, con porcentales de regeneración de 32,8 y 70,4%, respectivamente, aunque en escaso número (1-10 brotes/explante). Otras combinaciones de reguladores de crecimiento (ANA-BAP-AG3) posibilitaron la regeneración de brotes, tanto en hojas como en entrenudos, los cuales mostraron un mayor potencial morfogénico con 66,5% de respuesta, aunque siempre en escaso número de formación de brotes (1-10 brotes/explante). En ambos tratamientos de reguladores de crecimiento, también fue posible la inducción de callos friables que cubren de 1/2 a 2/3 del explante (++), y que cubren totalmente el explante (+++). En P. cernuum la regeneración de brotes fue observada en los tratamientos con BAP y KIN 2,0 mg L-1, así como con TDZ 0,5 a 2,0 mg L-1, tanto en hojas como peciolos, en niveles tan altos como 75 y 65%, respectivamente, con TDZ 2,0 mg L-1. Sin embargo, en todos los casos el número de brotes regenerados por explante fue escaso (1-10 brotes/explante). En P. crassinervium una alta tasa de regeneración de brotes (30-50 brotes/explante) se observó en el 65,7% de las hojas tratadas con TDZ 0,5 mg L-1 y en las interacciones ANA 0,5 mg L-1 - BAP 1,0 y 2,0 mg L-1, en explantes de hojas, peciolos y raíces, alcanzándose tasas de regeneración de 100% y un número elevado de brotes regenerados (>50 brotes/explante). En P. solmsianum la interacción ANA 0,01 - BAP 1,0 mg L-1, BAP 0,5 mg L-1 y TDZ 0,5 mg L-1, indujeron hasta 100% de regeneración de brotes en hojas y entrenudos e incluso con una alta tasa de número de brotes formados (>50 brotes/explante). En general, la regeneración de brotes fue tan eficiente en hojas como en peciolos en todas las especies de Piper ensayadas e incluso en entrenudos, como fue el caso de P. aduncum y P. solmsianum, y en raíces como fue el caso de P. crassinervium, lo que indica que todos estos explantes tienen el potencial morfogénico necesario que permite la formación de brotes, pero ello dependerá de la calidad y concentración de los reguladores de crecimiento utilizados.
La inducción de callos friables (++ y +++) fue observada solamente en P. aduncum en todos los tratamientos de reguladores de crecimiento ensayados En tanto que la formación de raíces fue observada únicamente en hojas y peciolos de P. crassinervium en los tratamientos TDZ 0,05 y ANA 0,5 mg L-1, respectivamente.
En un trabajo pionero de organogénesis directa con P. longum, P. betle y P. nigrum de la India, Bhat et al. (1995) demostraron el potencial morfogénico de diversos explantes como raíces, hojas (limbo y peciolo), nudos y entrenudos, en la inducción de brotes, después de seis semanas de cultivo. En P. longum se demostró que el mayor número de brotes formados correspondió a las raíces seguido de los nudos, entrenudos y hojas, en las concentraciones de 1 y 2 µm (0,2 y 0,4 mg L-1) de BAP y KIN, en tanto que en P. betle y P. nigrum los brotes se diferenciaron solamente en entrenudos y nudos, en las concentraciones de 5 y 10 µm (1 y 2 mg L-1) de BAP. Estos resultados guardan concordancia con los obtenidos en este trabajo, puesto que los mayores porcentajes de explantes que formaron brotes y el mayor número de brotes formados se presentó en los tratamientos con las citocininas BAP o TDZ. Así mismo, resultó significativo que en este trabajo las raíces de P. crassinervium exhibieran un alto potencial morfogénico al igual que P. longum (Bhat et al., 1995). Recientemente, en P. nigrum, alrededor de 18 brotes se formaron en ápices caulinares en medio de cultivo con BAP - AIA, 2,5 y 0,5 mg L-1, respectivamente, en tanto que el enraizamiento fue mejor en medio de cultivo con AIB 0,5 mg L-1 (Maju y Soniya, 2012) y en Pothomorphe umbellata (Piper umbellatum), la regeneración de plantas, a partir de callos inducidos en semillas, fue alrededor de cinco, en medio de cultivo con AG3 - BAP 0,1 y 0,5 mg L-1, respectivamente (Cesty et al., 2007).
En un trabajo previo realizado en P. solmsianum se observó que BAP 0,5 mg L-1 y BAP 1,0 mg L-1, con ANA 0,01 mg L-1, indujeron 100% de formación de brotes en entrenudos, mientras que TDZ 0,5 mg L-1 y TDZ 0,5 mg L-1, con ANA 0,01 mg L-1, indujeron 100% de formación de brotes tanto en entrenudos como en hojas con un máximo de 16,6 brotes/explante (Vásquez et al., 2010). En este trabajo se obtuvieron resultados similares, es decir, en las mismas concentraciones se alcanzó 100% de formación de brotes pero siempre en un rango de 1-10 brotes/explante. Por otro lado, Balbuena et al. (2009), trabajando con discos de hojas y peciolos de P. solmsianum, en varios tratamientos de la interacción BAP (0; 0,2 y 2,0 mg L-1) con las auxinas AIA, ANA y 2,4-D (0; 0,2 y 2,0 mg L-1) observaron la formación de raíces cuando se utilizó únicamente AIA 0,2 y 2,0 mg L-1, tanto en hojas como en peciolos; mientras que la formación de brotes ocurrió en la interacción BAP - AIA, en hojas y peciolos y BAP - ANA solamente en peciolos. Un hecho significativo fue la formación de callos, únicamente en peciolos, en la interacción BAP - 2,4-D, en tanto que en la misma interacción los brotes fueron formados mayormente en hojas. Es posible asumir que tanto en este estudio como en el trabajo de Balbuena et al. (2009) la aplicación de auxinas - citocininas resultó esencial para inducir respuestas morfogénicas en P. solmsianum, en especial BAP para la inducción de brotes, aunque este regulador de crecimiento no resultó esencial para otras especies de Piper (Mathews y Rao, 1984; Philip et al., 1992; Aminuddin-Johri et al., 1993; Kelkar et al., 1996). Por otro lado, en P. solmsianum la inducción de brotes fue a lo largo y en los extremos del peciolo (Balbuena et al., 2009) y en P. longum en la región proximal de las hojas (Soniya y Das, 2002).
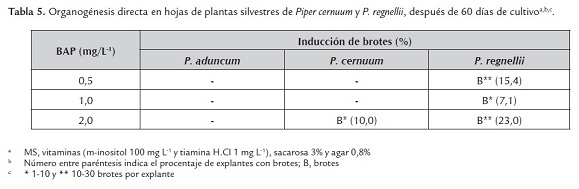
En un experimento adicional, la organogénesis directa fue inducida en explantes de hojas colectadas de plantas en crecimiento activo en condiciones de invernadero. De las tres especies ensayadas, P. regnellii mostró una mayor totipotencia puesto que los brotes fueron inducidos en los tres tratamientos de BAP ensayados, aunque un mayor porcentaje lo fue en el tratamiento BAP 2,0 mg L-1. En ese mismo tratamiento, también fue inducida la formación de brotes en P. cernuum, en cambio en P. aduncum no hubo respuesta morfogénica en ninguno de los tratamientos ensayados (tabla 5). El caso de P. regnellii resultó particularmente significativo, puesto que es una especie donde se observó escasa formación de frutos y los pocos colectados no presentaron semillas viables. En trabajos pioneros realizados en P. betle, P. longum y P. nigrum (Bhat et al., 1995), los cultivos fueron iniciados con segmentos nodales obtenidos de plantas en crecimiento activo en condiciones de invernadero, pero los explantes (hojas, peciolos, entrenudos y raíces) utilizados en los cultivos posteriores (inducción de callos y organogénesis) se originaron de las plántulas micropropagadas y no de explantes obtenidos directamente de plantas de invernadero. Al igual que en los estudios de Bhat et al. (1995), la tasa de contaminación observada en este estudio fue superior a 90%.
Conservación de germoplasma
En un informe elaborado por el International Plant Genetic Resources Institute (IPGRI, ex IBPGR) se aclaró el marco conceptual básico de la conservación in vitro, se identificaron las áreas críticas de investigación y las especies que requerían atención prioritaria para éste propósito (IBPGR, 1983). En tal sentido, fueron incluidas en esta relación las especies de propagación vegetativa y las de propagación sexual con semilla recalcitrante o plantas "difíciles" (Withers y Williams, 1985), como es el caso de las especies de Piper. En las condiciones de conservación por "limitación del crecimiento a tasas mínimas", el lapso de mantenimiento del cultivo fue de 12 a 18 meses mostrando una viabilidad de 100% cuando los explantes fueron transferidos a medio de cultivo fresco, en tanto que en condiciones de irradiancia normal (70 - 80 µmol m-2 s-1) el lapso de mantenimiento del cultivo fue de 6 - 10 meses.
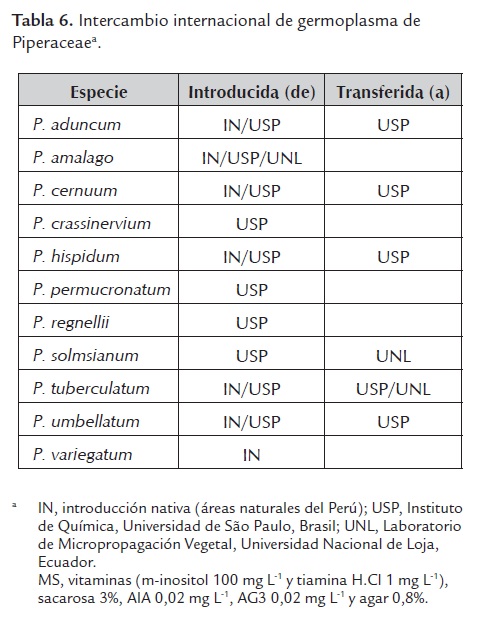
La metodología del cultivo in vitro ha sido aceptada por diversos países como uno de los medios más seguros para recibir el material vegetativo (Roca et al., 1991). A partir de este trabajo, se realizó el intercambio internacional entre el Laboratorio de Cultivo de Tejidos y Recursos Genéticos de la Facultad de Ciencias Biológicas de la UNPRG-Lambayeque, el Laboratorio de Cultivo de Tejidos del Instituto de Química de la USP-São Paulo y el Laboratorio de Micropropagación Vegetal de la UNL-Loja de germoplasma in vitro (tabla 6). Para lograr esto, cinco días antes de la transferencia las plántulas se establecieron en condiciones de 10 - 30 µmol m-2 s-1 de irradiancia para minimizar el efecto del estrés lumínico que significa el permanecer 24 - 72 horas en absoluta oscuridad. Este mecanismo de intercambio de material genético permite minimizar la transferencia de plagas de insectos, ácaros, nemátodes y enfermedades causadas por bacterias y hongos, aunque no por virus y relacionados. Una vez recibido en el laboratorio de destino, las plántulas se subcultivaron en medio de cultivo de la misma formulación, obteniendo una tasa de supervivencia del 100%.
Conclusiones
Este trabajo describe un protocolo de germinación de semillas in vitro, propagación clonal, a partir de ápices caulinares y segmentos nodales, y organogénesis directa de varias especies de Piper, a partir de diversos explantes, para la inducción de brotes organogénicos.
Estos resultados son importantes, ya que permiten la conservación ex situ del material genético, debido a la recalcitrancia de las semillas, y el intercambio de germoplasma minimizando el riesgo de transferir plagas y enfermedades. Además, pueden apoyar una estrategia de domesticación, multiplicación y aclimatación a gran escala de las especies en riesgo, que permita establecerlas en su ambiente natural e iniciar trabajos que conlleven al establecimiento de suspensiones celulares con el propósito de inducir la biosíntesis de diversos metabolitos secundarios. De esta forma, se estaría contribuyendo con la conservación de la diversidad de especies de Piper de Brasil, Ecuador y Perú, y la preservación del acervo etnobotánico de las poblaciones que conforman ampliamente el sector rural de estos países.
Agradecimientos
G.E. Delgado agradece a la Fundação do Amparo a Pesquisa do Estado de São Paulo (FAPESP) por la beca de Pós-doutorado en el Instituto de Química de la Universidad de São Paulo, Brasil.
Referencias bibliográficas
1 Aminuddin-Johri J.K., Anis M., Balasubrahmanyam V.R. 1993. Regeneration of Piper betle from callus tissue. Current Science, 65: 793-796. [ Links ]
2 Ayres D.C., Loike J.D. 1990. Lignans-chemical, biological and clinical properties. Cambridge University Press. 424 p. [ Links ]
3 Balbuena T., Santa-Catarina C., Silveira V., Kato M.J., Floh E.I.S. 2009. in vitro morphogenesis and cell suspensión culture establishment in Piper solmsianum C. DC. (Piperaceae). Acta Botanica Brasileira. 23: 274-281. [ Links ]
4 Barceló J., Nicolás G., Sabater B., Sánchez R. 2000. Fisiología Vegetal. Madrid: Ediciones Pirámide, p. 465-524. [ Links ]
5 Benevides P.J.C., Sartorelli P., Kato M.J. 1999. Phenylpropanoids and neolignans from Piper regnellii. Phytochemistry. 52: 339-343. [ Links ]
6 Bhat S.R., Chandel K.P.S., Malik S.K. 1995. Plant regeneration from various explants of cultivated Piper species. Plant Cell Reports. 14: 398-402. [ Links ]
7 Brack A. 1999. Diccionario Enciclopédico de Plantas Útiles del Perú. Cusco, Perú: Centro de Estudios Regionales Andinos "Bartolomé de las Casas" (CBC), 556 p. [ Links ]
8 Brako L., Zarucchi J.L. 1993. Catalogue of the Flowering Plants and Gymnosperms of Peru. St. Louis, Missouri, USA: Missouri Botanical Garden Press, p 884-923. ISBN: 0915279193 [ Links ]
9 Callejas R. 1999. Piperaceae. En: Catalogue of the Vascular Plants of Ecuador. Jørgensen PM & León-Yánez S (eds.). St. Louis, Missouri, USA: Missouri Botanical Garden Press, p 785-805. [ Links ]
10 Cesty C., Sáenz E.C., Pereira G.P. 2007. Micropropagación de Pothomorphe umbellata (L.) Miq. vía organogénesis directa. Revista Cubana de Plantas Medicinales. 12 (4). [ Links ]
11 Cheng M.J., Lee S.J., Chang Y.Y., Wu S.H., Tsai I.L., Jayaprakasam B., Chen Y.Y. 2003. Chemical and cytotoxic constituents from Peperomia sui. Phytochemistry. 63: 603-608. [ Links ]
12 Danelutte A.P., Costantin M.B., Delgado G.E., Braz-Filho R., Kato M.J. 2005. Divergence of secondary metabolism in cell suspension cultures and differentiated plants of Piper cernuum and P. crassinervium. Journal of the Brazilian Chemical Society. 16 (6B): 1425-1430. [ Links ]
13 Delgado G.E., Rojas C., Nunomura S.M., Kato M.J. 2002. Análisis fitoquímico en suspensiones celulares de Piper aduncum L. ("matico"). Avances en Ciencia y Tecnología. 3: 15-26. [ Links ]
14 Dodson C.D., Dyer L.A., Searcy J., Wright Z., Letourneau D.K. 2000. Cenocladamine a dihydropyridone alkaloid from Piper cenocladum. Phytochemistry. 53: 51-54. [ Links ]
15 Dominguez F., Lozoya X, Simon J. 2006. Tissue culture regeneration of a medicinal plant from Mexico: Piper auritum Kunth. HortScience. 41: 207-209. [ Links ]
16 Dyer L.A., Palmer A.D.N. 2004. Piper. A model genus for studies of evolution, chemical ecology, and trophic interactions. New York, USA: Kluwer Academic/Plenum Publishers, 214 pp. [ Links ]
17 Hussain A., Naz S., Nazir H., Khan Z. 2011. Tissue culture of black pepper (Piper nigrum L.) in Pakistan. Pakistan Journal of Botany. 43: 1069-1078. [ Links ]
18 IBPGR (International Board for Plant Genetic Resources). 1983. IBPGR Advisory Committee on in vitro storage: Report of the First Meeting. Roma, Italia. 11 p. [ Links ]
19 Jaramillo M.A., Manos P.S. 2001. Phylogeny and patterns of floral diversity in the genus Piper (Piperaceae). American Journal of Botany. 88: 706-716. [ Links ]
20 Kato M.J., Furlan M. 2007. Chemistry and evolution of the Piperaceae. Pure and Applied Chemistry. 79: 529-538. [ Links ]
21 Kelkar S.M., Krishnamurthy K.V. 1998. Adventitious shoot regeneration from root, internode, petiole and leaf explants of Piper colubrinum Link. Plant Cell Reports. 17: 721-725. [ Links ]
22 Kelkar S.M., Deboo G.B., Krishnamurthy K.V. 1996. in vitro plant regeneration from leaf callus in Piper colubrinum Link. Plant Cell Reports. 16: 215-218. [ Links ]
23 Lago J.H.G., Ramos C.S., Casanova D.C.C., Morandim A.A., Bergamo D.C.B., Cavalheiro A.J., Bolzani V.S., Furlan M., Guimaraes E.F., Young M.C.M., Kato M.J. 2004. Benzoic acid derivatives from Piper species and their fungitoxic activity against Cladosporium cladosporioides and C. sphaerospermum. Journal of Natural Products. 67: 1783-1788. [ Links ]
24 Ludlow B., Vázquez-Yanes C. 1979. Germinación de semillas de Piper hispidum Sw. bajo diferentes condiciones de iluminación. En: Investigaciones sobre la Regeneración de Selvas altas en Veracruz, México. Gómez Pompa A, Del Amo S, Vázquez-Yanes C & Butanda A. (eds.). 2da. Ed. México: Compañía Editorial Continental, S.A., p 263-277. [ Links ]
25 Mabberley D.J. 1997. The Plant Book. A Portable Dictionary of the Higher Plants. New York, USA: Cambridge University Press. [ Links ]
26 Maju T.T., Soniya E.V. 2012. in vitro regeneration on system for multiplication and transformation in Piper nigrum L. International Journal of Medicinal and Aromatic Plants. 2: 178-184. [ Links ]
27 Mathews V.H., Rao P.S. 1984. in vitro responses in black pepper (Piper nigrum). Current Science. 53: 183-186. [ Links ]
28 Mesa A.M., Toro J.F., Cardona F., Blair S. 2012. Actividad antiplasmodial y citotóxica de extractos etanólicos de especies de Piper. BLACPMA. 11: 154-162. [ Links ]
29 Murashige T. 1974. Plant propagation through tissue culture. Annual Review of Plant Physiology. 25: 135-166. [ Links ]
30 Murashige T., Skoog F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum . 15: 473-497. [ Links ]
31 Nair R.R., Gupta S.D. 2006. High-frequency plant regeneration through cyclic secondary somatic embryogenesis in black pepper (Piper nigrum L.). Plant Cell Reports. 24: 699-707. [ Links ]
32 Orjala J., Erdelmeier C.A.J., Wright A.D., Rali T., Sticher O. 1993. Five new prenylated p-hydroxybenzoic acid derivatives with antimicrobial and molluscicidal activity from Piper aduncum leaves. Planta Medica. 59: 813-818. [ Links ]
33 Parmar V.S., Jain S.C., Bisht K.S., Jain R., Taneja P., Jha A., Tyagi O.D., Prasad A.K., Wengel J., Olsen C.E., Boll P.M. 1997. Phytochemistry of the genus Piper. Phytochemistry. 46: 597-673. [ Links ]
34 Philip V.J., Joseph D., Triggs G.S., Dickinson N.M. 1992. Micropropagation of black pepper (Piper nigrum Linn.) trough tip cultures. Plant Cell Reports. 12: 41-44. [ Links ]
35 Rani D., Kumar P. 2012. Direct shoot regeneration from nodal, internodal and petiolar segments of Piper longum L. and in vitro conservation of indexed plantlets. Plant Cell, Tissue and Organ Culture. 109: 9-17. [ Links ]
36 Roberts E.H. 1973. Predicting the storage life of seeds. Seed Science and Technology. 1: 499-514. [ Links ]
37 Roca W.M., Arias D.I., Chávez R. 1991. Métodos de conservación in vitro del germoplasma. En: Cultivo de Tejidos en la Agricultura: Fundamentos y Aplicaciones. Roca WM & Mroginski LA. (eds.). Cali, Colombia: Centro Internacional de Agricultura Tropical - CIAT, p 697-713. [ Links ]
38 Silva R.V., Navickiene H.M.D., Kato M.J., Bolzani V., Méda C.I., Young M.C.M., Furlan M. 2002. Antifungal amides from Piper arboreum and Piper tuberculatum. Phytochemistry. 59: 521-527. [ Links ]
39 Soniya E.V., Das M.R. 2002. in vitro micropropagation of Piper longum - an important medicinal plant. Plant Cell, Tissue and Organ Culture. 70: 325-327. [ Links ]
40 Statistical Graphics Corporation. 1999. Software "Statgraphics Plus por Windows 4.1" [ Links ].
41 Sujatha R., Babu L.C., Nazeem P.A. 2003. Histology of organogenesis from callus cultures of black pepper (Piper nigrum L.). Journal of Tropical Agriculture. 41: 16-19. [ Links ]
42 Taylor D.W., Hickey L.J. 1992. Phylogenetic evidence for the herbaceous origin of angiosperm. Plant Systematics and Evolution. 180: 137-156. [ Links ]
43 Tebbs M.C. 1989. Revision of Piper (Piperaceae) in the New World. 1. Review of characters and taxonomy of Piper section Macrostachys. Bulletin of the Natural History Museum of London. 19: 117-158. [ Links ]
44 Tebbs M.C. 1990. Revision of Piper (Piperaceae) in the New World. 2. The taxonomy of Piper section Churumayu. Bulletin of the Natural History Museum of London. 20: 193-236. [ Links ]
45 Tebbs M.C. 1993. Revision of Piper (Piperaceae) in the New World. 3. The taxonomy of Piper section Lepianthes and Radula. Bulletin of the Natural History Museum of London. 23: 1-50. [ Links ]
46 Trelease W. 1936. Piperaceae. En: Flora of Peru. Vol. XIII. MacBride JF. (ed.). Chicago, USA: Field Museum of Natural History, 253 pp. [ Links ]
47 Vásquez-Yanes C. 1974. Estudios sobre ecofisiología de la germinación en una zona cálido húmedo de México. Tesis doctoral. México: Facultad de Ciencias, UNAM, 140 pp. [ Links ]
48 Vásquez N., Kato M.J., Rojas C., Malquichagua K., Delgado G. 2010. Tissue culture and production of secondary metabolites from micropropagated plants of Piper solmsianum. Ciencia, Tecnología y Humanidades. 1: 15-21. [ Links ]
49 Withers L.A., Williams J.T. 1985. in vitro conservation. IBPGR Research Highlights. Roma, Italia. [ Links ]
50 Yuncker T.G. 1972. The Piperaceae of Brazil: Piper - Group I, II, III and IV. Hoehnea. 2: 23-366. [ Links ]
51 Yuncker T.G. 1973. The Piperaceae of Brazil II: Piper - Group V; Ottonia; Pothomorphe; Sarcorhachis. Hoehnea. 3: 29-284. [ Links ]
52 Yusuf A., Thyagi R.K., Malik S.K. 2001. Somatic embryogenesis and plant regeneration from leaf segments of Piper colubrinum. Plant Cell, Tissue and Organ Culture. 65: 255-258. [ Links ]
53 Zhang Z., Zhao L., Chen X., Zheng X. 2008. Successful protocol of micropropagation of Piper methysticum. Biologia Plantarum. 52: 110-112. [ Links ]