Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Biotecnología
versión impresa ISSN 0123-3475
Rev. colomb. biotecnol vol.14 no.2 Bogotá jul./dic. 2012
ARTÍCULO DE INVESTIGACIÓN
Caracterización de actinobacterias raras, degradadoras de lignocelulosa: demostración de actividad lacasa en dos aislados de Tsukamurella sp y Cellulosimicrobium sp
Characterization of lignocellulose-degrading rare actinobacteria: demostration of laccase activity in two isolates of Tsukamurella sp and Cellulosimicrobium sp
Enrique Luis Revollo Escudero1 , Oriana Danuta Serna Daza1 , Jorge Hernández Torres1.
1 Centro de Innovación en Biotecnología Industrial y Biología Molecular (CINBIN), Universidad Industrial de Santander, Sede de la UIS en Guatiguará, Km 2 vía al Refugio, Piedecuesta (Santander), Colombia.
Autor para correspondencia: Jorge Hernández Torres, M.Sc., Ph.D., hernanj@uis.edu.co
Recibido: enero 02 de 2012 Aprobado: noviembre 25 de 2012
Resumen
Las características fisicoquímicas de la lignina y su compactación con la celulosa han dificultado la explotación biotecnológica de enormes cantidades de biomasa vegetal. Las lacasas constituyen una subfamilia de oxidasas multicobre que intervienen en la despolimerización de la lignina. Si bien han sido ampliamente caracterizadas en los hongos, los estudios de la diversidad y las funcionalidades de las lacasas en los procariotas se han centrado especialmente en isoformas enzimáticas de Streptomyces sp. En este trabajo se aislaron 20 cepas de actinobacterias del suelo. La actividad lacasa de 17 de ellas fue evidenciada en ensayos cualitativos con guayacol y dos cepas seleccionadas fueron caracterizadas en detalle. Las pruebas morfológicas y el análisis de las secuencias del gen 16S rRNA apuntan a que estos dos aislados pertenecen a los géneros Tsukamurella y Cellulosimicrobium. En cultivo sumergido con agitación, AC01 (Tsukamurella sp.) expresó una máxima actividad de oxidación de ABTS (2,2’-azino-bis-(3-etilbenzotiazolin-6-sulfonato) de 108 U/L. Por otra parte, AC18 (Cellulosimicrobium sp.) que había exhibido una actividad oxidativa de guayacol superior a las 16 cepas restantes y demostró ser resistente a niveles tóxicos de cobre, logró un valor máximo de oxidación del ABTS de 0,56 U/L. Estos resultados sugieren que en el aislado AC18 operaría un fenómeno de especificidad de sustrato o de inductor, regulador de la expresión y de la actividad lacasa cuantificable. La caracterización genómica y funcional de las lacasas de nuevas actinobacterias lignocelulósicas ampliará la gama de centros redox con aplicaciones biotecnológicas específicas, además de facilitar el establecimiento de sus relaciones evolutivas con las eucariotas.
Palabras clave: Actinobacteria, deslignificación, enzimas modificadoras de lignina, EC 1.10.3.2, ABTS.
Abstract
The physicochemical characteristics of lignin and its compaction with cellulose have restricted the biotechnological exploitation of enormous amounts of plant biomass. Laccases are a subfamily of multicopper oxidases involved in lignin depolymerization. Although they have been extensively characterized in fungi, studies of the diversity and functions of laccases in prokaryotes are mainly on enzyme isoforms of Streptomyces sp. In this work we isolated 20 strains of soil actinomycetes. The laccase activity of 17 of them was evidenced in qualitative assays with guaiacol, and two selected strains were characterized in detail. The morphological evidence and the analysis of the 16S rRNA gene sequences suggest that these two isolates belong to the genera Tsukamurella and Cellulosimicrobium. In submerged cultures with shaking, AC01 (Tsukamurella sp.) exhibited a maximal oxidation activity of ABTS (2,2 '-azino-bis-(3-ethylbenzthiazoline-6-sulfonate) of 108 U/L. On the other hand, AC18 (Cellulosimicrobium sp.) that exhibited a higher oxidative activity of guaiacol than the other 16 isolated strains and showed resistance to toxic levels of copper, reached a maximum ABTS oxidation rate of 0.56 U/L. These results suggest that in AC18 operates a mechanism of substrate or inducer specificity, regulating the measurable laccase activity and laccase gene expression. Genomic and functional characterization of laccases of new ligninolytic actinomycetes may help to extend the range of redox centers with specific biotechnological applications, as well as establishing their evolutionary relationships with eukaryotes.
Key words: Actinobacteria, delignification, lignin-modifying enzymes, EC 1.10.3.2, ABTS.
Introducción
Los altos contenidos en celulosa de la biomasa vegetal (>45%, peso seco) son una excelente materia prima potencial para la obtención de biocombustibles y otros compuestos orgánicos (Lynd et al., 1999). No obstante, el aprovechamiento industrial de la biomasa lignocelulósica no ha alcanzado su punto de madurez en razón a las propiedades físicas y químicas de la lignina y su densa compactación con la celulosa (Weimer, 1996; Lynd et al., 1999; Tuomela et al., 2002). En efecto, la relativa hidrofobicidad de la lignina reduce la permeabilidad de la pared celular vegetal, lo cual obstaculiza su degradación por agentes biológicos. En consecuencia, la industria ha recurrido al desarrollo de procesos químicos de deslignificación; sin embargo, los investigadores en biotecnología están impulsando el desarrollo de métodos biotecnológicos de despolimerización de la lignina (Lynd et al., 2002).
La lignina no es digerible por los animales pero sí por hongos y bacterias secretoras de enzimas que pueden degradar el polímero. Aunque se ha utilizado el término genérico "ligninasa", es preferible referirse a "enzimas modificadoras de lignina" (lignin-modifying enzymes o LMEs) ya que no catalizan reacciones hidrolíticas sino oxidativas (Winquist et al., 2008). Las LMEs comprenden las peroxidasas y muchas fenol-oxidasas del tipo lacasas (Shah y Nerud, 2002).
Las lacasas (1,2-benzenediol:oxígeno óxidorreductasa, EC 1.10.3.2) son oxidasas de una variedad de compuestos aromáticos (p-difenoles) y se caracterizan por poseer 3 centros catalíticos: Un centro T1, mononuclear, se encarga de la oxidación del sustrato, mientras que dos centros T2 y T3, forman un centro trinuclear, el cual se encarga de reducir el oxígeno molecular a agua (Alcalde y Bulter, 2003; Arias et al., 2003). Entre los sustratos naturales de las lacasas se incluyen fenoles, polifenoles, anilinas, aril-diaminas, fenoles metoxi-sustituidos, hidroxi-indoles, benzenotioles, compuestos metálicos orgánicos e inorgánicos, entre otros (Kunamneni et al., 2008a).
Entre las aplicaciones potenciales de las lacasas se encuentran: deslignificación de biomasa lignocelulósica (Rodríguez et al., 2003); bioblanqueamiento de pulpa de papel (Bourbonnais et al., 1997; Ibarra et al., 2006); tratamiento de aguas residuales industriales (Bergbauer et al., 1991; Berrio et al., 2007); modificación enzimática de fibras y blanqueamiento de textiles (Abadulla et al., 2000; Kunamneni et al., 2008b); destoxificación de contaminantes y biorremediación (Alcalde et al., 2002); destoxificación de hidrolizados de lignocelulosa para la producción de etanol por levaduras (López, 2005) y remoción enzimática de compuestos fenólicos en el procesamiento de bebidas (Brijwani et al., 2010). El uso de las lacasas en la degradación de biopolímeros estructurales como la lignina es materia de estudio para el aprovechamiento de gigantescos volúmenes de biomasa vegetal residual, e.g., palma africana (Cujia y Bula, 2010).
Las lacasas de origen fúngico han sido ampliamente estudiadas y en la actualidad tienen usos biotecnológicos (Rodríguez et al., 2003; Kiiskinen et al., 2004). No obstante, son escasas las lacasas bacterianas que han sido caracterizadas bioquímicamente in extenso, e.g., Streptomyces cyaneus, S. viridosporus, Bacillus subtilis, Pseudomonas desmolyticum y Azospirillum lipoferum (Faure et al., 1995; Berrocal et al., 1997; Diamantidis et al., 2000; Martins et al., 2002; Claus, 2003 y 2004). El análisis bioinformático de las secuencias alojadas en Genbank predice la existencia y amplia distribución de enzimas con actividad lacasa en procariotas (Alexandre y Zhulin, 2000; Hernández-Torres et al., 2006).
En este artículo describimos el aislamiento y la identificación morfológica y molecular de dos cepas de actinobacterias raras con actividad lacasa. Se evaluó su capacidad para oxidar guayacol en pruebas cualitativas, y cuantitativamente ABTS (2,2’-azino-bis-(3-etilbenzotiazolin-6-sulfonato) en paralelo con curvas de crecimiento. Los resultados obtenidos permiten concluir que los dos aislados tienen un gran potencial en la búsqueda de nuevos genes con actividad lacasa, de importancia para la industria biotecnológica.
Materiales y métodos
Aislamiento primario de microorganismos
Se tomaron muestras de suelo (2-5 cm de profundidad) y materia orgánica vegetal en descomposición, a partir de zonas agrícolas de los Municipios de Abrego (Norte de Santander [N. de S.] 1380 msnm) y alrededores de la Meseta de Bucaramanga (Santander [S.] 1000 msnm). Se llevó a cabo un aislamiento selectivo de actinobacterias según Seong et al., (2001). Diez gramos de cada muestra fueron sometidos a calor húmedo (70 ºC) por 15 min. Posteriormente, las muestras fueron transferidas a un recipiente con 50 ml de 1,5% fenol, homogenizadas e incubadas a temperatura ambiente durante 2 h. De las suspensiones fenólicas se realizaron diluciones seriadas hasta 10-6 en solución salina estéril y se sembraron por diseminación en Agar CYC pH 7.0 (Agar Czapek-Dox-Extracto de Levadura-Casaminoácidos, Ramírez y Coha, 2003). Los cultivos fueron incubados a temperatura ambiente (±25 ºC), por 14 d. Se obtuvieron cultivos axénicos mediante resiembras en agar para aislamiento de actinobacterias (Difco).
Detección de actividad lacasa
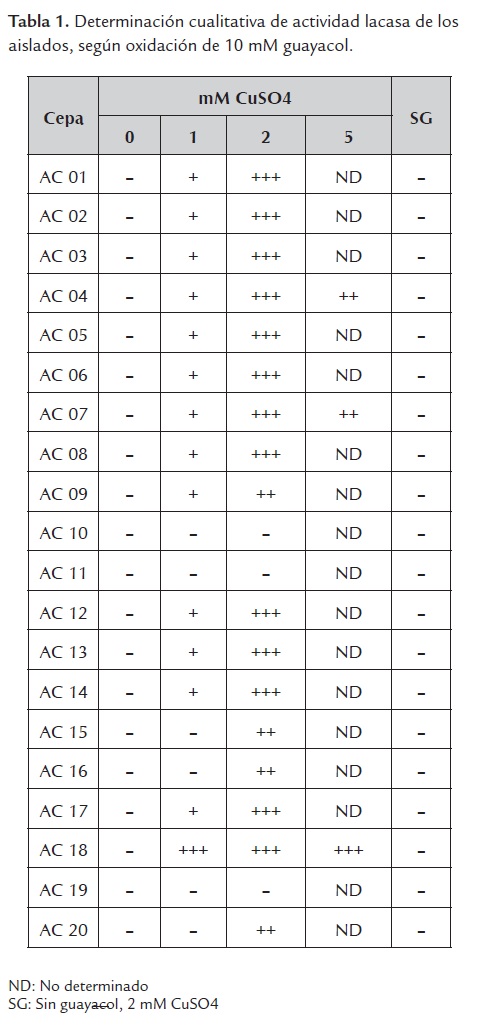
Las pruebas cualitativas para lacasas extracelulares se realizaron siguiendo la oxidación de guayacol en medio mineral basal MBC (0.1% KH2PO4, 0.4% Na2HPO4·7H20, 0.02% NaCl, 0.02% MgSO4· 7H20, y 0.005% CaCl2·2H20 suplementado con 5 g/L carboximetilcelulosa (CMC, Sigma) como única fuente de carbono) (Crawford, 1978), con presencia de iones Cu2+ (Gnanamani et al., 2006), durante 48 h. Se aplicaron los siguientes tratamientos, con la adición de: i) 10 mM guayacol sin CuSO4 [Control 1]; ii) 2 mM CuSO4 sin guayacol [Control 2]; iii) 10 mM guayacol y 1 mM CuSO4; iv) 10 mM guayacol y 2 mM CuSO4; v) 10 mM guayacol y 5 mM CuSO4.
Determinación morfológica
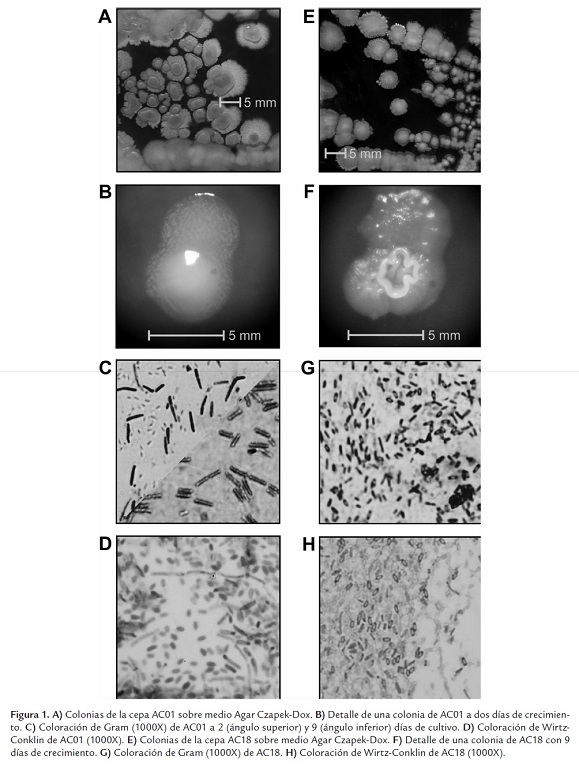
Para la determinación de las características morfológicas se realizaron siembras en Agar Czapek-Dox (Muiru et al., 2008). Los medios fueron dispensados en cajas de Petri estériles e incubados a 37 °C >24 h para facilitar el secado y controlar la esterilidad. Los cultivos fueron incubados a 25 ºC (AC1) y 37 ºC (AC18). Para la determinación de las características microscópicas, se realizó tinción de Gram y de Wirtz-Conklin con 0,1% verde de malaquita y 0,5% safranina (Schaeffer y MacDonald, 1933).
Análisis de las secuencias del gen 16S rRNA
Se amplificó parcialmente el gen de la subunidad pequeña del RNA ribosomal, por reacción en cadena de la polimerasa (PCR) utilizando oligonucleótidos así: para AC01, F243 (Heuer et al., 1997) y ACT1159R (Blackwood et al., 2005); para AC18, EUB338F (Guo et al., 2008) y ACT1159R. La mezcla de reacción de 25 µl contenía 50 ng de DNA total, búfer 1X flexible, 2,0 mM MgCl2, 0,4 mM dNTPs, 0,4 mM de cada cebador y 1,25 U de Taq ADN polimerasa (Promega). Las rutinas de PCR se realizaron con una desnaturalización inicial a 94 °C durante 3 min, seguido por 30 ciclos de 1 min a 94 ° C, 1 min a 60 °C y 1 min a 72 °C, y una extensión final a 72 °C durante 5 min en un termociclador Max Pro (ESCO). Los productos de PCR fueron verificados en geles de 0,8% agarosa teñidos con bromuro de etidio. Los amplificados (~500 ng) se purificaron con el kit PCR System Clean-Up (Promega ®) y enviados a la empresa Macrogen (Corea) para su secuenciación.
Ensayos de actividad lacasa en cultivo sumergido
Las cepas AC01 y AC18 fueron precultivadas durante 72 h en 30 g/L Caldo Tripticasa (Merck). Se inocularon 40 ml de suspensión celular en biorreactores provistos de 360 ml de medio mineral basal MBC suplementado con 10 g/L CMC, 100 UI/ml nistatina, 0,1% lignina álcali y 2 mM CuSO4 adicionado a 48 h de incubación (Ramírez y Coha, 2003). Los cultivos fueron incubados a ±25 ºC por 7 d, con aireación y agitación constantes. Luego se centrifugaron a 1600 g hasta alcanzar un volumen de sedimento de 5 ml, por triplicado para cada aislado. Las células fueron resuspendidas con 35 ml de medio mineral basal MBC para un volumen final de 40 ml. Cada triplicado de suspensión celular fue utilizado para la inoculación de 3 biorreactores de 500 ml, cada uno provisto de 360 ml de medio MBC suplementado con 10 g/L CMC, 100 UI/ml nistatina, 0,1% lignina álcali y 2 mM CuSO4. Los cultivos fueron incubados a 28 ºC por 7 d. Cada 24 h se extrajeron alícuotas de 20 ml para monitorear el crecimiento bacteriano a 620 nm y efectuar los ensayos de actividad lacasa.
De cada inóculo, 10 ml de cultivo sumergido se centrifugaron a 10.000 g por 20 min a 4 °C. El incremento de ABTS oxidado se midió a 405 nm (Wang y Ng, 2006), usando un lector de placas multipozos Anthos 2020. La mezcla de reacción consistió de 15 μL de sobrenadante, 85 μL de búfer 0,2 M acetato de sodio pH 4,5 y 100 µL de 10 mM ABTS (Sigma). Una unidad de actividad enzimática fue definida como la cantidad de enzima que cataliza la oxidación de 1 μmol de ABTS en 1 min. Para el cálculo de la actividad lacasa se utilizó un coeficiente de extinción molar de 35.000 M-1cm-1 para el ABTS oxidado.
Resultados
Aislamiento primario de microorganismos
Para la provisión de actinobacterias degradadoras de lignocelulosa, se aplicó el método de aislamiento de Seong et al., (2001). Este procedimiento, basado en la incubación de las muestras de suelo a 70 ºC por 15 min y posterior tratamiento con fenol, garantiza la selección de actinobacterias raras del suelo, por la supervivencia de las esporas a tales condiciones.
Se aislaron 20 cepas bacterianas (AC1-AC20) capaces de crecer sobre medio mineral basal MBC con carboximetilcelulosa como única fuente de carbono. Varias cepas se destacaron por una proliferación abundante sobre este medio de cultivo. En la Fig. 1 se muestran detalles morfológicos de los aislados AC01, procedente de Abrego (N. de S.) y AC18, nativa de los alrededores de la Meseta de Bucaramanga (S.). A juzgar por el crecimiento en las condiciones nutricionales restrictivas, se concluyó que los aislados expresaban actividades celulolíticas.
Detección de actividad lacasa en los aislados
La actividad lacasa puede evidenciarse en bioensayos con lignina como única fuente de carbono, aunque los ensayos analíticos para determinación de lignina los hacen dispendiosos. No obstante, otros compuestos orgánicos como el guayacol, empleado en este trabajo, también son sustratos de las enzimas modificadoras de lignina y la actividad se revela fácilmente por un cambio de coloración del medio de cultivo a púrpura (Winquist et al., 2008).
De acuerdo con la literatura científica, los iones Cu2+ tienen un efecto regulador positivo en la expresión de las lacasas de los hongos ligninolíticos Pleurotus ostreatus (Palmieri et al., 2000), P. pulmonarius (Tychanowicz et al., 2006), Lentinus (Panus) tigrinus (Shutova et al., 2008), Trametes versicolor (Collins y Dobson, 1997), entre otros. Por esta razón, inicialmente se hicieron ensayos de determinación cualitativa de actividad lacasa de todos los aislados celulolíticos, a las concentraciones de 0, 1, 2 y 5 mM CuSO4 y 10 mM guayacol. Los cultivos con los debidos controles demostraron que la coloración púrpura se debe a la presencia indispensable de iones Cu2+ y de guayacol (Tabla 1). A 5 mM, la actividad tiende a disminuir (cepas AC04 y AC07). Excepcionalmente, se pudo apreciar que en comparación con los otros 16 aislados positivos, la cepa AC18 exhibió una actividad lacasa precoz a 1 mM de iones Cu2+, la cual se constata aún a 5 mM CuSO4. Esta etapa de calibración de la concentración de CuSO4 permitió concluir que la concentración de 2 mM parece ser la más apropiada para obtener una fuerte actividad oxidativa del guayacol con las cepas aisladas. Por provenir de muestras de suelo distintas y generar un mayor producto coloreado, las cepas AC01 y AC18 (Tabla 1) fueron seleccionadas para una caracterización morfológica y molecular detalladas.
Identificación bacteriana
El método de aislamiento empleado, específico para actinobacterias, impone un filtro de selección de las especies bacterianas a obtener (Seong et al., 2001). Como era de esperarse, las pruebas morfológicas y moleculares aplicadas a las cepas AC01 y AC18 apuntan a que esos dos aislados pertenecen al phylum Actinobacteria, orden Actinomycetales.
Las características morfológicas de la cepa AC01 en cultivo sobre medio Agar CYC, fueron las siguientes: colonias de consistencia blanda, aspecto brillante, forma elevada convexa, superficie rugosa, borde irregular, color blanco (anverso y reverso), sin hifas aéreas ni producción de pigmento melanoide (Figs. 1A y 1B). Microscópicamente, mostró ser Gram variable, positiva en cultivos frescos con pérdida de la coloración en cultivos envejecidos (Fig. 1C). Células aerobias, en forma de cocobacilos de ≈2 µm, sin movilidad, filamentos en grupos de 3 a 6 células, micelio septado, formadoras de esporas (Fig. 1D). Las búsquedas mediante BlastN (Altschul et al., 1990) con la secuencia parcial del gen 16S rRNA (944 pb, segmentos hipervariables V2 a V7 (Chakravorty et al., 2007)) arrojó la mayor identidad con gran cantidad de especies del género Tsukamurella (97-99%) y unas pocas del género Rhodococcus (95-96%). La aplicación Sequence Match de la Ribosomal Database (Cole et al., 2009) encontró homólogos exclusivamente del género Tsukamurella con un score de similaridad de 0,948. Una búsqueda en Genbank de lacasas dentro de la familia Tsukamurellaceae con la secuencia de CotA de B. subtilis (la lacasa bacteriana mejor caracterizada), arrojó la presencia de oxidasas multicobre potenciales, con un E value de 1e-42. Curiosamente, búsquedas BlastP y BlastN con las secuencias de lacasas típicas de actinobacterias como Streptomyces lavendulae y la pequeña lacasa de Streptomyces coelicolor (Machczynski et al., 2004) no produjeron ningún resultado.
Por otra parte, las características morfológicas de la cepa AC18 en cultivo sobre medio Agar CYC fueron: colonias de consistencia cremosa, aspecto brillante, forma elevada, superficie irregular con formación de cráter, borde irregular, color blanco, sin hifas aéreas y sin producción de pigmento melanoide (Figs. 1E y 1F). A diferencia de los demás aislados, esta cepa mostró un crecimiento más rápido a 37 °C que a 25 °C. Microscópicamente, mostró ser Gram variable, células aerobias, en forma de bacilos pequeños ≈1.5 x 0.8 µm (Fig. 1G), sin movilidad, con formación de esporas y cadenas largas de conidios (Fig. 1H). BlastN capturó secuencias únicamente del género Cellulosimicrobium con una identidad de 99% (832 pb, segmentos hipervariables V3 a V7). Así mismo, Sequence Match de la RDP encontró homólogos exclusivamente del género Cellulosimicrobium con un score de similaridad de 0,889. Búsquedas BlastP y BlastN con las diversas lacasas bacterianas y fúngicas no arrojaron E values los suficientemente bajos, relacionados con el género Cellulosimicrobium.
Ensayos de actividad lacasa
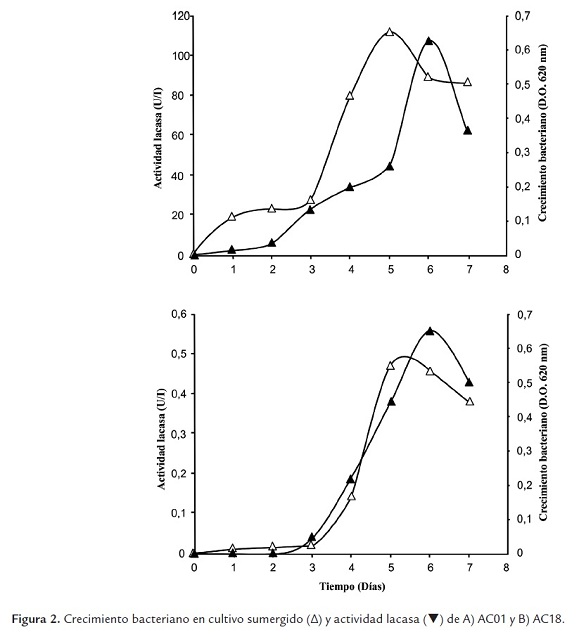
Se realizaron pruebas de actividad lacasa a sobrenadantes de cultivos sumergidos de los aislados seleccionados, i.e., cepas AC01 y AC18. Ambas cepas presentaron una fase de latencia hasta el día 3 y una fase exponencial hasta el día 5. Durante los días siguientes, ambos cultivos se encaminaron hacia la fase estacionaria (Fig. 2).
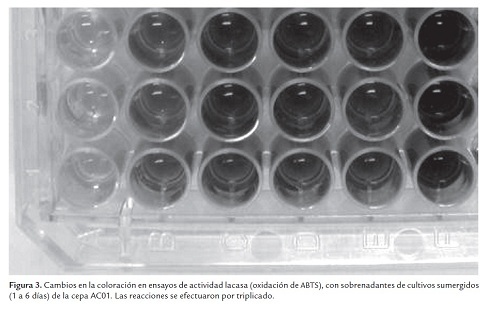
La actividad de las lacasas extracelulares expresadas en cultivos sumergidos se cuantificó con base en la oxidación de 2,2’-azino-bis-(3-etilbenzotiazolin-6-sulfonato) (ABTS). En estos ensayos enzimáticos, la oxidación del ABTS se manifiesta por la aparición de un color verde oscuro brillante en la mezcla de reacción (Fig. 3). Como puede apreciarse en la Fig. 2A, el aislado AC01 reveló una actividad lacasa detectable desde 24 h de cultivo (2 U/L). En los días siguientes, la actividad se incrementó rápidamente hasta un valor máximo de 108 U/L (día 6) y decreció en 24 h a 60 U/L con el alcance de la fase estacionaria. La cepa AC18 presentó el mismo comportamiento enzimático, aunque sorpresivamente los valores de actividad lacasa fueron muy bajos. En efecto, la actividad se hace detectable junto con el crecimiento, el día 3 con 4 x 10-2 U/L y aumentó rápidamente hasta alcanzar un valor máximo de tan solo 0,56 U/L el día 6. Al igual que la cepa AC01, la estabilización del cultivo en la fase estacionaria tiene un efecto negativo y en 24 h la actividad decrece a alrededor de 0,4 U/L (Fig. 2B). En la Fig. 3 se aprecia el cambio de coloración que sufre el ABTS, como producto de la actividad lacasa de la cepa AC01.
Discusión
En este trabajo se logró el aislamiento de 20 cepas celulolíticas, 17 de ellas también degradadoras de lignina, y la caracterización morfológica, molecular y funcional de la actividad lacasa de dos de ellas. Como se pudo apreciar, el protocolo de aislamiento de actinobacterias raras del suelo es muy eficiente en cuanto a su selectividad. No puede descartarse que las tres cepas celulolíticas restantes ostenten actividad ligninolítica, ya que podrían requerir condiciones nutricionales o ambientales específicas (D’Zouza-Ticlo et al., 2006; Zak et al., 2011). Son pocos los géneros bacterianos a los cuales se les ha comprobado la actividad lacasa, la mayoría de ellos de Actinobacteria, las bacterias más abundantes del humus de los bosques (Stevenson, 1994).
La actividad ligninolítica de los aislados quedó demostrada por la biotransformación del guayacol y del ABTS. Está bien documentado que el guayacol y el Cu2+ inducen la expresión de genes que codifican para diferentes isoenzimas de lacasa (Collins y Dobson, 1997; Palmieri et al., 2000, Terrón et al., 2004). La presencia de iones Cu2+ en el medio de cultivo es una condición esencial para que ocurra la expresión de las lacasas, debido a que esta enzima pertenece a la familia de proteínas multicobre (Claus, 2004). No obstante, se pudo constatar que concentraciones alrededor de 5 mM CuSO4 lograron ser inhibitorias del crecimiento bacteriano y de la actividad lacasa, en 2 de 3 cepas (Tabla 1). El efecto del cobre en dosis tóxicas ha sido previamente reportado (Gordon et al., 1994; Tychanowicz et al., 2006, Patel et al, 2009).
Los dos aislados escogidos por su alta expresión de lacasas en las pruebas cualitativas, resultaron ser actinobacterias poco estudiadas. Las características morfológicas, así como los análisis del gen 16S rRNA, hacen coincidir el aislado AC01 con el género Tsukamurella (Collins et al., 1988). Dos especies (T. pseudospumae y T. spumae) se han aislado de lodos activados (Nam et al., 2003; Nam et al., 2004), otras más de muestras clínicas (Nam et al., 2004) y recientemente, T. soli, una especie aislada del suelo (Weon et al., 2010). Es muy escasa la literatura científica relacionando el género Tsukamurella con las lacasas. Además, el hecho de que en Genbank no se encuentren proteínas homólogas de las lacasas típicas hace suponer que esta especie podría albergar una nueva variedad isoenzimática.
De otro lado, los resultados obtenidos permiten concluir que el aislado AC18 muy probablemente sea un representante del género Cellulosimicrobium. Aunque de nuevo, existe poca literatura vinculando las lacasas con este género (Mishra y Lata., 2007), es de presumir que las contienen, pues no es sorprendente encontrarlo como agente de biodegradación del humus boscoso (Yoon et al., 2007; Lo et al., 2009). Esta cepa llama la atención por su resistencia a altos niveles de cobre, que como se expresó anteriormente, son normalmente tóxicos (Tabla 1). Sin embargo, no es la única, pues ya se han reportado casos individuales de actinobacterias tolerantes a valores alrededor de 25 mM CuSO4 (Albarracín et al., 2005). Por otra parte, AC18 se destacó igualmente por un crecimiento rápido y abundante a 37°C sobre medio sólido, a diferencia de 25 °C de los demás aislados. Si bien la temperatura óptima establecida para el crecimiento de especies de este género es de ±28 °C, e.g., C. variabile (Bakalidou et al., 2002) y C. terreum (Yoon et al., 2007), otras especies como C. funkei (Brown et al., 2006) y C. cellulans (Heym et al., 2005; Rowlinson et al., 2006) pueden tolerar e incluso preferir temperaturas mayores (Yoon et al., 2007), pues se han encontrado como agentes infecciosos en humanos inmunosuprimidos.
Los valores de transformación del ABTS en cultivo sumergido se encuentran dentro de los rangos previamente identificados para basidiomicetos y actinobacterias (Srinivasan et al., 1995; Niladevi y Prema, 2005; Gomes et al., 2009). Sorprenden las cifras extremadamente bajas del aislado AC18 (Cellulosimicrobium sp), cuando en las pruebas cualitativas con guayacol se esbozaba como una de las más interesantes para caracterizar, por su precocidad en la expresión de la actividad lacasa y su resistencia a altos niveles de cobre (Tabla 1). Es claro que ocurrió un efecto inhibidor durante la línea de tiempo del cultivo y aunque la explicación de este fenómeno requiere de nuevas pruebas de laboratorio, es de considerar la posibilidad de que exista una especificidad de sustrato, como ha sido demostrado de manera muy similar en Pleurotus ostreatus (Mansur et al., 2003) y Lentinus edodes (D'Annibale et al., 1996) o de inductor de la expresión en Trametes sp. AH28-2 (Xiao et al., 2004).
Tomados en conjunto todos los resultados, podemos concluir que hemos aislado y caracterizado dos cepas de actinobacterias raras, interesantes por su actividad lignocelulósica. Detallados estudios bioquímicos y de la expresión y regulación de la actividad lacasa podrían revelar su potencial científico y biotecnológico.
Conclusiones
Se demostró el aislamiento selectivo de cepas bacterianas secretoras de lacasas, de las cuales dos géneros de actinobacterias raras del suelo fueron caracterizados: Tsukamurella sp y Cellulosimicrobium sp. Los dos aislados ostentan características microbiológicas y funcionales que las relacionan con la biodegradación de lignocelulosa. Como es prácticamente nula la literatura científica sobre estos dos géneros y su actividad secretora de lacasa, este trabajo hace un aporte significativo al conocimiento de la microbiota involucrada en la biodegradación del material vegetal. La caracterización bioquímica de las posibles nuevas isoformas de lacasas aquí reportadas podría revelar el papel que cumplen estos microorganismos en la degradación de la lignocelulosa y su potencial uso biotecnológico.
Agradecimientos
Los autores agradecen a la Vicerrectoría de Investigaciones y Extensión de la Universidad Industrial de Santander, por su apoyo financiero y logístico en el marco del proyecto de investigación "Biotratamiento de residuos lignocelulósicos por fermentación sobre sustrato sólido mediante el uso de actinobacterias con actividad lacasa extracelular".
Referencias bibliográficas
1 Abadulla, E., Tzanov, T., Costa, S., Robra K. H., Cavaco-Paulo, A., Gübitz, G. M., 2000. Decolorization and detoxification of textile dyes with a laccase from Trametes hirsuta. Applied and Environmental Microbiology, 66(8):3357-3362. [ Links ]
2 Albarracín, V. H., Amoroso, M. J., Abate, C. M., 2005. Isolation and characterization of indigenous copper resistant actinomycete strains. Chemie der Erde/Geochemistry, 65(1):145-156. [ Links ]
3 Alcalde, M., Bulter, T., Arnold, F. H., 2002. Colorimetric assays for biodegradation of polycyclic aromatic hydrocarbons by fungal laccases. Journal of Biomolecular Screening, 7(6):547-553. [ Links ]
4 Alcalde, M., Bulter, T., 2003. Colorimetric assays for screening laccases. En : Methods in Molecular Biology, vol. 230. Directed Enzyme Evolution: Screening and Selection Methods. Humana Press Inc., Totowa, NJ. pp 193-201. [ Links ]
5 Alexandre, G., Zhulin, I. B., 2000. Laccases are widespread in bacteria. Trends in Biotechnology, 18(2):41-42. [ Links ]
6 Altschul, S. F., Gish, W., Miller, W., Myers, E. W., Lipman, D. J., 1990. Basic local alignment search tool. Journal of Molecular Biology, 215(3):403-410. [ Links ]
7 Arias, M. E., Arenas, M., Rodríguez, J., Soliveri, J., Ball, A. S., Hernández, M., 2003. Kraft pulp biobleaching and mediated oxidation of a nonphenolic substrate by laccase from Streptomyces cyaneus CECT 3335. Applied and Environmental Microbiology, 69(4):1953-1958. [ Links ]
8 Bakalidou A., Kämpfer, P., Berchtold, M., Kuhnigk, T., Wenzel, M., König, H., 2002. Cellulosimicrobium variabile sp. nov., a cellulolytic bacterium from the hindgut of the termite Mastotermes darwiniensis. International Journal of Systematic and Evolutionary Microbiology, 52(4):1185-1192. [ Links ]
9 Bergbauer, M., Eggert, C., Kraepelin, G., 1991. Degradation of chlorinated lignin compounds in a bleach plant effluent by the white-rot fungus Trametes versicolor. Applied Microbiology and Biotechnology, 35(1):105-109. [ Links ]
10 Berrio, J., Plou, F. J., Ballesteros, A., Martínez, A. T., Martínez, M. J., 2007. Immobilization of Pycnoporus coccineus laccase on Eupergit C: Stabilization and treatment of olive oil mill wastewaters. Biocatalysis and Biotransformation, 25(2):130-134. [ Links ]
11 Berrocal, M., Rodríguez, M. J., Ball, A. S., Pérez, M. I., Arias, M. E., 1997. Solubilisation and mineralization of [14C] lignocellulose from wheat straw by Streptomyces cyaneus CECT 3335 during growth in solid-state fermentation. Applied Microbiology and Biotechnology, 48(3):379-384. [ Links ]
12 Blackwood, C. B., Oaks, A., Buyer, J. S., 2005. Phylum- and class-specific PCR primers for general microbial community analysis. Applied and Environmental Microbiology, 71(10):6193-6198. [ Links ]
13 Bourbonnais, R., Paice, M. G., Freiermuth, B., Bodie, E., Borneman, S., 1997. Reactivities of various mediators and laccases with kraft pulp and lignin model compounds. Applied Environment Microbiology, 63(12):4627-4632. [ Links ]
14 Brijwani, K., Rigdon, A., Vadlani, P. V., 2010. Fungal laccases: Production, function, and applications in food processing. Enzyme Research, 2010(1):1-10. [ Links ]
15 Brown, J. M., Steigerwalt, A. G., Morey, R. E., Daneshvar, M. I., Romero, L. J., McNeil, M. M., 2006. Characterization of clinical isolates previously identified as Oerskovia turbata: proposal of Cellulosimicrobium funkei sp. nov. and emended description of the genus Cellulosimicrobium. International Journal of Systematic and Evolutionary Microbiology, 56(4):801-804. [ Links ]
16 Chakravorty, S., Helb, D., Burday, M., Connell, N., Alland, D., 2007. A detailed analysis of 16S ribosomal RNA gene segments for the diagnosis of pathogenic bacteria. Journal of Microbiological Methods, 69(2):330-339. [ Links ]
17 Claus, H., 2003. Laccases and their occurrence in prokaryotes. Archives of Microbiology, 179(3):145-150. [ Links ]
18 Claus, H., 2004. Laccases: structure, reactions, distribution. The International Research and Review Journal for Microscopy, 35(1-2):93-96. [ Links ]
19 Cole, J. R., Wang, Q., Cardenas, E., Fish, J., Chai, B., Farris, R. J., Kulam-Syed-Mohideen, A. S., McGarrell, D. M., Marsh, T., Garrity, G. M., Tiedje, J. M., 2009. The Ribosomal Database Project: improved alignments and new tools for rRNA analysis. Nucleic Acids Research, 37(Suppl. 1): D141-D145. [ Links ]
20 Collins, M. D., Smida, J., Dorsch, M., Stackebrandt, E., 1988. Tsukamurella gen. nov. harboring Corynebacterium paurometabolum and Rhodococcus aurantiacus. International Journal of Systematic and Evolutionary Microbiology, 38(4):385-391. [ Links ]
21 Collins, P. J., Dobson, A. D. W., 1997. Regulation of laccase gene transcription in Trametes versicolor. Applied Microbiology and Biotechnology, 63(9):3444-3450. [ Links ]
22 Crawford, D. L., 1978. Lignocellulose decomposition by selected Streptomyces strains. Applied and Environmental Microbiology, 35(6):1041-1045. [ Links ]
23 Cujia, G., Bula, A., 2010. Potencial obtención de gas de síntesis para la producción de metanol a partir de la gasificación de residuos de palma africana. Interciencia, 35(2):106-112. [ Links ]
24 D'Annibale, A., Celletti, D., Felici, M., Di Mattia, E., Giovannozzi-Sermanni, G., 1996. Substrate specificity of laccase from Lentinus edodes. Acta Biotechnologica, 16(4):257-270. [ Links ]
25 Diamantidis, G., Effosse, A., Potier, P., Bally, R., 2000. Purification and characterization of the first bacterial laccase in the rhizospheric bacterium Azospirillum lipoferum. Soil Biology and Biochemistry, 32(7):919-927. [ Links ]
26 D"Souza-Ticlo, D., Verma, A. K., Mathew, M., Raghukumar, C., 2006. Effect of nutrient nitrogen on laccase production, its isozyme pattern and effluent decolorization by fungus NIOCC #2a, isolated from mangrove wood. Indian Journal of Marine Sciences, 35(4):364-372. [ Links ]
27 Faure, D., Bouillant, M. L., Bally, R., 1995. Comparative study of substrates and inhibitors of Azospirillum lipoferum and Pyricularia oryzae laccases. Applied and Environmental Microbiology, 61(3):1144-1146. [ Links ]
28 Gnanamani A., Jayaprakashvel M., Arulmani M., Sadulla S., 2006. Effect of inducers and culturing processes on laccase synthesis in Phanerochaete chrysosporium NCIM 1197 and the constitutive expression of laccase isozymes. Enzyme and Microbial Technology, 38(7): 1017-1021. [ Links ]
29 Gomes, E., Aguiar, A. P., Carvalho, C. C., Bonfá, M. R. B., Da Silva, R., Boscolo, M., 2009. Ligninases production by Basidiomycetes strains on lignocellulosic agricultural residues and their application in the decolorization of synthetic dyes. Brazilian Journal of Microbiology, 40(1):31-39. [ Links ]
30 Gordon, A. S., Howell, L. D., Harwood, V., 1994. Responses of diverse heterotrophic bacteria to elevated copper concentrations. Canadian Journal of Microbiology, 40(5):408-411. [ Links ]
31 Guo, X., Xia, X., Tang, R., Wang, K., 2008. Real-time PCR quantification of the predominant bacterial divisions in the distal gut of Meishan and Landrace pigs. Anaerobe, 14(4):224-228. [ Links ]
32 Hernández-Torres, J., Rodríguez-Buitrago, J. A., Chomilier, J., 2006. Hydrophobic Cluster Analysis (HCA) revela la existencia de isoformas de baja intensidad de lacasas (EC 1.10.3.2) en 7 phyla de bacteria. Actualidades Biológicas, 28(85):101-114. [ Links ]
33 Heuer, H., Krsek, M., Baker, P., Smalla, K., Wellington, E., 1997. Analysis of actinomycete communities by specific amplification of genes encoding 16S rRNA and gel-electrophoretic separation in denaturing gradients. Applied and Environmental Microbiology, 63(8):3233-3241. [ Links ]
34 Heym, B., Gehanno, P., Friocourt, V., Bougnoux, M. E., Le Moal, M., Husson, C., Leibowitch, J., Nicolas-Chanoine, M. H., 2005. Molecular detection of Cellulosimicrobium cellulans as the etiological agent of a chronic tongue ulcer in a human immunodeficiency virus-positive patient. Journal of Clinical Microbiology, 43(8):4269-4271. [ Links ]
35 Ibarra, D., Camarero, S., Romero, J., Martínez, M. J., Martínez, A. T., 2006. Integrating laccase-mediator treatment into an industrial-type sequence for totally chlorine free bleaching eucalypt kraft pulp. Journal of Chemical Technology and Biotechnology, 81(7):1159-1165. [ Links ]
36 Kiiskinen, L. L., Rättö, M., Kruus, K., 2004. Screening for novel laccase-producing microbes. Journal of Applied Microbiology, 97(3):640-646. [ Links ]
37 Kunamneni, A., Camarero, S., García-Burgos, C., Plou, F. J., Ballesteros, A., Alcalde, M., 2008a. Engineering and Applications of fungal laccases for organic synthesis. Microbial Cell Factories, 7(1):32. [ Links ]
38 Kunamneni, A., Ghazi, I., Camarero, S., Ballesteros, A., Plou, F. J., Alcalde M., 2008b. Decolorization of synthetic dyes by laccase immobilized on epoxy-activated carriers. Process Biochemistry, 43(2):169-178. [ Links ]
39 Lo, Y. C., Saratale, G. D., Chen, W. M., Bai, M. D., Chang, J.S., 2009. Isolation of cellulose-hydrolytic bacteria and applications of the cellulolytic enzymes for cellulosic biohydrogen production. Enzyme and Microbial Technology, 44(6-7): 417-425. [ Links ]
40 López, G. D., 2005. Situación y perspectivas de los polímeros biodegradables: diseño y formulación según la demanda del mercado. Ingeniería Química, 37(424):176-185. [ Links ]
41 Lynd, L. R., Wyman, C. E., Gerngross, T. U., 1999. Biocommodity engineering. Biotechnology Progress, 15(5):777-793. [ Links ]
42 Lynd, L. R., Weimer, P. J., van Zyl, W. H., Pretorius, I. S., 2002. Microbial cellulose utilization: Fundamentals and biotechnology. Microbiology and Molecular Biology Reviews, 66(3):506-577. [ Links ]
43 Machczynski, M.C., Vijgenboom, E., Samyn, B., Canters, G. W., 2004. Characterization of SLAC: a small laccase from Streptomyces coelicolor with unprecedented activity. Protein Science, 13(9):2388-2397. [ Links ]
44 Mansur, M., Arias, M.E., Copa-Patiño, J.L., Flärdh, M., González, A.E., 2003. The white-rot fungus Pleurotus ostreatus secretes laccase isozymes with different substrate specificities. Mycologia, 95(6):1013-1020. [ Links ]
45 Martins, L. O., Soares, C. M., Pereira, M. M., Teixera, M., Costa, T., Jones, G. H., Henriques, A. O., 2002. Molecular and biochemical characterization of a highly stable bacterial laccase that occurs as a structural component of the Bacillus subtilis endospore coat. Journal of Biological Chemistry, 277(21):18849-18859. [ Links ]
46 Mishra, B. K., Lata, A. K. P., 2007. Lignocellulolytic enzyme production from submerged fermentation of paddy straw. Indian Journal of Microbiology, 47(2):176-179. [ Links ]
47 Muiru, W. M., Mutitu, E. W., Mukunya, D. M., 2008. Identification of selected actinomycete isolates and characterization of their antibiotic metabolites. Journal of Biological Sciences, 8(6):1021-1026. [ Links ]
48 Nam, S. W., Chun, J., Kim, S., Kim, W., Zakrzewska-Czerwinska, J., Goodfellow, M., 2003. Tsukamurella spumae sp. nov., a novel actinomycete associated with foaming in activated sludge plants. Systematic and Applied Microbiology, 26(3):367-75. [ Links ]
49 Nam, S. W., Kim, W., Chun, J., Goodfellow, M., 2004. Tsukamurella pseudospumae sp. nov., a novel actinomycete isolated from activated sludge foam. International Journal of Systematic and Evolutionary Microbiology, 54(4):1209-12. [ Links ]
50 Niladevi, K. N., Prema, P., 2005. Mangrove actinomycetes as the source of ligninolytic enzymes. Actinomycetologica, 19(2):40-47. [ Links ]
51 Palmieri, G., Giardina, P., Bianco, C., Fontanella, B., Sannia G., 2000. Copper induction of laccase isoenzymes in the ligninolytic fungus Pleurotus ostreatus. Applied and Environmental Microbiology, 66(3):920-924. [ Links ]
52 Patel, H., Gupte, A., Gupte, S., 2009. Effect of different culture conditions and inducers on production of laccase by a basidiomycete fungal isolate Pleurotus ostreatus HP-1 under solid state fermentation. BioResources, 4(1):268-284. [ Links ]
53 Ramírez, P., Coha, J. M., 2003. Degradación enzimática de celulosa por actinomicetos termófilos: aislamiento, caracterización y determinación de la actividad celulolítica. Revista Peruana de Biología, 10(1):67-77. [ Links ]
54 Rodríguez, S., Fernández, M., Bermúdez, R., Morris, H., 2003. Tratamiento de efluentes industriales coloreados con Pleurotus spp. Revista Iberoamericana de Micología, 20(4):164-168. [ Links ]
55 Rowlinson, M. C., Bruckner, D. A., Hinnebusch, C., Nielsen, K., Deville, J. G., 2006. Clearance of Cellulosimicrobium cellulans bacteremia in a child without central venous catheter removal. Journal of Clinical Microbiology, 44(7):2650-2654. [ Links ]
56 Schaeffer, A. B., MacDonald, F., 1933. A simplified method of staining endospores. Science, 77(1990):194. [ Links ]
58 Seong, C. N., Choi, J. H., Baik, K. S., 2001. An improved selective isolation of rare actinomycetes from forest soil. The Journal of Microbiology, 39(1):17-23. [ Links ]
59 Shah, V., Nerud, F., 2002. Lignin degrading system of white-rot fungi and its exploitation for dye decolorization. Canadian Journal of Microbiology, 48(10):857-870. [ Links ]
60 Shutova, V. V., Revin, V. V., Myakushina, Y. A., 2008. The effect of copper ions on the production of laccase by the fungus Lentinus (Panus) tigrinus. Applied Biochemistry and Microbiology, 44(6):619-623. [ Links ]
61 Srinivasan C., Dsouza, T. M., Boominathan, K., Reddy, C. A., 1995. Demonstration of laccase in the white rot basidiomycete Phanerochaete chrysosporium BKM-F1767. Applied and Environmental Microbiology, 61(12):4274-4277. [ Links ]
62 Stevenson, F. J., 1994. Humus Chemistry: Genesis, Composition, Reactions. John Wiley & Sons, New York. [ Links ]
63 Terrón, M. C., González, T., Carbajo, J. M., Yagüe, S., Arana-Cuenca, A., Téllez, A., Dobson, A. D., González, A. E., 2004. Structural close-related aromatic compounds have different effects on laccase activity and on lcc gene expression in the ligninolytic fungus Trametes sp. I-62. Fungal Genetics and Biology, 41(10):954-962. [ Links ]
64 Tuomela, M., Oivanen, P., Hatakka, A., 2002. Degradation of synthetic 14C-lignin by various white-rot fungi in soil. Soil Biology and Biochemistry, 34(11):1613-1620. [ Links ]
65 Tychanowicz, G. K., Souza, D. F., Souza, C. G. M., Kadowaki, M. K., Peralta, R. M., 2006. Copper improves the production of laccase by the white-rot fungus Pleurotus pulmonarius in solid state fermentation. Brazilian Archives of Biology and Technology, 49(5):699-704. [ Links ]
66 Wang, H. X., Ng, T. B., 2006. Purification of a laccase from fruiting bodies of the mushroom Pleurotus eryngii. Applied Microbiology and Biotechnology, 69(5):521-525. [ Links ]
67 Weimer, P. J., 1996. Why don"t ruminal bacteria digest cellulose fast. Journal of Dairy Science, 79(8):1496-1502. [ Links ]
68 Weon, H. Y., Yoo, S. H., Anandham, R., Schumann, P., Kroppenstedt, R. M., Kwon, S. W., Stackebrandt, E., 2010. Tsukamurella soli sp. nov., isolated from soil. International Journal of Systematic and Evolutionary Microbiology, 60(7):1667-1671. [ Links ]
69 Winquist, E., Moilanen, U., Mettälä, A., Leisola, M., Hatakka, A., 2008. Production of lignin modifying enzymes on industrial waste material by solid-state cultivation of fungi. Biochemical Engineering Journal, 42(2):128-132. [ Links ]
70 Xiao, Y. Z., Chen, Q., Hang, J., Shi, Y. Y., Xiao, Y. Z., Wu, J., Hong, Y. Z., Wang, Y. P., 2004. Selective induction, purification and characterization of a laccase isozyme from the basidiomycete Trametes sp. AH28-2. Mycologia, 96(1):26-35. [ Links ]
71 Yoon, J. H., Kang, S. J., Schumann, P., Oh, T. K., 2007. Cellulosimicrobium terreum sp. nov., isolated from soil. International Journal of Systematic and Evolutionary Microbiology, 57(11):2493-2497. [ Links ]
72 Zak, D. R., Pregitzer, K. S., Burton, A. J., Edwards, I. P., Kellner, H., 2011. Microbial responses to a changing environment: implications for the future functioning of terrestrial ecosystems. Fungal Ecology, 4(6):386-395. [ Links ]