Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.15 no.1 Bogotá jan./jun. 2013
ARTÍCULO DE INVESTIGACIÓN
Evaluación del potencial mutagénico de biocidas (vertimec y pentacloro) sobre cebolla
Título corto: Genotoxicidad en Allium cepa producida por biocidas.
Evaluation of the mutagenic potential of biocides (vertimec and pentachloro) on onion
Alfredo M. Berrocal1,2 , Raúl H. Blas1 , Joel Flores1 , María A. Siles3.
1 Laboratorio de citogenética y biología molecular del instituto de Biotecnología, Universidad Nacional Agraria la Molina, Apartado 456 Lima 1, Perú.
2 Correspondencia: Blgo Alfredo Miguel Berrocal Huallpa, Alfredo.bh17@gmail.com Blga María Angélica Siles Vallejos, mariansi@hotmail.com
3 Universidad Nacional Mayor de San Marcos, Av. Universitaria /Av. Germán Amézaga s/n, Lima 1, Perú.
Recibido: abril 17 de 2013 Aprobado: junio 18 de 2013
Resumen
El uso de biocidas es una constante en el campo agronómico, el daño ocasionado a los cultivos y por consiguiente el gran potencial de daño para los consumidores es conocido, sin embargo su uso sigue en marcha. Por ello se realizaron pruebas citogenéticas para la observación de aberraciones cromosómicas en Allium cepa, usando muestras de raíces de plantas expuestas y no expuestas a biocídas. Los tratamientos se realizaron con el objetivo de comparar el grado de afectación de los biocídas sobre la mitosis y la ocurrencia de mutaciones cromosómicas. El ANOVA para los datos de desarrollo radicular al finalizar la experimentación, mostraron un CV de 9.88, se observo diferencias significativas entre el control y los tratamientos, los porcentajes de inhibición llegaron a tener valores máximos de 84.2% para vertimec X8 y 76.5% para pentacloro X8, y valores mínimos de 38.2% para vertimec X0.5 y 43.8% para pentacloro 0.5 X. El índice mitótico fue mayor para el control (0.193) y menores para el tratamiento con menor desarrollo radicular, vertimec X8 (0.021) y pentacloro X8 (0.028). Las pruebas citogenéticas mostraron la ocurrencia de anomalías en el ciclo celular siendo la más frecuente la C-mitosis. Se puede concluir que el test Allium es un buen indicador de citotoxicidad y genotoxicidad. Los biocidas ocasionan cambios en la estructura genómica de un cultivo, estos cambios podrían acumularse y ocasionar cambios de expresión génica, pudiendo dañar regiones de interés agronómico para una especie y afectar su estabilidad genética.
Palabras clave: test Allium, anomalía mitótica, estabilidad genética, genotoxicidad, citotoxicidad.
Abstract
Use of biocides is a constant in the agronomic field, the damage to crops and therefore the potential for harm to consumers is known, however its use is ongoing. Therefore, tests were performed to observe cytogenetic aberrations in Allium cepa using plant root samples exposed and not exposed to biocides. Treatments were performed in order to compare the degree of impact of biocides on mitosis and the occurrence of chromosomal mutations. The ANOVA for root development data at the end of the experiment showed a CV of 9.88, significant differences was observed between control and treatments; the inhibition percentages have reached maximum values of 84.2% for Vertimec X8 and 76.5% for pentachloro X8, and minimum values of 38.2% for Vertimec X0.5 and 43.8% for pentachloro X0.5. The mitotic index was higher for control (0.193) and lower for treatment with less developed root Vertimec X8 (0.021) and pentachloro X8 (0.028). Tests showed the occurrence of cytogenetic abnormalities in the cell cycle being the most frequent C-mitosis. It can be concluded that the Allium test is a good indicator of cytotoxicity and genotoxicity. Biocides cause changes in the genomic structure of crops; these changes may accumulate and cause gene expression changes, can damage agronomic interest regions for a species and affect their genetic stability.
Key words: Allium test, mitotic abnormalities, genetic stability, genotoxicity, cytotoxicity.
Introducción
La aplicación de biocídas en los cultivos vegetales de importancia económica para el país, es una práctica común frente a problemas de enfermedades y plagas, sin embargo a pesar de ser conocidos sus efectos tóxicos en diferentes grados, dependiendo de diversos factores, se sabe que muchos de estos provocan alguna alteración a nivel del ADN, y esto puede ser expresado a nivel citológico ( Palani, 2007), como un fallo en la maquinaria mitótica la cual a su vez es observada con una disminución del índice mitótico y alguna anomalía en los cromosomas ( Grant, 1982) como por ejemplo la presencia de puentes anafásicos, C-mitosis, deleciones, translocaciones y fragmentos aberrantes productos de algún daño en la mitosis (Rank, 2003).
Además de los efectos agudos y crónicos ya descritos, existen otros efectos de los biocidas que se presentan a muy largo plazo en la población o bien se manifiestan en otras generaciones. Estos efectos se derivan de la exposición continua a dosis bajas de una sustancia y pueden incluir una gran variedad de alteraciones bioquímicas, fisiológicas y morfológicas. Entre los más importantes se encuentran la aparición de mutaciones (Olufunsho, 2010). Comprobar la capacidad toxicológica de un compuesto es muy difícil, en particular a concentraciones normales de uso y sobre todo el detectar los niveles de concentración que se requieren para inducir mutaciones, en este aspecto muchas mutaciones que a determinadas dosis no se manifiestan se van acumulando y por consiguiente van desestabilizando la configuración genómica normal. Parte del problema radica en que en estos casos, no se puede establecer claramente la relación dosis-efecto y, por lo tanto, no es posible fijar un valor o dosis mínima capaz de provocar alteraciones. Por lo mismo, tampoco se puede establecer una concentración que sea "segura". Por otra parte, la especificidad de los compuestos hacia cada especie en particular dificulta relacionar los efectos que causan las sustancias químicas en las plantas con los que podrían causar en el hombre. Aun así se debe considerar que los agentes químicos que generan mutaciones, o cualquier efecto tóxico sistemático en plantas de experimentación (Grant, 1994), teóricamente también tienen la capacidad de causar efectos en los seres humanos.
El test de Allium cepa viene siendo usado para el diagnóstico de toxicidad de diferentes compuestos tanto farmacéuticos, alimenticios y contaminantes (Frainer et al., 2006; Konuk, 2007; Olusegun et al., 2010), esto debido a que fácilmente se pueden distinguir algunas anomalías cromosómicas, producto de un agente mutagénico, en consecuencia el obtener un diagnóstico citogenético (Ragunathan et al., 2007). Frente a la utilización de biocídas en cultivos de importancia agronómica, la utilización del test de Allium cepa permite obtener un buen registro de la ocurrencia de estas anomalías (Grant, 1982 y Rank, 2003); existen muchos trabajos que aprovechan la facilidad de identificar efectos genotóxicos debido a diferentes contaminantes biológicos ambientales (Ukaegbu et al., 2009). El test de Allium cepa aprovecha la consecuencia de la disminución del índice mitótico, expresada en el menor desarrollo radicular, observando así diferencias significativas entre compuestos a distintas concentraciones, y tiempos de exposición (Fiskesjo, 1985).
El uso del test de Allium cepa permite determinar la toxicidad de muchos compuestos por su gran sensibilidad (Fiskesjo, 1988) es por ello que en la actualidad se viene usando para monitorear el grado toxicológico de distintos compuestos como el azufre, magnesio, boro, cromo, pesticidas, herbicidas, farmacéuticos entre otros (Fiskesjo, 1993, Peña et al., 1999; Espinoza et al., 2007; Feretti et al., 2007; Shukla et al., 2002; Tartar et al., 2006; Grant, 1978; Mustafa et al., 2008). El test de Allium cepa además, es usado en programas de biorremediación (Srivastava et al., 2005), y también podría usarse en estudios de conservación.
Materiales y métodos
Materiales biológicos, equipos y reactivos
Como material biológico se usaron 55 bulbos de cebolla (Allium cepa), se seleccionaron bulbos de cebolla de aproximadamente 100 gramos, secos y sin formación de hojas y/o raíz. Los bulbos fueron limpiados mediante la eliminación de la epidermis seca y remoción de los restos de tejido y raíces secas, sin dañar las raíces primordiales. Adicionalmente se usaron 24 bulbos de cebollas con las mismas características, para determinar la hora adecuada de corte de ápices radiculares. Los reactivos para citogenética fueron fijador carnoy (Etanol: ácido acético (3:1)), HCl 1N, solución Targa, Orceína acética (2%).
Instalación del diseño experimental
Previo al diseño experimental se determinó la hora adecuada de corte de ápices radiculares, en un ambiente oscuro y con 26º C condicionado para el experimento, en el intervalo de 7.00 am a 1.00 pm. En el experimento se utilizó agua dura para el tratamiento control, así como para la preparación de las diluciones de los biocídas vertimec (Vertimec - Syngenta) y pentacloro (Pentacloro Saume). Se realizo la dilución en forma secuencial, obteniendo así las siguientes concentraciones: 0.5x, 1x, 2x, 4x y 8x para cada biocida (1X representa la dosis de uso recomendada). Las pruebas se realizaron en frascos de ensayo de 12 cm de longitud x 5 cm de diámetro. Se rotularon los frascos con V0.5, V1, V2, V4, V8 para vertimec, P0.5, P1, P2, P4, P8 para pentacloro y C para el control, todos con 5 replicas, siendo un total de 55 unidades experimentales. El ensayo se inició con el llenado de los frascos con cada una de las diluciones y controles; este llenado se hizo cerca al borde del frasco. A continuación se colocaron los bulbos sobre la boca del frasco, cuidando que la zona radicular quedara inmersa en el líquido. Las evaluaciones se hicieron a los 3, 6, 9 y 12 días de exposición, y en cada periodo de evaluación se midió todas las raíces emergentes y se calculó el promedio, el cual representó el valor de la medición para dicha unidad experimental (valores extremos se descartaron). Para obtener el porcentaje del efecto de inhibición se realizó la siguiente operación:
Con los valores de inhibición se construyo una gráfica de concentración versus porcentaje de inhibición y se calculó el CI50 (concentración que produce el 50 % de reducción en la longitud de raíz). Diseño experimental utilizado fue el DCA (diseño completamente aleatorio) adaptado para el test Allium (Fiskesjo, 1985). Para analizar los datos obtenidos se utilizó el paquete estadístico SAS 9.2 que permitió hacer el análisis de varianza y pruebas de comparación de medias como Duncan y Dunnett's.
Análisis citogenético
Al finalizar el periodo de exposición se retiraron todos los bulbos de los tratamientos a frascos con agua potable por una hora, luego se procedió con la tinción cromosómica de la manera que sigue: se cortaron ápices radiculares de 1-2 mm de longitud, se colocaron en una luna de reloj y se agregó la solución fijadora durante 15 minutos(a más tiempo). Se colocaron las raíces en acido clorhídrico 1N durante 10 min. Se agregó 1 a 2 gotas de la solución Targa y se mantuvo la muestra en esta solución durante 15 min. Se cortaron las raíces en secciones transversales al eje mayor de la raíz y fueron colocadas sobre una lámina. Se añadió 1 o 2 gotas de orceína acética al 2% durante 17 min. Luego se colocó una laminilla en 45º y se realizó el squash. Finalmente se extendió la muestra por golpeteo con la punta del lápiz. Se observó al microscopio tratando de identificar células que se encuentren en mitosis y fases mitóticas con anomalías (observación a 10x, 40x y 100x).
Calculo del índice mitótico
Los diferentes índices fueron obtenidos de la siguiente manera: el índice mitótico IM= (Número de células en división/ número de células totales); y los indices de Fase: IFp= (células en profase/células en división), IFm= (células en metafase/células en división), IFa= (células en anafase/células en división), y IFt= (células en telofase/células en división).
Resultados
Hora adecuada de corte de ápices radiculares
El monitoreo de la hora adecuada para el corte de ápices de raíz en cebolla, fue entre las 9 -11 de la mañana, en las condiciones del laboratorio (oscuridad y 26º C), teniendo como índice mitótico a 17% en promedio. Por lo tanto en la experimentación usando tratamientos con biocidas se realizaron cortes de ápices radiculares entre las 9 y 11 de la mañana, lo que permitió poder trabajar adecuadamente las 55 unidades experimentales.
Resultados del análisis estadístico
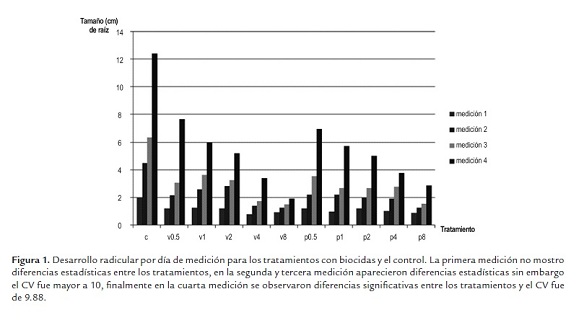
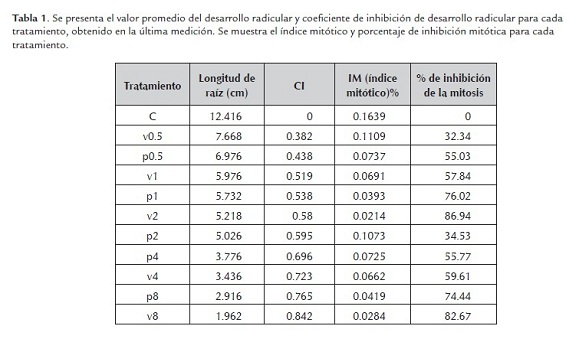
El coeficiente de variación (CV) para la primera medición resulto superior a 10, por consiguiente el análisis de varianza y comparación de medias no eran estadísticamente aceptables. Conforme se hicieron la segunda y tercera medición se obtuvieron valores de CV (coeficiente de variación) cercanos a 10, es decir, en cada medición siguiente el CV fue disminuyendo, mostrando diferencias significativas entre los tratamientos y agrupamientos estadísticamente aceptables (figura 1). El análisis de varianza del ensayo para la última medición con 10 grados de libertad, con 5 repeticiones por tratamiento, con 0 unidades perdidas y un alfa= 0.01 para el análisis de agrupamiento mostró diferencias significativas entre los tratamientos y un CV de 9.88, siendo estadísticamente aceptable el experimento realizado. La comparación de medias mediante Duncan (alfa= 0.01) muestra cinco grupos distintos (A: control; B: V0.5 y P0.5; C: V1, V2, P1 y P2; D: V4, P4 y P8; E: V8), el tratamiento V8 presenta menor tamaño de raíz, 1.96 cm, los tratamientos V1, V2, P1, P2 no muestran diferencias significativas en el tamaño de raíz (tamaño promedio 5.5 +/- 0.4 cm) y el control el mayor tamaño, 12.42 cm. Mediante Dunnett´s (alfa= 0.01) se observó que el control es distinto a los demás tratamientos, teniendo una diferencia menor entre medias con los tratamientos V0.5 (4.7cm) y P0.5 (5.4cm), y mayor diferencia de medias con los tratamientos V8 (10.5cm) y P8 (9.5cm), sin embargo todos los tratamientos son estadísticamente muy diferentes al control.
Coeficiente de inhibición (CI)
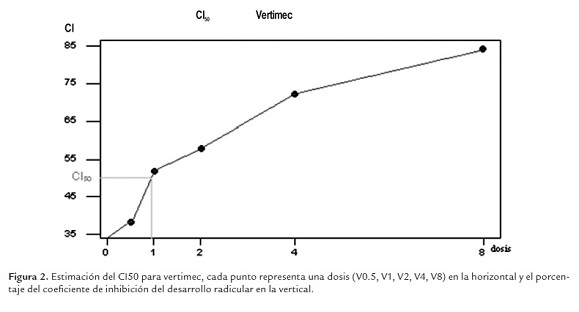
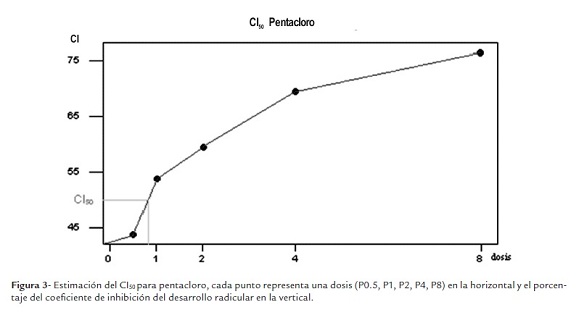
El coeficiente de inhibición para los tratamientos con biocidas tuvo valores mínimos de 0.382 para V0.5 y 0.438 para P0.5, y valores máximos de 0.842 para V8 y 0.765 para P8 (ver tabla 1). Con base en los diferentes coeficientes de inhibición obtenidos para las distintas concentraciones probadas se calculó el CI50 para cada tipo de biocida, teniendo un CI50 de 0.91 para vertimec (figura 2) y un CI50 de 0.78 para pentacloro (figura 3). En ambos casos, valores cercanos a la dosis recomendada para su uso (P1 y V1).
Resultados del análisis citogenético
La tinción cromosómica fue satisfactoria, ya que permitió diferenciar las distintas etapas del ciclo celular normal (figura 4), además permitió reconocer alguna anomalía en el ciclo de división celular.
Índices mitóticos
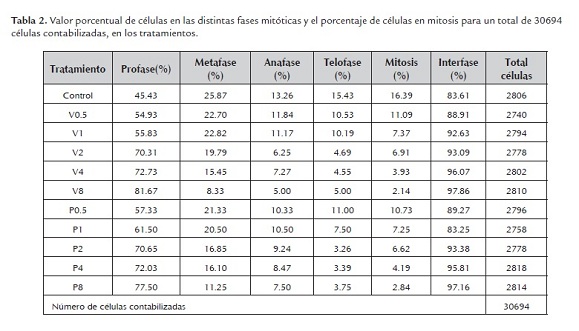
Contabilizado el número de células en mitosis y el número de células en total, se hallo el IM (índice mitótico), teniendo como índice mayor al tratamiento control, 16.39%, y menores índices para los tratamientos P8 y V8, 2.8% y 2.1% respectivamente (tabla 1). Se calculó también el coeficiente de inhibición mitótica para cada tipo de biocida y resultó que los índices para los tratamientos P1 y V1 correspondientes a la dosis normal de uso, representan el 55 % de inhibición mitótica (tabla 1 y 2), esto muy relacionado al coeficiente de inhibición media para el tamaño de raíz.
Presencia de anomalías
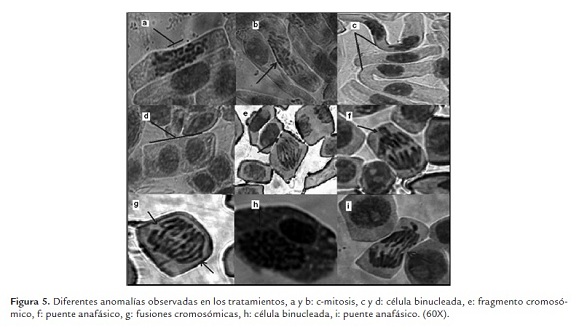
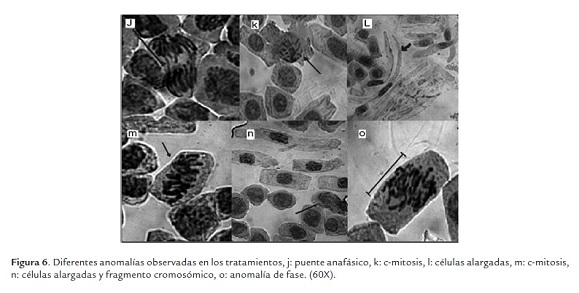
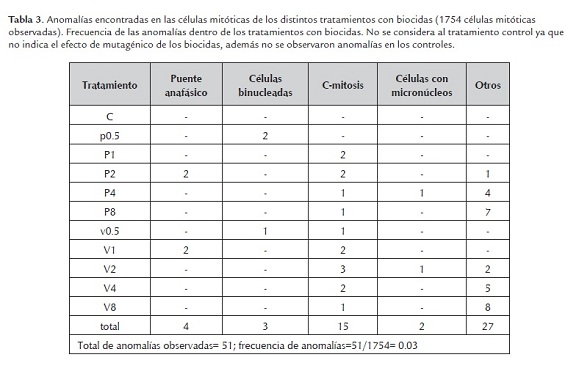
Se observó la presencia de anomalías en el ciclo celular producido por la toxicidad de los biocidas, observándose distintos tipos de aberraciones o anomalías cromosómicas dentro de las distintas etapas del ciclo celular. En la figura 5 y 6 se observan las anomalías más comunes encontradas, en el tratamiento V0.5 se observa un puente anafásico (i), en el tratamiento P0.5 una célula binucleada con un núcleo en interfase y otro en profase (h) y una c-mitosis (m), en el tratamiento V1 una c-mitosis (b) y un puente anafásico (j), en el tratamiento P1 una C-mitosis (a), células alargadas y un fragmento cromosómico aberrante (n) y una anomalía en la anafase por el huso mitótico desorganizado (o), en el tratamiento V2 una célula binucleada y una célula en telofase posiblemente binucleada (c) y varias fusiones cromosómicas que podrían ser múltiples puentes anafásicos (g), en el tratamiento P2 una célula binucleada (d) y una c-mitosis (k), en el tratamiento V4 un puente anafásico (f), en el tratamiento P4 un fragmento cromosómico aberrante candidato a formar micronúcleo (e), y en el tratamiento P8 células alargadas y presencia de fantasmas celulares (l). Para los tratamientos V8 y P8 muchas células estaban fragmentadas y eran de mayor tamaño, difícilmente se observo una anomalía. Según lo observado las anomalías más frecuentes eran la C-mitosis y anomalías en anafase, adicionalmente cambios en la forma celular.
Discusión
Los estudios realizados sobre el efecto de los diferentes biocidas demuestran algunos efectos genotóxicos en las plantas (Tartar et al., 2006). El presente estudio evaluó efectos genotóxicos, citológicos inducidos por dos biocídas en células meristemáticas de raíz de A. cepa. El diseño experimental reflejo una disminución del desarrollo radicular asociado a la mayor concentración de los biocidas en los tratamientos, y este menor desarrollo radicular está directamente relacionado con la inhibición de la mitosis normal en las células meristemáticas de la raíz (tabla 1). Estos cambios en actividades mitóticas como el índice mitótico, los índices de fase mitótica y la inducción de anomalías cromosómicas aparecieron en diferentes grados, dependiendo de la dosis (ver tabla 1, 2 y 3; figura 5 y 6). La alteración del índice mitótico puede ser debido a la interferencia del biocida en el proceso normal de mitosis, reduciendo el número de células que se dividen (Ghareeb y George, 1997; Badr, 1983). Otras investigaciones atribuyen la depresión de la actividad mitótica a la inhibición de la síntesis de proteínas (Kim y Bendixen, 1987). La inhibición mitótica también puede ser debido a la inhibición de la síntesis de ADN, lo que se considera como uno de los principales requisitos previos para que la célula se divida (Badr, 1983). Sin embargo, Chand (1981) informó que la reducción de la fosforilación oxidativa que resulta en un bajo nivel de ATP en la célula podría ser otro factor de inhibición de la síntesis de ADN y ARN en las plantas con tratamiento de biocidas. Por otra parte, Wuu y Grant (1967) informaron que los pesticidas en la célula pueden ejercer algún efecto sobre la función fundamental de una enzima; la producción, la inducción, la represión o la inhibición por retroalimentación podría ser una posible razón de la disminución del índice mitótico. En esta investigación, el índice mitótico disminuyó con el aumento de las concentraciones y la duración de los tratamientos (tabla 1 y 2). Este resultado sugiere que los biocídas utilizados causan cambios citológicos e inducen una amplia gama de anomalías mitóticas en las células del ápice de raíz de A. cepa. Se ha obtenido resultados similares después de tratar a células meristemáticas de raíz de Allium cepa con insecticidas y pesticidas (Ajay y Sarbhoy, 1987; El-Khodary et al., 1989). Sin embargo, se observo un aumento del índice de profase asociado a la disminución del índice mitótico conforme aumenta la concentración de los tratamientos con biocidas (tabla 2), se puede atribuir a la prolongación de la etapa de profase que afecta el eje de formación metafásica por presencia de biocidas. Esta acumulación de profases fue similar a lo observado por El-Khodary et al., (1989) y Prasad y Das (1977), según ellos, el envenenamiento de las células ocurre en la etapa en que entran en mitosis, siendo detenidos en la profase. Por tanto los resultados muestran la disminución en los índices de metafase, anafase y telofase con el aumento de la concentración (tabla 2), debido a una prolongada profase o las células en división bloqueadas en profase que no permite entrar en las siguientes fases. El análisis citogenético mostro un valor de 0.03 para la frecuencia media de anomalías en células mitóticas de los tratamientos con biocidas (tabla 3). La frecuencia de anomalías poco a poco aumenta con la duración del tratamiento y la concentración de biocídas (tabla 3). Trastornos anormales de profase, metafase y anafase fueron los principales tipos de anomalías detectadas. Se presentaron eventos como la formación de puentes, retrasos en la citocinesis, metafase con cromosoma retrasado, células binucleadas en interfase y citocinesis desigual. Similares anomalías fueron registradas con el tratamiento de fluorochloridone en puntas de raíces de A. cepa por Yuzbasioglu et al., (2003) y tratamiento con el insecticida Ethion en puntas de raíces de A. cepa por Kabir et al., (2010). Profases con cromosomas anormales e irregulares fueron reportados por El-Khodary et al., (1990, 1989) en raíces de A. cepa tratadas con herbicida Tribunil y Garlon-4, donde la cantidad de anomalías en metafase fue superior a la ocurrida en anafase. Estas anomalías también podrían explicarse por una alteración en la organización del huso, causando una orientación irregular de los cromosomas (Grant, 1978; Mansour, 1984). Es preciso señalar la naturaleza pegajosa de los cromosomas que dan como resultado, cromosomas que no pueden llegar a los polos y permanecen dispersos en el citoplasma, presentándose de modo condensado y pegajoso (Ajay y Sarbhoy, 1988). Sin embargo, Klasterska et al., (1976) sugiere que la rigidez de los cromosomas surgió debido a la doblez impropia de fibras de los cromosomas en una sola cromátida y por lo tanto son una mezcla de fibras, lo que hace a los cromosomas adherirse el uno al otro por medio de puentes de cromatina. El tipo más común de anomalía en el presente estudio fue C-metafase o c-mitosis inducida por vertimec y pentacloro. De acuerdo con Nagl (1970), el tratamiento con insecticidas a las células meristemáticas de raíces causa el bloqueo del ciclo celular en metafase que posteriormente resulta en C-metafase. El tipo más observado de aberraciones en células en anafase es la anafase precoz. La formación de cromosomas precoces puede ser causada por la rigidez de los cromosomas (Kaur y Grover, 1985). Otras anomalías interesantes son los puentes cromosómicos que se han observado con frecuencia en los diferentes tratamientos (figura 5 y 6), esto podría ser debido a uniones por roturas cromosómicas generales (Tomkins y Grant, 1972; Badr, 1983).
Sería interesante evaluar la frecuencia de la variación genética debido a biocídas en un curso de tiempo prolongado en un ensayo de campo. Sin embargo está claro que la frecuencia de la variación dependerá del cultivo. Estos resultados sugieren que puede haber una región específica en el genoma de cebolla, que es extremadamente susceptible a la mutación generada por las condiciones de citotoxicidad por biocidas. Parece posible que las mutaciones inducidas por biocidas, en algunos casos, se asemejan a las mutaciones somáticas que tuvieron lugar en la naturaleza y deben haber llevado a la formación de las diferentes variedades de especies vegetales, aunque estas hipótesis requieren una mayor investigación rigurosa. Sin embargo es preciso señalar que en el presente estudio no se observaron anomalías en los tratamientos control.
Es un hecho bien documentado que Allium cepa expuesto a sustancias toxicas genera condiciones de estrés genómico que podrían resultar en roturas cromosómicas. Muchos estudios han indicado que las posiciones de ruptura no parecen ser al azar sino que se producen en una región de heterocromatina y podrían llevar a los cromosomas a una translocación, inversión o eliminación (Benzion y Phillip, 1988; Lapitan et al., 1988). En Allium sativum, estas regiones de heterocromatina se encuentran en las regiones proximales del satélite de los cuatro cromosomas que llevan la región de organización nucleolar y tienen la constricción secundaria (Sato y Kawamura, 1981). Sería interesante identificar estas regiones en otros cultivos y caracterizarlo molecularmente a fin de determinar si involucran perdida de genes favorables para la especie vegetal.
Conclusiones
La presente investigación reveló que los biocídas usados ejercen un efecto mitodepresivo en las células del meristemo de la raíz de Allium cepa; teniendo la capacidad de producir aberraciones cromosómicas y efectos tóxicos a largo plazo. La presencia de cambios a nivel citogenético, se observó incluso en dosis por debajo de la dosis recomendada. La dosis recomendada de uso, es similar al CI50 para cada biocida, sin embargo esta produce anomalías en el ciclo celular. Tanto el CI50 y la inhibición mitótica al 50% coinciden con la dosis recomendada de uso V1 y P1 para vertimec y pentacloro respectivamente. El método usado ha permitido conocer la citotoxicidad celular y genotoxicidad cromosómica producida por biocidas usados en la agricultura y su potencial efecto sobre la estabilidad genética.
Referencias bibliográficas
1 Ajay K., Sarbhoy R. 1987. Cytogenetical studies on the effect of some chlorinated pesticides I. Effect on somatic chromosomes of Lens and Pisum. Cytology. 52: 47-53. [ Links ]
2 Ajay K., Sarbhoy R. 1988. Cytogenetic studies on the effect of some chlorinated pesticides. Cytology. 53: 427-436. [ Links ]
3 Badr A. 1983. Mitodepressive and cytomotoxic activities of two herbicides in Allium cepa. Cytology. 48: 451-457. [ Links ]
4 Benzion G., Phillips R. 1988. Cytogenetic stability of maize tissue cultures: a cell line pedigree analysis. Genome. 30: 318-325. [ Links ]
5 Chand S. 1981. Effect of herbicide 2,4-dinitrophenol on mitosis, DNA, RNA and protein synthesis in Nigella sativa. Biology Plant 24: 198-202. [ Links ]
6 El-Khodary S., Habib A., Haliem A. 1990. Effects of the herbicides Tribunil on root mitosis of Allium cepa. Cytology. 55: 209-215. [ Links ]
7 El-Khodary S., Habib A., Haliem A. 1989. Cytological effects of the herbicide Garlon-4 on root mitosis of Allium cepa. Cytology. 54: 465- 472. [ Links ]
8 Espinoza F., Palacio S., Módenes A., Szymanski N., Silva N., Rizzutto A. 2007. Toxic effects on the Allium cepa L. roots by Cr6+-doped river waters. Brazilian Synchrotron Light Laboratory, Activity Report. [ Links ]
9 Feretti D., Zerbini I., Zani C., Ceretti C., Moretti C., Monarca S. 2007. Allium cepa chromosome abberation and micronucleus tests applied to study genotoxicity of extracts from pesticide-treated vegetables and grapes. Food Additives and Contaminants. 24 (6): 561-572. [ Links ]
10 Fiskesjo G. 1985. The Allium test as a standard in environmental monitoring. Hereditas. 102: 99-112. [ Links ]
11 Fiskesjo G. 1988. The Allium test an alternative in environmental studies: the relative toxicity of metal ions. Mutation Research. 197: 243-260. [ Links ]
12 Fiskesjo G. 1993. The Allium test in wastewater monitoring. Enviromental Toxicology and Water Quality. 8: 291-298. [ Links ]
13 Frainer M., Ferreira C., Scotti T., Bosio S. 2006. Effects of Pterocaulon polystachyum DC. (Asteraceae) on onion (Allium cepa) root-tip cells. Genetics and Molecular Biology. 29: 539-542. [ Links ]
14 Ghareeb A. 1997. Cytotoxicity of insecticide Temik 15G (Decarb) in mitotic and meiotic cells of Vicia faba plant. Cytology. 62: 259-263. [ Links ]
15 Grant W. 1978. Chromosome Aberrations in Plants as a Monitoring System. Environmental Health Perspectives. 27: 37-43. [ Links ]
16 Grant W. 1982. Chromosome aberration assays in Allium A report of the US Environmental Protection Agency gene tox program. Mutation Research. 99: 273-291. [ Links ]
17 Grant W. 1994. The present status of higher plants bioassays for the detection of environmental mutagens. Mutation Research. 310: 175-185. [ Links ]
18 Kabir L., Bimal K., Pankaja S., Amal K., Sang W., Chang Y., Youn Y., Shyam R. 2010. Genotoxicity evaluation of the insecticide ethion in root of Allium cepa L. African Journal of Biotechnology. 9(27): 4204-4210. [ Links ]
19 Kaur P., Grover I. 1985. Cytological effects of some organophosphorus pesticides I. Mitotic effects. Cytology. 50: 187- 197. [ Links ]
20 Kim J., Bendixen E. 1987. Effect of haloxyfop and CGA-82725 on cell cycle and cell division of oat (Avena sativa) root tips. Weed Sci. 35: 769-774. [ Links ]
21 Klasterska I., Natarajan A., Ramel C. 1976. An interrelation of the origin of subchromatid aberrations and chromosome stickiness as a category of chromatid aberrations. Hereditas. 83: 153-162. [ Links ]
22 Konuk M., Liman R., Cigerci I. 2007. Determination of Genotoxic effect of Boron on Allium cepa root meristemático cells. Pakistan Journal of Botany. 39(1): 73-79. [ Links ]
23 Lapitan N., Sears R., Gill B. 1988. Amplification of repeated sequences in wheat rye hybrids regenerated from tissue culture. Theoretical and Applied Genetics. 75:381-388. [ Links ]
24 Mansour K. 1984. Cytological effects of the herbicide Tribunile on Vicia faba. Egyptian Journal of Botany. 27: 191-198. [ Links ]
25 Mustafa Y., Suna E. 2008. Destroy Genotoxicity testing of quizalofop-P-ethyl herbicide using the Allium cepa anaphase-telophase chromosome aberration assay. Caryologia. 61(1): 45-52. [ Links ]
26 Nagl W. 1970. The mitotic and endomitotic nuclear cycle in Allium carinatum II. Relations between DNA replication and chromatin structure. Caryologia. 23: 71-78. [ Links ]
27 Olufunsho A., Akintonwa A., Sunday O. 2010. Mutagenic Screening of Crude Oil Fractions Using Modified Ames Test and Allium cepa (Linn) Assay. American Journal of Pharmacology and Toxicology. 5 (1): 1-8. [ Links ]
28 Olusegun S., Fidelia I., Odeigah P. 2010. Cytogenotoxicity evaluation of two industrial effluents using Allium cepa assay. African Journal of Environmental Science and Technology. 4(1): 021-027. [ Links ]
29 Palani L., Panneerselvam N. 2007. Cytogenetic studies of food preservative in Allium cepa root meristem cells. Medicine and Biology. 14: 60-63. [ Links ]
30 Peña C., Añez B., Dávila M. 1999. Respuesta de la cebolla (Allium cepa L.) a la aplicación de azufre, magnesio, cinc y boro en un suelo alcalino. Revista Forestal Venezolana. 43(2): 173-182. [ Links ]
31 Prasad G., Das K. 1977. Effect of some growth substances on mitosis. Cytology. 42: 323-329. [ Links ]
32 Ragunathan I., Panneerselvam N. 2007. Antimutagenic potential of curcumin on chromosomal aberrations in Allium cepa. Journal of Zhejiang Univ Sci. 8(7): 470-475. [ Links ]
33 Rank J. 2003. The method of Allium anaphase - telophase chromosome aberration assay. Department of environment, technology social studies. Ekologija. Activity Report. [ Links ]
34 Sato S., Kawamura S. 1981. Cytological studies on the nucleolus and the NOR-carrying segments of Allium sativum. Cytology. 46:781-790. [ Links ]
35 Shukla Y., Arora A., Taneja P. 2002. Anti-mutagenic potential of curcumin on chromosomal aberrations in Wistar rats. Mutation Research. 515:197-202. [ Links ]
36 Srivastava R., Kumar D. 2005. Bioremediation of municipal sludge by vermitechnology and toxicity assessment by Allium cepa. Bioresource Technology. 96(17): 1867-1871. [ Links ]
37 Tartar G., Kaymak F., Gokalp F. 2006. Genotoxic Effects of Avenoxan on Allium cepa L. and Allium sativum L. Caryologia. 59(3): 241-247. [ Links ]
38 Tomkins D., Grant W. 1972. Comparative cytological effects of the pesticides Menazon, Metobromuron and Tetrachloriosphthalonitrile in Hordeum and Tradescantia. Canadian Journal of Genetics and Cytology. 14: 245-256. [ Links ]
39 Ukaegbu M., Odeigah P. 2009. The Genotoxic Effect of Sewage Effluent on Allium cepa. Report and Opinion. 1(6): 36-41. [ Links ]
40 Wuu K., Grant W. 1967. Morphological and somatic chromosomal aberrations induced by pesticides in meiotic cells of Barley (Hordeum vulgare). Canadian Journal of Genetics and Cytology. 8: 481-501. [ Links ]
41 Yuzbasioglu D., Unal F., Sancak C., Kasap R. 2003. Cytological effects of the herbicide racer flurochloridone on Allium cepa. Caryologia. 56: 97-105. [ Links ]
42 Vertimec - Syngenta. 2012. Acaricida e insecticida para el control de ácaros en cultivos www.syngenta.com/country/cl/cl/soluciones/proteccioncultivos/Paginas/Vertimec.aspx (acceso 4/06/2012). [ Links ]
43 Serfi S.A(R). 2012. Pentacloro Saume es un fungicida que previene enfermedades en las semillas-cultivos www.serfi.com.pe/INTERIOR/productos_peru/pentacloro_saume.html (acceso 10/06/2012). [ Links ]