Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.15 no.2 Bogotá July/Dec. 2013
https://doi.org/10.15446/rev.colomb.biote.v15n2.41261
http://dx.doi.org/10.15446/rev.colomb.biote.v15n2.41261
ARTÍCULO DE INVESTIGACIÓN
Optimización de las condiciones de inoculación por biobalística de un Begomovirus en tomate y tabaco
Optimizing conditions for biolistic inoculation of Begomovirus in tomato and tobacco
Karina López-López1, Diana Milena Rodríguez-Mora2, Juan Carlos Vaca-Vaca3
1 Ph.D, Biotecnología de Plantas. Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia. AA 237. Palmira, Valle del Cauca, Colombia. Email: klopezl@unal.edu.co.
2 MSc. Ciencias Agrarias. Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia. AA 237. Palmira, Valle del Cauca, Colombia.
3 Ph.D, Biotecnología de Plantas; MSc. Microbiología con Enfasis en Biotecnología. Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia. AA 237. Palmira, Valle del Cauca, Colombia. Email: jcvacava@unal.edu.co.
Recibido: abril 5 de 2013. Aprobado: octubre 29 de 2013
Resumen
La transmisión experimental de Begomovirus es problemática. La mayoría de estos virus se pueden transmitir de planta a planta por su vector biológico, Bemisia tabaci. Las inoculaciones experimentales con mosca blanca son problemáticas debido a sus hábitos de alimentación, requerimiento de una planta viva infectada e instalaciones de contención para el vector. Por su parte la inoculación mecánica de Begomovirus es posible, pero generalmente a tasas bajas y no en todos los casos. Por esta razón el bombardeo de partículas (biobalística) de DNA viral como una estrategia de inoculación fue desarrollada. La posibilidad de utilizar el dispositivo de mano Helios Gen Gun System (Biorad®), un equipo de biobalística, para la transmisión de un Begomovirus bipartita a plantas de tomate y tabaco fue ensayado y optimizado. Los parámetros evaluados fueron: número de disparos (1-2), presión de helio (220 y 320 psi) y diámetro de las partículas de oro (0.6 y 1.6µm). Los síntomas característicos de la enfermedad viral (clorosis, mosaico y deformación de la hoja) aparecieron 3 semanas después del bombardeo en las hojas jóvenes no inoculadas. La replicación del DNA viral en las plantas se confirmó por Reacción en cadena de la polimerasa. Plantas infectadas en un 100% se obtuvieron cuando en el bombardeo se emplearon partículas de oro de 1.6 µm recubiertas con DNA viral a una presión de 320psi. A nuestro entender este es el primer reporte en Colombia de la inoculación directa de plantas de tomate y tabaco con un Begomovirus bipartita usando un dispositivo portátil de biobalística.
Palabras clave: geminivirus, Solanum lycopersicum, Nicotiana tabacum, N. benthamiana, Bemisia tabaci.
Abstract
Experimental transmission of Begomovirus is problematic. Most Begomoviruses can be transmitted readily from plant to plant by the whitefly vector, but this also requires a live infected plant and extensive facilities to maintain the insect. Whitefly inoculations can also be problematic because of their preferential feeding habits on certain plants. Mechanical inoculation of Begomovirus is possible but generally at low rates and for others not at all. For this reason particle bombardment (biolistic) of DNA viral as an inoculum was developed. The possibility of using the Helios Gen Gun System (Biorad®), a biolistic hand-held device, for transmitting Begomovirus bipartite to tomato and tobacco plants was assayed and optimized. Biolistic inoculation was carried out with the hand held device at 220 or 320 psi, applying 1 or 2 shots /plant and using gold particles of 0.6 or 1.6µm in size. Characteristic symptoms of viral disease (chlorosis, mosaic and leaf deformation) appeared 3 weeks post-inoculation in the newly developing leaves. Replication of the viral DNA in plants was confirmed by Polymerase Chain Reaction. All bombarded plants became infected when biolistic inoculation was carried out with the hand held device at 320psi and using 1.6 µm gold particles in size. To our knowledge this is the first report in Colombia of successful direct inoculation of tomato and tobacco plants with Begomovirus bipartite geminivirus using a biolistic hand-held device.
Key words: geminivirus, Solanum lycopersicum, Nicotiana tabacum, N. benthamiana, Bemisia tabaci.
Introducción
La producción de tomate (Solanum lycopersicum L.) en Colombia está seriamente afectada por la incidencia de enfermedades virales, en especial aquellas causadas por el género Begomovirus, perteneciente a la familia Geminiviridae (Morales et al., 2002; Vaca-Vaca et al., 2011). En este género se incluye un gran número de miembros que infectan muchas dicotiledóneas y son transmitidos por el insecto mosca blanca Bemisia tabaci Genn biotipo B, (también denominada Middle East Asia Minor, MEAME1) (De Barro et al., 2011), causando pérdidas altamente significativas en cosecha (Fauquet et al., 2003; Morales and Anderson, 2001). Los Begomovirus poseen genomas de DNA de cadena sencilla (ssDNA) que pueden ser mono o bipartita (Rojas et al., 2005). Los genomas bipartitas se caracterizan por tener 2 componentes genómicos llamados DNA A y DNA B. En el DNA A se encuentran funciones necesarias para replicación, transcripción y encapsidación, mientras que en el DNA B se codifican funciones de movimiento y pueden estar alojados determinantes sintomáticos (Sudarshana et al., 1998; Rojas et al., 2005). Sin embargo, para que se produzca una infección sistémica eficiente en la planta se requiere que ambos componentes virales estén presentes (Rojas et al., 2005).
La sintomatología típica causada por los Begomovirus es enanismo, mosaicos amarillos brillantes, moteados cloróticos, clorosis foliar marginal, enrollamiento foliar, deformaciones foliares y arrugamientos de las hojas (Polston and Anderson, 1997; Nava et al., 2006). Estudios realizados en Colombia han detectado la presencia de Begomovirus bipartita en cultivos de tomate de los departamentos de Antioquia, Santander, Boyacá, Cundinamarca y Valle del Cauca; siendo esta la primera vez que se reporta la presencia de Begomovirus afectando cultivos de tomate localizados por encima de 1500 m.s.n.m. (Vaca-Vaca et al., 2011). Dada esta problemática, estos virus fueron caracterizados a nivel molecular y se encontró que estaban relacionados filogenéticamente con el Virus del mosaico amarillo de la papa (PYMV) y con el Tomato Venezuela virus (ToVEV); y que presentaban una distribución geográfica de variantes virales: por ejemplo, en el departamento de Santander predominan Begomovirus relacionados filogenéticamente con PYMV-Martinica y ToVEV; en el departamento de Cundinamarca hay Begomovirus emparentados con PYMV-Valle y ToVEV; y en el departamento de Valle del Cauca predominan únicamente Begomovirus relacionados con PYMV-Valle (Vaca-Vaca et al., 2012).
Los métodos de control que comúnmente se usan para tratar de disminuir el daño ocasionado por las enfermedades virales en tomate son el cultural, biológico y químico, los cuales al parecer no son eficientes en cultivos de tomate a gran escala, donde se presente una alta incidencia de mosca blanca virulíferas (Zakay et al., 1991, Polston and Anderson, 1997) a menos que sean utilizados en combinación con genotipos resistentes (Polston and Anderson, 1997; Laterrot, 1999). Actualmente, los agricultores colombianos no cuentan con variedades de tomate resistentes a Begomovirus endémicos, por lo que es necesario iniciar la búsqueda de fuentes de resistencia en introducciones silvestres de tomate que servirán a futuros programas de mejoramiento genético para introgresar genes de resistencia en variedades de interés agronómico.
Para identificar estos materiales resistentes a Begomovirus se requiere contar con un método de inoculación eficiente del virus en las plantas de tomate a evaluar, para lo cual se han reportado diferentes métodos: mecánico (abrasivo), agroinoculación, transmisión directa del insecto vector, injerto y biobalística (Ascencio and Settlage, 2007). La biobalística es un método en donde partículas de metales pesados biológicamente inertes (oro o tungsteno) son cubiertas con DNA o RNA, aceleradas hacia un tejido blanco en el cual penetra y una vez allí, el DNA o RNA que portan estas partículas se inserta directamente en el genoma de las plantas (Gan, 1989). Este método de inoculación viral a diferencia de los otros, ha reportado eficiencias hasta del 100% (Aebig et al., 2005), ha sido utilizado con éxito no sólo para inocular Begomovirus (Hernández et al., 2001; Morilla et al., 2005; Ariyo et al., 2006), sino también Potyvirus (Gal-On et al., 1995; 1997), Luteovirus (Yamagishi et al., 2006), Nepovirus (Valat et al., 2003), Cucumovirus (Aebig et al., 2005), Polerovirus (Hoffmann et al., 2001), entre otros.
En el presente trabajo de investigación se reportan las condiciones óptimas de inoculación por el método de biobalística de un Begomovirus bipartita en plantas de tomate y tabaco utilizando un pistola génica de baja presión (Helios Gene Gun System, BioRad®).
Materiales y métodos
Multiplicación del Begomovirus bipartita: se utilizaron los genomas virales completos de un Begomovirus bipartita aislado de plantas de tomate recolectadas en Tuluá - Valle del Cauca (Betancur-Perez, 2012). Este virus fue identificado como el Virus del mosaico amarillo de la papa aislado Túlua/Valle del Cauca/2008 (PYMV-TV). Cada componente del Begomovirus (DNA A y DNA B) fue clonado en el vector pUC19 y transformado en la bacteria Escherichia coli, obteniéndose dos clonas. Estos plásmidos fueron multiplicados y purificados de E. coli utilizando el protocolo de Birnboim and Dolly (1979) y el Plasmid Midi Kit (Qiagen ®).
Preparación de microcarriers y cartuchos con DNA viral: la preparación de los microcarriers y cartuchos se realizó siguiendo las instrucciones de la pistola Helios Gene Gun System (BioRad, Hércules, CA, USA), con algunas modificaciones. Se pesaron 10 mg de microcarriers de oro (0.6 ó 1.6 µm de diámetro, Biorad®), se adicionó espermidina 0.05M y se sonicó. Luego se adicionó 50 µg de DNA plasmídico (50µl DNA A + 50µl DNA B) y se homogenizo vortex. A esta mezcla se le adicionó 100 µl de Cloruro de Calcio 1M, se homogenizó en vortex y se sónico. La mezcla se incubó a temperatura ambiente por 10 minutos. Esta mezcla se centrifugó por 10 segundos, se eliminó el sobrenadante y la pastilla se lavó con 1 ml de etanol al 100%. Este paso de centrifugación y lavado se repitió dos veces más. Finalmente, la pastilla se resuspendió en 3 ml de polivinil pirrolidona PVP 5% y se almacenó a -20°C hasta su utilización.
Para la preparación de los cartuchos, se insertaron 75 cm de tubo Tefzel (Biorad®) en la estación de preparación de cartuchos (Tubing Prep Station, Biorad®) y se le eliminó la humedad pasando nitrógeno por 30 minutos. El tubo se retiró para cargarlo con la solución de microcarriers previamente preparada empleando una jeringa de 10 ml. El tubo Tefzel se colocó nuevamente en la estación de preparación de cartuchos, se dejó en reposo por 5 minutos y se eliminó el etanol a una velocidad de 4-5 ml/min. Se desconectó la jeringa y se giró el tubo en una posición de 90° por 2 segundos, 180° por 2 segundos, 90° por 2 segundos y rotación completa por 5 segundos. A continuación se hizo pasar nitrógeno a través del tubo con una rotación completa para secarlo por 5 minutos. Terminado el proceso se cortó el tubo a una medida uniforme. Los cartuchos se almacenaron a 4°C con desecante antes de la inoculación.
Inoculación del Begomovirus bipartita por biobalística: Para la inoculación de los cartuchos con DNA viral se utilizaron plantas jóvenes (cuatro hojas verdaderas) de tomate (Solanum lycopersicum L.) y de tabaco: N. tabacum var. xanthi y N. benthamiana.
Por cada ensayo de inoculación, plantas de tabaco y tomate fueron bombardeadas utilizando la pistola Helios Gene Gun System (BioRad®) siguiendo las instrucciones del fabricante con algunas modificaciones (ver estandarización de parámetros) de acuerdo a un diseño experimental completamente al azar. Luego del bombardeo, las plantas fueron llevadas a unas jaulas cubiertas con malla antitrips, para evitar el ingreso de insectos, en especial del vector biológico mosca blanca (B. tabaci) y también se realizaron aplicaciones de insecticidas Engeo® (Tiametoxam) 247 SC y Confidor® (Imidacloprid) 350 SC (1 cc/l) para evitar el daño causado por estas moscas. Se realizó un monitoreo diario para evaluar la incidencia (porcentaje de plantas infectadas basado en los síntomas) y la severidad de los síntomas, en el tiempo.
Optimización de parámetros de inoculación: para optimizar las condiciones de inoculación se evaluaron los siguientes parámetros con el fin de identificar los que resultaran en una sintomatología de mosaicos, clorosis y deformaciones foliares típicas del virus:
- Presión de helio: 220 y 320 libras por pulgada cuadrada (Pounds per Square Inch- psi). La pistola génica Helios Gene Gun System (Biorad®) utiliza helio como gas para disparar las partículas de oro.
- Número de disparos: 1, 2.
- Tamaños de partícula de oro: 0.6 y 1.6 µm de diámetro.
Los parámetros que no variaron en los ensayos de inoculación fueron: concentración de espermidina, polivinil pirrolidona (PVP) y DNA viral por cartucho. La concentración utilizada de espermidina (0,05 M) fue la recomendada por el fabricante de la pistola génica Helios Gene Gun System (Biorad®); la concentración de PVP (5%) se ajustó de acuerdo a un reporte previo para inocular por biobalística un viroide de RNA (Matousek et al., 2004); y la concentración de DNA viral (1µg DNA por cartucho) se seleccionó de acuerdo a ensayos previos por biobalística (Vaca-Vaca, 2003). Como control negativo se utilizaron plantas de tomate y tabaco no inoculadas que recibieron el mismo tratamiento en invernadero.
Detección del Begomovirus bipartita en las plantas inoculadas: se tomaron hojas jóvenes de plantas inoculadas y no inoculadas (mock) para realizar una extracción de DNA genómico con la metodología CTAB descrita por CIMMYT (2006). La identificación del componente A begomoviral se realizó mediante PCR usando los primers PAL1v1978 / PAR1c496 y las condiciones reportadas por Rojas et al. (1993), con la cual se amplifica una región de 1200 pb. El equipo que se utilizó para la amplificación fue un termociclador ICycler® de BioRad®. Los productos amplificados fueron observados en geles de agarosa al 1% (p/v) teñidos con bromuro de etidio (10 ng/µl), visualizados en un transiluminador de luz ultravioleta (Molecular Imager Gel DocXR+ Systems BIORAD®) y analizados mediante el uso del software Quantity One - 4.6.5 provisto por el fabricante del equipo.
Porcentaje (%) de infección viral: el % de infección viral se calculó como el cociente del número de plantas positivas a la presencia del virus detectado por PCR dividido por el número de plantas inoculadas, multiplicado por 100.
Incidencia y Severidad de los síntomas: la incidencia se medió como el porcentaje de plantas infectadas basado en los síntomas. La severidad de síntomas se medió usando una escala tomada de Jawdah et al. (1999) con algunas modificaciones. La escala de síntomas ajustada fue: 1: no se observan síntomas, 2: aparición de mosaicos en las hojas y 3: aparición de amarillamiento en las hojas, hojas deformadas y más pequeñas que las normales.
Análisis estadístico: los datos obtenidos se analizaron realizando un análisis de varianza (ANOVA) utilizando el paquete estadístico SAS, versión 9, 2002.
Resultados y discusión
Teniendo en cuenta la relación virus-planta y los diferentes parámetros de inoculación por biobalística publicados en la literatura hasta el momento para diferentes tipos de virus y hospederos (Garzón-Tiznado et al., 1993; Morilla et al., 2005; Ariyo et al., 2006, Yamagishi et al., 2006; Wege et al., 2000; Guenoune-Gelbart et al., 2010), se inició la estandarización de las condiciones óptimas de inoculación por biobalística de un Begomovirus bipartita aislado de plantas de tomate recolectadas en Tuluá- Valle del Cauca como un requisito para futuros trabajos de inoculación viral de material vegetal. Las plantas de tomate inoculadas con dos disparos mostraron síntomas aproximadamente a los 18 días post-inoculación mientras que las plantas inoculadas con un solo disparo presentaron mosaicos a los 25 días post-inoculación (figura 1).
Para corroborar si la sintomatología observada en las plantas inoculadas era causada por el virus previamente inoculado, se llevó a cabo la detección del componente genómico A begomoviral mediante PCR a partir de DNA total extraído de hojas jóvenes sintomáticas a los 18 y 47 días después de la inoculación. A partir de esta estrategia molecular se obtuvo un producto de amplificación correspondiente a una banda de tamaño esperado de alrededor de 1200 pb en la mayoría de las plantas inoculadas y no se encontró evidencia de la presencia de infecciones no sintomáticas ni de productos de amplificación en plantas no inoculadas (mock) (figura 2). Este resultado confirma que la infección viral observada en las plantas positivas son causadas por el Begomovirus inoculado por el método de biobalística y no fruto de la presencia de mosca blanca (Bemisia tabaci Genn.) en el invernadero. Por su parte la evidencia del amplificado (1200pb) en las muestras inoculadas analizadas es un indicativo que el Begomovirus se está replicando, encapsidando y moviéndose, es decir está cumpliendo cada una de las etapas que abarca su ciclo infectivo natural. Además comprueba que tanto el componente genómico A como el componente genómico B del Begomovirus están presentes en la planta ya que se ha demostrado que para que haya ciclo infectivo geminiviral completo se requiere la presencia simultánea de ambos componentes genómicos. Es decir la sola presencia del componente genómico A begomoviral no es suficiente para causar la aparición de síntomas virales y tampoco permite al virus moverse ni célula a célula ni a largas distancias a través de la planta ya que muchas de estas funciones están codificadas exclusivamente por los por genes que están presentes en los componentes B geminivirales (Hanley-Bowdoin et al., 1999).
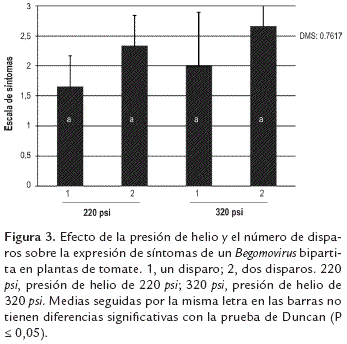
Al comparar las presiones empleadas, 220 y 320 psi, con el número de disparos utilizados, 1 ó 2 disparos para inocular las plantas de tomate, se encontró que independientemente de la presión las mejores inoculaciones fueron logradas cuando se usaron dos cartuchos por inoculación, logrando un 100% de plantas infectadas (determinado por la detección de DNA viral por PCR), posiblemente porque llega un mayor número de partículas virales a los tejidos (tabla 1). Además se encontró una correlación positiva del 100% (r = 1, p <.0001) entre la incidencia (porcentaje de plantas infectadas con base en los síntomas) y el porcentaje de plantas infectadas, así como entre el nivel de síntomas y detección del Begomovirus bipartita por PCR, ya que a medida que los síntomas aumentaron, también aumentó la cantidad de partículas virales amplificadas (PCR-semicuantitativa) (figura 2 y 3). Asimismo la severidad cualitativamente es mayor cuando la inoculación se realizó a 320 psi con dos disparos ya que las plantas presentaron síntomas típicos acentuados de enfermedad geminiviral tales como mosaicos, clorosis y deformaciones foliares en el 100 % de las plantas de tomate inoculadas (figura 2). Esto puede estar relacionado con el hecho que a mayor presión mayor efecto de barrido de los microproyectiles de oro que se encuentran adheridos al cartucho lo cual tiene una incidencia directa en un aumento de las plantas infectadas (Gal-On et al., 1995; 1997).
Al comparar estos resultados con los obtenidos en plantas de tabaco N. benthamiana, se obtuvo un porcentaje similar de infección viral con la diferencia que los síntomas virales observados fueron leves (tabla 1 y figura 1D). Contrasta este resultado con el obtenido por Garzón-Tiznado et al. (1993) quienes inocularon el Virus huasteco de la vena del chile (PHV) en ají por biobalística y obtuvieron un porcentaje de plantas de tomate y tabaco infectadas que osciló entre el 60-70% a pesar de ser este un virus bien adaptado a las solanáceas. El retraso observado en la aparición de síntomas en plantas inoculadas con un solo disparo puede estar asociado con una baja tasa de inóculo viral comparado con una mayor concentración de este mismo inóculo cuando se aplicaron dos disparos. Esto último redundó en una mayor efectividad biológica que permitió que el geminivirus reclutara con mayor éxito la maquinaria biosintética de las células vegetales y así éste pudiera llevar a cabo todo su ciclo infectivo con la consecuente manifestación de clorosis y deformaciones foliares en hojas jóvenes, las cuales se acentuaron con el transcurso del tiempo (figura 1).
Muchos de estos síntomas fueron evidenciados no solo en hojas en donde el virus fue inicialmente inoculado sino también en las hojas más jóvenes, lo que confirma el desarrollo de infección sistémica viral pues muchas de estas hojas no habían sido inoculadas por biobalística sino que el Begomovirus las había infectado transportándose probablemente por vía floema desde las hojas inoculadas hasta alcanzar estas últimas. Contrasta este resultado con el obtenido en plantas de N. tabacum var. xanthi inoculadas por biobalística con uno o dos disparos en donde se obtuvo un porcentaje de infección de 75 y 66.6 %, respectivamente, y no se observaron síntomas de infección geminiviral en las plantas (tabla 1). Un resultado similar lo obtuvieron Guevara-Gonzales et al. (1999) cuando por biobalística inocularon el Virus huasteco de la vena del chile (PHV) en plantas de N. tabacum var. xanthi y relacionaron la ausencia de síntomas virales en esta planta con la poca permisividad de este hospedero a la movilidad de este geminivirus. Es decir el movimiento célula a célula de los virus vegetales requiere por necesidad una vía simplástica mediada por plasmodesmos (Harries and Ding, 2011; Scholthof, 2005). Es probable que tal y como sucedió en el caso de PHV, nuestro Begomovirus no esté bien adaptado a N. tabacum var. xanthi, por tanto el movimiento viral se vea limitado bien sea por factores intrínsecos al propio virus o por factores propios de este hospedero vegetal tales como el diámetro de exclusión de los plasmodesmos (SEL) el cual podría limitar la dispersión célula a célula de este geminivirus lo cuál limitaría el ciclo infectivo del mismo tan solo a unas pocas células vegetales en donde probablemente fue inoculado. Desde este punto de vista bien se podría afirmar que N. tabacum var. xanthi es un hospedero atípico para nuestro Begomovirus por lo que éste fue excluido en posteriores ensayos.
Las partículas de oro, que sirven como vehículo al cual van adherido el virus y que serán inoculadas a presión por biobalística tienen varias presentaciones comerciales que difieren entre sí por el diámetro de la partícula en sí misma. Con el fin de determinar si este parámetro (diámetro) incidía en el éxito de la estrategia de inoculación viral por biobalística se procedió a realizar inoculaciones en plantas jóvenes de tomate y tabaco N. benthamiana, utilizando partículas de oro de 0.6 µm y 1.6 µm de diámetro que portaban el Begomovirus adheridas a ellas. Todas las inoculaciones se realizaron con dos disparos y una presión de helio de 320 psi. Los resultados obtenidos en este ensayo (tabla 1) muestran que diámetro de la partícula de oro empleada en cada inoculación tiene un efecto en el porcentaje de plantas infectadas, ya que cuando se utilizó partículas de oro de 1.6 µm de diámetro se obtuvo un porcentaje de infección de 100% en las plantas de tomate inoculadas mientras que con partículas de oro de 0.6 µm diámetro el porcentaje de plantas de tomate infectadas descendió a un 83.3%. Este aumento en el número de plantas infectadas puede estar asociado a su vez con el hecho que a mayores presiones las partículas de oro de mayor diámetro alcanzan mayores velocidades inerciales hecho que a su vez incrementa la probabilidad que el geminivirus que ellas portan alcancen las células floemáticas vegetales por la cuales este tipo de virus tienen un tropismo particular (Quin and Petty, 2001). Esta preferencia por las células del floema por parte de los geminivirus cobra mayor importancia cuando se considera el caso de las plantas solanáceas tales como el tomate ya que en éstas el floema se encuentra rodeado exteriormente por una capa gruesa de células xilemáticas, explicando las dificultades que en la práctica tienen los investigadores en el laboratorio al intentar inocular mecánicamente estos virus en esta clase de hospedantes (Ascencio-Ibañez and Settlage, 2007). La biobalística, como lo demuestran los resultados de esta investigación, sobrepasa este obstáculo anatómico ya que al inocular por biobalística plantas jóvenes de tomate con un Begomovirus bipartita adherido a partículas de oro de 1.6µm de diámetro utilizando dos disparos y acelerados a una presión de helio de 320 psi se obtuvo un porcentaje de 100% de plantas infectadas. Al analizar los datos obtenidos en tabaco N. benthamiana, el diámetro de la partícula de oro no tuvo un efecto en el porcentaje de infección viral, obteniéndose en ambos casos un 100% de infección (tabla 1).
Los resultados obtenidos en la presente investigación demuestran la alta reproducibilidad y confiabilidad que la técnica de biobalística ofrece para la inoculación de geminivirus. Asimismo el empleo de equipos de biobalística de baja presión para inocular virus, tal como el que se empleó en esta investigación, permite al investigador infectar plantas cuyos tejidos foliares pueden considerarse como "extremadamente delicados" sin el temor de que éstos sufran daños mecánicos que impidan el posterior desarrollo del ciclo infectivo viral. A esta conclusión también llegaron Rothenstein et al. (2005) cuando comprobaron que el Virus del mosaico de la yuca India (Indian cassava mosaic virus, ICMV) era solamente posible inocularlo en yuca por medio de biobalística de baja presión ya que por estrategias de alta presión estas plantas sufrían daños mecánicos severos. Desde el punto de vista práctico la biobalística como estrategia de inoculación de geminivirus le brinda al investigador en virus una alternativa que le permite obviar el dispendioso empleo del vector natural de estos virus, tal como es la mosca blanca (B. tabacci, Genn) con todas las limitaciones y desafíos que implica el uso de estos insectos para tales fines (Czosnek, 2002). Los investigadores Gal-On et al. (1997) y Guenoune-Gelbart et al. (2010) afirman basados en sus resultados que la inoculación de virus por biobalística es 105 veces más efectiva para inocular geminivirus que cualquiera de las otras estrategias de inoculación que han sido reportadas para éstos a la fecha. También le brinda al investigador una herramienta práctica, fácil y rápida de emplear en estrategias de evaluación a gran escala de posibles materiales tolerantes o resistentes a geminivirus (Ariyo et al., 2006; Briddon et al., 1998; Guenoune-Gelbart et al., 2010; Lapidot et al., 2007). También se ha reportado en inoculaciones de varios géneros de virus en diversos hospederos. Gilbertson et al. (1991), realizaron una introducción eficiente de ácidos nucleicos de varios aislamientos del Virus del mosaico dorado del fríjol (Bean golden mosaic virus - BGMV-Begomovirus) en plantas de fríjol y maíz; Gal-On et al. (1995) lograron bombardear partículas infectadas con el Virus del mosaico amarillo del calabacín (Zucchini yellow mosaic virus - ZYMV-Potivirus) en plantas de calabacín, pepino, sandía y melón. Matousek et al. (2004) utilizaron el Viroide del eje del tubérculo de la papa (Potato spindle tuber viroid - PSTVd - Pospiviroide) para inocularlo con este método en plantas de tomate y papa. La biobalística también ha permitido con éxito la transmisión del Virus del mosaico del pepino (Cucumber mosaic virus - CMV - Cucumovirus) en plantas de gladiolo (Aebigl et al., 2005). Recientes investigaciones han permitido identificar de genotipos de yuca resistentes al mosaico de la yuca, causada por el Virus del mosaico africano de la yuca (African cassava mosaic virus ACMV - Begomovirus), utilizando la inoculación por biobalística (Ariyo et al., 2006). Finalmente, la pistola génica de baja presión Helios Gene Gun System (Bio-Rad, Hercules, CA, USA), a diferencia de otros protocolos de biobalística, permite la inoculación del material genético de un virus particular en un organismo blanco (planta) sin necesidad del uso de condiciones de vacío, sino mediante la aceleración de estas partículas a bajas presiones de helio se logra obtener infecciones manifiestas en las plantas sometidas a bombardeo en condiciones controladas. Esta estrategia de inoculación amplia enormemente el rango de organismos blanco a ser inoculados y en el caso particular de los organismos vegetales, dicha inoculación puede llevarse a cabo prácticamente en todas las etapas del desarrollo de las éstas así como prácticamente en todos sus tejidos (Gal-On et al., 1997; Hoffmann et al., 2001; Guenone-Gelbart et al., 2010).
Conclusiones
Se estandarizaron las condiciones ideales de inoculación de plantas de tomate y tabaco con un Begomovirus bipartita aislado de plantas de tomate recolectadas en Tuluá- Valle del Cauca por el método de biobalística utilizando un pistola génica de baja presión (Helios Gene Gun System, BioRad®). Las condiciones ideales de inoculación que permiten la obtención de un 100% de infección en plantas de tomate con síntomas típicos de la enfermedad viral son adherir el virus de interés a partículas de oro de 1.6 µm de diámetro e inocularlo con dos disparos a una presión de helio de 320 psi. Esta estrategia de inoculación mecánica permitirá al investigador prescindir del empleo de la mosca blanca (Bemisia tabacci Genn.) para realizar infecciones con este Begomovirus en plantas de tomate o bancos de germoplasma de tomate silvestre en futuros programas de mejoramiento genético que busquen identificar fuentes de resistencia begomoviral en estos cultivos.
Agradecimientos
El presente proyecto de investigación fue financiado con recursos del Ministerio de Agricultura y Desarrollo Rural de Colombia, contrato 134-2008N6396-3460, y se desarrolló en asocio con la empresa Defrescura S.A. y la Universidad Nacional de Colombia. Agradecemos a los Doctores Fredy Betancur Pérez y Franco Alirio Vallejo por su participación y aportes en esta investigación.
Referencias bibliográficas
1 Aebig, J. A., Kamo, K. and Hsu, H. 2005. Biolistic inoculation of gladiolus with cucumber mosaic cucumovirus. J. Virol. Methods, 123: 89-94. [ Links ]
2 Ariyo, O. A., Atiri, G. I. and Dixon A. G. O. 2005. Whitefly Bemisia tabaci Gennadius (Homoptera: Aleyrodidae) infestation on cassava genotypes grown at different ecozones in Nigeria. J. Econ. Entomol., 98: 611-617. [ Links ]
3 Ariyo, O.A., Atiri, G.I., Dixon, A.G.O. and S. Winter. 2006. The use of biolistic inoculation of cassava mosaic begomoviruses in screening for resistance to cassava mosaic disease. J. Virol. Methods, 137: 43-50. [ Links ]
4 Ascencio-Ibañez, J.T. and S.B. Settlage. 2007. DNA abrasion onto plants is an effective method for geminivirus infection and virus-induced gene silencing. J. Gen. Virol., 142: 198-203. [ Links ]
5 Betancur-Perez, F. 2012. Identificación y caracterización molecular de virus transmitidos por mosca blanca Bemisia tabaci que infectan tomate en la región andina de Colombia. Tesis de Doctorado. Universidad Nacional de Colombia Facultad de Ciencias Agropecuarias, Sede Palmira. p. 113. [ Links ]
6 Birnboim, H. and Dolly, J. 1979. Extraction procedure for screening recombinant plasmid DNA. Nucleic Acids Res., 7: 1513-1523. [ Links ]
7 Briddon, R. W., Liu, S., Pinner, M. S. and Markham, P. G. 1998. Infectivity of African cassava mosaic virus clones to cassava by biolistic inoculation. Arch. Virol., 143: 2487-2492. [ Links ]
8 CIMMYT. 2006. Protocolos de laboratorio: Laboratorio de Genética Molecular Aplicada del CIMMYT. Tercera edición. México, D.F. CIMMYT, 2. [ Links ]
9 Czosnek, H., Ghanim, M. and Ghanim, M. 2002. The circulative pathway of begomoviruses in the whitefly vector Bemisisa tabaci insights from studies with Tomato yellow leaf curl virus. Ann. Appl. Biol., 140: 215-231. [ Links ]
10 De Barro, P.J., Liu, S.S., Boykin, L.M. and Dinsdale, A.B. 2011. Bemisia tabaci: A statement of species status. Ann. Rev. Entomol., 56: 1-19. [ Links ]
11 Fauquet, C. M., Bisaro, D. M., Briddon, R.W., Brown, J. K., Harrison, B. D., Rybicki, E. P., Stenger, D. C. and Stanley, J. 2003. Revision of taxonomic criteria for species demarcation in the family Geminiviridae, and an updated list of begomovirus species. Arch. Virol., 148: 405-421. [ Links ]
12 Gal-On, A., Meiri, E., Hua, W. J., Raccah, B. and Gaba, V. 1995. Particle bombardment drastically increases the infectivity of cloned DNA of zucchini yellow mosaic potyvirus. J. Gen. Virol., 76: 3223-3227. [ Links ]
13 Gal-On, A., Meiri, E., Elman, C., Gray, D.J. and. V. Gaba. 1997. Simple hand-held devices for efficient infection of plants with viral-encoding constructs by particle bombardment. J. Virol. Methods., 64: 103-110. [ Links ]
14 Gan, C. 1989. Gene Gun Accelerates DNA-Coated Particles To Transform Intact Cells. The Scientis, 3: 25. [ Links ]
15 Garzón-Tiznado, J.A., Torres-Pacheco, I., Ascencio-Ibañez, J.T., Herrera- Estrella, L. and R. F. Rivera-Bustamante. 1993. Inoculation of peppers with infectious clones of a new geminivirus by a biolistic procedure. Phytopathol, 83: 514-521. [ Links ]
16 Gilbertson, R. L., Faria, J.C., Hanson, S.F., Morales, F.J., Ahlquist, P., Maxwell, D.R. and D.P. Russell. 1991. Cloning of the complete DNA genomes of four bean-infecting geminiviruses and determining their infectivity by electric-discharge particle-acceleration. Phytopathol, 81: 980-985. [ Links ]
17 Guenoune, G. D., Sufrin, R. T., Capobianco, H., Gaba, V., Polston, J. E. and Lapidot, M. 2010. Inoculation of plants with begomoviruses by particle bombardement without cloning: Using rolling circle amplification of total DNA from infected plants and whiteflies. J. Gen. Virol., 168: 87-93. [ Links ]
18 Guevara-Gonzales, R.G., Ramos, P.L. and R. F. Rivera-Bustamante. 1999. Complementation of coat protein mutants of Pepper huasteco virus in transgenic tobacco plants. Phytopathol., 89: 540-545. [ Links ]
19 Hanley-Bowdoin, L., Settlage, S.B., Orozco, B.M., Nagar. S. and D. Robertson. 1999. Geminivirus: Models for plant DNA replication, transcription and cell cycle regulation. Crit. Rev. Plant Sci., 18: 71-106. [ Links ]
20 Harries, P. and B. Ding. 2011. Cellular factors in plant virus movement: at the leading edge of macromolecular trafficking in plant. Virol., 411: 237-243. [ Links ]
21 Hernández, V. S., Guevara, G. R., Rivera, B. R. and Oyama, K. 2001. Screening wild plants of Capsicum annuum for resistance to papper huasteco virus (PHV): Presence of viral DNA and differentiation among populations. Euphytica, 122: 31-36. [ Links ]
22 Hoffmann, K., Verbeek, M., Romano, A., Dullemans, A. M., J. F. J. M. van den Heuvel, F. van der Wilk. 2001. Mechanical transmission of poleroviruses. J. Virol. Methods., 91: 197-201. [ Links ]
23 Jawdah, Y.A., Maalouf, R., Shebaro, W. and Soubra, K. 1999. Comparison of the reaction of tomato lines to infection by tomato yellow leaf curl begomovirus in Lebanon. Plant Pathology, 48: 727-734. [ Links ]
24 Lapidot, M., Weil, G., Cohen, L., Segev, L. and V. Gaba. 2007. Biolistic inoculation of plants with Tomato yellow leaf curl virus DNA. J. Virol. Methods, 144: 143-148. [ Links ]
25 Laterrot, H. 1999. Disease resistance in tomato present situation and hopes. Acta Hort., (ISHS) 495: 281-282. [ Links ]
26 Matousek, J., Orctova, L., Stenger, G. and D. Riesner. 2004. Biolistic inoculation of plants with viroid nucleic acids. J. Virol. Methods, 122: 153-164. [ Links ]
27 Morales, F. J., Martínez, A. K. y Velasco, A. C. 2002. Nuevos brotes de geminivirus en Colombia. Fitopatol. Colombiana., 26: 76-78. [ Links ]
28 Morales, F.J. and Anderson, P. 2001. The emergence and dissemination of whitefly transmitted geminiviruses in Latin America. Arch Virol., 146: 415-441. [ Links ]
29 Morilla, G., Janssen, D., Garcia, S., Moriones, E., Cuadrado, I. M. and Bejarano, E. R. 2005. Pepper (Capsicum annuum) is a dead-end host for Tomato yellow leaf curl virus. Phytopathology., 95: 1089-1097. [ Links ]
30 Nava, A., Patte, P., Hiebert, E. and Polston, J. 2006. Detection and Variability of begomoviruses in tomato from the Andean states of Venezuela. Plant Dis., 90: 61-66. [ Links ]
31 Polston, J. E. and Anderson, P. K. 1997. The emergence of whitefly-transmited geminivirus in tomato in the western hemisphere. Plant Dis., 81: 1358-1369. [ Links ]
32 Quin, Y. and I.T.D. Petty. 2001. Genetic analysis of bipartite geminivirus tissue tropism. Virol., 291: 311-323. [ Links ]
33 Rojas M. R., Gilbertson R. L., Ruseel D. R., and Maxwell D. P. 1993. Use of generate oligonucleótidos in the polymerase chain reaction to detect whitefly-transmitted geminivirus. Plant Dis, 77: 340-347. [ Links ]
34 Rojas, M. R., Hagen, C., Lucas, W. J. and Gilbertson, R. L. 2005. Exploiting chinks in the plants armor: Evolution and emergence of Geminivirus. Annu. Rev. Phytopathol, 43: 361-394. [ Links ]
35 Rothenstein, D., Briddon, R.W., Haible, D., Stanley, J., Frischmuth, T. and H. Jeske. 2005. Biolistic infection of cassava using cloned components of Indian cassava mosaic virus. Arch. Virol., 150: 1669-1675. [ Links ]
36 Scholtof, H.B. 2005. Plant virus transport: motions functional equivalence. Trends Plant Sci,. 10: 376-382. [ Links ]
37 Sudarshana, M. R., Wang, H. L., Lucas, W. J. and Gilbertson, R. L. 1998. Dynamics of Bean Dwarf Mosaic Geminivirus cell-to-cell and long-distance movement in Phaseolus vulgaris revealed, using the green flourescent protein. Molecular Plant-Microbe Interactions, 11: 277-291. [ Links ]
38 Vaca-Vaca, J. C. 2003. Identificación y caracterización de elementos cis-regulatorios que contribuyen a la actividad del promotor del gen de la proteína de la cápside del Virus huásteco del chile. Tesis Doctoral. CINVESTAV-IPN. México. [ Links ]
39 Vaca-Vaca, J. V., Betancurt-Pérez J. F. y López-López. K. 2011. Detección, identificación y localización geográfica de Begomovirus que afectan al tomate en Colombia. Rev. Colomb. Biotecnol., 8: 115-122. [ Links ]
40 Vaca-Vaca, J. V., Betancur-Pérez, J. F. y López-López. K. 2012. Distribución y diversidad genética de Begomovirus que infectan tomate (Solanum lycopersicum L.) en Colombia. Rev. Colomb. Biotecnol., 14: 60-76. [ Links ]
41 Valat, L., Mode, F., Mauro, M. C. and Burrus, M. 2003. Preliminary attempts to biolistic inoculation of grapevine fanleaf virus. J. Virol. Methods., 108: 29-40. [ Links ]
42 Wege, C., Gotthardt, R.D., Fritschmuth, T. and H. Jeske. 2000. Fulfilling Koch's postulates for Abutilon mosaic virus. Arch.Virol., 145: 2217-2235. [ Links ]
43 Yamagishi, N., Terauci, H., Kanematsu, S. and S. Hidaka. 2006. Biolistic inoculation of soybean plants with Soybean dwarf virus. J. Virol. Methods., 137: 164-167. [ Links ]
44 Zakay, Y., Navot, N., Zeidan, M., Kedar, N., Rabinowitch, H., Czosnek, H. and Zamir, D. 1991. Screening Lycopersicon accesions for resistance to tomato yellow leaf curl virus: Presence of viral DNA and symptom development. Plant Dis., 75: 279-281. [ Links ]