Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.15 no.2 Bogotá jul./dez. 2013
https://doi.org/10.15446/rev.colomb.biote.v15n2.41743
http://dx.doi.org/10.15446/rev.colomb.biote.v15n2.41743
ARTÍCULO DE REVISIÓN
Una revisión sobre la producción de taxoides anticancerígenos en cultivos in vitro de callos y células de Taxus spp
A review on the production of taxoids anti-cancer of callus and cells of Taxus spp. in cultures in vitro
Hebert Jair Barrales Cureño1, Marco Favio Ramírez Sepúlveda2
1 Licenciado en Química Agrícola por la Universidad Veracruzana. Maestro en Ciencias en Genética por el Colegio de Postgraduados Campus Montecillo. Doctor en Ciencias en Botánica. Colegio de Postgraduados, Campus Montecillo, Instituto de Botánica. Km. 36.5 Carretera México-Texcoco. Montecillo, Texcoco, Edo. de México. C.P. 56230. e-mail: barrales.hebert@colpos.mx.
2 Ingeniero Agroindustrial, Universidad Autónoma Chapingo. Maestro en Ciencias en Química. Departamento de Ingeniería Agroindustrial, Universidad Autónoma Chapingo. Km 38.5 Carretera México-Texcoco. C.P. 56230, Chapingo, Edo. de México.
Recibido: enero 20 de 2013. Aprobado: noviembre 20 de 2013
Resumen
Los taxoides son diterpenos polioxigenados provenientes de la ruta metabólica del 2-metil-eritritol 4-fosfato cuya biosíntesis se genera en los plastidios. La importancia de los taxoides entre ellos el taxol, en el área de la medicina humana es muy valiosa debido a la utilización en oncología, fármaco utilizado contra el cáncer de seno, pulmón y ovario. Las especies de árboles de Taxus spp. están en peligro de extinción debido a la tala inmoderada, a la baja reproducción, lento crecimiento; por lo que el cultivo de tejidos vegetales in vitro es una alternativa biotecnológica de alto impacto y de gran ayuda para el conocimiento de la producción de los taxoides a nivel in vitro y sobre todo, para la conservación de este valioso recurso natural. Los objetivos de este artículo son: origen del taxol, su mecanismo de acción biológico, la biosíntesis de los taxoides, el método de extracción así como la producción de taxoides in situ y en cultivos in vitro de callos y células de Taxus spp.
Palabras clave: cáncer, biotecnología, metabolismo secundario, taxol, Taxaceae.
Abstract
The taxoids are polioxigenated diterpenes from the metabolic pathway of the 2-methyl-erythritol 4-phosphate whose biosynthesis is generated in the plastides. The importance of the taxoides including taxol, in the area of human medicine is very valuable due to the use in oncology, drug used against breast, lung and ovarian cancer. The species of trees of Taxus spp. are in danger of extinction due to logging immoderate, to the low reproduction rate, slow growth; therefore, the plant tissue culture in vitro is a biotechnological alternative high-impact and a great help to the knowledge of the production of the taxoides to level in vitro and above all, for the conservation of this valuable natural resource. The objectives of this article are to determine some general information about the geographical distribution of Taxus spp.; chemical characteristics of taxoids, biological mechanism of action of taxol; path of biosynthesis, methods of extraction and analysis of the taxoids and a current review of the production of taxoids in situ and in vitro cultures and cells of Taxus spp.
Key words: cancer, biotechnology, secondary metabolism, taxol, Taxaceae.
Introducción
El cáncer es un término que se usa para enfermedades en las que células anormales se dividen sin control y pueden invadir otros tejidos. Las células cancerosas pueden diseminarse a otras partes del cuerpo por el sistema sanguíneo y por el sistema linfático y pueden invadir partes adyacentes del cuerpo o propagarse a otros órganos, proceso conocido como metástasis (Wakefield y Hunter, 2007).
El cáncer es la principal causa de muerte a escala mundial. Se le atribuyen 7.6 millones de defunciones (aproximadamente el 13% del total ocurridas en todo el mundo en 2008). Se prevé que el número de defunciones por cáncer siga aumentando en todo el mundo y supere los 13.1 millones en 2030 (Parkin et al., 2002). Los principales tipos de cáncer que afectan a la población es el de pulmón (Ashton, 2013a), seguido del cáncer gástrico, hepático, colorrectal (Ashton, 2013b), seno (Ashton, 2013c) y cervicouterino (Ashton, 2013d).
La aplicación de los tratamientos adecuados que combinan cirugía, radioterapia y quimioterapia ha permitido mejorar en gran medida la calidad de vida de los pacientes de cáncer y abatir la mortalidad. Aunque la cirugía continúa siendo la principal arma terapéutica, en nuestros días se ha logrado que sea menos radical, lo que se debe en gran medida al empleo de la radioterapia, la cual puede eliminar la masa tumoral con gran precisión y una potencia antes impensable. No obstante, esa forma de terapia es local y muy efectiva si las células malignas se encuentran localizadas dentro del campo irradiado, pero es ineficaz cuando las células cancerosas se han expandido a otros órganos (Barrales et al., 2012). Aquí entra a desempeñar su papel la quimioterapia, que es la tercera arma con que se cuenta para combatir el cáncer. Los fármacos antitumorales actúan sobre la división celular, inhibiéndola u obstaculizándola (Barrales et al., 2012). El tratamiento quimioterápico del paciente oncológico está limitado por la necesidad de que las dosis del agente químico empleado sean lo más bajas posible para minimizar el efecto sobre las células sanas y los efectos secundarios (Soto et al., 2005).
El taxol® es un fármaco anticáncer utilizado en el tratamiento de tumores sólidos como el cáncer de seno (Holmes et al., 1991), pulmón y ovario (Michaud et al., 2000), entre otros tipos de cáncer (Zu et al., 2006). El taxol se encontró por primera vez en extractos de la corteza de árboles de Taxus brevifolia y actualmente se extrae de otras especies de Taxus spp, lo que ha llevado a que los árboles se encuentren al borde de la extinción (Baebler et al., 2005).
Los árboles de Taxus spp. pertenecen a la familia Taxaceae.
Posteriormente, el taxol fue producido semisintéticamente a partir de los precursores tales como: baccatina III y 10 diacetil baccatina III aislados de las agujas y otras especies de Taxus spp. recientemente, la producción comercial del taxol a partir de cultivos de células en suspensión se ha establecido. El taxol se aprobó por la Administración de Fármacos y Alimentos (US FDA, Food and Drug Administration) como uno de los fármacos anticáncer más potentes y eficientes. Hasta ahora, se conocen más de 350 taxoides que se han aislado de diversas especies de Taxus, tales como T. baccata, T. wallichiana, T. cuspidata, T. canadensis, T. chinensis y T. yunnanensis y el número de taxoides podría incrementar (Maheshwari et al., 2008).
La técnica del cultivo de tejidos vegetales in vitro es una herramienta exitosa para la generación de cultivos de callos y células que produzcan metabolitos secundarios de gran importancia farmacéutica tales como el taxol y taxoides relacionados, sin que se destruyan los árboles de Taxus spp. (Yu et al., 2005; Arias et al., 2009). Dada la importancia anterior los objetivos del presente trabajo son: indicar el origen del fármaco taxol, su mecanismo de acción biológico, la biosíntesis de los taxoides, el método de extracción así como actualizar la información de los antecedentes de manera general de la producción de los principales taxoides: taxol, cefalomanina y 10 diacetil baccatina in situ y en cultivos in vitro de callos y células de Taxus spp.
Distribución geográfica de Taxus spp
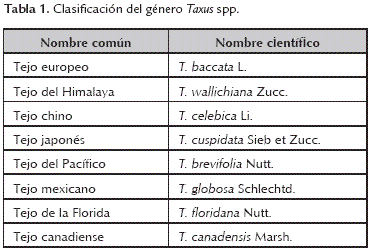
Los árboles de Taxus spp. se distribuyen en los Continentes Americano, Europeo y Asiático (tabla 1). En Asia, la planta es utilizada en la medicina tradicional de China, siendo el extracto de Taxus un diurético e hipotensor. El género Taxus pertenece a la clase Pinopsida, orden Taxales y a la familia Taxaceae (Malik et al., 2011).
Origen del Taxol
Es importante definir los acontecimientos importantes en el descubrimiento del taxol, desde el aislamiento de un compuesto químico denominado taxina en 1856, compuesto químico que es responsable de la toxicidad de las hojas (Baloglu, 2001), hasta las prioridades de obtener una mayor cantidad del producto para los pacientes con cáncer (tabla 2).
Características químicas del taxol
La fórmula molecular del taxol es C47H51NO14 y su peso molecular es de 853.9 Da (Malik et al., 2011). En 1999, las ventas a nivel mundial de taxol, producido por Bristol-Myers Squibb (BMS) alcanzaron $1.5 billones de dólares. Aunque esta compañía reporto una disminución del 24% de ventas de taxol®, de 422 millones de dólares en 2006 a $385 millones en 2007 (Malik et al., 2011), esta reducción se debe primariamente a que la patente expiro y se originó un incremento de competición de genéricos en Europa así como la entrada de genéricos en Japón durante el tercer trimestre de 2006.
Mecanismo de acción biológica del taxol
El fármaco antitumoral taxol® tiene un mecanismo de acción específico, su principal función es estabilizar los microtúbulos (Schiff et al., 1979), reduciendo su dinamismo y promoviendo un detenimiento de la mitosis y por lo tanto, muerte celular (Xiao et al., 2006). Los microtúbulos son estructuras dinámicas, son cilindros huecos, largos y no ramificados de alrededor de 25 nm de diámetro y de hasta varios micrómetros de longitud, que cumplen dos funciones en la célula: forman un esqueleto interno rígido para algunas células y actúan como un andamiaje a lo largo del cual las proteínas motoras pueden mover estructuras dentro de la célula y proporcionan el alineamiento apropiado de los cromosomas durante la división celular (Sadava et al., 2009).
Los microtúbulos se ensamblan a partir de moléculas de la proteína tubulina. La tubulina es un dímero: una molécula compuesta por dos monómeros. Los monómeros polipeptidicos que forman el dímero de tubulina se conocen como alfa tubulina y beta tubulina. Trece cadenas de dímeros de tubulina rodean la cavidad central del microtúbulo. Los dos extremos de un microtúbulo son diferentes: un extremo se designa con el signo positivo (+) y el otro con el signo negativo (-). Los dímeros de tubulina pueden adicionarse o sustraerse con rapidez, sobre todo en el extremo positivo, alargando o acortando el microtúbulo. Debido a su capacidad de cambiar de longitud de manera rápida (Sadava et al., 2009). Bioquímicamente, el taxol induce la polimerización de los microtúbulos creando uniones estables no funcionales que impiden la posterior despolimerización, interfiriendo con la división normal de la célula y los procesos que se desarrollan en la interfase. El taxol afecta a la subunidad ß de la tubulina (Centelles e Imperial, 2010). En la actualidad su uso clínico es muy amplio en los tratamientos para el carcinoma de ovario, mama, pulmón, cabeza y cuello (Hara et al., 2008).
Ruta de biosíntesis de los taxoides
El taxol y otros terpenoides se biosintetizan a partir del bloque estructural universal C5, el isopentenil difosfato (IpPP) (Kuzuyama y Seto, 2003). La extensión de la cadena terpénica puede proseguir en el cloroplasto, donde se condensan, por la acción de la enzima geranil geranil difosfato sintasa, una unidad de DMAPP y tres de IpPP para formar geranil geranil difosfato (C20) (GGPP, Jin et al., 2006). Este compuesto es el precursor directo de los diterpenos como el taxol y, por la dimerización de estos últimos, de los tetraterpenos (Azcón-Bieto y Talón, 2008).
La ruta de biosíntesis inicia con la formación del taxol in planta, esta abarca genes que codifican para las enzimas de biosíntesis consecutivas, las cuales han sido extensamente investigadas y documentadas. La ruta de formación del taxol en Taxus requiere de 19 pasos enzimáticos (Walker y Croteau, 2001).
El primer paso en la ruta de biosíntesis del taxol comienza con la ciclización de GGPP (geranilgeranil pirofosfato), formando taxa-(4,5), (11,12)-dieno, el primer compuesto en la ruta de biosíntesis del taxol que presenta el esqueleto de taxano. Esta reacción se cataliza por la enzima taxadieno sintasa (TS), una proteína monomérica de 79 kDa con propiedades similares a otras terpenoide ciclasas. La enzima se purificó y se caracterizó en 1995 (Hezari et al., 1995) y el gen que codifica para TS se identificó y se clonó en 1996 (Wildung y Croteau, 1996).
Las etapas siguientes involucran una serie de oxigenaciones mediadas por enzimas citocromo P450 oxigenasas (Kaspera y Croteau, 2006), posteriormente continúa un arreglo de acilaciones, luego, la formación del anillo de oxetano y varios pasos de ensamblamiento a la cadena lateral, resultando finalmente en la síntesis de taxol.
Sin embargo, el hecho de que la biosíntesis de este diterpenoide sea altamente funcionalizada y única in planta, hace que se involucren un gran número de genes. Algunos pasos están indefenidos en la ruta de biosíntesis del taxol que ya ha sido estudiada debido a que varios genes que regulan esta ruta se han clonado y caracterizado principalmente en Taxus spp. (Malik et al., 2011). Actualmente, la metabolómica se perfila como una herramienta molecular eficaz para el conocimiento más preciso y detallado de la ruta de biosíntesis de los taxoides, debido a que aún no está del todo dilucidada (Tanaka et al., 2011).
En la tabla 3, se indican las principales enzimas de la ruta de biosíntesis del taxol, las enzimas se extrajeron por procesos de recuperación automatizada de sistemas específicos de información enzimática y base de datos presentados en la web.
La enzima taxadieno sintasa es la enzima responsable que origina la ciclización del geranilgeranildifosfato a taxa-4,11-dieno siendo un paso lento en la biosíntesis del taxol. Esta enzima es sin embargo, suficientemente activa para promover la formación de altos niveles (85%) de otros taxoides en cultivos celulares (Hung et al., 2005). La redirección genética de la ruta hacia la formación del taxol, y lejos de rutas alternativas para otros taxoides, puede ser la manera más eficiente de incrementar los rendimientos de taxol (Ketchum y Croteau, 2006).
Método de extracción y análisis de taxoides
Los cultivos de células de Taxus contienen baja cantidad de pigmentos, substancias cerosas y lípidos no polares que los extractos de las agujas o de las cortezas de los árboles. Debido a esto, la extracción de los taxoides a partir de materiales de callos o células se simplifica.
Típicamente, los callos secos o las muestras celulares se maceran en metanol, cloruro de metileno o una mezcla de metanol-cloruro de metileno en una proporción de 1:1 (Barrales et al., 2011). Después de la partición del solvente con una fase acuosa, el extracto no-polar se evapora y se redisuelve en un solvente apropiado o solución buffer previo al análisis del taxol o taxoides relacionados. El análisis cualitativo de los taxoides se lleva a cabo por medio de la Cromatografía en Capa Fina (TLC, Thin Layer Cromatography), o bien, por Cromatografía en Capa Fina de Alta Resolución (HPTLC, High Performance Thin Layer Cromatography) (Barrales et al., 2011). El análisis cuantitativo de los taxoides se lleva a cabo por Cromatografía Líquida de Alta Resolución (HPLC) (Zu et al., 2006).
Contenido de taxol in situ
Las investigaciones que se han realizado para conocer la producción de taxol in situ en la corteza de árbol maduro de 100 años de edad cuya tasa de biosíntesis especifica es de 4.70 x 10-6 mg/g/día (0.017 % peso seco de contenido promedio de taxol) (Gibson et al., 1995) y en acículas de plantaciones de árboles de 4 años de edad es de 0.34 x 10-6 mg/g/día (0.005 % peso seco de contenido promedio de taxol) Gibson et al., 1995.
Respecto a los contenidos de taxol y otros taxoides relacionados tales como cefalomanina y 10-diacetil baccatina (precursores en la biosíntesis del taxol), en la tabla 4 se concentran las principales investigaciones.
Las agujas tambien contienen un grupo de once compuestos alcaloides tóxicos, denominados taxinas (0.4-0.7% de peso fresco del material vegetal). Las taxinas fueron aisladas antes que el taxol fuese descubierto. El taxoide 10-diacetil baccatina fue primeramente identificado en agujas de T. baccata (Maheshwari et al., 2008). Además, en agujas de T. wallichiana se ha identificado a un taxoide particular denominado wollifoliol, conteniendo 5/6/6/6/4 sistemas de anillos (Maheshwari et al., 2008). Varios órganos que incluyen cortezas, tallos y hojas de Taxus wallichiana y otras pocas especies, T. yunnanensis y T. cuspidata acumulan taxoides oxigenados en la posición C-14. Todos los taxoides oxigenados C-14 exhiben baja citotoxicidad debido a la carencia de la cadena lateral C-4 (20) y al anillo de oxetano-5 (Maheshwari et al., 2008).
Producción de taxoides en cultivos in vitro de callos de Taxus spp
Los callos son un conjunto de células desdiferenciadas que crecen en medio sólido y es el material de inicio para el establecimiento y crecimiento de células en suspensión (Malik et al., 2011). Se ha observado que tejidos jóvenes responden mejor a la iniciación de callos que las partes vegetales maduras o tejidos jóvenes de árboles adultos (Brunakova et al., 2004).
Las investigaciones que se han realizado para conocer la producción de taxol in vitro en cultivo de tejidos de Taxus cuya productividad volumétrica varia de 0.13 mg/L/día (0.050 % peso seco de contenido promedio de taxol) (Gibson et al., 1995); 0.14 mg/L/día (0.013 % peso seco de contenido promedio de taxol) Kim et al., 1995; 0.64 mg/L/día (0.2 % peso seco de contenido promedio de taxol) Mirjalili y Linden 1995.
En la tabla 5 se concentran las principales investigaciones de la cuantificación de taxoides en callos de Taxus spp.
Existe una gran variabilidad en las respuestas de crecimiento así como en la producción de taxol en cultivos de callos derivados de genotipos diferentes (Brunakova et al., 2004). La producción del taxol en los callos depende de la morfología y la edad. Los callos producen más taxol cuando son longevos y de color café que cuando son jóvenes y pálidos (Brunakova et al. 2004). Por otro lado, la distribución de tamaño de los agregados celulares juega un papel importante en el mezclado, nutrientes y transferencia de oxígeno, facilidad para la purificación de productos y con frecuencia está directamente relacionada con la productividad (McDonald et al., 2001).
Producción de taxoides en cultivos in vitro de células de Taxus spp
Los cultivos de células en suspensión generalmente muestran considerable variabilidad en su capacidad para producir metabolitos secundarios debido a la variación genética o a la heterogeneidad asociada con las células (Malik et al., 2011). El paso preliminar en el establecimiento de un cultivo celular a largo plazo se debe a la selección y clonación de líneas celulares de rápido crecimiento capaces de producir taxol. Por ejemplo, en líneas celulares de Taxus baccata crecidas se muestran variaciones diferentes para producir taxol en cultivos en suspensión (Brunakova et al., 2004).
En los cultivos de células en suspensión, las células individuales se distribuyen en forma homogénea a través del medio de cultivo y por estar rodeadas del mismo, se facilita la transferencia de nutrientes y oxígeno hacia el citoplasma. Este tipo de cultivo presenta la ventaja de permitir el control sencillo de variables como la temperatura, el oxígeno disuelto y el pH; sin embargo, pueden verse modificadas algunas características de las células presentes en las células como su diferenciación y la comunicación intercelular, lo que implica en muchos casos la disminución de los metabolitos secundarios, debido a que se ha reportado que en algunas especies la síntesis de ciertos metabolitos requiere la coexistencia de diferentes tipos celulares o la compartimentación intracelular (Arias et al., 2009).
Las células vegetales en suspensión tienden a formar agregados de manera natural ya que al dividirse no se separan adecuadamente lo cual puede afectar la producción de metabolitos secundarios, probablemente debido al estrés nutricional, especialmente de oxígeno, que es causado por la limitación a la transferencia de masa en los agregados y por la diferenciación celular dentro de los mismos; además el aumento de las interacciones intercelulares puede facilitar el intercambio de señales y metabolitos, necesarios en la síntesis de algunos metabolitos particulares (Edahiro y Ski, 2006).
Por otro lado, el análisis de células individuales de Taxus por vía de citometría de flujo revela un alto grado de variabilidad de célula a célula, en cuanto al contenido de proteínas, actividad del ciclo celular y acumulación de taxol (Nail y Roberts, 2005).
En los cultivos in vitro de líneas celulares vegetales indiferenciadas usualmente se desarrollan por desdiferenciación de células que toman lugar de explantes vegetales, pero estas líneas no son siempre homogéneas, originando una variabilidad e inestabilidad en las propiedades de los cultivos conocida como variación somaclonal (Xu et al., 2005; Murphy, 2011). Las suspensiones celulares finas están constituidas principalmente por células meristemáticas indiferenciadas, más débiles e inestables en comparación con su estado en el ambiente natural (Arias et al., 2009), Barrales et al., 2011 en una investigación realizada evidenciaron la formación de agregados celulares.
En la tabla 6 se presenta de manera general la tasa de producción de taxol extracelular en cultivos de células en suspensión de Taxus spp. en sistemas de matraces.
En la tabla 7 se concentran las principales investigaciones respecto al cultivo in vitro en células.
Existe un alto grado de variación de algunos genes implicados en la biosíntesis del taxol en poblaciones naturales del tejo de la Península Ibérica, lo que indica que algunos genes varían dentro de una misma población y también entre las diferentes poblaciones (Burgarella et al., 2012). Parte de la variación detectada es fruto de las presiones ambientales particulares de cada bosque de Taxus, así que es posible que existan nuevas variantes moleculares de los genes implicados en la producción de taxol en las diferentes poblaciones mundiales de tejo tanto a nivel in situ e in vitro (Burgarella et al., 2012). Abbasi et al. (2012) probaron cuatro diferentes medios de cultivo de células (WPM, B5, MS y SH), concluyendo que el medio de cultivo no solo afecta el rendimiento del taxol sino que también afecta significativamente las cantidades de taxol secretado por las células.
Otros compuestos y taxoides identificados en Taxus spp
En la búsqueda por encontrar nuevos compuestos análogos del taxol, una gran número de constituyentes químicos en Taxus spp. han sido identificados (Agrawal et al., 2000). Se ha reportado el aislamiento de 120 taxoides, flavonoides, abeotaxanos, lignanos y glicósidos en especies del tejo japonés Taxus wallichiana y éste ha sido utilizado para el aislamiento de un gran rango de compuestos no taxoideos por ejemplo, isoprenoides superiores, azucares derivados, apocarotenoides y compuestos fenólicos (Agrawal et al., 2000).
Otros compuestos principales identificados en varias especies de Taxus son: 3,11-ciclotaxanos producidos bajo irradiación del correspondiente 13-oxo-taxa-11-eno; abeotaxanos 11 (Maheshwari et al., 2008); pretaxoides tales como epitaxol, acetiltaxol, y taxol C que contienen estructura de anillo 6/8/6/4 (A/B/C/D, respectivamente). También se han descubierto una nueva serie de taxoides, nombrados taxuspinas, que poseen varios esqueletos conteniendo sistemas de anillos 5/7/6, 6/10/6, 6/5/5/6, 6/8/6, o 6/12 aislados a partir de T. cuspidata (Maheshwari et al., 2008).
Conclusiones
Las especies de Taxus spp. son de suma importancia debido a que son un recurso genético que se encuentra en peligro de extinción, en caso de que no se logre su conservación ex situ y se promueva su permanencia in situ o in vitro. Los constituyentes fitoquímicos de diferentes especies de Taxus han sido estudiados durante varias décadas y se han identificado: taxanos-alcaloides, diterpenos con esqueleto de taxano, lignanos, biflavonoides, esteroides y diterpenos. Los taxoides antitumorales han generado gran interés farmacológico destacando ampliamente el taxol, cefalomanina y 10-diacetil baccatina, diterpenos tetracíclicos, utilizados para fines terapéuticos en el tratamiento del cáncer cérvico uterino, seno, pulmón, carcinoma gástrico. El sistema in vitro de callos y células de Taxus spp. favorece la producción de los taxoides e impide la tala inmoderada de la corteza que causa la muerte progresiva de los árboles. La producción de taxoides en cultivos de callos y células de Taxus spp. varía de acuerdo a la línea celular, la edad y las condiciones del estado de crecimiento del cultivo de las células, por eso, cualquier cambio en los patrones de producción puede indicar variaciones del cultivo como respuesta a factores ambientales. Se recomiendan analizar las especies de Taxus faltantes para conocer la producción de los taxoides.
Referencias bibliográficas
1 Abbasi K.A., Reza M.M. y Otroshy M. 2012. Investigation of the effects of basal medium type on the production of anti-cancer drug taxol from cell culture of Taxus baccata L. Journal of Plant Biology. 4(12): 83-88. [ Links ]
2 Agrawal S., Banerjee S., Chattopadhyay S.K., Kulshrestha M., Madshusudanan K.P., Mehta V.K. Kumar S. 2000. Isolation of taxoids from cell suspension cultures of Taxus wallichiana. Planta Med. 66: 773-775. [ Links ]
3 Arias M., Aguirre A., Angarita M., Montoya C., Restrepo J. 2009. Aspectos ingenieriles del cultivo in vitro de células vegetales para la producción de metabolitos secundarios. Dyna. 157:109-121. [ Links ]
4 Ashton A. Q. 2013a. Lung Cancer: New Insights for the Healthcare Professional. Scholarly Edition. 937 p. [ Links ]
5 Ashton A. Q. 2013b. Colon Cancer: New Insights for the Healthcare Professional. Scholarly Edition. 1155 p. [ Links ]
6 Ashton A. Q. 2013c. Breast Cancer: New Insights for the Healthcare Professional. Scholarly Edition. 974 p. [ Links ]
7 Ashton A. Q. 2013d. Solid Cancer: New Insights for the Healthcare Professional. Scholarly Edition. 220 p. [ Links ]
8 Azcón-Bieto J. y Talón M. 2008. Fundamentos de Fisiología Vegetal. McGraw-Hill, Interamericana. 2a edición. 651 p. [ Links ]
9 Baebler S., Hren M., Camloh M., Ravnikar M., Bohanec B., Plaper I., Ucman R., Zel J. 2005. Establishment of cell suspension cultures of yew (Taxus x media Rehd.) and assessment of their genomic stability. In vitro Cel. Dev. Biol. Plant. 41: 338-343. [ Links ]
10 Baloglu E. 2001. Synthesis and biological evaluation of paclitaxel analogs. Phd Thesis. Virginia polytechnic institute and state university USA. [ Links ]
11 Barrales C.H.J., De la Rosa M.C.R., Villegas O.S. 2012. Hacia una genética celular del cáncer. Revista la Ciencia y el Hombre. 25(2): 1-6. [ Links ]
12 Barrales C.H.J., Soto H.R.M., Ramos V.A.C., Trejo T.L.I., Martínez V.M., Ramírez G.M.E., San Miguel CH.R. Luna P.R.G., López U.J. 2011. Extracción y cuantificación de taxoides por HPLC en hojas in situ y en callos inducidos in vitro de Taxus globosa Schlecht. Spanish Journal of Rural Development. 2:103-114. [ Links ]
13 Barrios H., Zhang Y., Sandoval C., Xiao Z. 2009. Increase of taxol production in Taxus globosa Shoot callus by Chlorocholine Chloride. The Open Natural Products Journal. 2: 33-37. [ Links ]
14 Burgarella C., Navascués M., Zabal-Aguirre M., Berganzo E., Riba M., Mayol M., Vendramins G. G., y González-Martínez C. 2012. Recent population decline and selection shape diversity of taxol-related genes. Molecular Ecology. 21: 3006-3021. [ Links ]
15 Brunakova K., Babincova Z., Takac M., Cellarova E. 2004. Selection of callus cultures of Taxus baccata L. as a potential source of paclitaxel production. Engineering in Life Sciences. 4: 465-469. [ Links ]
16 Centelles J., Imperial D. 2010. Paclitaxel, descubrimiento, propiedades y uso clínico. Fitoterapia. 29: 69-75. [ Links ]
17 Correa M.Y., Niño J., Mosquera M.O. 2006. Cuantificación de taxol y baccatin III en callos de T. baccata por cromatografía liquida de alta eficiencia (HPLC). Scientia Et Technica. 12 (32): 431-435. [ Links ]
18 Cragg G.M., Schepartz S.A., Suffness M., Grever M.R. 1993. The taxol supply crisis. New NCI policies for handing the large scale production of novel natural product anticancer and anti-HIV agents. Journal of Natural Products. 56: 1657-1759. [ Links ]
19 Cusido R.M., Palazon J. Bonfill M., Expósito O., Moyano E., Piñol M.T. 2007. Source of isopentenyl diphosphate for taxol and baccatin III biosynthesis in cell cultures of Taxus baccata. Biochemical Engineering Journal. 33: 159-167. [ Links ]
20 Chau M., Croteau R. 2004a. Molecular cloning and characterization of a cytochrome P450 taxoid 2a-hydroxylase involved in Taxol biosynthesis. Archives of Biochemistry and Biophysics. 427: 48-57. [ Links ]
21 Chau M., Jennewein S., Walker K., Croteau R. 2004b. Taxol biosynthesis: molecular cloning and characterization of a cytochrome P450 taxoid 7B-hydroxylase. Chemistry & Biology. 11: 663-672. [ Links ]
22 Edahiro J.I., Ski M. 2006. Pheylpropanoid metabolite supports cell agregate formation in strawberry cell suspension culture. Journal of Bioscience and Bioengineering. 102 (1): 8-13. [ Links ]
23 Eisenreich W., Menhard B., Lee M.S., Zenk M.H., Bacher A.J. 1998. Multiple oxigenase reactions in the biosynthesis of taxoids. Journal of the American Chemical Society. 120: 9694-9695. [ Links ]
24 Fu Y.J., Sun R., Zu Y.G., L. I.S.M., Liu W., Efferth T., Gu Ch. B., Zhang L., Luo H. 2008. Simultaneous determination of main taxoids in Taxus needles extracts by solid-phase extraction-high-performance liquid chromatography with pentafluorophenyl column. Biomedical Chromatography. 23: 63-70. [ Links ]
25 Gibson, D.M., Ketchum, R.E.B., Hirasuna, T.J., Shuler, M.L. 1995. Potential of plant cell culture for taxane production. In. Suffness M. (ed). Taxol science and applications CRC Press. pp. 71-95. [ Links ]
26 Gibson D.M., Ketchum, R.E.B., Vance N.C., Christen A.A. 1993. Initiation and growth of cell lines of Taxus brevifolia (Pacific yew). Plant Cell Reports. 12: 479-482. [ Links ]
27 Jha S., Sanyal D., Ghosh B., Jha., T.B. 1998. Improved taxol yield in cell suspensión cultura of Taxus wallichiana (Himalayan yew). Planta Medica. 64: 270-272. [ Links ]
28 Jin H., Gong Y., Guo B., Qiu C., Liu D., Miao Z., Sun X., Tang K. 2006. Isolation and characterization of a 2C-Methyl-D-Erythritol 2,4-Cyclodiphosphate Synthase gene from Taxus media. Molecular Biology. 40 (6): 914-921. [ Links ]
29 Jong M.W., Sam YB., Kim D., Yo B.S. 1998. Elicitation kinetics of taxane production in suspension cultures of Taxus baccata Pendula. Biotechnology Techniques. 12 (1): 79-81. [ Links ]
30 Hansen R.C., Cochran K.D., Keener H.M., Croom E.M. 1994. Taxus populations and clippings yields at commercial nurseries. Journal of Environmental Horticulture. 15 (4): 200-205. [ Links ]
31 Hara T., Arita T., Tachibana S., Itoh K. 2008. Paclitaxel production by immobilized cell suspension cultures of Taxus cuspidata var. nana. Biotechnology. 7 (3): 557-562. [ Links ]
32 Hezari M., Lewis N.G., Croteau R. 1995. Purification and characterization of taxa-4(5),11(12)-diene synthase from pacific yew (Taxus brevifolia) that catalyzes the first committed step of taxol biosynthesis. Archives of Biochemistry and Biophysics. 322 (2): 437-444. [ Links ]
33 Holmes F.A., Walters R.S., Theriault R.L., Buzdar A.U., Frye D.K., Hortobagyi G.N., Forman A.D., Newton L.K. y Raber M.N. 1991. Phase II trial of taxol, an active drug in the treatment of metastatic breast cancer. Journal of the National Cancer Institute. 83 (24): 1797-1805. [ Links ]
34 Hung Sh.H., Yu Ch.W., Lin Ch.H. 2005. Hydrogen peroxide functions as a stress signal in plants. Bot Bull. Acad. Sin. 46: 1-10. [ Links ]
35 Jennewein S., Long R.M., Williams R.M., Croteau R. 2004. Cytochrome p450 taxadiene 5alpha-hydroxylase, a mechanistically unusual monooxygenase catalyzing the first oxygenation step of taxol biosynthesis. Chemistry & Biology. 11 (3): 379-387. [ Links ]
36 Jennewein S., Rithner C.D., Williams R.M., Croteau R.B. 2001. Taxol biosynthesis taxane 13 alpha-hydroxylase is a cytochrome p450-dependent monoxygenase. Proceedings of the National Academy of Sciences of the United States of America. 98 (24): 13595-13600. [ Links ]
37 Kaspera R., Croteau R. 2006. Cytochrome P450 oxygenases of taxol biosynthesis. Phytochemistry Reviews. 5 (3): 433-444. [ Links ]
38 Ketchum R.E.B., Gibson D.M., Croteau R.B., Shuler M.L. 1999. The kinetics of taxoid accumulation in cell suspension cultures of Taxus following elicitation with methyl jasmonate. Biotechnology & Bioengineering. 62: 97-105. [ Links ]
39 Khosroushahi, A.Y., Valizadeh, M., Ghasempour, A., Khosrowshahli, M., Kim, B. J., Gibson, D. M., y Shuler, M. L. 2006. Improved Taxol production by combination of inducing factors in suspension cell culture of Taxus baccata. Cell Biology International. 30: 262-269. [ Links ]
40 Kim, B.J., Gibson, D.M., y Shuler, M.L. 2006. Effect of the plant peptide regulator, phytosulfokine-alpha, on the growth and taxol production from Taxus sp. suspension cultures. Biotechnology and Bioengineering. 95: 8-14. [ Links ]
41 Kim J.H., Yun J.H., Hwang Y.S., Byun S.Y., Kim D.I. 1995. Production of taxol and related taxanes in Taxus brevifolia cell cultures: effect of sugar. Biotechnology Letters. 17: 101-106. [ Links ]
42 Kim, S.I., Choi, H.K., Kim, J.H., Lee, H.S., y Hong, S.S. 2001. Effect of osmotic pressure on paclitaxel production in suspension cell cultures of Taxus chinensis. Enzyme and Microbial Technology. 28: 202-209. [ Links ]
43 Kuzuyama T., Seto H. 2003. Diversity of the biosynthesis of the isoprene units. Natural Product Reports. 20: 171-183. [ Links ]
44 Lucas H. 1856. Ueber in den blattern von Taxus baccata L. enthaltenes alkaloid (das taxin). Archiv der Pharmazie. 85: 145-149. [ Links ]
45 Malik, S., Cusido R.M., Mirjalili M.H., Moyano E., Palazon J., Bonfill M. 2011. Production of the anticancer drug taxol in Taxus baccata suspension cultures: a review. Process Biochemistry. 46: 23-34. [ Links ]
46 McDonald, K. J. y S. Hurst. 2001. Characterization of plant suspension cultures using the focused beam reflectance technique. Biotechnology letters. 23: 317-324. [ Links ]
47 McGuire W.P., Rowinsky E.K., Rosenshein N.B., Grumbine F.C., Ettinger D.S., Armstrong D.K. 1989. Taxol: a unique antineoplastic agent significant activity in advanced ovarian epithelial neoplasmas. Annals of Internal Medicine. 111: 273-279. [ Links ]
48 Maheshwari P., Garg S. y Kumar A. 2008. Taxoids: Biosynthesis and in vitro production. Biotechnology and Molecular Biology Reviews. 3 (4): 71-87. [ Links ]
49 Michaud L.B., Valero V., Hortobagyi G. 2000. Risks and benefits of taxanes in breast and ovarian cancer. Drug safety. 23: 401-428. [ Links ]
50 Mirjalili N., Linden J.C. 1995. Gas phase composition effects on suspension cultures of Taxus cuspidata. Biotechnology and Bioengineering. 48: 123-132. [ Links ]
51 Mulabagal V., y Tsay H.S. 2004. Plant Cell Cultures-an alternative and efficient source for the production of biologically important secondary metabolites. International Journal of Applied Science and Engineering. 2: 29-48. [ Links ]
52 Murphy A. C. 2011. Metabolomic engineering is key to a sustainable chemical industry. Natural Products Reports. 28: 1406-1425. [ Links ]
53 Nail C.M., Roberts C.S. 2005. Culture of isolated singe cells from Taxus suspensions for the propagation of superior cell populations. Biotechnology Letters. 27: 1725-1730. [ Links ]
54 Nguyen T., Eshraghi J., Gonyea G., Ream R., & Smith R. 2001. Studies on factors influencing stability and recovery of paclitaxel from suspension media and cultures of Taxus cuspidate cv densiformis by high-performance liquid chromatography. Journal of Chromatography A. 911: 55-61. [ Links ]
55 Parkin D.M., Bray F., Ferlay J., Pisani P. 2005. Global cancer statistics 2002. Cancer Journal for Clinicians. 55: 74-108. [ Links ]
56 Phisalaphong M., Linden J. 1999. Kinetics studies of paclitaxel production by Taxus canadensis cultures in batch and semicontinuous with total cell recycle. Biotechnology Progress. 15: 1072-1077. [ Links ]
57 Ramos L.N.A., Soto H.M., Zavala Ch.F., Rodríguez G. M.T. 2003. Taxoides en el follaje del tejo mexicano (Taxus globosa Schlecht.). Revista Chapingo Serie Horticultura. 9 (1): 29-38. pp. 29-38. [ Links ]
58 Roberts S.C., Nail M., Gibson D.M., Shuler M.L. 2003. A simple method for enhancing paclitaxel release from Taxus canadensis cell suspension cultures utilizing cell wall digesting enzymes. Plant Cell Reports. 21 (12): 1217-1220. [ Links ]
59 Sadava, P.D. 2009. Vida, la Ciencia de la Biología. Editorial Médica Panamericana. 1251 p. [ Links ]
60 Schiff P.B., Fant J., Horwitz S.B. 1979. Promotion of microtubule assembly in vitro by taxol. Nature. 277: 665-667. [ Links ]
61 Schoendorf A., Rithner C.D., Williams R.M., Croteau R.B. 2001. Molecular cloning of a cytochrome P450 taxane 10 beta hydroxylase cDNA from Taxus and functional expression in yeast. Proceedings of the National Academy of Sciences. 98 (4): 1501-1506. [ Links ]
62 Seki M., Ohzora C., Takeka M., Furusaki S. 1997. Taxol (paclitaxel) production using free and immobilized cells of Taxus cuspidata. Biotechnology & Bioengineering. 53: 214-219. [ Links ]
63 Skrlep K., Bergant M., De Winter G.M., Bohanec B., Zel J., Verpoorte R., Van Iren F., Camloh M. 2008. Cryopreservation of cell suspensión cultures of Taxus x media and Taxus floridana. Biologia Plantarum. 52 (2): 329-333. [ Links ]
64 Song J.L., Dumais M.R. 1991. From yew to us: the curious develop-ment of taxol. The Journal of the American Medical Association. 266 (9): 1281. [ Links ]
65 Soto J., Sainz C., Cos S., González-Lamuño D. 2005. Estudio in vitro de terapia combinada con bajas dosis de radiación (Rn-222) y quimioterapia (taxol). Radiobiología. 5: 100-103. [ Links ]
66 Soto M., Sanjurjo M., González M., Cruz D., Giral F. 2000. El tejo mexicano (Taxus globosa Sch.). Potencial de su aprovechamiento en taxol. Ciencia Ergo Sum. 7: 277-279. [ Links ]
67 Tanaka K., Li F., Morikawa K., Nobukawa T., Kadota S. 2011. Analysis of biosynthetic fluctuations of cultured Taxus seedlings using a metabolomic approach. Phytochemistry. 72 (14-15): 1760-1766. [ Links ]
68 Van Rozendaal L.M.E., Lelyveld G.P., van Beck T.A. 2000. Screening of the needles of different yew species and cultivars for paclitaxel and related taxoids. Phytochemistry. 53: 383-389. [ Links ]
69 Vongpaseuth K., Roberts S.C. 2007. Advancements in the understanding of paclitaxel metabolism in tissue culture. Current Pharmaceutical Biotechnology. 8: 219-236. [ Links ]
70 Wakefield L., Hunter K. W. 2007. Metastasis. IOS Press. 162 p. [ Links ]
71 Walker K., Croteau R. 2001. Taxol biosynthetic genes. Phytochemistry. 58: 1-7. [ Links ]
72 Walker K., Croteau R. 2000a. Molecular cloning of a 10-deacetylbaccatin III-10-O-acetyl transferase cDNA from Taxus and functional expression in Escherichia coli. Proceedings of the National Academy of Sciences. 97: 583-587. [ Links ]
73 Walker K., Croteau R. 2000b. Taxol biosynthesis: molecular cloning of a benzoyl-CoA: taxane 2alpha-O-benzoyl-transferase cDNA from Taxus and functional expression in Escherichia coli. Proceedings of the National Academy of Sciences. 97: 13591-13596. [ Links ]
74 Walker K.D., Klettke K., Akiyama T., Croteau R. 2004. Cloning, heterologous expression, and characterization of a phenylalanine aminomutase involved in taxol biosynthesis. Journal of Biological Chemistry. 279: 53947-53954. [ Links ]
75 Walker K., Schoendorf A., Croteau R. 2000. Molecular cloning of a taxa-4(20), 11(12)-dien-5alpha-ol-O-acetyl transferase cDNA from Taxus and functional expression in Escherichia coli. Archives of Biochemistry and Biophysics. 374: 371-380. [ Links ]
76 Wani M.C., Taylor H.L., Wall M.E., Coggon P., McPhail A.T. 1971. Plant antitumor agents. VI. The isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia. Journal of the American Chemical Society. 93: 2325-2327. [ Links ]
77 Wildung M.R., Croteau R.A. 1996. DNA clone for taxadiene synthase, the diterpene cyclase that catalyzes the committed step of taxol biosynthesis. The Journal of Biological Chemistry. 271: 9201-9204. [ Links ]
78 Xiao H., Verdier P.P., Fernández F.N., Burd B., Angeletti R., Fiser A., Band H.S., Orr G.A. 2006. Insights into the mechanism of microtubule stabilization by taxol. Proceedings of the National Academy of Sciences. 103 (27): 10166-10173. [ Links ]
79 Xu Q., Cheng J., Ge Z., Yuan Y. 2005. Abnormal mitosis versus apoptosis of Taxus cuspidata induced by oleic acid in two-liquid-phase suspensión cultures. Enzyme and Microbial Technology. 37: 76-81. [ Links ]
80 Yu L.J., Lan W.Z., Chen C., Yang Y., Sun Y.P. 2005. Importance of glucose-6-phosphate dehydrogenase in taxol biosynthesis in Taxus chinensis cultures. Biologia Plantarum. 49 (2): 265-268. [ Links ]
81 Zu Y., Fu Y., Li S., Sun R., Li Q., Schwarz G. 2006. Rapid separation of four main taxoids in Taxus species by a combined LLP-SPE-HPLC (DAD) procedure. Journal of Separation Science. 29: 1237-1244. [ Links ]