Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.1 Bogotá jan./jun. 2014
https://doi.org/10.15446/rev.colomb.biote.v16n1.44225
http://dx.doi.org/10.15446/rev.colomb.biote.v16n1.44225
ARTÍCULO DE INVESTIGACIÓN
Estimulación de cardenólidos en brotes de Digitalis purpurea L. cultivados in vitro mediante elicitores
Stimulation of cardenolides production in Digitalis purpurea L. shoot cultures by elicitors addition
Título corto: Elicitores en la producción de cardenólidos
Naivy Lisbet Pérez-Alonso1,a, Franklyn Arana Labrada2,b, Alina Capote Pérez1,b, Anabel Pérez Pérez1,c, Rafael Sosa3,b, Angel Mollineda4,c y Elio Jiménez González5,a.
1 Instituto de Biotecnología de las Plantas, Universidad Central ''Marta Abreu'' de Las Villas, Carretera a Camajuaní km 5,5, 54830 Santa Clara, Villa Clara, Cuba. E-mail: naivy@ibp.co.cu; alina@ibp.co.cu; anabel@ibp.co.cu
2 Universidad de las Tunas "Vladimir Ilich Lenin", Ave. Carlos J. Finlay s/n, Reparto Buenavista 75200 Israel Santos, Las Tunas, Cuba. E-mail: franklynal@ult.edu.cu
3 Centro de Bioactivos Químicos, Universidad Central ''Marta Abreu'' de Las Villas, Carretera a Camajuaní km 5,5, 54830 Santa Clara, Villa Clara, Cuba
4 Centro de Investigaciones Agropecuarias, Universidad Central ''Marta Abreu'' de Las Villas, Carretera a Camajuaní km 5,5, 54830 Santa Clara, Villa Clara, Cuba.
5 University of Florida, Tropical Research & Education Center Institute of Food & Agricultural Sciences. 18905 SW 280th Street Homestead, FL 33031. E-mail: eliojimenez@ufl.edu
a Doctor en Ciencias Agrícolas
b Master en Biotecnología vegetal
c Técnico especialista
Recibido: octubre 24 de 2013 Aprobado: abril 15 de 2014
Resumen
Digitalis purpurea L. es una de las principales fuentes de cardenólidos tales como digoxina y digitoxina. Estos fármacos son ampliamente usados en la disfunción cardíaca y para regular las arritmias del corazón. El presente trabajo se realizó con el objetivo de estudiar el efecto de tres elicitores en el cultivo de brotes de Digitalis purpurea var. Roter Berggold para incrementar la producción in vitro de cardenólidos. La elicitación es una estrategia para incrementar la producción de biomasa y metabolitos secundarios en el cultivo in vitro. Los elicitores evaluados fueron ChitoPlant (0,001; 0,01; 0,1 g.L-1); SilioPlant (0,01; 0,1; 1,0 g.L-1) y Jasmonato de metilo (60, 80 y 100 µM), descritos por primera vez para el incremento de cardenólidos. Se demostró que la elicitación es una estrategia viable para el incremento de cardenólidos en brotes de D. purpurea. El ChitoPlant®, redujo la altura sin afectación en el resto de las variables morfológicas evaluadas. Además indujo un incremento significativo en el contenido de cardenólidos. El SilioPlant® (0,01 g.L-1) no provocó afectaciones en la biomasa e incrementó significativamente la síntesis de cardenólidos en los brotes en 3,6 y 6,9 veces el contenido de digoxina y digitoxina respectivamente. La elicitación con el jasmonato de metilo provocó una reducción de la biomasa. Los contenidos de digoxina y digitoxina se incrementaron ligera y significativamente con 80 y 100 µM de jasmonato de metilo respectivamente. El mejor resultado integral se obtuvo con 0,01 g.L-1 de SilioPlant, el cual indujo la mayor producción neta de cardenólidos por frasco de cultivo (4,72 µg digoxina y 88,27 µg digitoxina).
Palabras clave: chitoplant, digitoxina, digoxina, jasmonato de metilo, silioplant
Abstract
Digitalis purpurea L. is one of the main sources of cardenolides such as digitoxin and digoxin. These drugs are widely used to strengthen cardiac diffusion and to regulate heart rhythm. The aim of this study was to evaluate the influence of three elicitors on shoots of Digitalis purpurea var. Roter Berggold in semisolid media in order to increase cardenolides biosynthesis. Elicitation is a strategy to increase biomass and secondary metabolites production on in vitro cultures. The elicitors evaluated were ChitoPlant (0,001; 0,01; 0,1 g.L-1); SilioPlant (0,01; 0,1; 1,0 g.L-1) and Methyl jasmonate (60, 80, 100 µM), which are reported here to induce cardenolide production for first time. Elicitation resulted an effective strategy to increase cardenolide production on D. purpurea shoot cultures. ChitoPlant induced a decrease in shoots length, but had no effect on the rest of morphological parameters evaluated. As well, ChitoPlant increased cardenolide content. SilioPlant (0,01 g.L-1) did not affect biomass production and at the same time, increased in 3,6-fold and 6,9-fold digoxin and digitoxin content respectively. Elicitation with Methyl jasmonate resulted in decreased biomass production. Digoxin and digitoxin content was slight and significantly increased by Methyl jasmonate 80 and 100 µM respectively. The best integral result was reached with 0,01 g.L-1 of SilioPlant, which induced the highest net yields per culture flask (4,72 µg of digoxin and 88,27 µg of digitoxin).
Key words: chitoplant, digitoxin, digoxin, methyl jasmonate, silioplant
Abreviaturas
6-BAP 6-Bencilaminopurina
ACN Acetonitrilo
AIA Ácido indol-3-acético
ChP ChitoPlant®
gMF Gramos de masa fresca
gMS Gramos de masa seca
HPLC Cromatografía Líquida Alta Resolución (del inglés High-Performance Liquid Chromatography)
MJ Jasmonato de metilo
MS Sales inorgánicas propuestas por Murashige y Skoog (1962)
SiP SilioPlant®
Introducción
Las plantas son consideradas una fuente valiosa para la producción de compuestos de interés farmacéutico (Fischer et al., 2007). Entre ellas se destacan las pertenecientes al género Digitalis, siendo Digitalis purpurea L. una de las dos únicas especies de interés económico de dicho género como fuente de cardenólidos (Sales et al., 2011). Estos compuestos muestran propiedades farmacodinámicas similares pero la digitoxina y la digoxina son los más relevantes para la industria farmacéutica (Hornberger et al., 2000). En medicina, estos compuestos son fármacos valiosos en el tratamiento de la insuficiencia cardíaca (Piñol et al., 2008), pero en los últimos años se han descrito también sus efectos en el control del cáncer de riñón, de próstata y leucemia (Lewis, 2009).
El cultivo de plantas es hasta el momento la única fuente comercial para la producción de cardenólidos (Kuate et al., 2008), pues la síntesis química de estos compuestos no es económicamente viable.
La variación de las condiciones ambientales que ocurre durante el crecimiento de las plantas en el campo, provoca la fluctuación y heterogeneidad de las sustancias activas y su concentración en los extractos obtenidos a partir de ellas (Roca-Pérez et al., 2004). Por las razones anteriormente expuestas, es prioritario el desarrollo de estrategias biotecnológicas, específicamente el cultivo de tejidos, para la producción de estos compuestos activos (Vanisree y Tsay, 2007).
En consecuencia, varios métodos de cultivo in vitro de Digitalis spp. han sido descritos en la literatura científica. Tal es el caso del cultivo de suspensiones celulares (Kreis et al., 1986), cultivos embriogénicos (Lindemann y Luckner, 1997), cultivo de raíces (Yoshimatzu et al., 1990) y cultivo de brotes (Erdei et al., 1981; Hagimori et al., 1983). Además, el cultivo in vitro ha brindado una excelente oportunidad para el desarrollo de investigaciones bioquímicas encaminadas al conocimiento de las rutas que rigen la biosíntesis de los cardenólidos (Gavidia et al., 2007).
No obstante, los bajos rendimientos de cardenólidos obtenidos en estas investigaciones han impedido su aplicación a escala comercial. En este sentido han sido ensayadas diversas alternativas con el objetivo de incrementar la producción de cardenólidos en el género Digitalis, tales como cambios en la composición nutricional de los medios de cultivo, la biotransformación, la adición de precursores y la modificación genética (Hagimori et al., 1983; Saito et al., 1990; Gurel et al., 2010).
En el caso específico de D. purpurea, por su importancia en la industria farmacéutica, existe una demanda creciente de tecnologías de producción alternativas al cultivo en condiciones naturales. El cultivo in vitro de células y tejidos permitiría contar con sistemas de producción definidos, en condiciones controladas, así como obtener rendimientos constantes del metabolito de interés (Paek et al., 2005; Vanisree y Tsay, 2007).
El empleo de elicitores bióticos y abióticos constituye una estrategia para estimular la síntesis de metabolitos secundarios de plantas cultivadas in vitro (Zhang y Memelink, 2009). La elicitación se ha descrito, mayormente, en el cultivo de suspensiones celulares, en cambio existen muy pocos ejemplos de su aplicación en brotes cultivados in vitro (Liu et al., 2007; Orlita et al., 2008; Coste et al., 2011).
Hasta el momento, en la literatura consultada sólo existen dos precedentes del empleo de elicitores, ambas en Digitalis lanata Erhn (Ghanem et al., 2010; Pérez-Alonso et al., 2012). En su investigación, Ghanem et al. (2010) compararon el efecto de la adición de ácido salicílico, extracto de levadura y cloruro de calcio en brotes de Digitalis lanata Ehrh. propagados en medio de cultivo semisólido, obteniendo los mayores contenidos de cardenólidos con 200 mM de cloruro de calcio. Por su parte, en previas investigaciones, Pérez-Alonso et al. (2012) describieron el efecto de la adición de elicitores en brotes cultivados en SIT. El ChitoPlant® a la vez que favoreció la producción de masa fresca y seca por SIT, provocó un incremento en 3,2 veces el contenido de lanatósido C, principal cardenólido de esta especie, respecto al control sin elicitar. Además, se estableció una correlación (r=0,893; p<0,01) entre marcadores de estrés oxidativo y el contenido de cardenólidos.
Teniendo en cuenta estos antecedentes se estudió el efecto de la adición de elicitores bióticos y abióticos sobre el contenido de cardenólidos y la respuesta morfológica en brotes de D. purpurea. Hasta el momento, no existen precedentes del efecto de los elicitores en estudio en D. purpurea.
Materiales y métodos
En esta investigación se utilizó como material vegetal plantas in vitro obtenidas a partir de semillas de Digitalis purpurea L. var. Roter Berggold. Las semillas fueron adquiridas en la empresa Pharmasaat GmbH (Alemania). Estas fueron desinfectadas según el protocolo propuesto por Erdei et al. (1981). Las mismas fueron colocadas para su germinación en cámara de crecimiento con un fotoperíodo de 16 h con lámparas fluorescentes de luz blanca, con una intensidad de flujo de fotones fotosintéticos de 40 µmol.m-2.s-1 a 27±2 ºC de temperatura.
Se empleó el medio de cultivo compuesto por las sales MS (Murashige y Skoog, 1962) suplementadas con 1,0 mg.L-1 de tiamina y 30 g.L-1 de sacarosa. Se utilizaron frascos de policarbamato de 500 mL de capacidad a los cuales se añadieron 50 mL de medio de cultivo. Las plántulas obtenidas crecieron hasta alcanzar una altura aproximada de 4,0 cm. Las hojas y raíces de estas fueron cortadas. Los brotes con una altura aproximada de 2,0 cm y en segundo subcultivo fueron transferidos a un medio de cultivo propuesto por Erdei et al. (1981) modificado compuesto por sales MS (100%) suplementado con 1,0 mg.L-1 de tiamina; 100 mg.L-1 de mio-inositol; 1,0 mg.L-1 de 6-bencilaminopurina (6-BAP); 0,1 mg.L-1 de ácido indol-3-acético (AIA) y 30 g.L-1 de sacarosa. Se utilizaron 40 explantes por tratamiento.
Se ensayaron tres elicitores: jasmonato de metilo (MJ) (Duchefa NV, Holanda) (60, 80 y 100 µM); ChitoPlant® (ChP®) (Quitosana, Chipro GmbH, Bremen, Alemania) ((0,001; 0,01; 0,1 g.L-1) y SilioPlant® (SiP®) (dióxido de silicio al 35% (p/v), Chipro GmbH, Bremen, Alemania) (0,01; 0,1; 1,0 g.L-1).Los mismos fueron añadidos al medio de cultivo referido anteriormente. El ChP® y el SiP® fueron añadidos previo a la esterilización. Para el MJ se preparó una solución en etanol a 100 mM y se esterilizó por filtración con una membrana de filtración ANALIPORE® (OSI) de celulosa estéril, con una porosidad de 0,22 µm.
Los brotes se cultivaron en cámara de crecimiento con un fotoperiodo de 16 h con lámparas fluorescentes de luz blanca, con una intensidad de flujo de fotones fotosintéticos de 40 µmol.m-2.s-1 y ocho horas de oscuridad, a 27±2 ºC de temperatura.
A los 28 días de cultivo se realizaron las evaluaciones morfológicas referentes a la altura, número de brotes por explante, masa fresca y masa seca por frasco utilizado. Se cuantificaron los contenidos de digoxina y digitoxina. Se calculó la producción neta de cardenólidos (µg de cardenólidos por frasco de cultivo) teniendo en cuenta la masa seca obtenida por frasco de cultivo.
El protocolo de extracción que se empleó para la determinación de cardenólidos fue el propuesto por Wichtl et al. (1982) con las modificaciones descritas por Pérez-Alonso et al. (2009). La detección de cardenólidos se realizó mediante cromatografía líquida de alta resolución (HPLC, Agilent 1100) equipado con un detector de arreglo de diodos y una columna Inertsil ODS-3 (150x4,6 mm, 5µm). Se inyectaron 10 µl de la solución final. Como solvente fue utilizado una mezcla de acetonitrilo (ACN)/agua (25:75) con un flujo de 1.5 ml.min-1. El gradiente varió de la siguiente forma: inicio (25% ACN), 4 min (25% ACN), 34 min (37% ACN), 45 min (50% ACN), a partir de 60 min (25% ACN) hasta 65 min que termina el análisis. Todas las determinaciones fueron realizadas a una temperatura de 40 ºC. Los cardenólidos fueron detectados a una longitud de onda de 220 nm. La digitoxina y la digoxina fueron identificados según el tiempo de retención y comparados con los estándares obtenidos de una fuente comercial (SIGMA).
Para el análisis estadístico se utilizó el programa SPSS ver. 18,0, para el sistema operativo Windows. Para la elaboración de ficheros de datos y gráficos se utilizó el programa EXCEL del paquete Microsoft Office 2007. Para comprobar los supuestos de normalidad se aplicaron las pruebas de Kolmogorov-Smirnov para muestras grandes, de Shapiro-Wilk para muestras pequeñas y de Levene para determinar la homogeneidad de varianza. Se aplicaron análisis no paramétricos en todos los datos puesto que no cumplieron los supuestos de normalidad y homogeneidad de la varianza. Se realizó la prueba de Kruskal-Wallis para p<0,05 de significación y las diferencias estadísticas entre los tratamientos fueron determinadas mediante la prueba de Mann Whitney con la penalización de Bonferroni.
Resultados y discusión
A partir de los resultados obtenidos se determinó que la elicitación es una estrategia que influyó en la producción de biomasa y en el contenido de cardenólidos. La adición de elicitores al medio de cultivo de multiplicación, en dependencia de la concentración aplicada, provocó cambios en el crecimiento y el desarrollo de los brotes de D. purpurea. Por su parte, los análisis por HPLC del contenido de cardenólidos revelaron la presencia de compuestos bioactivos en brotes de D. purpurea cultivados en medio de cultivo semisólido. Los elicitores indujeron cambios significativos en la síntesis de cardenólidos con respecto al cultivo sin elicitar, los cuales se describen a continuación.
ChitoPlant®
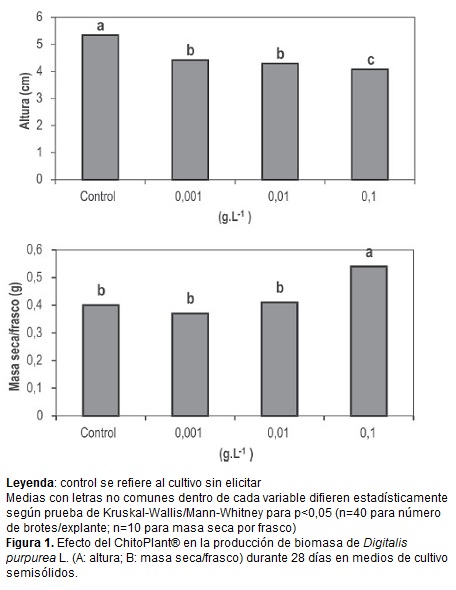
La adición de ChitoPlant® en las concentraciones evaluadas produjo una disminución significativa en la altura de los brotes con respecto al tratamiento control sin elicitar (figura 1A). Sin embargo, no se observaron diferencias significativas en el número de brotes por explante ni en la masa fresca por frasco respecto al control ni entre las concentraciones ensayadas para cada elicitor. Contradictoriamente, se observó en la variable masa seca un incremento significativo al emplearse la mayor concentración de ChP (0,1 g.L-1) (figura 1B). Esto pudo deberse al incremento de lignina y fenoles que provoca la quitosana según Vasconsuelo y Boland (2007).
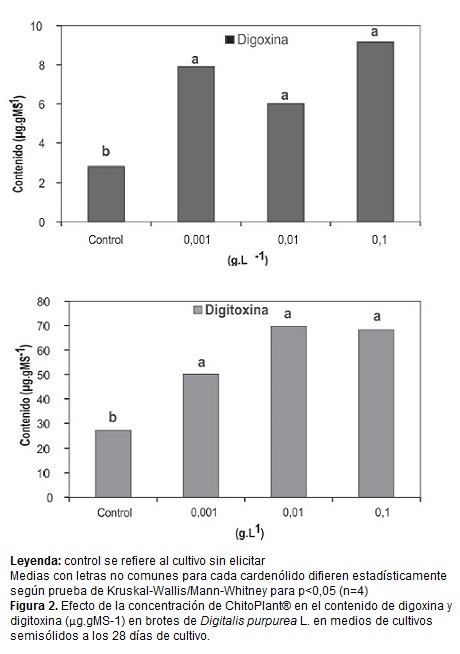
La adición de ChP en cualquiera de las tres concentraciones ensayadas incrementó los contenidos de digoxina y de digitoxina con respecto al control sin elicitar (figura 2). Sin embargo, entre las concentraciones de ChP evaluadas no se observaron diferencias significativas para los contenidos de digoxina ni digitoxina.
Medias con letras no comunes para cada cardenólido difieren estadísticamente según prueba de Kruskal-Wallis/Mann-Whitney para p<0,05 (n=4)
El ChP contiene como ingrediente activo la quitosana, un derivado de la quitina, componente que se encuentra en la pared celular de hongos, en insectos y crustáceos (Mathew y Sankar, 2012). La quitosana activa mecanismos de defensa en las plantas estrechamente relacionados con la inducción de resistencia sistémica al ataque de microorganismos (Agrawal et al., 2002). Sin embargo, su efecto en la inducción de metabolitos secundarios no ha sido ampliamente investigado, lo que dificulta la comparación de resultados en otras especies. En el cultivo de órganos, pocos resultados muestran el efecto del ChP en la producción de biomasa y síntesis de metabolitos secundarios. En el género Digitalis solo un estudio previo en D. lanata (Pérez-Alonso et al., 2012) muestra el efecto del ChP para la producción de biomasa y cardenólidos y se obtuvo un incremento significativo en lanatósido C (316 µg.gMs-1).
Los oligosacáridos como el ChP, han sido descritos como potentes moléculas señales que regulan el crecimiento y desarrollo de las plantas (Sudha y Ravishankar, 2002). Ait Barka et al. (2004) describieron que una concentración de 1,75% (v/v) en el medio de cultivo induce un incremento en el desarrollo de los explantes en Vitis vinífera L., pero una concentración de 2,0% (v/v) tuvo un efecto negativo en el cultivo. De manera similar, Kim et al. (2005) observaron un incremento en la altura y la masa fresca de plantas de Ocimum basilicum L. (17 y 12% respectivamente) así como en el contenido de fenoles y terpenos con concentraciones de quitosana hasta 1,0 g.L-1. Estos resultados muestran que la quitosana provocó un incremento en la biosíntesis de los isoprenoides, aspecto que aplicado a los resultados del presente trabajo, corrobora el aumento del contenido de los cardenólidos ante el ChP como respuesta de defensa de la planta.
SilioPlant®
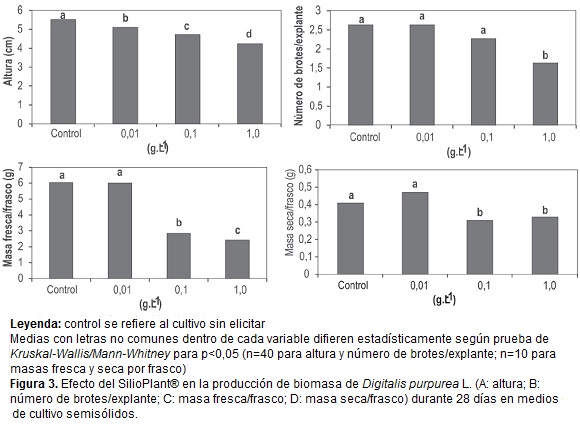
El aumento de las concentraciones de SilioPlant® afectó el desarrollo de los brotes. El tratamiento donde se empleó la menor concentración del SiP mostró un comportamiento similar al control en las variables evaluadas, excepto para la altura que disminuyó con el incremento de las concentraciones ensayadas (figura 3A). En cuanto al número de brotes por explante, la mayor concentración del SiP provocó una disminución con respecto a los tratamientos evaluados y fue la única que mostró diferencias significativas (figura 3B). Para las variables masa fresca (figura 3C) y masa seca por frasco (figura 3D) se observó un detrimento en las concentraciones de 0,1 y 1,0 g.L-1.
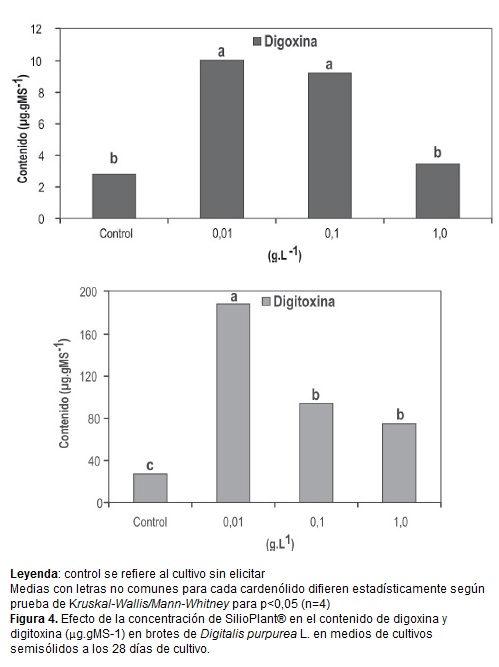
El SiP indujo un incremento en el contenido de digoxina y digitoxina excepto en la mayor concentración (1,0 g.L-1) que provocó una disminución en el contenido de digoxina sin diferencias significativas respecto al control sin elicitor (figura 4).
Los mayores valores de digoxina (10,0 µg.gMs-1) y digitoxina (187,8 µg.gMs-1) se alcanzaron en el tratamiento con 0,01 g.L-1 de SiP, lo que corresponde a incrementos de 3,6 y 6,9 veces en el contenido de digoxina y digitoxina respectivamente, en comparación con el control. Resultados similares fueron observados por Pérez-Alonso et al. (2012) quienes alcanzaron un incremento de 2,2 veces el contenido de lanatósido C respecto al control con 0,01 g.L-1 de SiP.
Es de destacar, que a pesar de que todos los tratamientos con SiP incrementaron el contenido de digitoxina en los brotes respecto al control, se observó una disminución de su contenido con concentraciones mayores que 0,01 g.L-1.
Existen pocos antecedentes sobre la utilización de este elicitor en el cultivo in vitro, aunque el efecto beneficioso del silicio en la nutrición en plantas ha sido estudiado en condiciones naturales (Epstein, 2001). El silicio es un elemento bioactivo con un efecto positivo en el crecimiento de las plantas, mejora las propiedades mecánicas de los tejidos, reduce la transpiración y además incrementa la resistencia de las plantas frente a organismos patógenos (Fauteux et al., 2005; Hammerschmidt, 2011). Sin embargo, ninguna de las concentraciones ensayadas provocó una mayor producción de biomasa que en el control sin elicitar.
En la actualidad se desconoce la naturaleza exacta de la interacción del silicio con las rutas bioquímicas relacionadas con la resistencia en plantas y por consiguiente en la acumulación de metabolitos secundarios asociados a esta. Al respecto, Fauteux et al. (2005) encontró que el silicio actúa en mecanismos comunes para todas las especies de plantas así como en aquellos relacionados con la expresión de genes. Bonilla (2008) refiere que el óxido de silicio se acumula en la pared celular e incrementa su impermeabilidad y resistencia al ataque de patógenos, no solo por constituir una barrera física, sino también por configurar compuestos silico-orgánicos que son muy estables frente a las enzimas de los patógenos.
El efecto positivo del SiP sugiere que este elicitor puede estar asociado con la acumulación de metabolitos secundarios relacionados con los mecanismos de defensa en plantas como los cardenólidos. Sin embargo, no existen ejemplos alentadores que contribuyan a dilucidar su acción en el incremento de cardenólidos.
Jasmonato de metilo
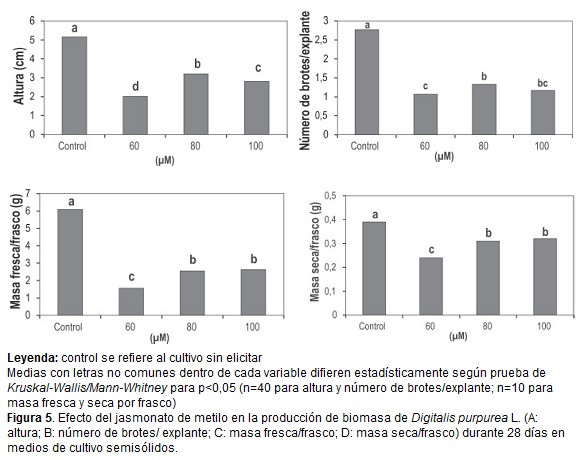
El jasmonato de metilo provocó un efecto negativo en todas las variables evaluadas independientemente de las concentraciones estudiadas con diferencias significativas respecto al control (figura 5). Al respecto, Howe (2004) afirma que uno de los efectos más notables de los jasmonatos exógenos es la inhibición del crecimiento y Crozier et al. (2000) lo describen como un retardador del crecimiento en diversas especies.
Además, en los primeros días de cultivo en los tratamientos con MJ los ápices de los brotes tenían una coloración violeta rojo pálido y a los 28 días las hojas mostraban una coloración verde pálido similar al color de plantas con clorosis. Siguiendo a Zacarías y Lafuente (2008), esto podría atribuirse a que la aplicación del MJ provoca una disminución en la expresión de los genes involucrados en la fotosíntesis y una reducción en el contenido de clorofila en las hojas de las plantas.
Los metabolismos primario y secundario comparten rutas y precursores, en los cuales la utilización de fuentes nutricionales disponibles como el carbono y el nitrógeno dependen en parte de la presencia de un grado de estrés que afecten a las plantas (Tisserat y Vaughn, 2008). Este estrés puede ser ocasionado por elicitores, los cuales pueden activar rutas metabólicas que dan origen a los metabolitos secundarios, por lo que la planta desvía parte del material del metabolismo primario para estos fines. Por esta razón, las plantas bajo tratamiento con elicitores pueden mostrar cambios morfológicos como disminución o detención del crecimiento. Este efecto supresor en el metabolismo primario ha sido descrito para el ácido jasmónico por Coste et al. (2011) en brotes de Hypericum hirsutum L. e Hypericum maculatum Crantz. De igual manera, Hu et al. (2011) informaron de la reducción de la biomasa por el efecto del MJ en el cultivo de suspensiones celulares de Fagopyrum esculentum L.
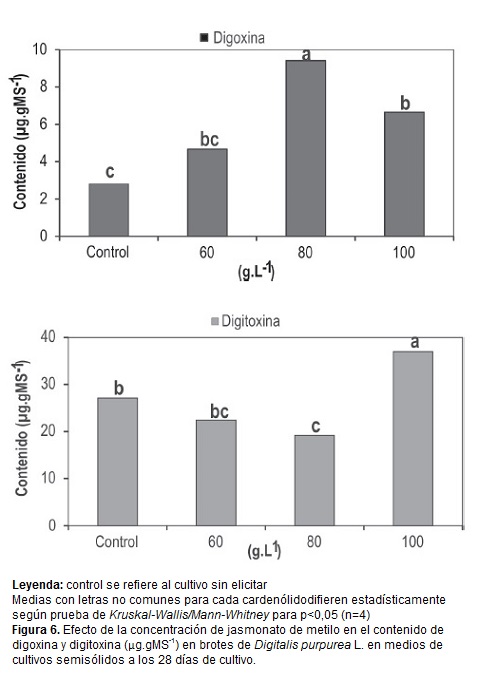
La adición de MJ en las concentraciones ensayadas indujo variaciones en el contenido de digoxina y digitoxina (figura 6). La mayor concentración (100µM) provocó un incremento en el contenido de ambos cardenólidos con diferencias significativas respecto al control. El incremento de la digitoxina fue más notable (37 µg.gMs-1) y difirió significativamente con el resto de las concentraciones evaluadas. Mientras, el mayor valor de digoxina se alcanzó en el tratamiento con 80µM (9,4 µg.gMs-1) con diferencias significativas respecto al resto de los tratamientos, que equivale a un aumento de 3,3 veces con respecto al control. Estos resultados indican que el MJ podría influir diferencialmente en las enzimas asociadas a la producción de cardenólidos.
El efecto de los jasmonatos en el incremento de un metabolito y en el detrimento de otro, ha sido observado por Coste et al. (2011) en brotes de H. hirsutum. La inducción de metabolitos secundarios es uno de los efectos del MJ comúnmente observado (Kim et al., 2007; Hu et al., 2011; Mathew y Sankar, 2012). Autores como Gundlach et al. (1992) demostraron que la inducción por el jasmonato no es específica para un tipo de metabolito, sino que influye de manera general en un amplio espectro de sustancias de bajo peso molecular tales como flavonoides, antraquinonas y varias clases de alcaloides.
Por su parte, Kim et al. (2009) indujeron cambios en el contenido de ginsenósidos en el cultivo de raíces de Panax ginseng C.A. Meyer, mediante la elicitación con el MJ.
Haciendo un análisis del efecto de los elicitores en la producción neta por frasco de cultivo (tabla 1), los mejores resultados se alcanzaron en el tratamiento con 0,01 g.L-1de SiP (4,72 µg de digoxina y 88,27 µg de digitoxina). El segundo mejor resultado se obtuvo en el tratamiento con 0,1 g.L-1 de ChP, que alcanzó una producción neta por frasco de cultivo de 4,95 µg de digoxina y 36,88 µg de digitoxina. Esta variable ha sido utilizada con el objetivo de evaluar las potencialidades del método desarrollado para la producción a nivel comercial. A su vez, ratifica la importancia de la producción de biomasa para obtener una mayor producción de cardenólidos en D. purpurea.
Estos resultados muestran que el tipo y el contenido de los cardenólidos dependen de la concentración y del elicitor utilizado en el cultivo de brotes de D. purpurea. Este aspecto ha sido señalado por autores como Ruiz-May et al. (2009) quienes describieron que el tipo de alcaloides y su acumulación en el cultivo de raíces de Catharanthus roseus L. estuvieron relacionados con ambos factores.
La acumulación de metabolitos secundarios en plantas es considerada como una respuesta de defensa al ataque de patógenos, la cual es activada por elicitores que actúan como compuestos de señalización de las respuestas de defensa en plantas (Namdeo, 2007; Pawar et al., 2011). En Digitalis se conoce que la síntesis de cardenólidos ocurre como un mecanismo de defensa de la planta ante el ataque de insectos (Wink, 2010).
Teniendo en cuenta las valoraciones realizadas por Pérez-Bermúdez et al. (2010) sobre los genes relacionados con la ruta biosintética de los cardenólidos, específicamente el P5βR2 cuya expresión fue independiente del MJ, es posible que el incremento de estos con el MJ se deba a la interacción sinérgica entre el etileno y el jasmonato y no al efecto aislado del MJ. Para ambos se ha descrito su contribución significativa a la resistencia contra herbívoros (Onkokesung et al., 2010). Los mecanismos de defensa en plantas están interconectados por una compleja red de rutas de señalización de hormonas (Pieterse et al., 2009; Mejía-Teniente et al., 2010). Estas rutas responden a condiciones de estrés o a elicitores, que modulan la biosíntesis de compuestos de defensa como un resultado combinado de las acciones múltiples de señalización (Zhao et al., 2005).
Aunque se han considerado muchas hipótesis sobre los mecanismos de acción de los elicitores, aún es necesario el estudio de los mismos. Los elicitores, a una concentración apropiada, pueden actuar como moléculas de señalización, las cuales son percibidas por un receptor presente en la membrana plasmática y que inicia la señal de transducción (Vasconsuelo y Boland, 2007). De esta manera, involucra la expresión de genes y la activación de rutas metabólicas implicadas en la biosíntesis del compuesto deseado. Al respecto, Orlita et al. (2008) consideraron que debido al escaso conocimiento de las rutas de biosíntesis de los metabolitos secundarios, el efecto de un elicitor en el cultivo de células o de tejidos no es predecible. Al respecto, Bhagwath y Hjortso (2000) utilizaron un diseño factorial donde incluyeron varios factores para la producción de metabolitos secundarios en el cultivo de raíces de Ambrosia artemissifolia L. y notaron que la mayoría de los métodos de elicitación son empíricos.
En el caso específico de las especies de Digitalis, hay limitada información acerca de la acumulación de cardenólidos mediante el uso de elicitores en el cultivo in vitro. En la literatura científica consultada solo existe una investigación desarrollada en D. lanata (Ghanem et al. 2010), quienes describen el estudio de elicitores como el ácido salicílico, el extracto de levadura y el cloruro de calcio. Este último elicitor incrementó el contenido total de cardenólidos 2,9 veces comparado con las plantas no elicitadas.
Los cardenólidos están constituidos por una genina o aglicona que contiene el núcleo esteroidal y una secuencia de moléculas de azúcares generalmente raros que se producen durante el ciclo de las pentosas como las digitoxosas (Piñol et al., 2008). En Digitalis la serie más común es la A pero la de mayor importancia es la C, la diferencia entre sus geninas está en el grupo OH que tiene la digoxina en el carbono 12 mientras que la digitoxina tiene un grupo hidrógeno, puede ser que fenómenos como la hidroxilación se vean afectados por elicitores. Se desconoce cuáles variaciones encontradas en las series A y C son determinadas genéticamente o cuáles pueden ser causadas por factores ambientales o externos (Yücesan, 2011).
Teniendo en cuenta los procesos relacionados con la síntesis de metabolitos secundarios podemos especular sobre su efecto en algunos aspectos básicos aunque no existen evidencias que confirmen los posibles mecanismos en los que influyen directamente los elicitores. Estas pueden estar relacionadas con afectaciones en el metabolismo primario que modulan la expresión de moléculas del metabolismo primario involucrado en el transporte a vacuolas donde se almacenan dichos metabolitos, limiten o favorezcan precursores de la ruta del ácido mevalónico descrita como ruta de biosíntesis de cardenólidos (Kreis y Müller-Uri, 2013). Por otra parte pueden alterar la localización o la solubilidad de las enzimas, activar aquellas específicas que regulan la síntesis de digitoxina, en detrimento de las enzimas que rigen la síntesis de digoxina. Las acetiltransferasas y glucosiltransferasas (Kreis et al., 1986; Kandzia et al., 1998) juegan importantes roles en la ruta biosintética de los cardenólidos y podría especularse que el ChP y en mayor medida el SiP, promovieran la glucosilación y la acetilación provocando un incremento en el contenido de los cardenólidos, aunque se requiere de nuevos experimentos para probar esta hipótesis.
Como estrategia para estimular la síntesis de metabolitos secundarios, la elicitación ha tenido una marcada aplicación comercial en los últimos años (Savitha et al., 2006). A esto se le adiciona, que podrían permitir el estudio de genes relacionados con la biosíntesis de cardenólidos mediante la evaluación de la expresión de los mismos ante el efecto del elicitor.
Conclusiones
Se demostró que la elicitación es una estrategia viable para el incremento de cardenólidos en brotes de D. purpurea en medio de cultivo semisólido. El SilioPlant® a razón de 0,01 g.L-1 permitió incrementar en 3,6 y 6,9 veces el contenido de digoxina y digitoxina respectivamente.
Referencias bibliográficas
1 Agrawal, GK.; Rakwal, R., Tamogami, S., Yonekura, M., Kubo, A., Saji, H. 2002. Chitosan activates defense/stress response(s) in the leaves of Oryza sativa seedlings. Plant Physiology & Biochemistry. 40: 1061-1069. [ Links ]
2 Ait Barka, E., Eullaffroy, P., Clément, C., Vernet, G. 2004. Chitosan improves development, and protects Vitis vinifera L. against Botrytis cinerea. Plant Cell Report. 22: 608-614. [ Links ]
3 Bhagwath, SG., Hjortso, MA. 2000. Statistical analysis of elicitation strategies for thiarubineA production in hairy root cultures of Ambrosia artemisiifolia. Journal of Biotechnology. 80: 159-167. [ Links ]
4 Bonilla, I. 2008. Introducción a la nutrición mineral de las plantas. Los elementos minerales. En: Azcón-Bieto, J., Talón, M. Fundamentos de fisiología vegetal. Mc Graw Hill Interamericana, Madrid, pp 103-121. [ Links ]
5 Coste, A.; Vlase, L., Halmagyi, A.; Deliu, C.; Coldea, G. 2011. Effects of plant growth regulators and elicitors on production of secondary metabolites in shoot cultures of Hypericum hirsutum and Hypericum maculatum. Plant Cell Tissue & Organ Culture. 106: 279-288. [ Links ]
6 Crozier, A., Kamiya, Y., Bishop, G., Yokota, T. 2000. Biosynthesis of hormones and elicitor molecules. En: Buchanan, B., Gruissem, W., Jones, R. (Eds) Biochemistry and molecular biology of plants. American Society of Plant Physiologists, Rockville, pp 850-929. [ Links ]
7 Epstein, E. 2001. Silicon in plants: facts vs concepts. En: Datnoff LE, Snyder GH, Korndöfer GH (Eds) Silicon in agriculture. Elsevier, Amsterdam, pp 1-16. [ Links ]
8 Erdei, I.; Kiss, Z.; Maliga, P. 1981. Rapid clonal multiplication of Digitalis lanata in tissue culture. Plant Cell Report. 1: 34-35. [ Links ]
9 Fauteux, F.; Rémus-Borel, W., Menzies, JG., Bélanger, RR. 2005. Silicon and plant disease resistance gainst pathogenic fungi. FEMS Microbiology Letter. 249: 1-6. [ Links ]
10 Fischer, R.; Twyman, RM.; Hellwig, S.; Drossard, J.; Schillberg, S. 2007. Facing the future with pharmaceuticals from plants. Proceedings of the 11th IAPTC&B Congress, Beijing, China. Dordrecht: Springer Netherland. pp 13-32. [ Links ]
11 Gavidia, I.; Tarrío, R.; Rodríguez-Trelles, F.; Pérez-Bermúdez, P.; Seitz, H. 2007. Plant progesterone 5β -reductase is not homologous to the animal enzyme. Molecular evolutionary characterization of P5βR from Digitalis purpurea. Phytochemistry. 68: 853-864. [ Links ]
12 Ghanem, SA.; Aboul-Enein, AM.; El-Sawy, A.; Rady, MR.; Ibrahem, MM. 2010. in vitro propagation and cardiac glycosides content of Digitalis lanata. International Journal of Academic Research. 2: 349-356. [ Links ]
13 Gundlach, H., Müller, M., Kutchan, T., Zenk, M. 1992. Jasmonic acid is a signal transducer in elicitor-induced plant cell cultures. Proceedings of the National Academic of Science. USA 89: 2389-2393. [ Links ]
14 Gurel, E.; Yücesan, B.; Aglic, E.; Gurel, S.; Verma, SK.; Sokmen, M.; Sokmen, A. 2010. Regeneration and cardiotonic glycoside production in Digitalis davisiana Heywood (Alanya Foxglove). Plant Cell Tissue & Organ Culture. 104: 217-225. [ Links ]
15 Hagimori, M.; Matsumoto, T.; Obi, Y. 1983. Effects of mineral salts, initial pH and precursors on digitoxin formation by shoot-forming cultures of Digitalis purpurea L. Grown in liquid media. Agriculture and Biological Chemistry. 47: 565-571. [ Links ]
16 Hammerschmidt, R. 2011. More on silicon-induced resistance. Physiological & Molecular Plant Pathology. 75: 81-82. [ Links ]
17 Hornberger, M.; Böttigheimer, U.; Hillier-Kaiser, A.; Kreis, W. 2000. Purification and characterisation of the cardenolide-specific [beta]-glucohydrolase CGH II from Digitalis lanata leaves. Plant Physiology & Biochemistry. 38: 929-936. [ Links ]
18 Howe, G. 2004. The roles of hormones in defense against insects and disease. Jasmonates. En: Davies P (Ed). Plant hormones: Biosynthesis, Signal transduction, Action! Kluwer Academic Publishers. pp 610-634. [ Links ]
19 Hu, Y-H.; Yu, Y-T., Piao, C-H., Liu, J-M., Yu, H-S. 2011. Methyl jasmonate- and salicylic acid-induced D-chiro-inositol production in suspension cultures of buckwheat (Fagopyrum esculentum). Plant Cell Tissue & Organ Culture. 106: 419-424. [ Links ]
20 Kandzia, R.; Grimm, R.; Eckerskorn, C.; Lindemann, P.; Luckner, M. 1998. Purification and characterization of lanatoside 15-O-acetylesterase from Digitalis lanata Ehrh. Planta. 204: 383-389. [ Links ]
21 Kim, HJ., Chen, F., Wang, X.; Rajapakse, NC. 2005. Effect of chitosan on the biological properties of sweet basil (Ocimum basilicum L.). Journal of Agricultural & Food Chemistry. 53: 3696-3701. [ Links ]
22 Kim, OT.; Bang, KH., Kim, YC.; Hyun, DY.; Kim, MY.; Cha, SW. 2009. Upregulation of ginsenoside and gene expression related to triterpene biosynthesis in ginseng hairy root cultures elicited by methyl jasmonate. Plant Cell Tissue & Organ Culture 98: 25-33. [ Links ]
23 Kim, OT.; Bang, KH., Shin, YS., Lee, MJ., Jung, SJ., Hyun, DY., Kim, YC., Seong, NS., Cha, SW., Hwang, B. 2007. Enhanced production of asiaticoside from hairy root cultures of Centella asiatica (L.) Urban elicited by methyl jasmonate. Plant Cell Report. 26: 1941-1949. [ Links ]
24 Kreis, W.; May, U.; Reinhard, E. 1986. UDP-glucose:digitoxin 162-O-glucosyltransferase from suspension-cultured Digitalis lanata cells. Plant Cell Report. 5: 442-445. [ Links ]
25 Kreis, W.; Müller-Uri, F. 2013. Cardenolide aglycone formation in Digitalis. En: Bach, TJ.; Rohmer, M. (Eds) Isoprenoid synthesis in plants and microorganisms: new concepts and experimental approaches. Springer Science+Business Media New York. pp 425-438. [ Links ]
26 Kuate, SP.; Pádua, RM.; Eisenbeiss, WF.; Kreis, W. 2008. Puri?cation and characterization of malonyl-coenzyme A: 21-hydroxypregn-ane 21-O-malonyltransferase (Dp21MaT) from leaves of Digitalis purpurea L. Phytochemistry. 69: 619-626. [ Links ]
27 Lewis, JA. 2009. Molecule of the month. Digoxin blocks tumor growth through HIF-1 inhibition. Current Topic in Medicinal Chemistry. 9: 117 [ Links ]
28 Lindemann, P.; Luckner, M. 1997. Biosynthesis of pregnane derivatives in somatic embryos of Digitalis lanata. Phytochemistry. 46: 507-513. [ Links ]
29 Liu, XN.; Zhang, XQ.; Zhang, SX.; Sun, JS. 2007. Regulation of metabolite production by precursors and elicitors in liquid cultures of Hypericum perforatum. Plant Cell Tissue & Organ Culture. 91: 1-7. [ Links ]
30 Mathew, R.; Sankar, PD. 2012. Effect of methyl jasmonate and chitosan on growth characteristics of Ocimum basilicum L., Ocimum sanctum L. and Ocimum gratissimum L. cell suspension cultures. African Journal of Biotechnology. 11: 4759-4766. [ Links ]
31 Mejía-Teniente, L.; Torres-Pacheco, I.; González-Chavira, MM.; Ocampo-Velázquez, RV.; Herrera-Ruiz, G.; Chapa-Oliver, AM.; Guevara-González, RG. 2010. Use of elicitors as an approach for sustainable agriculture. African Journal of Biotechnology. 9: 9155-9162. [ Links ]
32 Murashige, T.; Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum. 15: 473-497. [ Links ]
33 Namdeo, AG. 2007. Plant cell elicitation for production of secondary metabolites: a review. Pharmacognosis Reviews. 1: 69-79. [ Links ]
34 Onkokesung, N.; Baldwin, IT., Gális, I. 2010. The role of jasmonic acid and ethylene crosstalk in direct defense of Nicotiana attenuate plants against chewing herbivores. Plant Signaling & Behavior. 5: 1305-1307. [ Links ]
35 Orlita, A.; Sidwa-Gorycka, M.; Kumirska, J.; Malinski, E.; Siedlecka, E.; Gajdus, J., Lojkowska, E., Stepnowski, P. 2008. Identification of Ruta graveolens L. metabolites accumulated in the presence of abiotic elicitors. Biotechnology Progress. 24: 128-133. [ Links ]
36 Paek, KY.; Chakrabarty, D.; Hahn, EJ. 2005. Application of bioreactor systems for large scale production of horticultural and medicinal plants. Plant Cell Tissue & Organ Culture. 81: 287-300. [ Links ]
37 Pawar, KD., Yadav, AV., Shouche, YS.; Thengane, SR. 2011. Influence of endophytic fungal elicitation on production of inophyllum in suspension cultures of Calophyllum inophyllum L. Plant Cell Tissue & Organ Culture. 106: 345-352. [ Links ]
38 Pérez-Alonso, N.; Capote, A.; Gerth, A.; Jiménez, E. 2012. Increased cardenolides production by elicitation of Digitalis lanata shoots cultured in temporary immersion systems. Plant Cell Tissue & Organ Culture. 110: 153-162. [ Links ]
39 Pérez-Alonso, N.; Wilken, D.; Gerth, A.; Jahn, A.; Nitzsche, HM.; Kerns, G.; Capote, A.; Jiménez, E. 2009. Cardiotonic glycosides from biomass of Digitalis purpurea L. cultured in temporary immersion systems. Plant Cell Tissue & Organ Culture. 99: 151-156. [ Links ]
40 Pérez-Bermúdez, P.; Moya García, A.; Tuñón, I.; Gavidia, I. 2010. Digitalis purpurea P5βR2, encoding steroid 5β-reductase, is a novel defense-related gene involved in cardenolide biosynthesis. New Phytologist. 185: 687-700. [ Links ]
41 Pieterse, CM., Leon-Reyes, A., Van der Ent, S.; Van Wees, SC. 2009. Networking by small-molecule hormones in plant immunity. Nature Chemical Biology. 5:308-316. [ Links ]
42 Piñol, MT.; Palazón, J.; Cusidó, RM. 2008. Introducción al metabolismo secundario. En: Azcón-Bieto, J.; Talón, M. (Eds). Fundamentos de fisiología vegetal. McGraw Hill Interamericana, Madrid. pp 323-348. [ Links ]
43 Roca-Pérez, L.; Boluda, R.; Gavidia, I.; Pérez-Bermúdez, P. 2004. Seasonal cardenolide production and Dop5br gene expression in natural populations of Digitalis obscura. Phytochemistry. 65: 1869-1878. [ Links ]
44 Ruiz-May, E., Galaz-Ávalos, RM., Loyola-Vargas, VM. 2009. Differential secretion and accumulation of terpene indole alkaloids in hairy roots of Catharanthus roseus treated with methyl jasmonate. Molecular Biotechnology. 41: 278-285. [ Links ]
45 Saito, K.; Yamazaki, M.; Shimomura, K.; Yoshimatsu, K.; Murakoshi, I. 1990. Genetic transformation of foxglove (Digitalis purpurea) by chimeric foreign genes and production of cardioactive glycosides. Plant Cell Report. 9: 121-124. [ Links ]
46 Sales, E.; Müller-Uri, F.; Nebauer, SG.; Segura, J.; Kreis, W.; Arillaga, I. 2011. Digitalis. En: Kole, C. (Ed) Wild crop relatives: genomic and breeding resources, plantation and ornamental crops. Springer-Verlag Berlin Heidelberg. pp 73-112. [ Links ]
47 Savitha, BC.; Timmaraju, R.; Bhagyalaksami, N.; Ravishankar, GA. 2006. Different biotic and abiotic elicitors influence betalain production in hairy root cultures of Beta vulgaris in shake flask and bioreactor. Process Biochemistry. 41: 50-60. [ Links ]
48 Sudha, G., Ravishankar, G. 2002. Involvement and interaction of various signaling compounds on the plant metabolic events during defense response, resistance to stress factors, formation of secondary metabolites and their molecular aspects. Plant Cell Tissue & Organ Culture. 71: 181-212. [ Links ]
49 Tisserat, B.; Vaughn, S. 2008. Growth, morphogenesis, and essential oil production in Mentha spicata L. plantlets in vitro. in vitro Cellular & Developmental Biology-Plant. 44: 40-50. [ Links ]
50 Vanisree, M.; Tsay, H-S. 2007. Plant cell cultures: Production of biologically important secondary metabolites from medicinal plants of Taiwan. En: Kayser, O.; Quax, W. (Eds) Medicinal plant biotechnology. From basic research to industrial application. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim. pp 267-285. [ Links ]
51 Vasconsuelo, A.; Boland, R. 2007. Molecular aspects of the early stages of elicitation of secondary metabolites in plants. Plant Science. 172: 681-875. [ Links ]
52 Wichtl, M.; Mangkudidjojo, M.; Wichtl-Bleier, W. 1982. Hochleistungs-?üssigkeits-chromatographische analyse von digitalis-blattext-rakten. Journal Chromatography. 234: 503-508. [ Links ]
53 Wink, M. 2010. Introduction: biochemistry, physiology and ecological functions of secondary metabolites. En: Wink, M. (Ed) Biochemistry of plant secondary metabolism. Annual Plant Rev. 40: 1-19. [ Links ]
54 Yoshimatzu, K.; Satake, M.; Shimomura, K.; Sawada, J.; Terao, T. 1990. Determination of cardenolides in hairy root cultures of D. lanata by enzyme-linked immunosorbent assay. Journal of Natural Products. 53: 1498-1502. [ Links ]
55 Yücesan, B. 2011. in vitro propagation and cardiac glycoside production in endemic Digitalis L. species de Anatolia. Thesis submitted to the graduate school of natural and applied sciences of the Abant Izzet Baysal University, Turkey. p. 99. [ Links ]
56 Zacarías, L.; Lafuente, MT. 2008. Etileno, ácido abscísico y otros reguladores del desarrollo. En: Azcón-Bieto, J., Talón, M. Fundamentos de fisiología vegetal. McGraw Hill Interamericana, Madrid. pp 445-465. [ Links ]
57 Zhang, H.; Memelink, J. 2009. Regulation of secondary metabolism by jasmonate hormones. En: Osbourn, AE.; Lanzotti, V. (Eds). Plant-derived Natural Products. © Springer Science + Business Media, LLC. pp 181-194. [ Links ]
58 Zhao, J.; Davis, LC.; Verporte, R. 2005. Elicitor signal transduction leading to production of plant secondary metabolites. Biotechnology Advances. 23: 283-333. [ Links ]