Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.1 Bogotá Jan./June 2014
https://doi.org/10.15446/rev.colomb.biote.v16n1.44228
http://dx.doi.org/10.15446/rev.colomb.biote.v16n1.44228
ARTÍCULO DE INVESTIGACIÓN
Avances en la propagación vía embriogénesis somática de Psychotria ipecacuanha (Brot.) Stokes, planta medicinal en peligro crítico
Advances in vitro propagation via somatic embryogenesis of Psychotria ipecacuanha (Brot.) Stokes, medicinal plant critically endangered
Título corto: Avances en la propagación vía embriogénesis somática de Psychotria ipecacuanha
Esther J. Naranjo1, Aura I. Urrea2 y Lucia Atehortua3.
1 MSc., Instituto de Biología, Universidad de Antioquia (Medellín), Colombia. enaranjo@matematicas.udea.edu.co
2 PhD. en Ciencias, Docente Instituto de Biología, Universidad de Antioquia (Medellín), Colombia. aurrea@matematicas.udea.edu.co
3 PhD. en Ciencias, Docente Instituto de Biología, Universidad de Antioquia (Medellín), Colombia. latehor@gmail.com
Recibido: agosto 20 de 2013 Aprobado: mayo 6 de 2014
Resumen
Psychotria ipecacuanha (Brot.) Stokes (Rubiaceae Juss), es una especie vegetal con reconocidas propiedades medicinales. Esta especie se encuentra en peligro crítico de extinción, debido a la sobreexplotación de las poblaciones naturales. Conociendo además las dificultades para su propagación por medio de semillas (debido a la baja tasa de germinación y elevada muerte prematura de las plántulas) y por vía vegetativa (lento crecimiento), el presente trabajo tuvo como objetivo evaluar el potencial de propagación vía embriogénesis somática directa. Segmentos de hojas jóvenes de plantas mantenidas en casa malla fueron desinfectados y sembrados en el medio de cultivo MS (Murashige y Skoog) suplementado con diferentes concentraciones y combinaciones de reguladores de crecimiento. Las combinaciones IBA y BAP a 1 y 2 mg/L y 2 y 1 mg/L, respectivamente; mostraron ser efectivas en la formación de embriones somáticos en esta especie. La procedencia de la planta donadora parece tener influencia en la sensibilidad del tejido foliar a la respuesta. Este es el primer reporte de embriogénesis somática directa para esta especie y el primer reporte de cultivo in vitro de poblaciones colombianas.
Palabras clave: micropropagación, conservación, nativa, extinción, regeneración in vitro
Abstract
Psychotria ipecacuanha (Brot.) Stokes (Rubiaceae Juss), is a specie with known medicinal properties. This species is critically endangered due to overexploitation of natural populations.
Besides knowing the difficulties in propagation by seed (due to the low rate of germination and high seedling premature death) and by vegetative (slow growth), the present study evaluated the potential for propagation by using direct somatic embryogenesis.
Young leaves segments from plants cultivated in a greenhouse were disinfected and planted in MS medium (Murashige y Skoog), supplemented with different concentrations of growth regulators. IBA and BAP combinations at 1 and 2 mg / L and 2 and 1 mg / L, respectively, shown to be effective in the formation of somatic embryos in this species. The origin of the donor plant seems to influence foliar tissue sensitivity to the answer. This is the first report of direct somatic embryogenesis for this species and the first report of in vitro culture of Colombian populations.
Key words: micropropagation, conservation, native species, in vitro regeneration, overexploitation.
Introducción
Las plantas medicinales son un componente importante de la biodiversidad, en la actualidad la Organización Mundial de la Salud (WHO, por sus siglas en ingles), estima que estas, son la fuente principal para la atención primaria en salud en por lo menos el 75 u 80% de la población mundial (WHO, 2007, Siahsar B. et al., 2011; Kunle et al., 2012; Hong-Wen et al., 2012;). Además, se estima que cerca del 25 al 30% de las medicinas modernas son directa o indirectamente derivadas de plantas superiores. (Kumari S. et al., 2011; Hong-Wen et al., 2012).
De hecho, el mercado y la demanda de productos naturales para el cuidado de la salud, se ha incrementado de tal forma, que ha hecho que muchas plantas medicinales, enfrenten el peligro de la perdida de diversidad genética o incluso se encuentren en peligro de extinción (Hoareau y Da Silva 1999).
P. ipecacuanha, es una de estas plantas medicinales en peligro de extinción, debido principalmente a la sobreexplotación y pérdida de su hábitat natural, (Alvez Garcia et al., 2005). También conocida como "ipeca" o "raicilla", pertenece a la familia rubiácea, crece en el bosque húmedo tropical y se encuentra distribuida en América Central en Nicaragua, Costa Rica y Panamá y en Sur América en Brasil y Colombia (Alvez Garcia et al., 2005; Nomura y Kutchan 2010) . El extracto de la raíz es utilizado y reconocido en la farmacopeia, entre otros como amebicida, emético, y expectorante (Akinboye y Bakare 2011; Nomura y Kutchan 2010; Brandao et al., 2008; Ideda et al., 1988).
P. ipecacuanha, presenta dificultades en la propagación por semilla, ya que pierden fácilmente su viabilidad después de la recolección, (Chatterjee et al., 1982; citado por Satoko et al., 2007), presentan pobre germinación, crecimiento lento y muerte prematura de las plántulas en condiciones naturales (Rout et. al., 2000; Jha y Jha 1989). La propagación por vía vegetativa tiene como limitante el lento crecimiento de las plantas. Consecuentemente, hay una urgente necesidad de contar con un protocolo de propagación masiva que permita obtener material vegetal con miras a la reintroducción en su hábitat y además contar con material seleccionado (por su contenido de alcaloides principalmente) para el establecimiento de cultivos comerciales.
Las técnicas de cultivo in vitro, entre ellas la embriogénesis somática, se presentan como una alternativa para la propagación masiva y la conservación de especies amenazadas, raras y/o endémicas (Philip Robinson et al., 2009). Esta técnica, tiene entre otras ventajas frente a la micropropagación convencional la generación de plántulas con meristemo apical y radicular simultáneamente, por lo que no se requiere una etapa de enraizamiento posterior, además de la facilidad para su escalamiento, menor probabilidad de variación genética, entre otras, (Khadke y Kuvalekar 2013; Aiqing Ji et al., 2011; Philip Robinson et al., 2009). A pesar de estas ventajas, este proceso debe ser estandarizado teniendo en cuenta la respuesta diferencial de cada genotipo a los reguladores de crecimiento, al tipo de explante, la edad de la planta donadora y las condiciones de crecimiento entre otros factores (Aiqing Ji et al., 2011).
La embriogénesis somática ha sido reportada para Cephaelis ipecacuanha por Rout et al. (2.000) quienes describen la obtención de embriones somáticos indirectos y la obtención de vitroplantas a partir de los embriones formados; además, Lara et al. (2003), describen la obtención de brotes y embriones directos e indirectos a partir de explantes foliares en P. acuminata.
En Colombia, a pesar de ser uno de los pocos países de distribución de la esta especie, no existen trabajos sobre aspectos tan importantes como la fenología, la propagación sexual y asexual, conservación in situ y ex situ, entre otros.
Conociendo las ventajas de la propagación in vitro y teniendo en cuenta la importancia de esta especie medicinal desde el punto de vista de su potencial uso sostenible y conservación, el presente trabajo tuvo como objetivo evaluar el efecto de diferentes combinaciones y concentraciones de reguladores de crecimiento sobre las diferentes etapas de la embriogénesis somática en poblaciones colombianas de P. ipecacuanha.
Materiales y métodos
Material vegetal y condiciones de cultivo
El material vegetal de P. ipecacuanha fue colectado en el Urabá antioqueño en tres salidas de campo de acuerdo al "Contrato No.50 de Acceso a Recursos Genéticos sin interés Comercial".
Hojas jóvenes de la parte apical, provenientes de plantas mantenidas en condiciones semicontroladas en casa malla, fueron colectadas y desinfectadas mediante lavado con agua corriente durante 15 min. y un lavado con Tween 20 al 5% durante 5 min.; seguido por una inmersión en fungicida más antibiótico (Benomyl® y estreptomicina, 2 g/L cada uno), por 2 horas y luego en hipoclorito de sodio (NaClO) 3%, por 30 min., finalmente se realizó una segunda desinfección en NaClO al 1,6%. Después de cada paso se realizaron 3 enjuagues con agua destilada estéril. Las hojas desinfectadas fueron cortadas en segmentos de 0,8 cm2 aproximadamente y llevadas al medio de cultivo. Todo el proceso se realizó bajo un ambiente estéril en cámara de flujo laminar horizontal.
Todos los medios de cultivo, fueron preparados con agua destilada y homogenizados con agitación constante. El pH inicial fue ajustado a 5,75 con NaOH y/o HCl 1N, antes de su autoclavado, y gelificados con 2,8 g/L de gelrite (Phytotech). Los medios de cultivo fueron esterilizados durante 20 min., a 121oC y 15 psi.
La composición del medio de cultivo para todos los tratamientos fueron las sales basales de Murashige y Skoog (1962), a la mitad de su concentración suplementado con sacarosa (20 g/L), adenina (200 mg/L) y glutamina (50 mg/ L).
Inducción del proceso embriogénico
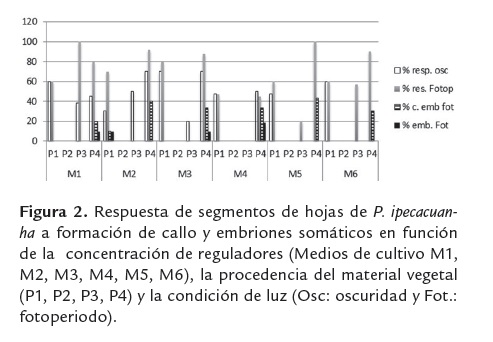
Teniendo en cuenta los resultados obtenidos en ensayos preliminares donde se evaluaron combinaciones de reguladores de crecimiento que fueron exitosos para esta especie (Rout et al., 2.000), en especies relacionadas (Lara et al., 2003 a y b) y otras combinaciones propuestas con base en la experiencia en otras especies; se plantearon en el medio basal MS los siguientes tratamientos (mg/L), M1: IBA 3,0 más BAP 1,5; M2: IBA 2, más BAP 1; M3: IBA 1,0 más BAP 0,5; M4: IBA 1,5 más BAP 3,0; M5: IBA 1,0 más BAP 2,0 y M6 :IBA 0,5 más BAP 1,0.
El tamaño de la muestra consistió entre 10 y 15 segmentos de hoja por tratamiento, sembrados individualmente en cajas de Petri.
Los explantes fueron mantenidos a 23 ± 2oC y bajo dos condiciones lumínicas, oscuridad constante y fotoperiodo, 16/8 horas luz/oscuridad. Además se tuvo en cuenta la procedencia de los explantes (poblaciones muestreadas P1, P2, P3 y P4), con el fin de evaluar el efecto de estos dos factores sobre la respuesta al cultivo in vitro. La colecta de material vegetal, se realizó en municipios del Urabá antioqueño, especificamente en poblaciones encontradas en Turbo y Carepa.
Las variables registradas cada 30 días fueron: Necrosis o muerte del tejido, formación o no de callo y tipo de callo: Embriogénico (E) y No Embriogénico (NE) en porcentaje, textura y color de los mismos.
Evaluación del potencial de regeneración
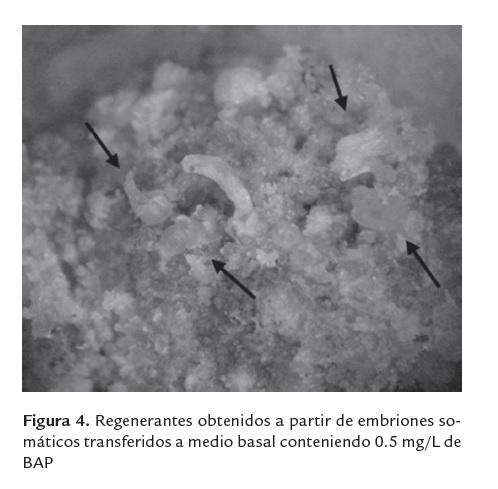
Los callos embriogénicos y embriones obtenidos (figura 2) después de cuatro meses, fueron trasferidos al mismo medio de cultivo basal conteniendo dos concentraciones de BAP: 0.5 y 2 mg/L, respectivamente. El material fue mantenido a 25 ± 2oC, bajo condiciones de fotoperiodo (16/8 horas luz/oscuridad).
Se utilizaron 10 cajas de Petri (15x60 mm.) cada una con un clúster embriogénico para un total de 10 clúster embriogénicos por tratamiento. Cada clúster o porción de callo embriogénico tuvo un tamaño aproximado de 1 cm2. Se registró cada mes el desarrollo de ejes caulinares a partir de los embriones y la formación o no de raíces.
Diseño experimental y análisis estadístico
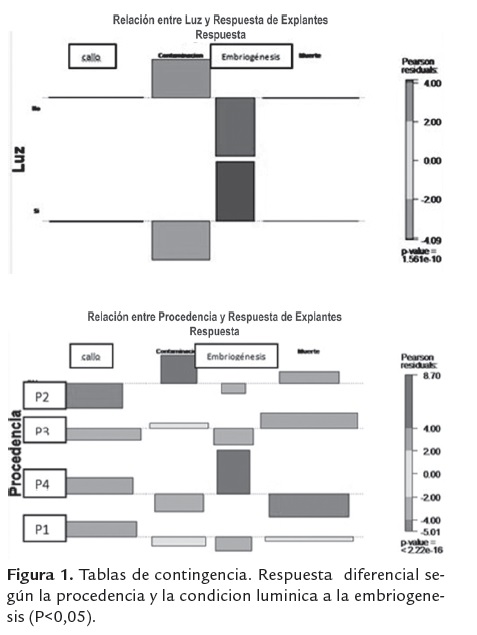
Teniendo en cuenta que los datos no se ajustaron a una distribución normal, se aplicaron pruebas no paramétricas. El efecto de las condiciones lumínicas (fotoperiodo y oscuridad constante) y la procedencia del material fueron evaluados mediante tablas de contingencia, contabilizando el número de explantes que produjeron callo E y NE. Esta información fue analizada con base en los residuales de Pearson y el valor P calculado mediante una prueba X2, usando, en el programa estadístico R, el paquete vcd y la función assoc () (Logan 2010).
Resultados y discusión
Los segmentos de hoja de plantas de diferentes procedencias (coordenadas geográficas), presentaron una respuesta diferencial al cultivo in vitro (figura 1), en los tratamientos evaluados para la inducción del proceso embriogénico.
La formación de callo embriogénico se presentó en todos los tratamientos evaluados, pero solo con una de las procedencias, igualmente la formación indirecta de embriones somáticos se logró solo en esta procedencia en los tratamientos M1, M2 y M3, aunque en baja proporción (figura 1); lo que nos permite sugerir que además del efecto de las concentraciones de los reguladores de crecimiento, la procedencia del material vegetal y la condición lumínica, tienen un efecto importante en la respuesta de esta especie al cultivo in vitro.
La respuesta obtenida en ensayos previos cuando se utilizó el 2,4 D como auxina y kinetina como citoquinina, no fue favorable para el proceso embriogénico, obteniéndose solo un callo húmedo, oscuro y no embriogénico. Este resultado no coincide con lo descrito por Rout et al. (2000) para esta misma especie, quienes describen la formación indirecta de embriones somáticos y su posterior regeneración. Tampoco se logró la formación de embriones somáticos con la combinación de reguladores de crecimiento BAP y ANA, utilizada por Lara et al. (2003a y 2003b) en P. acuminata con la cual obtuvieron formación de embriones de manera directa.
Otras combinaciones evaluadas en los ensayos preliminares de este trabajo (con base en la experiencia del grupo de trabajo) fueron 2,4-D más 2iP o BAP e IBA más 2iP o BAP, logrando con esta última combinación la mejor respuesta y por tanto planteada como base para la matriz evaluada en este trabajo.
Berros et al. (2005), reportan embriogénesis somática en avellana (Corylus sp.), con esta misma combinación de reguladores de crecimiento y describen la participación del IBA en la promoción de la inducción de los embriones y del BAP en la promoción del desarrollo en los primeros subcultivos y como principal agente durante el desarrollo polarizado. La adición de BAP en varias combinaciones y concentraciones en subcultivos consecutivos, facilito la inducción embriogénica en los explantes. Otros autores describen el efecto de esta misma combinación de reguladores de crecimiento en especies como: Onobrychis sativa, (Mohajer et al., 2012) y Solanum melongena, (Kahur et al., 2013).
El análisis de las tablas de contingencia mostro que la procedencia y la condición lumínica, tienen un efecto estadísticamente significativo (P<0,05), sobre la formación de callo E y NE (figura 1).
La figura 2, muestra los resultados obtenidos para diferentes procedencias, tanto en la formación de callo, como para la formación de embriones. La procedencia 2 no presentó respuesta en ninguno de los tratamientos, mientras que las procedencias 1, 3 y 4 presentaron respuesta a la formación de callo NE en casi todos los tratamientos y solo la P4 respondió a la formación de CE y de embriones (figura 2). Este resultado coincide con lo descrito por Lara et al. (2003), en la especie P. acuminata, quien describe respuesta diferencial a la proliferación de brotes, de material proveniente de diferentes zonas geográficas. En este mismo sentido, Pakhomov et al. (2005 y 2004), reportan alta capacidad embriogénica de cultivares de soya, (Glycine max (L.) Merr.), procedentes de unas zonas geográficas y muy baja capacidad embriogénica de estos cultivares procedentes de otras zonas geográficas. Contrario a nuestros resultados, Ahmad et al. (2011), reportan que la procedencia no tuvo efecto significativo en la germinación de semillas y la respuesta embriogénica a partir de estas en Picea abies; resultados similares a este último son reportados para algunas especies de Quercus, (Timofte et al., 2011).
Se encontró además, que las condiciones de luz tuvieron un efecto en la respuesta embriogénica de esta especie, la cual se obtuvo solo en condiciones de fotoperiodo. En la figura 2, se observa que la formación de callo siempre fue igual o superior en condiciones de fotoperiodo y que además la formación de CE y embriones somáticos solo se presentó en esta condición; no hubo formación de CE, ni embriones somáticos en condiciones de oscuridad.
Lo anterior nos permite sugerir, que la luz juega un papel importante en la respuesta embriogénica de la especie en estudio. Hoshino y Cuello (2006), coinciden en reportar que las condiciones de iluminación son uno de los factores ambientales críticos que tienen efecto sobre la inducción de embriogénesis somática. Resultados similares han sido reportados para especies como caña de azúcar (Saccaharum officinarum), (Ali et al., 2007) y canola (Brassica napus), (Angoshtari et al., 2009); en las cuales solo los explantes en condiciones de fotoperiodo, presentaron respuesta embriogénica.
Sin embargo, Gatica et al. (2008), evaluaron tres condiciones de iluminación y encontraron un buen promedio de formación de embriones por explante, tanto en condiciones de oscuridad como de fotoperiodo y el más bajo se reportó en condiciones de iluminación continua; Tangolar et al. (2008), reportan la formación de embriones somáticos en Vitis spp, tanto en condiciones de oscuridad como de fotoperiodo, sin embargo, la mejor eficiencia fue obtenida en condiciones de oscuridad. Contrario a nuestros resultados, Triqui et al. (2008) reportan la obtención de embriones somáticos solo en condiciones de oscuridad para Ipomoea batatas.
Varios autores han reportado el efecto de las condiciones de iluminación sobre la inducción de embriones somáticos y/o la respuesta al cultivo in vitro. Kintzios et al. (1998), revisan el efecto de las condiciones de iluminación sobre varias especies y confirman su efecto sobre la inducción y proliferación de embriones somáticos en la mayoría de las especies evaluadas, la incubación en la oscuridad o a bajas intensidades de iluminación favorece la embriogénesis somática, además resaltan diferencias del efecto de la condición lumínica sobre la proliferación de embriones en especies hortícolas en relación con especies ornamentales.
Otros autores describen además, el efecto de la iluminación sobre el desarrollo y la inducción de brotes, en diferentes especies, y que cambios en la condiciones y/o intensidades de iluminación tienen diferentes efectos morfogenéticos sobre el desarrollo en especies no relacionadas, lo que sugiere que la morfogénesis y la embriogénesis somáticas son mediadas en forma específica, en las diferentes especies de plantas (Kurilcik et al., 2008; Hataa et al., 2012; Marks y Simpson 1999).
Nuestros resultados y los reportados por otros autores confirman la influencia de los factores ambientales sobre la embriogénesis somática y por lo tanto, la necesidad de evaluarlos en el momento de trabajar con una especie nueva o incluso para variedades (genotipos) dentro de una misma especie. Los factores ambientales que prevalecen en las condiciones in vivo, pueden ser usados como referente de los requerimientos para el crecimiento en condiciones in vitro (Marks y Simpson 1999). El estudio de estos factores es necesario no solo en la embriogénesis somática, sino en todos los procesos in vitro de las diferentes especies, con el objetivo de establecer protocolos repetibles para la producción exitosa y el establecimiento y mantenimiento de los cultivos.
Evaluación del potencial de regeneración
Los mejores resultados se registraron en el medio de cultivo conteniendo BAP a 0.5 mg/L, en el cual se obtuvo entre 2-10 regenerantes por clúster embriogénico, mientras que en el tratamiento con BAP a 2.0 mg/L solo se obtuvieron 1-2 regenerantes por clúster. Es importante destacar que el inicio de la conversión de los embriones se alcanzó después de 20 días de ser transferidos al medio de regeneración, sin embargo la respuesta de desarrollo es lenta, alcanzando una altura de 1cm. aproximadamente después de 60 días (figura 3). Contrario a nuestros resultados, Rout et al. (2000), reportan una mayor germinación de embriones somáticos de esta especie en el medio de cultivo sin reguladores de crecimiento, lo cual en el presente trabajo desencadeno la necrosis y muerte de los callos y embriones.
Esta es la etapa inicial de la evaluación del proceso de conversión hasta planta completa en poblaciones colombianas de P. ipecacuanha.
Conclusiones
A pesar de la importancia medicinal de P. ipecacuana, del alto impacto sobre las poblaciones naturales y de las desventajas propias de la conservación in situ, son casi nulos los grupos de investigación que trabajan en la búsqueda de alternativas de conservación de esta especie. Para Colombia no se registran trabajos. Los resultados obtenidos a la fecha, nos permiten sugerir que la procedencia (coordenadas geográficas) y las condiciones de luz durante el cultivo en laboratorio, tienen un efecto importante sobre la respuesta de esta especie al cultivo in vitro. Es necesario realizar ensayos con otras condiciones ambientales ( intensidad lumínica, temperatura, entre otras) y combinaciones de reguladores de crecimiento que nos permitan avanzar y optimizar la propagación vía embriogénesis somatica. Este es el primer reporte sobre el cultivo in vitro de una especie nativa de Colombia en peligro crítico, se continua con ensayos de regeneración a partir de embriones somáticos y otros explantes, además se están desarrollando trabajos de conservación in vitro y marcadores moleculares para esta especie. Todo lo anterior con miras en un mediano plazo al desarrollo de un programa de conservación ex situ, uso sostenible y/o reintroducción en su hábitat.
Agradecimientos
A Colciencias por la financiación del proyecto de investigación. Al CODI-Estrategia de Sostenibilidad 2013-2014, Universidad de Antioquia por el apoyo al Grupo de Biotecnología. Finalmente, agradecemos al profesor Camilo Ramírez, por su asesoría en el análisis estadístico.
Referencias bibliografías
1 Ahmad I., Johansson S., Andrade G., Dedicova B. and Egertsdotter U. 2011. Somatic embryogenesis for mass propagation of elite Spruce families: effect of storage time on somatic embryogenesis initiation. BMC Proceedings. 5(7): 127. [ Links ]
2 Aiqing J., Xueqing G., Yan Z., Hongyan Y. and Guoliang W. 2011. Advances in Somatic Embryogenesis Research of Horticultural Plants. American Journal of Plant Sciences. 2: 727-732. [ Links ]
3 Akinboye E. and Bakare O. 2011. Biological activities of emetine. The Open Natural Products Journal. 4: 8-15. [ Links ]
4 Ali A., Naz S. and Iqbal J. (2007). Effect of different explants and media compositions for efficient somatic embryogenesis in sugarcane (Saccaharum officinarum). Pakistan Journal Botany. 39(6): 1961-1977. [ Links ]
5 Alves Garcia R., Oliveira L., Alves Moreira M. and Silva Barros W. 2005. Variation in emetine and cephaeline contents in roots of wild Ipecac (Psychotria ipecacuanha). Biochemical Systematics and Ecology. 33: 233-243. [ Links ]
6 Angoshtari R., Tavakkol Afshari R., Kalantari S. and Omidi M. 2009. Effects of abscisic acid on somatic embryogenesis and induction of desiccation tolerance in Brassica napus. Asian Journal of Plant Science. 8(4): 276-284. [ Links ]
7 Berros B., Rey M., Díaz-Sala C., Albuerne M. and Rodríguez R. 1995. Somatic embryogenesis in Hazelnut (Corylus Species). In: Biotechnology in Agriculture and Forestry 30 - Somatic Embryogenesis and Synthetic Seed I. Bajaj, Y.P.S. eds. Springer_Verlag. New York. pp. 318-334. [ Links ]
8 Brandão M., Zanetti N., Oliveira A., Grael C., Santos A. and Monte-Mór R. 2008. Brazilian medicinal plants described by 19th century European naturalists and in the Official Pharmacopoeia. Journal of Ethnopharmacology. 120: 141-148. [ Links ]
9 Chatterjee K., Nandi, P. and Ghosh C. 1982. Cultivation and utilization of ipecac In West Bengal. In: Atal, C.K.; Kapur, B. M. eds. Cultivation and utilization of medicinal plants. Jammu-Tawi, India: CSIR, Regional Research Laboratory. pp 295-301. [ Links ]
10 Gatica A. M., Arrieta G. and Espinosa A.M. 2008. Direct somatic embryogenesis in coffea arabica l. cvs. Caturra and catuaí: effect of triacontanol, light condition and medium consistency. Agronomía Costarricense. 32(1):139-147. [ Links ]
11 Hataa N., Hayashia Y., Okazawaa A., Onob E. Satakec H. and Kobayashi A. 2012. Effect of photoperiod on growth of the plants, and sesamin content and CYP81Q1 gene expression in the leaves of sesame (Sesamum indicum L.). Environmental and Experimental Botany. 75: 212- 219. [ Links ]
12 Hoareau L. and Da Silva E. 1999. Medicinal plants: a re-emerging health aid. Electronical Journal Biotechnology. 2: 56-71. [ Links ]
13 Hong-Wen Gao, Dong-Dong Ma and Gang Xu. 2012. Medicinal plant acid-treatment for a healthier herb tea and recycling of the spent herb residue. The Royal Society of Chemistry. 2: 5983-5989. [ Links ]
14 Hoshino T. and Cuello J. 2006. Environmental design consideration for somatic embryogenesis. Plant Cell Monograph (2) Mujib A and Samaj J (Ed.). Somatic Embryogenesis. Springer-Verlag Berlin Heidelberg. p. 357. [ Links ]
15 Ideda K.., Teshim, D., Aoyama T., Satake M. and Shimomura K. 1.988. Clonal propagation of Cephaelis ipecacuanha. Plant Cell Reports. 7:288-291. [ Links ]
16 Jha S. y Jha T. 1.989. Micropropagation of Cephaelis ipecacuanha Rich. Plant Cell Reports. 8:437 439. [ Links ]
17 Kaur M., Singh D., Ajmer S., Sandhu J., Singh Sidhu A. and Singh G. 2013. Effect of media composition and explant type on the regeneration of eggplant (Solanum melongena L.). African Journal of Biotechnology. 12(8): 860-866. [ Links ]
18 Khadke S. and Kuvalekar A. 2013. Direct Somatic Embryogenesis and Plant Regeneration from Leaf and Stem Explants of Nothapodytes foetida: A Critically Endangered. Plant Species. International Journal of Plant, Animal and Environmental Sciences. 3(1): 257-264. [ Links ]
19 Kintzios S. E., Hiureas G., Shortsianitis E., Sereti E., Blouhos P., Manos C., Makri O., Taravira N., Drossopoulos J. B. and Holevas C. D. 1998. The effect of light on the induction, development and maturation of somatic embryos from various horticultural and ornamental species. Acta Horticulturae (ISHS). 461:427-432. [ Links ]
20 kumari Sangita, Shukla Govind and Sambasiva Rao A. 2011. The Present Status of Medicinal Plants - Aspects and Prospects. International Journal of Research in Pharmaceutical and Biomedicine Sciences. 2(1): 11-22. [ Links ]
21 Kunle Oluyemisi, Folashade Egharevba, Omoregie Henry and Ahmadu Peter Ochogu. 2012. Standardization of herbal medicines - A review. International Journal of Biodiversity and Conservation. 4(3): 101-112. [ Links ]
22 Kurilcik A., Dapkuniene S., Kurilcik G., Šilinskaite S., Šukauskas A. and Duchovskis P. 2008. Effect of the photoperiod duration on the growth of Chrysanthemum plantlets in vitro. Scientific Works of the Lithuanian Institute of Horticulture and Lithuanian University of Agriculture. 27(2): 76-81. [ Links ]
23 Lara A., Valverde R. y Gómez L. 2.003. (a). Histología de Embriones Somáticos y Brotes Adventicios Inducidos en Hojas de Psychotria acuminata. Agronomía Costarricense. 27(1): 37-48. [ Links ]
24 Lara A., Valverde R. y Gómez L. 2.003. (b). Micropropagación de la planta medicinal Psychotria acuminata. Agronomía Costarricense. 27(2): 7-20. [ Links ]
25 Logan M. 2010. Biostatistical design and analysis using R. UK: Wiley-Blackwell, Inc. p. 546. [ Links ]
26 Marks T.R. and Simpson S.E. 1999. Effect of irradiance on shoot development in vitro. Plant Growth Regulation. 28: 133-142. [ Links ]
27 Mohajer Sadegh, Mat,Taha Rosna, Khorasani Arash and Syafawati Yaacob Jamilah. 2012. Induction of different types of callus and somatic embryogenesis in various explants of Sainfoin (Onobrychis sativa). Australian Journal of Crop Science. 6(8):1305-1313. [ Links ]
28 Murashige T., Skoog F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum. 15: 473-497. [ Links ]
29 Nomura T. and Kutchan T. 2010. Three new o-methyltransferases are sufficient for all o-methylation reactions of ipecac alkaloid biosynthesis in root culture of Psychotria ipecacuanha. The Journal of Biological Chemistry. 285 (10): 7722-7738. [ Links ]
30 Rout G.R., Samantaray S., and Das P. 2.000. in vitro somatic embryogenesis from callus cultures of Cephaelis ipecacuanha A. Richard. Scientia Horticulturae. 86: 71-79. [ Links ]
31 Pakhomov A.V., Emets A.I., Hu C.Y. and Blium B. 2004. Evaluation of embryological potential of soybean cultivars zoned in forest, steppe, and marshy woodlands of Ukraine as essential stage for the further transformation. Tsitol Genetic. 38(1):49-54. [ Links ]
32 Pakhomov A.V., Emets A.I. and Blium B. 2005. Comparative analysis of embryogenic potential of soybean cultivars zoned in different ecogeographic world regions. Tsitol Genetic. 39(5): 20-7. [ Links ]
33 Philip Robinson, Jayachandran Britto S. John and Balakrishnan V. 2009. Regeneration of Plants Through Somatic Embryogenesis in Emilia zeylanica C. B. Clarke a Potential Medicinal Herb. Botany Research International. 2 (1): 36-41. [ Links ]
34 Rout G.R. Samantaray S. and Das P. 2.000. in vitro somatic embryogenesis from callus cultures of Cephaelis ipecacuanha A. Richard. Scientia Horticulturae. 86: 71-79. [ Links ]
35 Satoko I., Kaori, T. y Koichiro, S. 2007. Gibberellic acid improved shoot multiplication in Cephaelis ipecacuanha. in vitro Celular and Developmental Biology Plant. 44(3): 216-220. [ Links ]
36 Siahsar B, Rahimi M, Tavassoli A, Raissi AS (2011) Application of Biotechnology in Production of Medicinal Plants. Journal Agriculture & Environmental Science. 11(3): 439-444. [ Links ]
37 Tangolar SG, Buyukalaca S, Ergenoglu F. 2008. High efficiency somatic embryogenesis from immature zygotic embryos of grapevine: the effect of genotype, media, 2, 4-d, and incubation conditions. Turkey Journal Agriculture Forestry. 32: 311-317. [ Links ]
38 Timofte A.I., Pamfil D., Palada-Nicolau M. and Timofte N.S. 2011. The effect of different factors upon the in vitro propagation in Quercus robur and Q. frainetto by Somatic Embryogenesis. Notulae Botanicae Horti AgrobotaniciCluj-Napoca. 39(1): 288-291. [ Links ]
39 Triqui Z.A, Guedir A, Chlyah, A., Chlyah H., Souvannavong V., Haicour R., Sihachakr D. 2008. Effect of genotype, gelling agent, and auxin on the induction of somatic embryogenesis in sweet potato (ipomoea batatas Lam.). Comptes Rendus Biologies. 331: 198-205. [ Links ]
40 World Health Organization. 2007. WHO guidelines for assessing quality of herbal medicines with reference to contaminants and residues. WHO Press. España. [ Links ]