Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.1 Bogotá jan./jun. 2014
https://doi.org/10.15446/rev.colomb.biote.v16n1.44281
http://dx.doi.org/10.15446/rev.colomb.biote.v16n1.44281
ARTÍCULO DE INVESTIGACIÓN
Evaluación de la fermentación del lactosuero ácido (entero y desproteinizado) utilizando Lactobacillus casei
Evaluation of acid whey fermentation (whole and deproteinized) using Lactobacillus casei
Título corto: Evaluación de la fermentación del lactosuero ácido
Katia Cury Regino1, Margarita Arteaga Márquez2, Guillermo Martínez Flórez3, Deivis Luján Rhenals4 y Alba Durango Villadiego5.
1 MSc. Departamento de Ingeniería Agroindustrial, Universidad de Sucre. Cra. 28 # 5-267, Sincelejo, Colombia. katiacuryr@hotmail.com
2 MSc. Departamento de Ingenierías, Universidad de Córdoba.
3 Doctor en Estadística. Departamento de Matemáticas y Estadística, Universidad de Córdoba.
4 Doctor en ciencia de los alimentos. Departamento de Ingenierías, Universidad de Córdoba.
5 Doctor en ciencia y tecnología de alimentos. Departamento de Ingenierías. Universidad de Córdoba.
Recibido: noviembre 16 de 2013 Aprobado: mayo 2 de 2014
Resumen
El lactosuero acidificado espontáneamente pone en riesgo la salud del consumidor al utilizarlo como acidificante de la leche usada en la elaboración del queso tipo mozzarella, y además reduce la calidad del producto. El objetivo de esta investigación fue evaluar el proceso de fermentación del lactosuero ácido (entero y desproteinizado) con Lactobacillus casei, utilizando diferentes porcentajes de su inóculo. Se caracterizaron fisicoquímicamente los lactosueros, sometiéndolos a fermentación anaeróbica a 37°C y 120 rpm por 96 h. Se evaluó la concentración de biomasa celular, el consumo de lactosa, la producción de ácido láctico (AL) y se estimaron los parámetros cinéticos y estequiométricos. Se aplicó un diseño experimental completamente al azar con arreglo factorial 2x3, empleando la metodología de medidas repetidas. Los datos, se procesaron a través de los paquetes estadísticos SAS® versión 9 y Statgraphics Centurión XVI®. El lactosuero, entero y desproteinizado, se encontró dentro de los intervalos fisicoquímicos aceptables para su acidificación. Los valores de acidez fueron superiores a 120 Grados Dornic (120°D) con la inoculación de L. casei, excepto en lactosuero desproteinizado, inoculado con 15% de cultivo. El lactosuero entero con 15% de inóculo, alcanzo 120°D en el menor tiempo (34h). Altas concentraciones de inóculo (15%) favorecieron la acidificación en el lactosuero entero, mostrando la mayor producción (20.83gAL/l), Y´p/s=0.86, Qp=0.173gAL/l*h; mientras el lactosuero desproteinizado mostró un mayor crecimiento microbiano, menor conversión de lactosa (8.2%) y menor producción media de ácido láctico (8.19g/l).
Palabras clave: suero lácteo, ácido láctico, queso hilado, parámetros cinéticos.
Abstract
The spontaneously acidified whey threatens consumer health and reduces quality of mozzarella cheese. The goal of this research was to evaluate the acidification process of acid whey (whole and deproteinized) by fermentation with different inoculum concentrations of Lactobacillus casei. The whey was physicochemically characterized and anaerobically fermented at 37°C and120 rpm during 96h. Cellular biomass was evaluated, as well as lactose consumption, lactic acid production, kinetic and stoichiometric parameters were estimated. A completely randomized design with factorial arrangement (2x3) was applied by using the repeated measures methodology. Data was processed by using SAS® statistical package, version 9 and Statgraphics Centurion XVI®. The acidification for the whole and deproteinized whey was found within the acceptable intervals. Acidification values were above 120 degrees Dornic (120°D) with L. casei inoculation, except in the deproteinized whey inoculated with 15% of inoculum. The whole whey with 15% of inoculum reached 120°D in the shortest time (34 hours). High concentrations of inoculum (15%) aided the acidification in whole whey and showed the highest production (20.83 g LA/l), and p/s=0.86, Qp=0.173 g AL/l*h; on the other hand, the deproteinized whey showed the highest microbial growth, lowest conversion of lactose (8.2%) and lowest lactic acid production (8.19g/l).
Key words: whey, lactic acid, cheese yarn, kinetic parameters.
Introducción
En los procesos de obtención de queso, caseína o coprecipitados, se genera lactosuero. Se estima que a partir de 10 litros de leche de vaca se puede producir de 1 a 2 kg de queso y un promedio de 8 a 9 kg de lactosuero, lo cual representa cerca del 85 - 90% del volumen de la leche, que contiene alrededor del 55% de sus nutrientes; es decir que el volumen de lactosuero es aproximadamente 7 a 10 veces mayor que el queso producido, según su variedad (Liu et al., 2005; Callejas et al., 2012).
Actualmente, la producción de lactosuero se constituye en un problema ambiental (Parra, 2009); si se consideran los altos volúmenes producidos, su vertimiento en fuentes naturales de agua o en suelos sin haber sido sometido a tratamiento y sin considerar su carácter contaminante, dada la cantidad de nutrientes que posee. Sólo una parte de lactosuero producido es aprovechado adecuadamente, aproximadamente el 47% de las 115 millones de toneladas de lactosuero producido a nivel mundial son desechadas al ambiente sin tratamiento previo, lo que además de ocasionar un gran daño ecológico, también representa una pérdida significativa de recursos (Guerrero et al., 2012). Se estima que, en términos de composición y de valor energético, los sólidos del lactosuero son comparables a la harina de trigo (357 Kcal/100 g) (Inda, 2000; Lagua, 2011).
Como consecuencias de su inadecuada disposición, en los suelos se produce saturación de los mismos y en las aguas, debido a la presencia de alto contenido de nutrientes en el lactosuero, se genera un contenido de materia orgánica del 40 al 60 g/l de Demanda Bioquímica de Oxígeno (DBO) y entre 50 y 80 g/l de Demanda Química de Oxígeno (DQO) de lactosuero líquido (Kavacik y Tapaloglu, 2010; Guerrero et al., 2012), siendo la lactosa el principal componente de los sólidos que contribuye a la alta DBO y DQO (Ghaly y Kamal, 2004; Mukhopadhyay et al., 2005; Koutinas et al., 2009; Almeida et al., 2009; Kavacik y Tapaloglu, 2010, Guerrero et al., 2012).
Para el año 2012, Colombia presento una producción de 10 millones de kilogramos de queso comercializado, en los Departamentos de Antioquia y Cundinamarca, de donde se produjeron aproximadamente 90.000.000 l de lactosuero (Martínez, 2012). En los Departamentos de Córdoba y Sucre, alrededor del 70% del total de la producción lechera se destina a la elaboración de queso, ya sea artesanal o industrialmente. La fabricación no estandarizada de quesos constituye un renglón importante en la economía de muchos pobladores, siendo un producto de consumo masivo (Gallegos et al., 2007). Empresas productoras de quesillo o queso tipo mozzarella fermentan de manera espontánea el lactosuero por acción de microorganismos presentes en él, proveniente de la leche cruda o por contaminación durante el proceso, esta reacción es favorecida por los sustratos que contiene el lactosuero y la temperatura ambiental (32ºC) de la región, pero estas fermentaciones se producen de manera no controlada de modo que en algunos casos podrían representar un riesgo para la salud del consumidor y van en detrimento de la calidad del producto obtenido; lo conveniente es realizar fermentaciones controladas empleando microorganismos y condiciones adecuadas para garantizar mejoras en el proceso y en el producto obtenido.
El propósito de esta investigación fue evaluar el proceso de acidificación de lactosuero ácido (entero y desproteinizado) por fermentación con Lactobacillus casei, para su utilización en elaboración de quesos de pasta hilada, buscando determinar la influencia del tratamiento aplicado al lactosuero y el porcentaje de inóculo adicionado, como alternativa para el aprovechamiento de los nutrientes que contiene este subproducto, de modo que sea posible desarrollar una tecnología que permita suprimir la fermentación espontánea del lactosuero, la que afecta la calidad sanitaria del producto terminado, y mejorar las características organolépticas del mismo; aprovechando que el empleo de L.casei produce un sabor ácido, inhibición de organismos patógenos, reducción de contenido de lactosa y formación de aromas, entre otros (Parra, 2010).
Metodología
Localización del proyecto. El estudio se realizó en la Planta Piloto de Operaciones Unitarias de la Universidad de Sucre, ubicada en la Granja Los Pericos del Municipio de Sampués - Sucre, Colombia. Los análisis fisicoquímicos se desarrollaron en los Laboratorios de Bromatología y Bioingeniería, y de Microbiología de la Universidad de Sucre, y en el Laboratorio de Control de Calidad de la empresa Colquesos.
Obtención de los lactosueros. Los lactosueros utilizados para el estudio proceden de la elaboración de queso tipo Mozzarella (lactosuero ácido entero) y a partir del proceso de obtención de requesón (lactosuero ácido desproteinizado), procesos desarrollado por la empresa Colquesos. Fueron almacenados en refrigeración a 4ºC para posteriores análisis.
Caracterización de los lactosueros utilizados. Los lactosueros se caracterizaron fisicoquímicamente utilizando las técnicas que se describen a continuación: Acidez (AOAC 947.05, 2009 adaptado; Jaramillo, 1993), Densidad (AOAC 925.22, 1990), pH (AOAC 981.12, 1990), Sólidos Totales (AOAC 925.105, 1990 adaptado), Proteína (AOAC 920.05, 1990 adaptado), Nitrógeno (AOAC 976.06, 1990), Materia grasa (AOAC 989.04, 1990 adaptado, CAA, Tomo II, 13-8, 1989), Cenizas (AOAC 945.05, 1990 adaptado) y Lactosa (AOAC 16051, 1984). Las mediciones fueron realizadas en base húmeda.
Fermentación
Activación del microorganismo y mantenimiento del cultivo
Cepas liofilizadas de Lactobacillus casei ATCC 393®, fueron activadas según las instrucciones del inserto. A partir de cultivo obtenido, se realizaron repiques periódicos de las cepas en agar MRS®, incubándolas a 37°C durante dos días y posteriormente almacenándolas a 4°C (Hujanen y Linko, 1996).
Preparación del Cultivo Madre. 800 ml de leche entera UHT, fueron calentadados a 37°C e inoculados con 5-6 azadas del caldo de cultivo de la cepa Lactobacillus casei ATTC 393®, previamente activado, que presentaba una turbidez de 0.5 en la escala de McFarland, lo cual corresponde a aproximadamente 1 a 2 x 106 UFC/ml; luego se incubó a 37°C hasta formar un coágulo transparente y firme; característica tomada como referencia, considerando que las bacterias ácido lácticas como Lactobacillus casei en productos como la leche, tienen la capacidad de formar geles (Parra, 2010). Desde la siembra, hasta la formación del coágulo, se realizaron mediciones de biomasa con Cámara de Neubauer, cada 2 horas y se midió la acidez.
Para el control se tomaron 100 ml de leche entera UHT a 37ºC, que fueron incubadas sin la siembra del microorganismo de modo que se pudiera comprobar la no existencia de contaminación por presencia de otros microorganismos.
Pretratamiento de lactosueros y preparación del cultivo de adaptación (Preinóculo). El lactosuero ácido entero se sometió a pasteurización lenta para garantizar el crecimiento del cultivo seleccionado, sin lograr la desproteinización del mismo; posteriormente fue enfriado hasta 37°C. Para el lactosuero desproteinizado (procedente de un tratamiento térmico severo) no se consideró necesario la pasteurización.
Se preparó un cultivo de adaptación (Preinóculo) para cada lactosuero, empleando 10% del cultivo madre y adicionando los lactosueros hasta completar 1000 ml. No se suplementaron los lactosueros, debido a que se quería conocer su capacidad como sustrato únicamente con su composición usual (Álvarez y Aguirre, 2008). Se realizaron mediciones de pH, acidez y recuento de microorganismos, en intervalos de una hora; se consideró que los cultivos presentaban condiciones óptimas para ser inoculados al observar un conteo superior a 108 UFC/ml, momento en el cual se suspendió la fermentación mediante una disminución lenta de la temperatura a 4ºC.
Proceso de fermentación batch. La fermentación se llevó a cabo en 6 montajes diseñados siguiendo las especificaciones del fermentador aerobio - anaerobio TECFERM® 2L serie 0204, fabricado por Tecferm y distribuido por PBM Colombia (2003). Se realizaron 3 repeticiones por cada batch, se controló la temperatura a 37°C (Serna y Rodríguez, 2005b; Aguirre et al., 2009; Escobar et al., 2010; García, 2012), con agitación a 120 rpm durante 96 h (Lee, 2005; Serna y Rodríguez, 2005 a,b; Serna y Rodríguez, 2007). No se suministro oxigeno.
Los lactosueros fueron inoculados con cepas del cultivo de Lactobacillus casei, en un 5, 10 y 15% (v/v) de los 700 ml en cada repetición, bajo condiciones asépticas. Para el control, se sometieron ambos lactosueros a las mismas condiciones de fermentación, pero sin la adición de microorganismo.
Seguimiento de la fermentación. Se realizó un seguimiento de los parámetros: consumo de sustrato, recuento en placa, acidez desarrollada, contenido de nitrógeno y proteína y estimación de parámetros cinéticos. Se realizaron mediciones a las 2, 4, 6, 8, 10, 22, 34, 46, 58, 72 y 96 horas.
Consumo de sustrato. Para establecer el comportamiento en relación al consumo de sustrato (lactosa), se tomó como base la curva patrón de azúcares reductores, determinada por el método colorimétrico modificado DNS (ácido dinitrosalicilico). La concentración de lactosa del medio de cultivo, fue medida por el método espectrofotométrico a 540 nm (AOAC 16051, 1984; Serna y Rodríguez, 2005a; Serna y Rodríguez, 2007).
Recuento en placa. Se utilizó peptona universal (0.1% p/v), para realizar diluciones sucesivas de las muestras inoculadas hasta 108 UFC/ml en proporción 1:9. Se sembró en profundidad en agar MRS y se incubó a 37oC, por 72h en condiciones de anaerobiosis. El conteo de células viables se realizó como UFC/ml y se expresó como unidades logarítmicas (UFC/ml). Para cada sustrato en los tiempos de control, el recuento se efectuó por triplicado. Se estableció, a través de preensayos que se debían realizar diluciones de 10-7 y 10-8 UFC/ml.
Acidez desarrollada. Fue medida mediante titulación según AOAC 947.05, 2009, en grados Dornic (ºD).Tomando como referencia la acidez requerida en lactosuero a emplear en elaboración de quesos de pasta hilada, según lo reportado por la empresa Colquesos (mínimo 120°D) (información primaria; suministrada por el departamento de calidad de la empresa Colquesos, Jaramillo et al., 1993).
Contenido de nitrógeno y proteína. Fue determinado por el método Kjeldahl (AOAC 976.06, 1995), para luego calcular el porcentaje de proteína.
Estimación de parámetros cinéticos. Se calcularon los parámetros cinéticos Y´p/s: Rendimiento del producto a partir del sustrato, Y´p/x: rendimiento del producto con respecto a la biomasa, Qp: Productividad volumétrica del ácido láctico, Qx: Productividad volumétrica de biomasa, a través de las variables de respuesta: concentraciones de lactosa, recuento en placa y acidez, en relación al tiempo de fermentación para cada uno de los tratamientos. (Jakymec et al., 2001; García, 2012).
Procesamiento y análisis. Se aplicó análisis de varianza ANAVA, pruebas de comparación de Duncan y polinomios ortogonales. Se realizaron análisis por cada tiempo y al final se realizó una regresión para ver el efecto del tiempo. Como prueba de validación se aplicó Shapiro-Wilk y la prueba de homogeneidad de varianza de Hartley.
Los parámetros estequiométricos y cinéticos fueron evaluados aplicando un análisis de varianza (ANOVA) a los diferentes tratamientos y una prueba de comparación de medias de Duncan a los tratamientos que mostraron diferencias significativas (p<0.05).
Se aplicó un diseño experimental completamente al azar con arreglo factorial 2x3, donde el factor 1 fue el tipo de lactosuero empleado, con 2 niveles (suero ácido entero y suero ácido desproteinizado) y el factor 2 fue la cantidad de inóculo empleado, con 3 niveles 5, 10 y 15%, con tres repeticiones, para un total de 18 unidades experimentales. Se evaluó el consumo de lactosa, producción de ácido láctico, los parámetros cinéticos y estequiométricos durante las 96 horas de fermentación. Se emplearon los programas estadísticos STATGRAPHICS® Centurión XVI (Warrenton, Virginia. U.S.A, 2009) y SAS® versión 9 (North Carolina, USA, 2003).
Resultados y Discusión
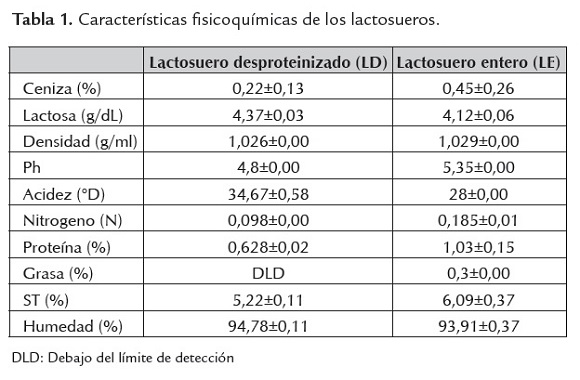
Caracterización del lactosuero. En la tabla 1 se muestran las características fisicoquímicas de los lactosueros empleados en la investigación.
La caracterización realizada a los lactosueros coincide con el intervalo de valores reportado para lactosuero ácido y lactosuero de requesón por Guerrero et al., (2012). En el suero desproteinizado se observa una mayor concentración de acidez que en el entero, posiblemente causada por el calor al efectuar la desproteinización, al igual que una disminución en el contenido de nitrógeno. Los valores de nitrógeno y proteína para este suero son comparables a los encontrados por Urribarri et al. (2004). Los resultados obtenidos para el lactosuero entero son similares a los reportados por Monsalve y González (2005); Madrid (1994); Panesar et al. (2007) y Franchi (2010).
El valor del pH en los dos tipos de lactosueros, los define como sueros ácidos (Miranda et al., 2009), pudiéndose considerar medianamente ácido al suero entero y ácido al desproteinizado, de acuerdo a lo observado por Gutiérrez (2006); estudios realizados señalan que la mayoría de las bacterias ácido lácticas tienen alta tolerancia a pH por debajo de 5.0, lo que les da ventaja competitiva sobre otras bacterias (Hofvendahl y Hahn-Hägerdal, 2000).
Relación de la acidificación con el tipo de lactosuero e inóculo. Al evaluar la interacción entre el tipo de lactosuero y la concentración del inóculo, se aprecia una diferencia altamente significativa (p<0,05) en los tiempos de fermentación analizados, por lo que influye en la formación del ácido láctico; observándose un efecto favorable a mayor concentración de inóculo y lactosuero desproteinizado; Obteniéndose con el lactosuero entero y 15% de inoculo, la acidez más alta con un promedio de 108°D, en los demás casos se formaron dos grupos estadísticamente significativos conformados por los tratamientos con lactosuero entero inoculado con 5 y 10%; lactosuero desproteinizado inoculado con 5, 10 y 15%. El tratamiento con mayor acidez se presentó en los lactosueros enteros; el inóculo del 15% logró una mayor acidez media en todos los tratamientos y las concentraciones de 5 y 10%, no mostro diferencias significativas para el porcentaje de inóculo (p>0,05).
Se observa que el lactosuero entero y las altas concentraciones del inóculo al inicio de la fermentación favorecen una alta acidificación del medio. Similar a lo reportado por Aguirre et al. (2009) y Hernandez-Miranda et al. (2007), quienes afirman que el crecimiento de los Lactobacillus se debe en parte a la composición de nutrientes de la materia prima inicial y el nivel de inóculo utilizado.
Entre los dos tipos de lactosuero, no se presentaron diferencias estadísticamente significativas (p<0,05) en el valor de la acidez durante las primeras 10h de la fermentación. Lo cual concuerda con lo reportado por Machado et al. (2007), quienes establecieron que a mayores tiempos de fermentación del suero lácteo se obtiene mayor cantidad de ácido láctico. Sin embargo, investigaciones Aguirre y colaboradores (2009), señalan que la producción de ácido láctico inhibe el desarrollo de biomasa del L. casei. Para contrarrestar este efecto, se recomienda la estrategia de cultivo por lote alimentado, la cual consiste en realizar montajes de cultivo en batch en donde se pueda alimentar continuamente medio nutritivo fresco o alguno de sus componentes.
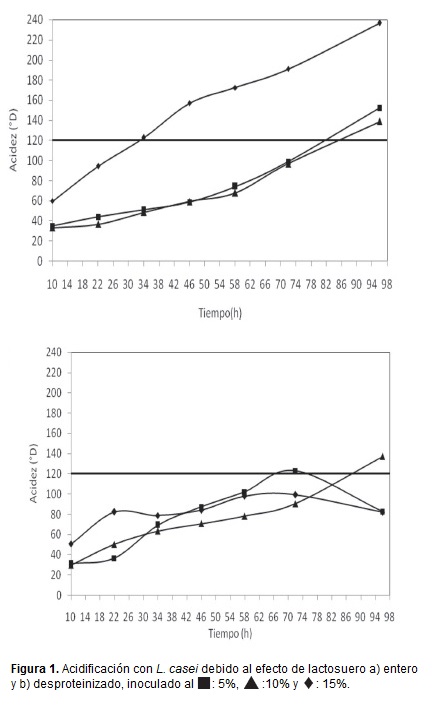
Para la elaboración de quesos de pasta hilada, se requiere el uso de lactosuero ácido con 120°D mínimo (información primaria, suministrada por el departamento de calidad de la empresa Colquesos; Jaramillo et al., 1993). En la figura 1 se muestra el comportamiento de la acidificación de los tratamientos con lactosuero entero y lactosuero desproteinizado inoculado al 5% y 10% y 15% con L. casei.
En los tratamientos con lactosuero entero inoculados al 5 y 10%, el valor de referencia (120°D), se alcanzó a las 82 y 86h, respectivamente; mientras que con el lactosuero desproteinizado el valor se alcanzó a las 72h y 87h, respectivamente. En el tiempo de 34h, el lactosuero entero inoculado al 15% alcanzó la acidez deseada, lo cual no se consiguió para el suero desproteinizado aun completándose las 96h de la fermentación.
Como sustrato, el lactosuero entero mostro un comportamiento que favorece la síntesis de producto, mientras el lactosuero desproteinizado beneficia el crecimiento del microorganismo, este comportamiento está acorde con los estudios reportados por Orozco y Solarte (2003), en donde los microorganismos toman los nutrientes del medio y lo utilizan para llevar a cabo todas sus funciones metabólicas, una vez que se verifica el crecimiento de la biomasa se favorece la biosíntesis de un metabolito como producto. En muchos casos el producto de las fermentaciones industriales es la biomasa, pero en la gran mayoría de los esquemas de producción son sustancias de alto valor agregado por fermentación.
Cinética de crecimiento, consumo de sustrato y formación del producto.
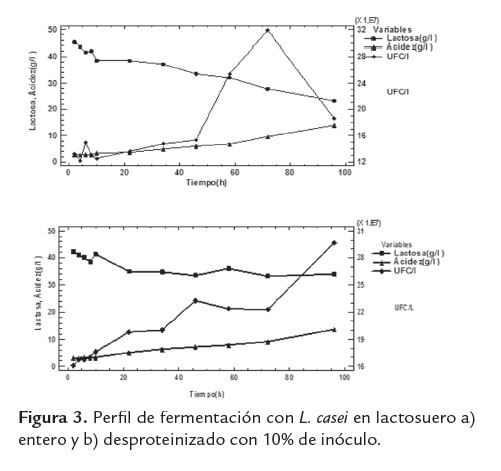
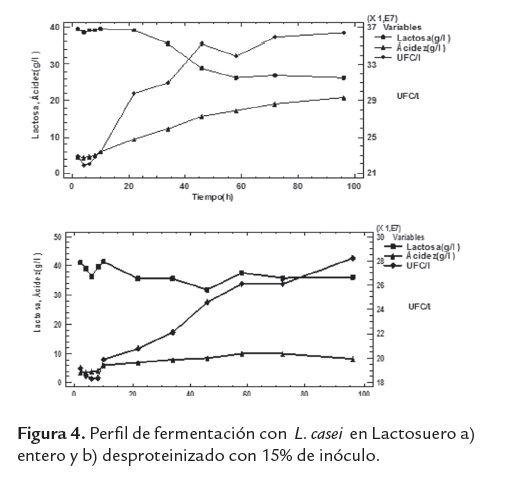
En las figuras 2, 3 y 4 se muestra la evolución en la formación de ácido láctico, concentración de lactosa y recuento de L. casei, durante la fermentación de los lactosueros con diferentes porcentajes de inóculos.
Se evidenció que en los medios con 5% de inóculo (figura 2) al final del periodo de fermentación (96h) la concentración de lactosa fue de 27,7 g/l en el lactosuero entero y 40,1 g/l en el desproteinizado, correspondiente a una conversión del 32,8% y 8,2% de lactosa, respectivamente. Esto concuerda con lo encontrado por Serna y Rodríguez (2007), quienes concluyeron que la concentración de azúcares totales muestra un efecto inverso sobre la concentración de ácido láctico.
El mayor crecimiento fue de 3,08 x 108 UFC/l en el lactosuero desproteinizado y de 2,88 x 108 UFC/l en el entero, a las 96h de fermentación. El comportamiento del lactosuero desproteinizado al ser empleado como sustrato, sugiere que en este se encuentran, además de los micronutrientes señalados en la caracterización, factores de crecimiento, aminoácidos y ácidos grasos, considerados esenciales para el crecimiento y la producción de ácido láctico por L.casei. Comportamientos similares fueron reportados por Serna y Rodríguez (2007).
En los medios inoculados con 10% del cultivo (figura 3), para el lactosuero entero y desproteinizado, se logró una conversión de lactosa del 43,6% y 22,2% y una concentración de ácido láctico 13,9g/l y de 13,7 g/l, respectivamente. Al final de la fermentación del lactosuero entero e inoculado con 10%, se observa una reducción del crecimiento del microorganismo de 3,16 x 108 UFC/l a las 72h hasta 1,86 x 108 UFC/l a las 96h; mientras en el lactosuero desproteinizado no se observó reducción del crecimiento. Estudios realizados por Jakimec et al. (2001) demostraron que los rendimientos de biomasa disminuyen al aumentar la concentración de lactosa, de modo que la mayor concentración de ácido láctico se obtiene en suero desproteinizado sin adición de lactosa, evidenciando que entre mayor es la concentración del sustrato, mayor es la velocidad de consumo y que la producción de ácido láctico origina una disminución del pH en el medio, lo cual afecta el crecimiento, el consumo y la producción. Este efecto se presentó con el lactosuero entero, que muestra mayor producción de ácido, pero menor crecimiento en términos de biomasa.
Con respecto a los medios inoculados con un 15% del cultivo (figura 4), durante la fermentación del lactosuero entero, se logró la mayor concentración final de ácido láctico (20,8 g/l), una conversión de 36,2% de lactosa y 3,63 x 108 UFC/l de L. casei; caso contrario en el lactosuero desproteinizado donde se obtuvo la menor concentración final de ácido láctico (8,1g/l).
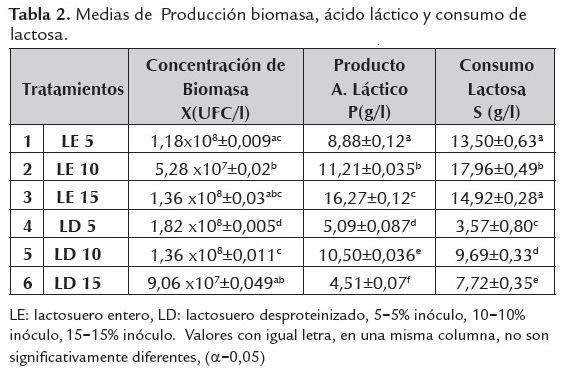
Las figuras 2, 3 y 4 concuerdan con lo reportado en la tabla 2, donde se observa que los tratamientos con lactosuero entero obtuvieron las mayores conversiones de lactosa a ácido láctico, a las tres concentraciones de inóculo. La menor conversión (8,2%) fue en el lactosuero desproteinizado e inoculado con 5% de L. casei y 5,09g/l de ácido láctico, mostrando que la fermentación se direccionó al desarrollo del L. casei.
La concentración promedio de Lactobacillus casei fue de 2,82x108±0,097 UFC/l a las 96h de fermentación. De acuerdo con lo reportado por García (2012) se confirma que el efecto de la suplementación favorece la bioconversión a ácido, ya que cuando se suplementó con una fuente de nitrógeno se mejoró la velocidad de bioconversión, duplicándose el ácido láctico producido (De Lima et al., 2009).
En la tabla 2, se presentan los valores medios obtenidos de la concentración de la biomasa de L. casei, ácido láctico y lactosa para los diferentes tratamientos a través del tiempo de fermentación. Se observó que el tipo de lactosuero, inóculo y la interacción de estos muestran un efecto significativo (p<0,05) sobre el crecimiento, el consumo de sustrato, la formación de producto y los rendimientos de la fermentación.
El tratamiento con lactosuero desproteinizado inoculado al 5% favoreció el crecimiento del L. casei comparado con el lactosuero entero, donde se obtuvo el menor crecimiento con el inóculo del 10% de cultivo. Respecto a la producción, cabe destacar que el tratamiento con lactosuero entero y 15% de inóculo, mostró la mayor producción de ácido láctico, mientras que el lactosuero desproteinizado con 15% de inóculo presentó la menor. En cuanto al consumo de lactosa, el tratamiento con lactosuero entero y 10% de inóculo, presento el mayor consumo de lactosa, y el lactosuero desproteinizado con 5% de inóculo evidencio el menor; lo cual indica que el lactosuero desproteinizado fue un medio propicio para el desarrollo del microorganismo en lugar de sintetizar producto, mientras que en el lactosuero entero el rendimiento del producto con respecto a la biomasa (Y´p/x) fue superior.
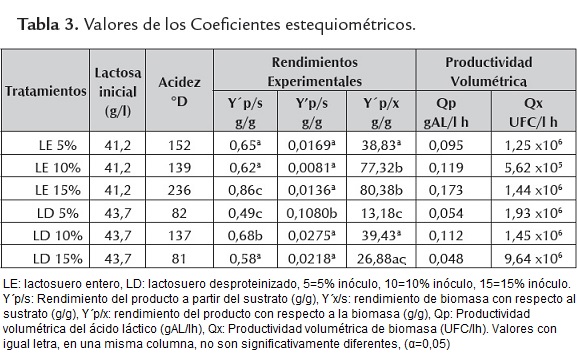
Parámetros fermentativos. Basado en los datos experimentales de concentración de lactosa, ácido láctico y recuento de L. casei, los coeficientes estequiométricos fueron determinados para formación de producto, consumo de sustrato y biomasa (tabla 3) en cada uno de los tratamientos, donde los factores de variación mostraron un efecto significativo (p<0,05) sobre estos. El rendimiento de producto a partir del sustrato (Y´p/s) fue más estable en los tratamientos con lactosuero entero que cuando se usó el desproteinizado, y no está relacionado directamente con el logro de la acidificación del medio al estándar requerido (120°D). El medio con lactosuero entero e inoculado con 15% de cultivo madre logró la acidificación a las 34h de fermentación, contrastado con el mejor rendimiento Y´p/x igual a 80,38.
Los rendimientos obtenidos Y'p/s son superiores a los reportados por Mirdamadi et al. (2008) quienes encontraron rendimientos de 0,47 a 0,33 (g ácido láctico / g lactosa) cuando suplementaron con glucosa, por otro lado, Plessas et al. (2008) obtuvieron rendimientos de 0,23 (g ácido láctico / g lactosa) en lactosuero diluido y no diluido usando L. helveticus, al igual que a los obtenidos por Aguirre et al. (2009) en suero de leche de cabra en un cultivo batch (Yp/s de 0,52 g ácido láctico / g lactosa quienes emplearon suero de leche de cabra en un cultivo batch y por García (2012) quienempleando lactosuero desproteinizado suplementado con sulfato de amonio y lactosa logro rendimientos de 0,5306 y 0,2488 (g ácido láctico / g lactosa).
El máximo rendimiento teórico de ácido láctico producido debe ser de 1,05 g Ac. Láctico/g Lactosa, lo cual en la práctica, generalmente no ocurre y se obtienen rendimientos de alrededor un 85% en los mejores casos (Serna y Rodríguez, 2005b). Los resultados de este estudio difieren con lo observado en sustratos como el lactosuero, dado que en condiciones teóricas un sustrato puro adicionaría una fuente de vitaminas y cofactores que son aprovechados en su totalidad, sin considerar que una parte de estos en la realidad no son transformados, pues son usados para la realización de las actividades metabólicas del microorganismo.
Los resultados muestran que altas concentraciones de inóculo favorecen la acidificación en el lactosuero entero, mientras que en el lactosuero desproteinizado el crecimiento microbiano fue mayor y favorecido por la baja concentración inicial de inóculo. Varios factores estimulan el crecimiento y tienen considerable efecto sobre la producción de ácido láctico, entre ellos la mezcla de aminoácidos y péptidos usualmente no solo estimulan el crecimiento y resultan en velocidades de crecimiento mucho más altas (Vásquez, 2008).
La evaluación de la productividad Qp y Qx, evidenció que el tratamiento con lactosuero entero y 15% de inóculo presentó mayor productividad en relación a la formación de ácido láctico, siendo la menor la obtenida en el lactosuero desproteinizado inoculado con 5% de L. casei; esto concuerda con el comportamiento mostrado al evaluar los rendimientos Y´p/s en esta investigación, y con lo establecido por Serna y Rodríguez (2005b), para quienes las cepas que generan altas concentraciones y rendimientos, tienen altas productividades.
Respecto a Qx, se encontró que la mayor productividad fue obtenida en el lactosuero desproteinizado con 5% de inóculo, y la menor en el tratamiento con lactosuero entero inoculado con 10% de L. casei, estos resultados concuerdan con lo establecido por Aguirre et al. (2009), quienes afirman que dado que el producto principal del metabolismo de L. casei es el ácido láctico, se inhibe el desarrollo de biomasa, recomendando el uso de la estrategia de cultivo por lote alimentado para conseguir altas productividades, tanto de biomasa como de producto.
En otra investigación similar, Urribarrí et al. (2004), evaluo la producción de acido láctico a partir de lactosuero desproteinizado suplementado con extracto de levadura y peptona trípsica de caseína fermentada en un cultivo continuo con L. helveticus, se encontró una tasa específica de crecimiento máximo de μmax= 0,469 ± 0,012/h, un rendimiento real de Yc= 0,759 ± 0,061 kg de biomasa producido/ kg de lactosa consumido para crecimiento, similar a lo observado en la presente investigación para el lactosuero entero con 10% de inóculo. La máxima concentración de biomasa y ácido láctico fue de 55 y 10,97 kg/m3, siendo la máxima productividad de biomasa y ácido láctico 6,2 y 1,83 kg/m3.h, respectivamente. Estos resultados sugieren el potencial uso del lactosuero como sustrato para bacterias homolacticas (Urribarrí et al., 2004).
Conclusiones
Los parámetros fisicoquímicos de los lactosueros entero y desproteinizado provenientes de la elaboración de queso tipo mozzarella y requesón, se encuentran dentro de los intervalos aceptables para su acidificación y posterior empleo como suero ácido en la elaboración de nuevos lotes de producción de este tipo de queso.
La acidificación del lactosuero en los diferentes tratamientos se logró con la inoculación de L. casei a 37°C, 96h y 120rpm, obteniéndose valores superiores a 120ºD, excepto en el lactosuero desproteinizado con 15% de cultivo.
El lactosuero entero inoculado al 15% con L. casei presentó el menor tiempo de acidificación, mayor valor de Y´p/s = 0,86 g/g, al igual que la mayor productividad (0,173 gAL/lh). Sin embargo, el mayor crecimiento del cultivo se experimentó en lactosueros desproteinizados, sin alcanzar el valor de acidificación deseada durante el tiempo de fermentación.
Agradecimientos
Los autores agradecen el apoyo para el desarrollo de esta investigación a la empresa Colquesos, a la Universidad de Córdoba (Colombia) y su programa de Maestría en Ciencia Agroalimentarias, a la Universidad de Sucre y a la Secretaria de Desarrollo Económico y Medio Ambiente de la Gobernación de Sucre.
Referencias bibliográficas
1 Aguirre E. J., Ramírez A., Álvarez M. 2009. Producción de Lactobacillus casei a partir de suero de leche en cultivos batch, fed-batch y continuo. En: XIII Congreso Nacional de Biotecnología y Bioingeniería y VII Simposio Internacional de Producción de Alcoholes y Levaduras. Acapulco, México: Sociedad Mexicana de Biotecnología y Bioingeniería. [ Links ]
2 Almeida K.E., Tamime A.Y, Oliveira M.N. 2009. Influence of total solids contents of milk whey on the acidifying profile and viability of various lactic acid bacteria. LWT - Food Science and Technology. 42(2): 672-678. [ Links ]
3 Álvarez M., Aguirre J. 2008. Proceso de alto rendimiento para la producción de biomasa probiótica de bacterias lácticas a partir de suero de leche no suplementado. Patente mexicana en trámite. MX/a/2008/016564. [ Links ]
4 A.O.A.C. Association of Official Analytical Chemists. Manual of Official Methods of Analysis. 13th Edition. 1990. Washington, USA. [ Links ]
5 A.O.A.C. Association of Official Analytical Chemists. Manual of Official Methods of Analysis. 15th Edition. 1995. Washington, USA. [ Links ]
6 Callejas J., Prieto F., Reyes V., Marmolejo Y., Méndez M. 2012. Caracterización fisicoquímica de un lactosuero: potencialidad de recuperación de fósforo. Acta Universitaria. 22(1): 11-18 [ Links ]
7 De Lima C., Fontes L., Blanco K., Contiero J. 2009. Response surface optimization of D(-)-lactic acid production from Lactobacillus SMI8 using corn steep liquor and yeast autolysate as nitrogen sources. African Journal of Biotechnology. 8 (21): 5842-5846. [ Links ]
8 Escobar L., Rojas C., Giraldo G., Padilla L. 2010. Evaluación del crecimiento de Lactobacillus casei y producción de ácido láctico usando como sustrato el suero de leche de vacuno. Revista de Investigaciones de la Universidad del Quindío. (20):42-49. [ Links ]
9 Franchi O. 2010. Suero de leche, propiedades y usos. Recuperado de http://www.buenastareas.com/ensayos/Suero-De-Leche-Usos/1792630.html. [ Links ]
10 Gallegos J., Arrieta G., Mattar S. Poutou R., Trespalacios A., Carrascal A. 2007. Frecuencia de Listeria spp., en quesos colombianos costeños. Revista MVZ Córdoba. 12(2): 996-1012. Disponible en: http://revistas.unicordoba.edu.co/ojs/index.php/mvz/article/viewFile/139/136 [ Links ]
11 Garcia, C. 2012. Producción de ácido láctico l(+) a partir de lactosuero utilizando Lactobacillus casei en un cultivo batch. Tesis de Maestría en Ciencias Agroalimentarias. Universidad de Córdoba. [ Links ]
12 Ghaly A., Kamal M. 2004. Submerged yeast fermentation of acid cheese whey for protein production and pollution potential reduction. Water Research. 38(3): 631-644. [ Links ]
13 Guerrero W., Castilla P., Cárdenas K., Gómez C., Castro J. 2012. Degradación anaerobia de dos tipos de lactosuero en reactores UASB. Tecnología Química. 33(1): 99-106. [ Links ]
14 Hofvendahl K., Hahn-Hägerdal B. 2000. Factors affecting the fermentative lactic acid production from renewable resources. Enzyme and Microbial Technology. 26(2): 87-107. [ Links ]
15 Hujanen M., Linko Y. 1996. Effect of temperature and various nitrogen sources on L(+) lactic acid production by Lactobacillus casei. Applied Microbiology and Biotechnology. 45(3): 307- 313. [ Links ]
16 Inda A., 2000. Optimización de Rendimiento y Aseguramiento de Inocuidad en la Industria de la Quesería. Una guía para la pequeña y mediana empresa. Organización de los Estados Americanos (OEA), División de Ciencia y Tecnología. pp. 63-93. México [ Links ]
17 Jakymec M., Morán H., Páez G., Ferrer J., Mármol Z., Ramones, E. 2001. Cinética de la producción de ácido láctico por fermentación sumergida con lactosuero como sustrato. Revista Científica FCV-Universidad de Zulia. 11(1):53 -59. [ Links ]
18 Jaramillo M., Mejía L., Sepúlveda J. 1993. Quesos Frescos y de Pasta Hilada. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. Departamento de Ingeniería Agrícola y Alimentos. [ Links ]
19 Kavacik B., Topaloglu B. 2010. Biogas production from co-digestion of a mixture of cheese whey and dairy manure. Biomass and Bioenergy. 34(9): 1321-1329. [ Links ]
20 Koutinas A., Papapostolou H., Dimitrellou D., Kopsahelis N. Katechaki E., Bekatorou A., Bosnea L. 2009. Whey valorisation: A complete and novel technology development for dairy industry starter culture production. Bioresource Technology. 100(15): 3734-3739. [ Links ]
21 Lagua H. 2011. Elaboración de una bebida nutritiva a partir de la pulpa de maracuyá (pasiflora incarnata), y suero láctico, en la planta procesadora de frutas y hortalizas de la Universidad Estatal de Bolívar. Tesis de Grado. Escuela de Ingeniería Agroindustrial. Facultad de Ciencias Agropecuarias, Recursos Naturales y del Ambiente, Universidad Estatal de Bolívar. Guaranda, Ecuador. [ Links ]
22 Lee K. 2005. Comparison of fermentative capacities of lactobacilli in single and mixed culture in industrial media. Process Biochemistry. 40(5):1559-1564. [ Links ]
23 Liu X., Chung Y.K., Yang S.T., Yousef A.E. 2005. Continuous nisin production in laboratory media and whey permeate by immobilized Lactococcus lactis. Process Biochemistry. 40(1): 13-24. [ Links ]
24 Machado A., Gorrochotegui L., Cardenas A. 2007. Recuperación del ácido láctico de suero lácteo fermentado utilizando la técnica de electrodiálisis. Revista Técnica de la Facultad de Ingeniería Universidad del Zulia. 30(1): 56-63. Disponible en: http://www.scielo.org.ve/scielo.php?pid=S0254-07702007000100007&script=sci_arttext. Consultado el 11 de julio de 2013. [ Links ]
25 Madrid A. 1994. Manual de Tecnología Quesera. 2a edición. Ediciones Mundi-Prensa. Madrid, España. [ Links ]
26 Martínez A. 2012. Bebida deslactosada y fermentada a partir del lactosuero, con pulpa de maracuyá, y enriquecida con l-glutamina, Tesis de Maestría en Ciencias Agroalimentarias. Universidad de Córdoba, Argentina. [ Links ]
27 Hernández-Miranda A., Matos-Chamorro A. 2011. Importancia del lactosuero en la industria de alimentos como bebida isotónica. En: Congreso Internacional de Investigación. Universidad Peruana Unión. Lima, Perú [ Links ].
28 Miranda O., Ponce I., Fonseca P., Cutiño M., Díaz R., Cedeño C. 2009. Características físico-químicas de sueros de queso dulce y ácido producidos en el combinado de quesos de Bayamo. La Revista Cubana de Alimentación y Nutrición. 19(1): 21-25. [ Links ]
29 Mirdamadi S., Atashgahi S., Rajabi A., Aziz-Mohseni F., Roayaei M., Hamedi J. 2008. Cell entrapment of Lactobacillus casei subsp. casei ATCC 39392 for lactic acid production. Iranian Journal of Biotechnology. 6(1): 16-21. [ Links ]
30 Monsalve J., González D. 2005. Elaboración de un queso tipo ricotta a partir de suero lácteo y leche fluida. Revista Científica FCV-Universidad de Zulia. 15(6): 543-550. [ Links ]
31 Mukhopadhyay R., Chatterjee S., Chatterjee B., Banerjee P., Guha A. 2005. Production of gluconic acid from whey by free and immobilized Aspergillus niger. International Dairy Journal. 15(3): 299-303. [ Links ]
32 Orozco, M y Solarte, J. 2003. Búsqueda del mejor medio de cultivo y modelamiento cinético para obtención del ácido láctico a partir de glucosa por vía fermentativa. Trabajo de grado para optar al título de Ingeniero Químico. Facultad de Ingeniería y Arquitectura. Universidad Nacional de Colombia - Sede Manizales. [ Links ]
33 Panesar P., Kennedy J., Gandhi D., Bunko K. 2007. Bioutilisation of whey for lactic acid production. Food Chemistry. 105(1): 1-14. [ Links ]
34 Parra R.A. 2009. Lactosuero: importancia en la industria de alimentos. Revista Facultad Nacional de Agronomía- Medellín. 62(1): 4967-4982. [ Links ]
35 Parra R.A. 2010. Review: Bacterias Ácido Lácticas: papel funcional en los alimentos. Revista Biotecnología en el Sector Agropecuario y Agroindustrial. 8(1): 93-105. [ Links ]
36 Plessas S., Bosnea L., Psarianos C., Koutinas A., Marchant R., Banat I. 2008. Lactic acid production by mixed cultures of Kluyveromyces marxianus, Lactobacillus delbrueckii ssp. bulgaricus and Lactobacillus helveticus. Bioresource Technology. 99 (13): 5951-5955. [ Links ]
37 Serna L., Rodríguez A. 2005a. Producción de ácido láctico por una mezcla de Lactococcus lactis y Streptococcus salivarius en fermentaciones en discontinuo. Revista Colombiana de Biotecnología. 7(1): 32-38. [ Links ]
38 Serna L., Rodríguez A. 2005b. Producción biotecnológica de ácido láctico: Estado del arte. Ciencia y Tecnología Alimentaria. 5(1): 54-65. [ Links ]
39 Serna L., Rodríguez A. 2007. Producción económica de ácido láctico utilizando residuos de cosecha y jugos de caña de azúcar (Saccharum officinarum L.). Agricultura Técnica. 67(1): 29-38. [ Links ]
40 Urribarrí L., Vielma A., Páez G., Ferrer J., Mármol Z., Ramones E. 2004. Producción de ácido láctico a partir de suero de leche, utilizando Lactobacillus helveticus en cultivo continuo. Revista Científica FCV-Universidad de Zulia. 14(4): 297-302. [ Links ]
41 Vázquez J., Murado M. 2008. Mathematical tools for objective comparison of microbial cultures: Application to evaluation of 15 peptones for lactic acid bacteria productions. Biochemical Engineering Journal. 39(2): 276-287. [ Links ]