Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.1 Bogotá jan./jun. 2014
https://doi.org/10.15446/rev.colomb.biote.v16n1.44284
http://dx.doi.org/10.15446/rev.colomb.biote.v16n1.44284
ARTÍCULO CORTO
Producción de etanol a partir de yuca en condiciones de alta concentración de sólidos (VHG).
Ethanol production from cassava using very high gravity conditions (VHG)
Título corto: Producción de etanol a partir de harina de yuca var. Copiblanca
Mabel Betariz Esquivia Mercado1, Hader Ivan Castaño Peláez2, Lucía Atehortua Garcés3, Alejandro Acosta Cárdenas4 y Carlos Eduardo Mejía Gómez5.
1 M.Sc. Grupo de Biotrasformación. Universidad de Antioquia. Calle 67 No. 53-108/Bloque 5 Laboratorio 226. Medellín, Colombia. mbem19@ gmail.com
2 M.Sc. Facultad de Administración. Politécnico Colombiano Jaime Isaza Cadavid. Carrera 48 No. 7-151. Medellín, Colombia. hcastano954@gmail.com
3 PhD. Grupo de biotecnología Vegetal. Universidad de Antioquia. Calle 70 No. 52 - 21, A.A. 1226. Medellín, Colombia. latehor@gmail.com
4 M.Sc. Grupo de Biotrasformación. Universidad de Antioquia. Calle 67 No. 53-108/Bloque 5 Laboratorio 226. Medellín, Colombia. aleacosta45@gmail.com
5 M.Sc. Grupo de Biotrasformación. Universidad de Antioquia. Calle 67 No. 53-108/Bloque 5 Laboratorio 226. Medellín, Colombia. mcemg@udea.edu.co
Recibido: octubre 5 de 2013 Aprobado: abril 25 de 2014
Resumen
La investigación realizada evalúa el efecto del medio fermentativo y la concentración de azúcares iniciales sobre la producción de etanol en sistemas batch, cuando se emplean sacarificados de harina de yuca (Manihot esculenta), como fuente de carbono. El diseño experimental ejecutado fue de tipo bifactorial de efectos fijos y analiza la productividad de bioetanol en cuatro medios fermentativos diferentes, dos de los cuales se suplementaron con sacarificados de harina de yuca variedad Copiblanca. Las concentraciones de azúcares iniciales evaluadas en estos sustratos fueron de 250, 300 y 350 g/L. Estos tratamientos fermentativos fueron inoculados con una variedad etanologénica comercial de S. cerevisiae a una concentración de 0.05% (p/v). Las condiciones de proceso incluyeron un volumen final de 150 mL, una incubación a 35°C por 48 horas, agitación constante de 150 rpm y pH entre 4.0 y 4.5. Los sacarificados provenientes de esta variedad de yuca usados como fuente de carbono, mostraron ser excelentes sustratos para la obtención de etanol. Se evidenciaron aumentos de más del 500% en términos de productividad volumétrica con respecto al control experimental y se alcanzaron concentraciones finales de etanol del 14.7%v/v, asociadas a rendimientos producto/sustrato de 0,48 g/g y productividades de 2,4 g/L/h. Estos parámetros cinéticos fueron logrados con el medio fermentativo más simple evaluado, medio compuesto por los sacarificados como fuente de carbono y como única fuente nutricional, bajo concentraciones de azúcares iniciales de 250g/L; lo que demuestra la aptitud de estos sustratos para efectos de producción etanólica.
Palabras clave: Bioetanol, sacarificados de harina de yuca, fermentaciones con alto contenido de sólidos.
Abstract
This research exposes the fermentative medium and initial sugar concentration effect on ethanol production in batch systems, when used glucose syrups derivatives of cassava (Manihot esculenta), as a carbon source. The experimental design was factorial and analyzes the productivity of bioethanol in four different fermentation media, two of which were supplemented with cassava flour sugared. The initial sugar concentrations tested on these substrates were 250, 300 and 350 g / L. These fermentative treatments were inoculated with a commercial ethanolic variety of S. cerevisiae at a concentration of 0.05% (w / v). The process conditions included a final volume of 150 mL, incubation at 35 ° C for 48 hours , constant stirring at 150 rpm and pH between 4.0 and 4.5. The saccharified from this cassava variety showed be excellent substrate for the bioethanol production, achieving increases of 550% in terms of volumetric productivity over the control experiment, the above, allowed us to achieve final concentrations of ethanol of 14.7% v / v, yields product / substrate of 0.5 g / g, and productivities of 2.4 g / L / h. Most interesting is that these kinetic parameters were achieved with the simplest fermentation medium evaluated, the mean was compound of saccharified as a carbon source and as a sole source of nutrition, and its initial concentration of sugars was 250g / L; the above shows the ability of these substrates for ethanol production purposes.
Key words: Bioethanol, cassava flour saccharified, very high-gravity fermentations.
Introducción
La avanzada crisis ambiental y la futura crisis energética y económica, pueden ser enfrentadas con la producción de biocombustibles, la cual sería exitosa si se establecen tempranamente políticas que regulen su alcance y que protejan aspectos tan importantes como la seguridad alimentaria de las comunidades involucradas en la explotación de los recursos renovables destinados para tal propósito.
Debe tenerse en cuenta que no son solo ambientales los beneficios de los combustibles ecológicos tales como el biodiesel y el bioetanol, ya que alrededor de estas interesantes estrategias de energía alternativa, se tejen importantes unidades de negocios, que promueven el desarrollo rural e impactan positivamente el empleo en el campo; muestra de ello es Brasil, país que se vio obligado con la crisis de los precios del petróleo en la década de los setenta a cambiar las fuentes convencionales de abastecimiento energético, creando toda una industria del etanol que en el año 2000 alcanzó los 700.000 empleos a partir de uso de biomasa procedente de la caña, Menéndez (2001). Experiencias como estas son seguidas por países que le han apostado a la producción de alcohol carburante a partir de biomasa vegetal, tales son los casos de EEUU con los cultivos de maíz, India con la caña de azúcar y Tailandia con biomasa de yuca, Lan et al. (2007).
Son diversas las estrategias fermentativas asociadas a la producción de etanol a partir de biomasa vegetal; sin embargo, una de las mejor calificadas por sus interesantes ahorros energéticos e hídricos, eficiente autocontrol microbiano y altas concentraciones finales de etanol, ha sido el modelo fermentativo bajo condiciones de alto contenido de sólidos; modelo caracterizado por fermentaciones a contracciones superiores de 270 g/L Bai et al. (2004). La aplicación de este modelo ha ofrecido resultados satisfactorios en materia de producción etanólica, logrando porcentajes finales de etanol y rendimientos producto/sustrato que oscilan entre 12 a 18%v/v y 0.45 a 0.49 g/g respectivamente, a partir de sustratos amiláceos procedentes de trigo son regularmente suplementados con fuentes de nitrógeno y micronutientes específicos, Jones et al. (1994). Las optimizaciones de este tipo de medios de cultivo han sido evaluadas, a fin de disminuir los tiempos de fermentación y los costos de producción por concepto de la suplementación nutricional, punto en el que el sorgo dulce ha ofrecido una interesante alternativa; recientes reportes revelan que solo con la suplementación de la fuente de nitrógeno, este sustrato ofrece porcentajes de etanol próximos al 15%v/v y rendimientos producto/sustrato entre 0.49 y 0.5 g/g, bajo cinéticas de fermentación cercanas a las 56 horas, (Nuapeng et al., 2011; Chan et al., 2013). Parte del éxito de estas estrategias fermentativas depende del tipo de cultivo amiláceo empleado y su contenido propio de nutrientes, variable que juega un papel determinante en la viabilidad técnico-económica de los modelos evaluados y que definen su adaptación a las realidades del sector industrial alcoholero.
La industria del etanol en América Latina es promisoria dada la biodiversidad de sus cultivos amiláceos y la riqueza y extensión de sus tierras disponibles para uso agrícola. Colombia es uno de los países de mayor productividad en materias primas de enorme peso en la producción futura de biocombustibles con cultivos que incluyen caña de azúcar, sorgo dulce, remolacha, maíz, cebada y yuca, Bochno (2008). Este último cultivo ha sido propuesto por el Ministerio de Minas y Energía, después de la caña azucarera, para la obtención de bioetanol de primera generación; decisión que no es gratuita, ya que tiene la capacidad de tolerar la sequía y los suelos degradados, con lo que ha asegurado su importancia económica a nivel mundial. La yuca se adapta a diferentes condiciones agro ecológicas, climáticas y su cultivo requiere de poca tecnología, además presenta bajo costo de producción, poca mano de obra requerida, alta estabilidad de sus rendimientos y un largo período de cosecha. Soportado en estas ventajas agroindustriales, el Ministerio de Agricultura y Desarrollo Rural en 2001 inicia el proyecto ""Alianzas Productivas para la Paz", bajo el cual se estudiaron 40 variedades yuca, de estas se seleccionaron 12 exponentes a abril de 2003 y son las que actualmente se tienen sembradas en más de 110 hectáreas en Mutatá - Urabá Antioqueño. Entre las variedades seleccionadas como clones de altos rendimientos se cuentan Copiblanca, Copiroja, la Verónica y Ginnés con las que se puede lograr hasta 25 t/ha, MADR (2001).
En resonancia a este llamado socio-económico y medioambiental, y con el fin de contribuir al fortalecimiento de la cadena productiva de la yuca, se desarrolla el presente estudio aplicado cuyo propósito es evaluar la aptitud de los sacarificados de harina de yuca variedad Copiblanca (clon seleccionado como de alto rendimiento de acuerdo a los últimos estudios del CIAT en el Urabá Antioqueño), para efectos de su bio-conversión a etanol con una cepa comercial de demostrada capacidad etanologénica, cuando se emplean condiciones de alto contenido de sólidos.
Materiales y métodos
Microorganismos y condiciones de cultivo
Los microorganismos empleados fueron dos variedades nativas de S. cerevisiae obtenidas por estudios de bioprospección microbiana para estos propósitos y facilitadas por el Laboratorio de Biotrasformación de la Universidad de Antioquia, y una variedad etanologénica comercial de Saccharomyces cerevisiae (cuya referencia no es reportada en este trabajo). Las condiciones de manejo incluyeron su mantenimiento bajo temperaturas de refrigeración en placas de agar PDA (Papa Dextrosa Agar) y su respectiva reactivación en caldos YM (Yeast Medium), para su posterior inoculación en los medios alternativos evaluados.
Selección de la cepa etanologénica
La selección de la cepa de S. cerevisiae incluyó criterios de etanol-tolerancia y producción etanólica en medio estándar modificado YM (Yeast Medium). Se manejó la misma composición nutricional del medio base, sólo que la fuente de carbono fue reemplazada en origen y concentración por sacarificados de harina de yuca variedad Copiblanca a 100g/L en términos de azúcares fermentables, respectivamente, a fin de generar un reto osmolar primario con la fuente de carbono de interés para el presente estudio. Las condiciones de cultivo incluyeron el uso de Erlenmeyers de 250 mL, en donde los volúmenes finales fueron de 150 mL mantenidos en condiciones de anaerobiosis, se manejó una agitación de 150 rpm y una temperatura de 35 ºC. El pH del proceso fermentativo osciló entre 4.0 y 4.5 y el inóculo de levadura utilizado fue del 0.05% (p/v). El tiempo de cultivo evaluado fue de 24 horas con muestreo único a final de proceso.
Preparación de hidrolizados de harina de yuca variedad Copiblanca
Se realizaron suspensiones de harina de yuca variedad Copiblanca al 40% p/v, a las cuales se les ajustó el pH a 5.5 previa adición de Ca2+ a 30 ppm. Las suspensiones fueron licuadas durante 2.5 horas a una temperatura de 83ºC, empleando para tal fin una amilasa comercial Termamyl® 120 L a una dilución de 0.5 mL/L. Posteriormente el material licuado fue llevado a un pH de 4.5 por adición de NaOH y sometido a sacarificación durante 6 horas a 60ºC, la enzima utilizada en este proceso fue una amiloglucosidasa comercial AMG® 300L a una concentración de 1.5 mL/L. Ambas enzimas con actividades de 120 KNU/g y 300 AGU/ml respectivamente, son ofrecidas por Novozymes a través de Coldanzimas Ltda. en Colombia. Los sacarificados obtenidos fueron objeto de análisis bromatológico.
Medios de fermentación
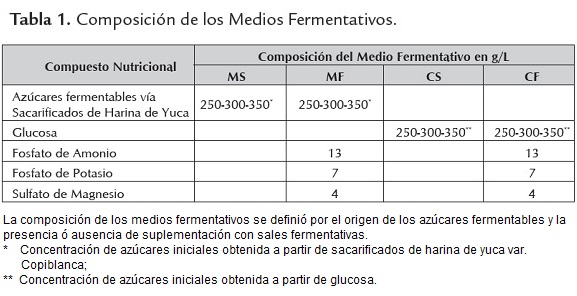
Se evaluaron dos medios de fermentación, cada uno de los cuales contó con su respectivo control; los medios estudiados fueron: Sacarificado de harina de yuca variedad Copiblanca (MS), el cual fue obtenido por la licuefacción y posterior sacarificación de la harina de yuca, siendo el sacarificado obtenido el único nutriente empleado en este medio. Medio Formulado (MF), cuya composición fue obtenida por balance estequiométrico empleando para ello la constitución bioquímica de la levadura. En este balance se consideró el nitrógeno, potasio y magnesio propio de las materias primas empleadas. La fuente de carbono fue suplementada a partir de los sacarificados de harina de yuca; las fuentes de nitrógeno y micronutrientes fueron suplementadas por sales de uso convencional en la industria alcoholera (ver tabla 1).
Los controles manejados hacen referencia al Control del Sacarificado (CS), que emplea como fuente de carbono y único constituyente glucosa anhidra y al Control del Medio Formulado (CF), este presentó la misma composición que el medio obtenido por formulación (MF), sin embargo la fuente de carbono fue suplementada por glucosa anhidra.
Los niveles de concentración de azúcares iniciales (CAI) objeto de evaluación fueron: 350, 300 y 250 g/L en términos de glucosa, tanto para los medios suplementados con sacarificado como para aquellos que se trabajaron con glucosa anhidra.
Condiciones de fermentación
Las fermentaciones fueron llevadas a cabo en sistemas discontinuos para lo cual se hizo uso de Erlenmeyers de 250 mL, en donde los volúmenes de fermentación fueron de 150 mL mantenidos en condiciones de anaerobiosis, se manejó una agitación de 150 rpm y una temperatura de 35ºC. El pH del proceso fermentativo osciló entre 4.0 y 4.5 y el inóculo de levadura utilizado fue del 0.05% (p/v). Las cinéticas de fermentación se evaluaron durante 48 horas con muestreos cada 8 horas.
Muestreo y análisis de muestras
Los muestreos se realizaron por extracción de 5mL del fermentado manteniendo las condiciones de anaerobiosis; del volumen extraído 1mL fue usado para cuantificación de biomasa por peso seco, el material restante fue sometido a centrifugación a 4000 rpm durante 10 minutos, el sobrenadante obtenido fue empleado para determinación de azúcares reductores por DNS y para análisis de glucosa por GOD-PAD; la cuantificación de etanol, fue realizada por HPLC empleando un cromatógrafo Agillent 1200 y una columna BioRad Aminex HPX-87H (300x 7.8 mm), la fase móvil manejada fue una solución de 0.012 N de ácido sulfúrico con un flujo de 0.5 mL/min y una temperatura de 65°C , para las lecturas fue utilizado un detector de índice de refracción. Los estudios de viabilidad se apoyaron en la técnica de azul de tripán. Las células con capacidad proliferativa se cuantificaron por siembra en PCA con el consecuente cálculo de UFC/mL.
Los sacarificados fueron sometidos a análisis de proteínas por el método 968.05 de la AOAC, la determinación de cenizas solubles fue realizada por el método 923.03 de la AOAC, la cuantificación de la fibra soluble se realizó por el método 31.012 de la AOAC. La determinación de oligosacáridos desde DP2 a DP10 (cadenas de glucosa de 2 unidades hasta 10 unidades), fue realizada por HPLC con una columna BioRad Aminex HPX-87P (300x 7.8 mm), la fase móvil fue agua MilliQ desgasificada con un flujo de 0.5 mL/min y una temperatura de 85°C, las lecturas se hicieron en un detector de índice de refracción.
En las harinas, la determinación de almidón post-hidrólisis ácida se realizó por el método 906.03 de la AOAC. Los análisis de grasa y humedad se realizaron por los métodos 925.45 y 920.39 referidos en la AOAC, respectivamente.
Diseño experimental y análisis estadístico
El diseño experimental utilizado es de tipo bifactorial de efectos fijos, cuyos factores fueron la concentración de azúcares inicial (CAI) y el tipo de medio de fermentación, los cuales fueron evaluados a 3 y 4 niveles respectivamente.
Las variables de respuesta analizadas fueron rendimiento etanólico y productividad volumétrica de etanol, vía Análisis de Varianza, para lo que se empleó el paquete estadístico Statgraphics plus v 5.1.
Resultados y discusión
Cepa etanologénica seleccionada
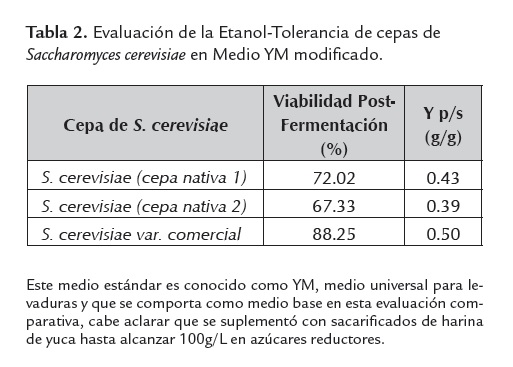
La viabilidad post-fermentación fue considerada como el indicador de tolerancia al etanol, el cual es bioquímicamente mas tóxico que el adicionado al medio de cultivo, esto debido al paso trans-membranal obligatorio, propio de los procesos de excreción de este producto metabólico, Bai et al. (2008).
La producción etanólica fue medida en términos del rendimiento Yp/s (g etanol/g glucosa), obtenido en fermentaciones de 24 horas bajo concentraciones de azúcares iniciales de100g/L.
Los resultados mostraron que la cepa de mejor desempeño etanólico y mayor etanol-tolerancia fue la variedad comercial de Saccharomyces cerevisiae, con valores de rendimiento y viabilidad post-fermentación de 0.5g/g y 88% respectivamente. Los datos de esta evaluación comparativa se muestran en la tabla 2.
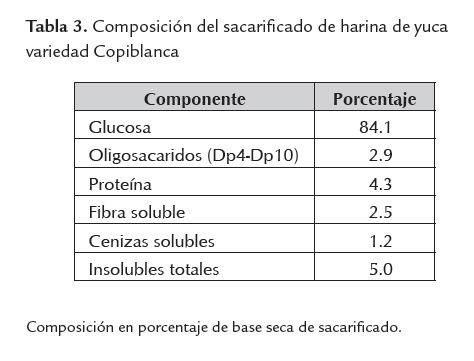
Sacarificado de harina de yuca variedad Copiblanca obtenido
La harina de yuca variedad Copiblanca llevada hasta procesos de sacarificación, permitió la obtención de jarabes de glucosa cuya composición se muestra en la tabla 3. El sustrato bio-convertible a etanol presente en las harinas de yuca var. Copiblanca, corresponde a su fracción de almidón, la cual fue valorada en un 78.7% p/p base seca. El contenido de humedad fue del 13.6%, proteína del 4.4%, fibra 4.1%, cenizas del 1,9% e insolubles del 6.8 %, base húmeda. No se encontraron azúcares libres en la harina de yuca empleada.
La conversión enzimática de la fracción de almidones presentes en la harina de yuca a azúcares fermentables por la levadura, corresponde al 97%; el 3% restante se halló en forma de azúcares reductores con cadenas iguales o superiores a 4 unidades de glucosa (Dp4 a Dp10).
Los sacarificados procedentes de la harina de yuca variedad Copiblanca sometida a procesos de hidrólisis enzimática, presentaron en materia de azúcares fermentables, solo monómeros (glucosas), ya que hubo ausencia de maltosas y maltotriosas, siendo el siguiente oligosacárido de menor tamaño presente en los sacarificados obtenidos, las maltotetrosas cuya estructura no es compatible para su bioasimilación por S. cerevisiae, Zhu et al. (2005), por esta razón la base de cálculo para los rendimientos producto/sustrato se redujo solo a la glucosa como único azúcar presente en nuestros sacarificados teóricamente fermentable por la levadura.
Por cada unidad de glucosa, se obtienen 2 unidades de etanol, por lo que se afirma que teóricamente por cada 180 gramos de glucosa se generan 92 gramos de etanol, resumiéndose lo anterior en un rendimiento esperado del 0.51 g/g como consecuencia de la estequiometria propia de esta biorreacción. Por lo que los hallazgos anteriores permiten afirmar que por cada gramo de harina de yuca variedad Copiblanca, se obtienen 0.43 gramos de etanol.
Efectos del medio de cultivo y la concentración de azúcares iniciales sobre la producción de etanol
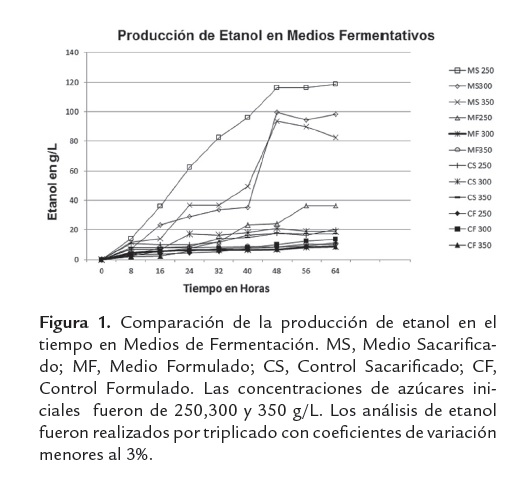
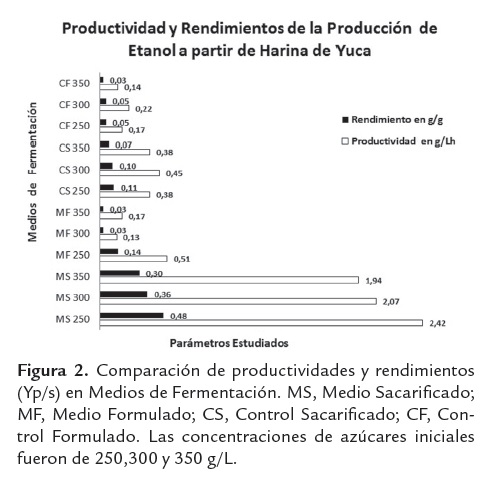
La generación de etanol a partir de sacarificados de harina de yuca presenta resultados asociados a amplios rangos de producción, en donde se hacen claros los efectos de la concentración de azúcares iniciales, así como el tipo de medio de fermentación empleado (ver figura 1).
Particularmente, el uso de los sacarificados de harina de yuca como fuente de carbono y única fuente nutricional (MS), muestra un impacto positivo en la producción de etanol, debido a que no presenta efectos inhibitorios sobre la viabilidad celular, (aspecto de vital importancia en la industria de etanol, que regularmente emplea el re-uso de la biomasa de levadura para efectos de nuevas fermentaciones) y en la productividad etanólica.
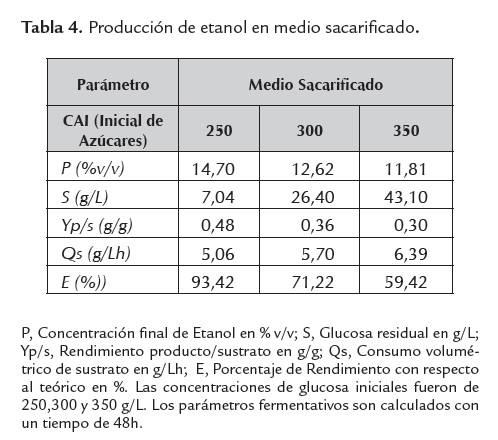
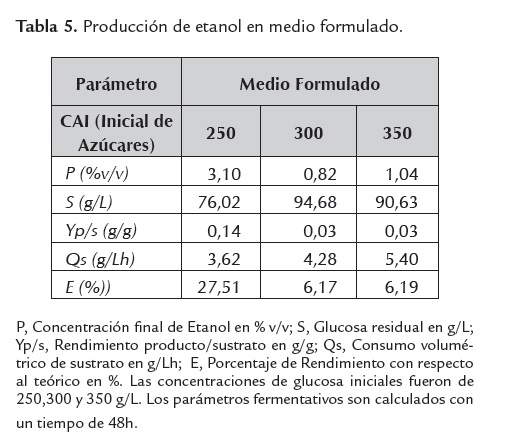
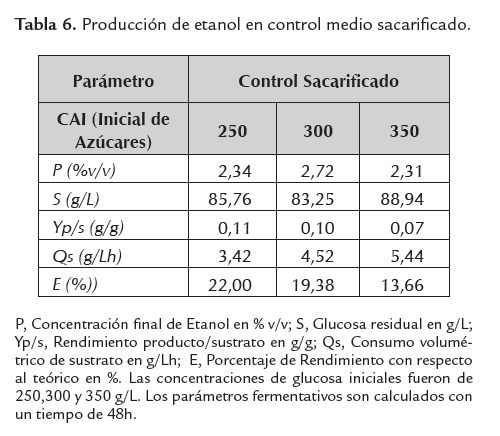
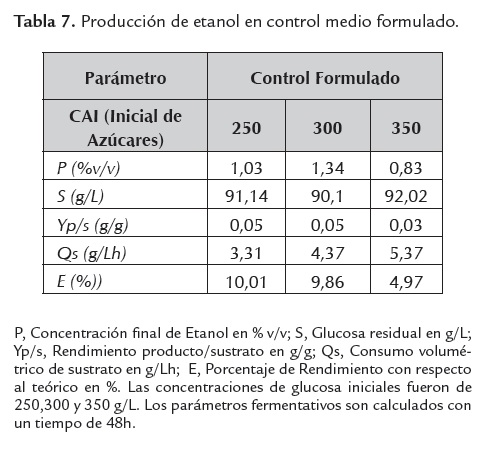
Un indicador indirecto de la inhibición metabólica de la levadura, es el grado de asimilación de la fuente de carbono y su consecuente desviación hacia etanol y/o biomasa, parámetro medido en términos de glucosa residual; para el caso, a mayor glucosa residual, menor grado de asimilación, lo que revelaría una mayor inhibición microbiana. Este parámetro se muestra altamente sensible dependiendo del tipo de medio fermentativo empleado y la concentración de azúcares iniciales evaluada (ver tablas 4, 5 ,6 y 7).
La figura 2 permite identificar el medio sacarificado con una CAI de 250 g/L (MS 250), como el medio más favorable para la producción de etanol y expone una comparación de los rendimientos para cada medio de fermentación empleado. La producción etanólica medida en términos de concentración final de producto resulta ser interesante cuando se trabaja como medio de fermentación el sacarificado de harina de yuca sin suplementar (MS), alcanzando porcentajes del 14.7% v/v. Este valor se encuentra en el límite superior de lo convencionalmente esperado, dado que las producciones etanólicas en sistemas batch oscilan entre 3.2 a 12.7%v/v, Sánchez et al. (2005).
Productividades de 2.42 g/Lh, asociadas a concentraciones de etanol de 14.7%v/v, son experimentadas con los sacarificados de harina de yuca variedad Copiblanca sin ningún tipo de adición de sales o enzimas reductoras de viscosidad. La composición química del sustrato es suficiente para soportar la producción de etanol, ya que estos resultados se obtuvieron en el medio sacarificado. Lo anterior, puede deberse a que estos sacarificados presentan otros componentes que incluyen derivados proteicos, cenizas y sales, los cuales contribuyen al adecuado desarrollo de la levadura en estado de anaerobiosis, facilitando el curso de la vía metabólica fermentativa (ver tabla 3). El uso de otro tipo de harinas, más que del componente amiláceo de manera independiente, ha mostrado resultados interesantes. Procesos de sacarificación fermentación simultánea (SSF) de masas de papa con 304 g/l de carbohidratos disueltos, uso de enzimas reductoras de viscosidad y suplementación del medio con sales, alcanzaron concentraciones de etanol de 16.61 %v/v y rendimientos de 89.7%, Srichuwong et al. (2009).
Por otro lado, Lim et al., en 2013 alcanzaron concentraciones de etanol de 14.92% v/v, fermentando masas de papa en condiciones de alta concentración de sólidos (28% p/v). En este estudio se usaron también enzimas reductoras de viscosidad y se suplementó el medio con sulfato de amonio. Los resultados fueron similares a los encontrados en este proyecto. Resultados obtenidos con otros sustratos como la patata en condiciones de alta concentración de sólidos, también son correspondientes a nuestros hallazgos; Cao et al., en 2011 manejaron condiciones de proceso SSF con concentraciones de carbohidratos de 284 g/l, alcanzando concentraciones de 15.5% v/v y rendimientos de etanol del 87.8%. Mejores resultados fueron los obtenidos por Zhang et al., en 2010, utilizando xilanasa para reducir la viscosidad del medio; en este caso la concentración final de etanol obtenida fue del 17% v/v, a partir de medios con 300 g/l de carbohidratos.
Otras experiencias con harina de yuca incluyen las reportadas por Yingling, et al., en 2011, que alcanzaron concentraciones de 18.46% p/p (22 %v/v), fermentando masas de yuca en condiciones SSF, concentraciones muy superiores a las alcanzadas en este proyecto; mostrando las ventajas de los estudios de optimización multiobjetivo en los procesos fermentativos. Este hecho pone de manifiesto la necesidad de incorporar técnicas de optimización a nuestros resultados y mejorar los rendimientos y concentraciones finales de etanol, además de explorar la posibilidad de evaluar la estrategia de proceso de sacarificación y fermentación simultánea.
Sin embargo, se observa que los sacarificados de harina de yuca var. Copiblanca suplementados con sales de acuerdo a formulación estequiométrica (MF) no favorecen la producción etanólica, aunque debe tenerse en cuenta que las concentraciones de azúcares y sólidos disueltos manejadas en la experimentación fueron altas, lo que se traduce en fuertes osmolaridades dentro de los medios fermentativos, las cuales aumentan cuando la fuente de carbono es suplementada con sales de convencional uso en fermentación (adición de sales a los sacarificados de harina de yuca). Este aumento de osmolaridad puede superar la tolerancia de la levadura frente a esta variable, lo que explicaría el comportamiento de los resultados obtenidos. Lo anterior indica que los modelos de suplementación deberían manejar fuentes complementarias de alto valor nutricional específico en materia de nitrógeno y micronutrientes y que a su vez aporten la menor osmolaridad posible; tal es el caso de la suplementación con matrices biológicas tipo extracto de levadura en bajos niveles y que ofrecen un ajuste nutricional adecuado para efectos de la producción de bioetanol y el incremento de sus parámetros cinéticos, Nuapeng et al. (2010); sin embargo, este tipo de fuentes suplementarias están asociadas a altos costos, punto que debe ser analizado para valorar la viabilidad técnica de su aplicación a escala industrial.
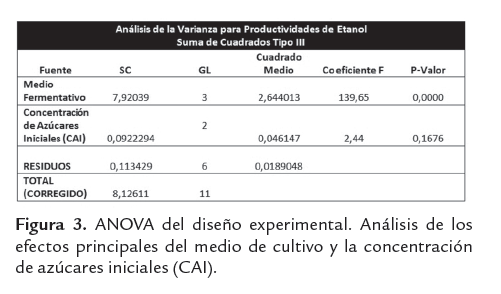
Con un p-valor de 0.000, el medio fermentativo confirma un efecto estadísticamente significativo sobre la productividad de etanol, la anterior afirmación e emite con un 95,0% de confianza. Esto es totalmente coherente con lo observado en la figura 2, en donde es claro el positivo impacto de los sacarificados de harina de yuca sin suplementar (MS), sobre los parámetros cinéticos de la fermentación etanólica (ver figura 3).
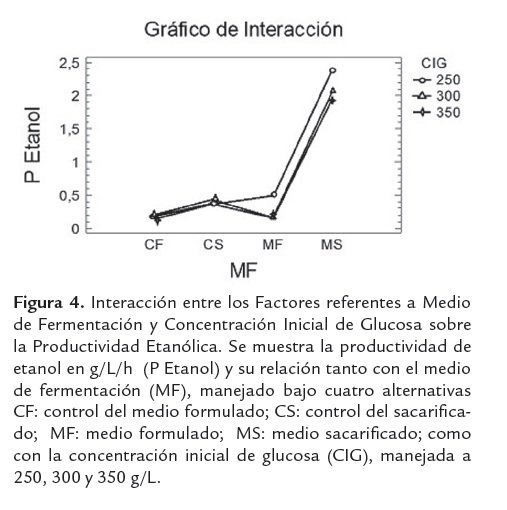
Por otro lado la concentración de azúcares iniciales (CAI), evidencia el favorecimiento práctico de la producción etanólica conforme baja su nivel; este comportamiento puede explicarse dado que al disminuir la concentración de azúcares iniciales disminuye el efecto inhibitorio por sustrato generado por los azúcares presentes en los hidrolizados de harina de yuca. Lo anterior confirma que las mejores condiciones para la producción de etanol incluyen el medio sacarificado sin suplementar (MS), cuando se trabaja con concentraciones iniciales de azúcares de 250g/L (ver figura 4).
Conclusiones
Los sacarificados de harina de yuca como fuente única nutricional mostraron ser un interesante sustrato, ya que la producción de etanol bajo su uso fue aún mayor que cuando se empleó suplementación con sales fermentativas y glucosa anhidra, esta última es de fácil consumo por la levadura al tratarse de un monómero y es considerada como la fuente de carbono estándar para este tipo de biorreacciones, Monsalve et al. (2006); lográndose aumentos de más del 500% en términos de productividad volumétrica con respecto a este control.
El uso de los hidrolizados de harina de yuca sin suplementar (MS), como medio alternativo para la fermentación etanólica demostró favorecer en alto grado los rendimientos y productividades de etanol, los cuales oscilaron entre 0.48-0.30 g/g y 2.4-1.9 g/Lh, respectivamente, llevando estos parámetros a los límites superiores de lo reportado por la literatura para procesos batch. Estos niveles se obtienen en sustratos amiláceos sin suplementar, es decir, con el medio más simple de los evaluados en este trabajo experimental (MS).
Los hallazgos del estudio realizado evidencian la aptitud de los sacarificados de harinas de yuca como medios fermentativos interesantes para la producción de bioetanol a través de variedades comerciales de S. cerevisiae.
Agradecimientos
El presente trabajo fue posible gracias a la colaboración técnica del Grupo de Biotransformación de la Universidad de Antioquia y el Grupo de Biotecnología de la Universidad de Antioquia. Los autores también expresan su agradecimiento a FUNDAUNIBAN, la Secretaria de Agricultura de Antioquia y el Ministerio de Agricultura y Desarrollo Rural (MADR) por la financiación del proyecto.
Referecias bibliográficas
1 Bai F., Anderson W., Young M. 2008. Ethanol fermentation technologies from sugar and starch feedstocks. Biotechnology Advances. 26: 89-105. [ Links ]
2 Bai F., Chen L., Zhang Z., Anderson W., Young M. 2004. Continuous ethanol production and evaluation of yeast cell lysis and viability loss under very high gravity medium conditions. Journal of Biotechnology 110 (3): 287-293. [ Links ]
3 Bochno H. 2008. Investigación en Materias Primas para Biocombustibles. Taller II Plan BIOCOM. [ Links ]
4 Cao Y., Tian H., Yao K., Xuan Y. 2011. Simultaneous saccharification and fermentation of sweet potato powder for the production of etanol under conditions of very high gravity. Frontiers of Chemical Science and Engineering. 5 (3): 318-324. [ Links ]
5 Chan P., Laopaiboon L., Jaisil P., Laopaiboon P. 2013. High Level Ethanol Production by Nitrogen and Osmoprotectant Supplementation under Very High Gravity Fermentation Conditions. Electronic Journal of Energy. 6: 884-899. [ Links ]
6 Jones A., Ingledew W. 1994. Fuel Alcohol Production: Optimization of Temperature for Efficient Very-High-Gravity Fermentation. Applied and Environmental Microbiology. 60 (3):1048-1051. [ Links ]
7 Lan T., Nguyen T., Gheewala S., and Garivait, S. 2007. Full Chain Energy Analysis of Fuel Ethanol from Cassava in Thailand. Environmental Science & Technology. 41 (11): 4135-4142. [ Links ]
8 Lim Y., Jang J., Kim K. 2013. Production of high concentration of ethanol from potato tuber by high gravity fermentation. Food Science and Biotechnology. 22 (2): 441-448. [ Links ]
9 Loapaiboon L., Sunan N., Penjit S., Preekamol K., Pattana L. 2009. Ethanol production from sweet sorghum juice using very high gravity technology: Effects of carbon and nitrogen supplementations. Bioresource Technology. 100: 4176-4182. [ Links ]
10 MADR. 2001. Proyecto Alianzas Productivas para la Paz. Documento Conpes 3111. República de Colombia, Departamento Nacional de Planeación. [ Links ]
11 Menéndez E. 2001. ""Energías renovables, sustentabilidad y creación de empleo. Una economía impulsada por el sol". Madrid. Ed. Menéndez Pérez, E.; Los libros de la catarata y Fundación 1º de Mayo, p 31. [ Links ]
12 Monsalve J., Medina V., Ruiz A. 2006. Producción de Etanol a partir de Cascara de Banano y de Almidón de Yuca. DYNA. 73 (150): 21-27. [ Links ]
13 Nuanpeng S., Laopaiboon L., Srinophakun P., Klanrit P., Jaisil P., Laopaiboon P. 2011. Ethanol production from sweet sorghum juice under very high gravity conditions: Batch, repeated-batch and scale up fermentation. Electronic Journal of Biotechnology. 14 (1): 1-12. [ Links ]
14 Sánchez O., Cardon, J. 2005. Producción Biotecnológica de Alcohol Carburante II: Integración de Procesos. Revista Virtual Interciencia. 30(11) 679-686. [ Links ]
15 Srichuwong S., Fujiwara M., Wang X., Seyama T., Shiroma R., Arakane M., Mukojima N., Tokuyasu K. 2009. Simultaneous saccharification and fermentation (SSF) of very high gravity (VHG) potato mash for the production of ethanol. Biomass and Bioenergy. 33 (5): 890-898. [ Links ]
16 Yingling B., Li C., Honglin W., Xiwen Y., Zongcheng Y. 2011. Multi-objetive optimization of bioethanol production during cold enzyme starch hydrolysis in vey high gravity cassava mash. Bioresources Technology. 102(17): 8077-8074. [ Links ]
17 Zhang L., Chen Q., Jin Y., Xue H., Guan J. 2010. Energy-saving direct ethanol production from viscosity reduction mash sweet potato at very hihg gravity (VHG). Fuel Processing Technology. 91: 1845-1850. [ Links ]
18 Zhu S., Wu Y., Yu Z., Zhang X., Wang C., Yu F., Jin Z., Zhao Y., Xue Y. 2005. Simultaneous Sachharification and Fermentation of Microwavve/alkali pretreated rice straw to ethanol. Biosystem Engineering. 92 (2):229-235. [ Links ]