Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.1 Bogotá jan./jun. 2014
https://doi.org/10.15446/rev.colomb.biote.v16n1.37928
http://dx.doi.org/10.15446/rev.colomb.biote.v16n1.37928
ARTÍCULO CORTO
Optimización del medio de cultivo QBP para la producción de biomasa del consorcio BIOYAF
Optimization of culture media QBP to the production of biomass of consortium BIOYAF
TÍTULO CORTO: Optimización de un medio de cultivo
Yaima Barrios San Martín1a, Silvia Acosta Días2, Francisca González Hernández3 y Ranyer Hayes García4.
1 Lic. en Microbiología, MSc. en Microbiología. yy@ceinpet.cupet.cu
2 Lic. en Microbiología, MSc. en Microbiología. sacosta@ceinpet.cupet.cu
3 Técnico en Química Industrial. francis@ceinpet.cupet.cu
4 Ing. en Química. ranyer@ceinpet.cupet.cu
a Centro de Investigaciones del Petróleo. Churruca 468 e/ Vía Blanca y Washington, CP 12 000 Cerro La Habana, Cuba.
Recibido: agosto 15 de 2013 Aprobado: mayo 5 de 2014
Resumen
La optimización de los medios de cultivo con fines industriales en la mayoría de los casos ha sido efectuada mediante procedimientos empíricos de ensayo y error. Empleando diversos métodos estadísticos es probable que el medio de cultivo original pueda ser optimizado, en muchos casos es posible obtener un medio que no solo sea más productivo, sino de menor o igual costo que el original. Se optimizó el medio de cultivo QBP para el crecimiento de las cepas del consorcio bacteriano BIOYAF capaz de degradar hidrocarburos del petróleo, empleando un Diseño de Factor Categórico Individual para determinar el tiempo de trabajo, un Diseño Factorial (24) para determinar los rangos de trabajo de concentración de los nutrientes y un Diseño de Superficie de Respuesta para optimizar las concentraciones. Las variables de respuesta de evaluación de los experimentos fueron masa húmeda, masa (UDO), conteo de viables, conductividad, pH y tensión superficial. El tiempo óptimo para el crecimiento de las cepas del consorcio BIOYAF es de seis horas. El medio de cultivo QBP con concentraciones óptimas de fosfato de amonio (3,19 g.L-1), sulfato de magnesio (0,04 g.L-1), levadura (3,77 g.L-1) y sacarosa (47,89 g.L-1) permite que la producción de biomasa aumente de 1,540 UDO a 3,082 UDO.
Palabras clave: superficie de respuesta, consorcio bacteriano, crecimiento óptimo.
Abstract
The optimization of culture media with industrial purposes, in most cases, has been made through empirical trial and error procedures. Using different statistical methods original culture media can be optimized, in many cases, is possible to obtain a more productive media, at the same cost as the original one. The culture media QBP was optimized for the growth of the bacterial consortium BIOYAF, which can degrade petroleum hydrocarbons, using a Categorical Individual Factor Design to determine the working time, a Factorial Design (24) to determine working range of elements concentration and a Surface Response Design to optimize the concentrations. The response variables of the experiments used in this work were: wet mass, mass (UDO), viable's count, conductivity, pH and surface tension. The optimal time for growth of the consortium was of six hours. The optimized QBP culture media (ammonium phosphate: 3.19; magnesium sulphate: 0,04; yeast extract : 3,77; sucrose: 47,89) allowed that the biomass' production increases of 1,540 UDO to 3,082 UDO.
Key words: Surface Response Design, bacterial consortium, optimum growth.
Introducción
Existen en la literatura diferentes ejemplos sobre técnicas que hacen posible la optimización de los medios de cultivo. La mayoría de estas basan la formulación de los mismos en la composición elemental del microorganismo a estudiar o de otros similares que puedan servir de referencia para realizar un balance de materia apropiado. Esto puede ser un punto de partida para la formulación y optimización de un medio de cultivo en particular, pero no suficiente ya que el crecimiento celular tiene implícito otros factores que determinan la estequiometria del mismo (Gutierrez y Vara, 2008)
La optimización de los medios de cultivo con fines industriales, en la mayoría de los casos ha sido efectuada mediante procedimientos empíricos de ensayo y error, no sólo en la formulación del medio de cultivo sino también en las condiciones de operación. De cualquier manera es probable que el medio de cultivo original pueda ser optimizado, modificando el porcentaje de los componentes del medio y las materias primas utilizadas, siendo factible en muchos casos optimizar un medio de tal manera que no sea solamente más productivo, sino de menor o igual costo que el original, para lo cual se requiere del uso de varios métodos de optimización (Maddox y Richert, 1977).
La metodología más elemental para la optimización de medios de cultivo consiste en realizar experimentos en los que se varía la concentración del componente a ensayar manteniéndose constante las concentraciones de los demás ingredientes. Para organismos aerobios generalmente se utiliza un sistema de cultivo en erlenmeyers agitados. En este caso, se analiza el efecto de la variable escogida sobre la velocidad de crecimiento y la concentración de biomasa obtenida. Si bien este procedimiento es simple, es evidente que hace falta una gran cantidad de trabajo preliminar ya que el operador no conoce de antemano qué nutriente es el limitante del crecimiento. Cuando son varios los posibles nutrientes limitantes el método resulta poco práctico. Por otra parte, puede ocurrir que la respuesta obtenida al variar la concentración de un componente dependa de los niveles de los otros, o sea, se produzca interacción entre componentes. Se puede mejorar mucho la optimización en batch empleando técnicas estadísticas o utilizando sistemas continuos con pulsos de componentes (Dreyer et al., 2000).
Un aspecto relevante en la optimización de un medio de cultivo de interés industrial no es sólo el logro de una formulación racional del medio, sino también la posible inclusión de materia prima de bajo costo que haga rentable el proceso. En este trabajo se empleará el medio QBP, denominación que se le ha dado a un medio de formulación a partir del medio descrito por Núñez (2004), para la producción de biomasa de BIOYAF. Este consorcio está constituido por las cepas Pseudomonas sp. B10, Alcaligenes sp. F10S1, Bacillus sp. F9S y Bacillus sp. RFA, todas aisladas de ambientes marinos contaminados con hidrocarburos del petróleo y con alta capacidad de emulsificar y degradar estos compuestos (Barrios, 2011; Barrios et al., 2012).
El objetivo general es optimizar un medio de cultivo para la producción de biomasa celular del consorcio BIOYAF, para lo que se requiere optimizar el tiempo de crecimiento del consorcio BIOYAF en medio QBP, así como los componentes del medio de cultivo QBP en función de la variable de respuesta: biomasa (determinada mediante el método turbidométrico-espectrofotométrico)
Materiales y métodos
Preparación del consorcio BIOYAF.
Las cepas seleccionadas para el consorcio BIOYAF, Pseudomonas sp. B10, Alcaligenes sp. F10S1, Bacillus sp. F9S y Bacillus sp. RFA, se sembraron individualmente en 30 ml de medio CTS suplementado con 2 % de NaCl y se incubaron a temperatura ambiente (28-30 °C) en zaranda reciprocante por 24 horas. Los cultivos fueron centrifugados a 5000 rpm (centrífuga modelo soviético O∏H-8-042) por 15 min, se decantó el sobrenadante y el pellet se lavó dos veces con solución salina 0,85% en iguales condiciones. El pellet final se re-suspendió en 25 ml de medio de cultivo QBP (Sacarosa 30,0 g.L-1; MgSO4 * 7 H2O 0,2 g.L-1; NH4(2)HPO4 5,0 g.L-1; Levadura forrajera 1,0 g.L-1) y se incubó en las condiciones descritas anteriormente. Para preparar el inóculo se tomaron los cultivos en medio QBP de las cepas a las 18 horas de incubación, estos se centrifugaron y el pellet de cada uno fue lavado como ya se describió en este párrafo, finalmente se re-suspendió cada uno en aproximadamente 20 ml de solución salina 0,85% hasta lograr una concentración en el orden de 106 UFC.mL-1 según la escala de McFarland (se comprobó mediante la siembra en placa petri por el método en Track Dilution) y luego se mezclaron en un frasco estéril y se homogenizaron por 30 min en zaranda reciprocante.
Optimización del tiempo de crecimiento.
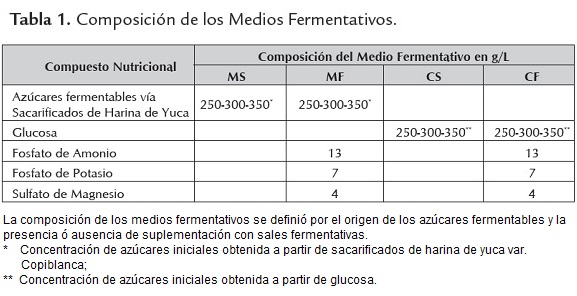
Se empleó un Diseño de Factor Categórico Individual (tabla 1). El estudio se realizó en zaranda empleando la base del medio de cultivo QBP, donde se estudiaron cuatro variables independientes: a) concentración de sacarosa, b) concentración de sulfato de magnesio, c) concentración de fosfato de amonio, y d) concentración de levadura forrajera. Se desarrolló un diseño factorial 24 (con una repetición por cada punto). Para el cual se prepararon 14 erlenmeyers de 250 ml con 50 ml de medio QBP, el pH se ajustó a 8 y se les adicionaron 5 ml del inóculo preparado y se incubaron en agitación orbital (150 rpm) a 30 °C. Cada dos horas se tomaron dos erlenmeyers y se evaluó como variable de respuesta principal la masa (Unidades de Densidad Óptica, la absorbancia se determinó en espectrofotómetro Genesys, Λ =650 nm inmediatamente después; la levadura forrajera no es soluble en agua aportándole turbidez al medio de cultivo, su presencia implicó que no se pudiera monitorear el crecimiento de forma efectiva por la medida de la turbidez (UDO), las muestras se conservaron por 24 horas a 4 °C hasta que la levadura sedimentara y transcurrido este tiempo se realizaron las mediciones, se empleó agua destilada como blanco). Además se evaluaron otras variables que permitieron confirmar los resultados obtenidos: conteo de viables (se realizaron diluciones seriadas y se sembró en medio Agar Triptona Soya suplementado con NaCl 2 %, se incubaron durante 24 horas a 30 °C, transcurrido este tiempo se realizó el conteo según la norma ISO 8199:2005 y los valores se reportaron como UFC.mL-1); pH (medidor de pH Orion 4 Star); conductividad (medidor de conductividad Orion 4 Star); tensión superficial (Tensiómetro Digital-Tensiometer K10T); masa húmeda (se centrifugaron 50 ml de cultivo en tubos para centrífugas previamente tarados (Mc) , se decantó el sobrenadante y se volvieron a pesar en balanza analítica (Mcp), este proceso también se hizo para una muestra de medio de cultivo sin inocular (Mm) y luego se realizaron los cálculos como se muestra en la ecuación 1, los resultados se expresaron en g.L-1). Con el objetivo de verificar si existía correspondencia en la concentración celular medida por turbidimetría a las 24 h y medida por células viables, se tomaron muestras hasta las seis horas de cultivo y se determinó el grado de correlación que existía entre ambas variables. En todos los ensayos los datos experimentales se procesaron empleando el software Statgraphics Centurion XV.
La cinética se desarrolló hasta alcanzar la fase estacionaria de crecimiento
Selección de los rangos de trabajo de los nutrientes del medio de cultivo QBP.
Ecuación 1: (Mcp-Mc )-(Mm-Mc )
Se empleó un Diseño Factorial 24 (tabla 2). Se prepararon 32 erlenmeyers de 500 ml con 50 ml de medio QBP con la composición ajustada según el diseño referido en este párrafo, y se inocularon con 5 ml del inóculo preparado (este se preparó como se describió con anterioridad, obviando el paso de resiembra de las cepas en medio CTS y se incubaron en iguales condiciones que durante la optimización del tiempo de crecimiento. Una vez inoculados se evaluaron las variables absorbancia (Λ = 650 nm), pH y conductividad, y luego de 6 h de incubación se evaluaron las mismas variables que durante la optimización del tiempo de crecimiento, exceptuando el conteo de viables.
Optimización de la composición de fosfato de amonio, levadura y sacarosa.
Se empleó un Diseño de Superficie de Respuesta (23, Compuesto central en dos bloques) (tabla 3). Se prepararon 18 erlenmeyers de 500 ml con 50 ml de medio QBP a las concentraciones según el diseño empleado, y se añadieron 5 ml del inóculo preparado (este se preparó como se describió para el ensayo anterior) y se incubaron en iguales condiciones que los experimentos realizados hasta el momento. Se evaluaron iguales variables que en el proceso de selección de los rangos de los nutrientes del medio de cultivo.
Resultados y discusión
Optimización del tiempo de crecimiento del consorcio BIOYAF en el medio QBP.
Se seleccionaron los cuatro componentes del medio de cultivo para ser estudiados. En la figura 1 aparece la curva de crecimiento en el medio de cultivo base, la figura 1A muestra el crecimiento bacteriano en UDO en función del tiempo. Se aprecia que alrededor de las 6 h el cultivo entra en la fase de crecimiento estacionario, alcanzándose una concentración celular máxima de 1,540 UDO. El análisis de varianza de clasificación simple de las medias muestran que existe diferencia significativa entre los grupos de tiempos 0, 2, 4 h y 6, 8, 10, 12 h (p < 0,05) empleando el método LSD de Fisher; en la figura 1A, también se muestran las desviaciones estándares.
Cuando se graficaron los valores de pH y conductividad (datos no mostrados), se obtuvieron mesetas en el periodo de 0 a 4 h, y posteriormente, una brusca disminución de los mismos en el periodo de 4 a 6 h, correspondiéndose con el tiempo de la fase exponencial del crecimiento del consorcio BIOYAF. Teniendo en cuenta estos resultados se determinó trabajar el resto de los experimentos con seis horas de cultivo, manteniendo las condiciones de agitación y temperatura.
Selección de los rangos de trabajo de los elementos del medio de cultivo QBP.
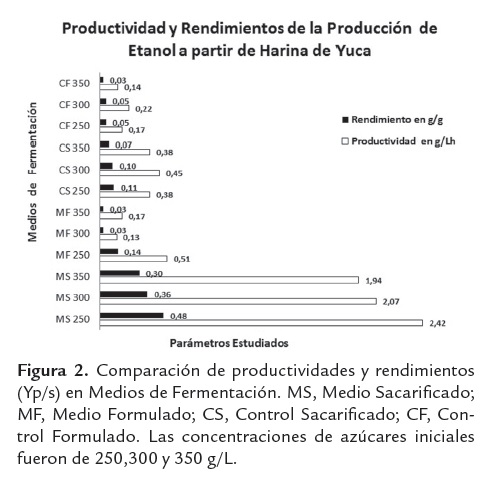
La variante con concentración de sacarosa (30,0 g.L-1), sulfato de magnesio (0,2 g.L-1), fosfato de amonio (5,0 g.L-1) y levadura forrajera (1,0 g.L-1) es el control del experimento, esta se corresponde con el medio de cultivo empleado en el proceso base. Los resultados del experimento se muestran en la figura 2, en la 2A se observan los efectos de las concentraciones del fosfato de amonio y de la levadura forrajera; y en la 2B el gráfico de Pareto.
En este experimento se observó que las concentraciones de fosfato de amonio, levadura y sacarosa tuvieron una influencia positiva sobre el crecimiento; a su vez, se apreció una interacción positiva entre las concentraciones de fosfato de amonio y de levadura, mientras que la concentración de sulfato de magnesio resultó ser no significativa, así como el resto de las interacciones, lo que se puede observar en el modelo descrito a continuación:
Xd=0,176167-0,00162708*Sac-1,01111*Mag+0,0258472*F_am-0,000416667*Lev+0,0446875*Sac*Mag+0,00044375*Sac*F_am-0,000416667*Sac*Lev+0,103125*Mag*F_am-0,826389*Mag*Lev+0,164028*F_am*Lev
donde: Sac: sacarosa, F_am: fosfato de amonio; Lev: levadura forrajera; Mag: sulfato de magnesio
La mejor variante (nivel alto de concentración de sacarosa, fosfato de amonio y levadura, y nivel bajo de sulfato de magnesio) permite aumentar 1,58 veces la concentración celular, respecto al nivel básico. Este resultado indica que para lograr un alto crecimiento microbiano se requieren aumentar las concentraciones de fosfato de amonio, levadura y sacarosa, mientras la de sulfato de magnesio se puede mantener en su valor bajo.
Optimización de la composición de fosfato de amonio, levadura y sacarosa.
Se realizó un estudio con un diseño factorial de superficie de respuesta del tipo compuesto central en dos bloques (con 3 factores y 2 puntos centrales por bloque) para concentraciones de sacarosa en un intervalo de 20,0 - 40, 0 g.L-1, fosfato de amonio de 5,0 - 10,0 g.L-1, y de levadura de 1,0 - 3,0 g.L-1; en todos los casos los intervalos están en correspondencia con el estudio anterior. En la figura 3 se muestran los resultados del ensayo, la 3A describe la superficie de respuesta obtenida para el crecimiento del consorcio BIOYAF y en la figura 3B se muestra el gráfico de Pareto.
Estos resultados demostraron que los efectos principales (de primer orden) concentraciones de levadura y sacarosa influyen positivamente sobre la producción de biomasa del consorcio BIOYAF, así como la interacción de estos dos factores, sin embargo, solo el efecto de la levadura se considera significativo. La concentración de fosfato de amonio y el efecto cuadrático de la concentración de levadura influyeron negativamente, siendo este último el único significativo de los dos, esto además indica que la concentración de levadura no se puede aumentar indefinidamente, pues en un punto dejará de ser positivo el efecto que provoca en el crecimiento microbiano.
Este resultado revela la existencia de un óptimo de concentración de sacarosa, fosfato de amonio y levadura donde la concentración de biomasa se hace máxima, y para determinar ese punto se eliminaron los efectos no significativos, alcanzándose el siguiente modelo:
Xd=-0,120197+0,0484666*Sac+0,283649*F_am+0,381163*Lev-0,000668754*Sac^2-0,003715*Sac*F_am+0,0158625*Sac*Lev-0,0141002*F_am^2-0,00455*F_am*Lev-0,149375*Lev^2
donde: Sac: sacarosa, F_am: fosfato de amonio; Lev: levadura forrajera
Acorde con la optimización, el máximo de concentración de biomasa en función de la absorbancia a Λ = 650 nm (3,082 UDO) corresponde a una concentración de sacarosa, fosfato de amonio y levadura de 47,89 g.L-1, 3,38 g.L-1 y 3,79 g.L-1, respectivamente. Esto significa el aumento en dos veces de la producción de biomasa con el medio en su condición base.
Conclusiones
Se determinó que el tiempo óptimo para el crecimiento de las cepas del consorcio BIOYAF es de 6 h.
Las concentraciones óptimas de fosfato de amonio (3,19 g.L-1), sulfato de magnesio (0,04 g.L-1), levadura (3,77 g.L-1) y sacarosa (47,89 g.L-1) en la formulación del medio de cultivo QBP permiten aumentar la producción de biomasa a 3,082 UDO.
Referencias bibliográficas
1 Barrios Y., Acosta S., Sánchez A., Toledo A., González F., García R. 2012. Study and isolation of aerobic hydrocarbon-degrading bacteria from Cuban shorelines. Biotecnología Aplicada. 29: 80-86. [ Links ]
2 Barrios Y. 2011. Obtención de un consorcio bacteriano para la remoción de hidrocarburos del petróleo. Universidad de La Habana, Tesis de Maestría. [ Links ]
3 Dreyer A., Coello N., Montiel E., 2000. Utilización de la metodología de superficie de respuesta de la optimización de un medio de cultivo para la producción de L-lisina por Corynebacterium glutamicum. Agronomía Tropical. 50: 167-188. [ Links ]
4 Gutierrez H.; de la Vara R. 2008. Análisis y diseño de experimentos. México DF : McGraw-Hill Interamericana. [ Links ]
5 Maddox I., Richert S. 1977. Use of response surface methodology for the optimization of microbiological media. J. Appl. Bacteriol. 43: 197-204. [ Links ]
6 Núñez R. 2004. Obtención, caracterización y aplicación de un bioproducto bacteriano para la biorremediación de derrames de hidrocarburos. Universidad de La Habana, Tesis de Doctorado.