Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.1 Bogotá jan./jun. 2014
https://doi.org/10.15446/rev.colomb.biote.v16n1.44302
http://dx.doi.org/10.15446/rev.colomb.biote.v16n1.44302
BIONOTA
El dicloruro de mercurio como desinfectante en la micropropagación del comino (Aniba perutilis Hemsley)
Dichloride of mercury as a disinfectant in the micropropagation of cumin (Aniba perutilis Hemsley)
Título corto: El dicloruro de mercurio en la micropropagación del comino
Beltrán Pedroza Diana Marcela1 y Mesa López Neftalí2.
1 Msc. en Ciencias Biológicas, Investigadora grupo de Genética y Biotecnología de la Universidad del Tolima (GEBIUT), Universidad del Tolima (Ibagué), Colombia. dianamabelbiology@gmail.com
2 Mg en Dirección Universitaria. Director grupo de Genética y Biotecnología de la Universidad del Tolima (GEBIUT), Docente Facultad de Ciencias. Universidad del Tolima. nmesa@ut.edu.co
Recibido: abril 18 de 2013 Aprobado: abril 4 de 2014
Resumen
El comino, Aniba perutilis Hemsley, especie de importancia económica por la resistencia, duración y excelente calidad de su madera; desde el punto de vista ecológico es importante para la sobrevivencia de especies animales como el guácharo y guacamayas. Es reportada por el Instituto Von Humboldt, como especie en peligro crítico (CR), debido principalmente a la sobre explotación de reductos de bosques donde aún se encuentran algunos ejemplares y al escaso conocimiento de su fenología y reproducción (Cárdenas y Salinas, 2006). El uso de técnicas de micropropagación, constituye una de las formas de conservación, para lo cual se hace necesario superar la fase de inducción en la cual se presentan problemas de contaminación de los explantes. Se desarrolló un protocolo de desinfección que permitió el establecimiento in vitro de la especie. La desinfección se inició desde el momento de la recolecta de los explantes sumergiéndolos en una solución de yodo+antifúngico (Benomil, 3gr/500 ml), llamada solución transportadora. El mejor resultado en el control de la contaminación fue utilizando Tween 80 (1 gota/100 ml) por 10 minutos y 20 minutos de inmersión en dicloruro de mercurio (HgCl2) al 0,2%, con un 8% de contaminación. En contraste con el tratamiento con hipoclorito de sodio (NaClO) que arrojó un 80% de contaminación; por lo que se puede afirmar que el dicloruro de mercurio es un desinfectante efectivo para el control de la contaminación de hongos y bacterias endógenas de los explantes de yemas, tanto apicales como laterales, de A. perutilis Hemsley.
Palabras clave: Desinfección, cultivo in vitro, solución transportadora, meristemos, contaminación.
Abstract
Cumin, Aniba perutilis Hemsley, a species of economic importance for its strength, durability and excellent quality of its wood; from an ecological point of view it's important for the survival of species and animals such as macaws and guacharo. It is reported by Von Humboldt Institute as Critically Endangered (CR), mainly due to over-exploitation of forest redoubts where there are still some copies and limited knowledge of phenology and reproduction (Cardenas and Salinas, 2006). The use of micropropagation techniques is one of the methods of preservation, whereby it's necessary to overcome the induction phase where there is possibility of contamination of the explants. We developed a disinfection protocol which was achieved in vitro establishment of Aniba perutilis Hemsley. Initial disinfection was determined from the time of collection of the explants, which were placed in plastic boxes, previously disinfected with 96% alcohol, a solution of iodine + antifungal (Benomyl, 3grs/500 ml) called carrier solution. The best result in the contamination control was achieved using Tween 80 (1 drop / 100 ml) for 10 minutes and 20 minutes immersion in mercury dichloride (HgCl2) 0.2% with an 8% of contamination. Opposed to the treatment with sodium hypochlorite (NaClO), this showed an 80% contamination, for which one can attest that the mercury dichloride is an effective disinfectant for the control of fungal and bacterial contamination of the explants endogenous buds, both apical and lateral A. perutilis Hemsley
Key words: disinfection, in vitro culture, carrier solution, buds, contamination.
Introducción
El comino, Aniba perutilis Hemsley, pertenece a la familia Laurácea. Aunque presenta un amplio rango de distribución, su mejor desarrollo se da entre los 500 a 2600 msnm (Obregón, 2006), adaptándose a diferentes tipos de bosque: húmedo tropical, premontano, pluvial tropical, húmedo montano bajo, muy húmedo montano bajo, húmedo premontano y muy húmedo premontano, según clasificación de Holdridge (1978). El comino es una especie reportada por el Instituto Von Humboldt, como especies en peligro de extinción. Esto debido principalmente a la sobre explotación de los reductos de bosques donde aún se encuentran algunos ejemplares y al escaso conocimiento de su fenología y reproducción. (Cárdenas y Salinas, 2006).
Esta situación aunada a la dificultad de obtención de semilla viable para su reproducción, hace necesario la búsqueda de alternativas para su propagación y garantizar la supervivencia de la especie. Dentro de estas alternativas se contempla el uso de técnicas biotecnológicas como el cultivo in vitro, el cual permite obtener material suficiente para satisfacer la demanda de cultivo de la especie con fines económicos y ecológicos y a su vez ayudar a la reforestación y recuperación de especies que se encuentran en peligro por el deterioro de sus ecosistemas. La aplicación de estas técnicas presenta algunas barreras como la contaminación endógena y la oxidación de los explantes lo que conlleva a una gran perdida de material vegetal, debido a que los explantes son tomados de árboles adultos expuestos a todos los factores contaminantes en las condiciones de un bosque natural, además se debe tener en cuenta la poca disponibilidad de material cuando se trata de especies en peligro de extinción.
El éxito de los sistemas de propagación de plantas por biotecnología depende en gran medida del control y prevención de la contaminación microbiana. Los microorganismos provocan pérdidas cuantiosas de material vegetal en los procesos productivos o de investigación. En las zonas tropicales, si no se tiene en cuenta, este problema puede alcanzar proporciones incalculables por que las condiciones climáticas favorecen el desarrollo y multiplicación de los microorganismos (Hernández y Gonzales, 2010).
El control de la contaminación en especies vegetales ha sido más dispendioso debido fundamentalmente a la contaminación endógena que presentan los explantes cuando son tomados directamente de campo, en su mayoría especímenes adultos altamente afectados por las condiciones adversas de su hábitat natural. (Materán, et al., 2008)
El objetivo de este trabajo es evaluar procedimientos de desinfección superficial durante el establecimiento in vitro de explantes de Comino (Aniba perutilis Hemsley), para controlar la contaminación endógena del material vegetal recolectado en campo.
Materiales y métodos
Ubicación de la zona de estudio y localización de plantas madre de A. Perutilis Hemsley
Con base en la revisión de literatura relacionada con A. perutilis, inventarios floristicos de la especie y la realización de muestreos previos, se visitaron los siguientes sitios: Reserva Nirvana en el municipio de Palmira (Valle), Vereda San Andrés del municipio de Dolores (Tolima), Ataco en los corregimientos de Santiago Perez: veredas Casa de Zinc y La Miranda, y Vereda Coello - Cocora, finca La Vega Larga.
Obtención de explantes
En la finca Vega Larga (Coello-Cocora) se encuentra un árbol de A. perutilis Hemsley de 3 metros de altura y aproximadamente 5 años, a una hora de distancia del laboratorio de protección de plantas, lo cual permitió realizar tratamientos previos a la recolección del material, como la fumigación con antifúngico e insecticida a fin de controlar microorganismos patógenos e insectos que podían dañar la planta; además la poda de las ramas para obtener los explantes: segmentos nodales y yemas de ramas juvenilizadas. Debido a esto la mayor cantidad de tratamientos realizados fueron con explantes tomados de esta planta madre juvenil.
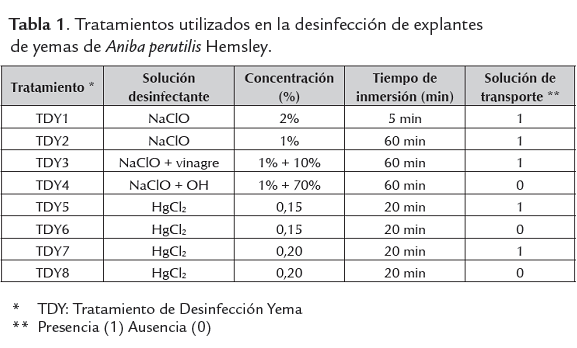
Tratamientos de desinfección
Ante la dificultad presentada en la obtención de plantas jóvenes, debido a la no consecución de árboles en período de fructificación y al escaso resultado en obtención de brotes en estacas, se trabajo con explantes tomados directamente de árboles en campo, con las consecuentes dificultades en el control de la contaminación. Esta etapa requirió de permanentes modificaciones al protocolo de desinfección probándose en total ocho (8) tratamientos para yemas (tabla 1), y once (11) tratamientos para segmentos nodales, estos últimos, resultaron no apropiados para la micropropagación, debido al difícil control de contaminación, esto puede radicar en que es un explante con tejidos lignificados, de mayor tamaño que las yemas, en los que el riesgo de aparición de patógenos aumenta; además, este tejido está más expuesto al ambiente comparado con los meristemos que por ser tejido indiferenciado en los que no hay aún presencia de tejidos vasculares y el domo meristemático está protegido por un par de primordios foliares que lo aísla y preserva de la contaminación, son convencionalmente utilizados en la generación de plantas libres de patógenos, especialmente de virus, micoplasmas, bacterias y hongos (Pedroza, 2008).
La mayoría de los ensayos con segmentos nodales arrojó un 100% de contaminación, por lo que no se muestran datos y se suspende su uso en el desarrollo de este trabajo, más teniendo en cuenta los resultados favorables con la utilización de yemas, con las cuales se obtuvieron respuestas exitosas en menor tiempo y sin el peligro subsecuente de la oxidación del material.
Los explantes se sembraron en medio Murashige y Skoog (1962) (MS).
Análisis estadístico
El modelo estadistico utilizado fue al azar teniendo en cuenta como Variables respuesta contaminación, oxidación y brotación. La validez estadística de los resultados se comprobó con la prueba de Shapiro-Wilks (1965), para determinar la normalidad de los datos, seguido del análisis de varianza con prueba de Bonferroni (1939), para la comparación múltiple de medias a un nivel de significancia P = 0.05, la información fue procesada con el software estadístico Infostat/E versión estudiantil 2010.
Resultados y discusión
Inventario de los árboles de A. perutilis hemsley encontrados en las zonas de estudio seleccionadas
La distribución de A. perutilis Hemsley ha sido reportada en Colombia por diferentes autores desde la Costa del Pacífico, y en los departamentos de Sarare (Arauca), Antioquia, Caldas, Llanos Orientales, Chocó, Santander, Valle delCauca, Risaralda, Huila, Meta y en estribaciones de las Cordilleras Occidental y Central (Obregón, 2006; Santamaría, 2005); pero no se conocen reportes en el departamento del Tolima, debido a la escasa población que se encuentra en estos momentos por la sobreexplotación a la que es sometida, se realiza el primer reporte de esta especie en el departamento del Tolima (tabla 2).
Aunque el A. perutilis Hemsley ha sido registrado desde el nivel del mar hasta los 2.600 m.s.n.m., (Hurtado, 2007) los pocos individuos hallados durante este estudio en el departamento del Tolima no superaron los 2.000 m.s.n.m.; en Ataco (vereda Casa de Zinc), se halló una cantidad considerable de individuos de A. perutilis Hemsley gracias a que en esta zona se está trabajando en la reforestación de la especie; en los otros sitios sólo se encontraron dos o tres individuos o a veces solo uno. Esta situación dificultó la recolección de muestras, seleccionándose finalmente la vereda vega larga como sitio de colecta.
Yemas
Inicialmente se realizaron ensayos con Hipoclorito de Sodio (NaClO) a diferentes concentraciones y tiempos de inmersion cortos (5 minutos), solo cuatro de estos produjeron un control leve de contaminación en las yemas apicales y laterales. Al no obtener buenos resutados se modificaron estas variables y se empleó otra solución desinfectante: el dicloruro de mercurio (HgCl2). Se realizaron tratamientos de desinfección tanto para yemas como para segmentos, obteniendo, en todos los tratamientos en los que se uso el dicloruro de mercurio, importantes reducciones en el porcentaje de contaminación, con respecto a los tratamientos en los que se utilizó el hipoclorito de sodio. (figura 1).
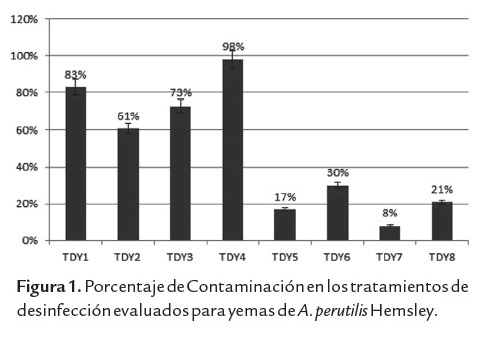
La prueba de Shapiro-Wilks determinó la normalidad de los datos. Al realizar el analisis de varianza, se comparó las medias de los tratamientos mediante la prueba de Bonferroni. Se encontraron diferencias significativas entre los desinfectantes utilizados (NaClO - HgCl2), obteniéndose con dicloruro de mercurio una media de 22,73 lo que indica una alta sobrevivencia de los explantes de yemas, en comparación con el hipoclorito de sodio que obtuvo una media de 81, es decir, presentó mayor contaminación (figura 2).
El dicloruro de mercurio resultó ser un desinfectante muy efectivo para el control de la contaminación de hongos y bacterias endógenas de los explantes de yemas de A. perutilis Hemsley. Sin embargo por ser un producto tóxico, debe ser utilizado con mucha cautela, ya que tiene la capacidad de impregnarse en la piel y causar intoxicación con el mercurio; preparada como solución es mas peligrosa, puesto que a medida que se va secando en la piel, ésta, lo absorbe (George, 1993).
En especies forestales se ha evaluado la eficiencia del HgCl2, por ejemplo, en Aspidosperma polyneuron fue mas eficiente que el NaClO en la desinfección de brotes apicales (Ribas et al., 2003). Este producto ha sido utilizado con éxito, para muchas especies leñosas que presentan serios problemas de contaminación por microorganismos, como relata Bennett y Davies JR (1986), Chalupa (1990), Purchit et al., (1994) y Patnaik and Debata (1996).
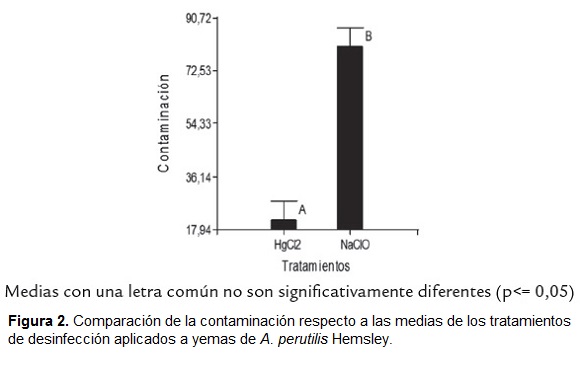
Con la prueba de Bonferroni, se realizó la comparación de medias entre las dos formas de transporte que se utilizó para llevar el material colectado de campo al laboratorio, el cual fué: en seco (0) y en la Solución transportadora (1), la cual contenía una solución de yodo + antifúngico (Benomil, 3gr/500 ml), encontrándose diferencias significativas entre los tratamientos; mostrando mejores resultados en el control de la contaminación de los explantes inmersos en la solución transportadora con una media de 44,55 de contaminación comparada con 71,33 correspondiente a la media de los explantes transportados en seco (figura 3).
Respecto a los tratamientos con hipoclorito de sodio (NaClO), se encontró que al reducir la concentración (1%) y aumentar el tiempo de exposición del material vegetal a una hora y con la solución transportadora de antifungico + yodo, el porcentaje de sobrevivencia fue mayor en comparación con los otros tratamientos con hipoclorito.
Al analizar los tratamientos de desinfección, la mejor respuesta se obtuvo con yemas de A. perutilis Hemsley transportadas en solución antifúngica 90% + yodo 10%, y desinfectadas en el laboratorio, con dicloruro de mercurio (HgCl2) al 0,2% por 20 minutos (figura 4).
Para reducir los efectos que tiene el proceso de desinfección sobre el explante, se recomienda tener en cuenta: (1) reducir la duración del proceso de escisión y de esterilización del explante, y (2) sustituir el agente desinfectante. Esto se corrobora con la revisión de literatura, en la cual, Seneviratney (1996), con brotes de Hevea brasiliensis para su establecimiento in vitro, encontraron que la desinfección de los explantes con hipoclorito de sodio (NaClO), a diferentes concentraciones, promovió el oscurecimiento de los tejidos y la exudación de fenoles; por su parte, el uso de dicloruro de mercurio (HgCl2) como agente desinfectante provocó menos problemas de oscurecimiento en los tejidos. En Strelitzia reginae, el uso de HgCl2 al 0,3% fue menos lesivo que el hipoclorito de calcio al 9% (Ziv y Halevy 1983); igualmente fue el caso de A. perutilis Hemsley ya que con el cambio de desinfectante se logró tanto el control de la contaminación como una mayor sobrevivencia de los explantes durante el establecimiento in vitro.
Conclusiones
El explante de yemas fue el que mejor se comportó en los distintos tratamientos aplicados.
Trasladar el material colectado en campo hasta el laboratorio en solución de Benlate 90% más yodo 10%, mejora el control de la contaminación.
El dicloruro de mercurio a una concentración de 0,2% por 20 minutos de inmersión arrojó la mayor efectividad en el control de la contaminación de hongos y bacterias endógenas y en la reducción de los efectos colaterales sobre los explantes de yemas de A. perutilis Hemsley.
Referencias bibliográficas
1 Alzate, C. N. 1987. La influencia del Guacharo (Steatornis caripensis) en la germinación de varias especies forestales y en la regeneración del comino (Aniba perutilis Hemsley) en la región de Río claro (Antioquia). (Tesis posgrado) Medellín. Universidad Nacional de Colombia, p 110. [ Links ]
2 Bennett, L.K., and Davies, JR. F.T. 1986. in vitro Propagation of Quercus shumardii seedlings. Hortscience. 21(4):1045-1047. [ Links ]
3 Bonferroni, C.E. 1936. Teoria estadistica de la clase de calculo de la probabilidad. Instituto Superior de las ciencias economicas, comerciales y de finanzas. 3-62. [ Links ]
4 Cárdenas L, D y Salinas, N . R. 2006. Libro rojo de plantas de Colombia. Especies maderables amenazadas. Bogóta D.C. Instituto Amazónico de Investigaciones SINCHI, Ministerio de ambiente, vivienda y desarrollo territorial. p 169. [ Links ]
5 Chalupa, V. 1990. Micropropagation of Hornbeam (Carpinus betulus L.) and Ash (Fraxinus excelsior L.). Biologia Plantarum. 32(5):332-338. [ Links ]
6 George, E. F. 1993. Plant propagation by tissue culture: The technology. Great Britain: exegetics Limited. Part 1. The Technology. 2 ed. Edington, UK: Exegetics Ltd. 1(2):574. [ Links ]
7 Hernandez, Y.; y Gonzalez, M. E. 2010. Efectos de la contaminación microbiana y oxidación fenólica en el establecimiento in vitro de frutales perennes. Cultivos Tropicales. 31(4): 00-00. [ Links ]
8 Holdridge, L.R. 1978. Ecología basada en zonas de vida. San José, Costa Rica: Instituto de interamericano de Ciencias Agrícolas. p 216. [ Links ]
9 Hurtado, A. C. A. 2007. Uso de modelos de predicción como herramienta para estimar el área de distribución potencial de la especie Aniba perutilis Hemsley (Comino Crespo) en el Departamento del Valle del Cauca. (Tesis de pregrado). Fundación Universitaria de Popayán, Facultad de ciencias naturales, Programa de ecología. Popayán, p 72. [ Links ]
10 Materán M. E., Vega M. C., Sánchez-Olate M., Sáez K., Rodríguez R. y Ríos D. 2008. Reactivación de material vegetal élite de Pinus radiata d. Don. Mediante microinjerto in vitro. Interciencia. 33(1): 66-70. [ Links ]
11 Murashige T. and Skoog F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum. 15:473-497. [ Links ]
12 Obregon S. C. 2006. El comino crespo: Belleza 100% colombiana. En vía de extinción. Revista M&M. 15(51):14-19. Link: http://www.revista-mm.com/ediciones/rev51/especie.pdf [ Links ]
13 Pedroza M.J.A. 2008. Aplicaciones del cultivo de tejidos vegetales en condiciones in vitro. Bogotá, Colombia: Universidad Distrital Francisco José de Caldas, p 348. [ Links ]
14 Purchit, S., Kukda, G., Sharma, P., and Tak, K. 1994. in vitro propagation of an adult tree Wrightia tomentosa through enhanced axillary branching. Plant Science. 103: 67-72. [ Links ]
15 Ribas, L.L.F., Zanette, F., Kulchetscki, L., and Guerra, M.P. 2003. Estabelecimento de culturas assépticas de Aspidosperma polyneuron. Ciência Florestal. 13(1): 115-122. [ Links ]
16 Santamaría, H. A. 2005. Recursos Biológicos Escuela de Ingeniería de Antioquia. Disponible en: http://biologia.eia.edu.co/ecologia/estudiantes/comino.htm [ Links ]
17 Seneviratne, P., and Wijesekara, G. A. S. 1996. The problem of phenolic exudates in in vitro culture of mature Hevea brasiliensis. Journal of Plantation Crop. 24: 54-62. [ Links ]
18 Shapiro, S. S. and Wilk. M. B. 1965. An analysis of variance test for normality (Complete Samples). Source: Biometrika. 52 (3/4), pp. 591-611. Published by: Biometrika Trust Stable. URL: http://www.jstor.org/stable/2333709 Accessed: 03/02/2009 15:44 [ Links ]
19 Ziv, M., and Halevy, A. 1983. Control of oxidative browning and in vitro propagation of Strelitzia reginae. HortScience. 18: 434-436. [ Links ]