Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.2 Bogotá July/Dec. 2014
https://doi.org/10.15446/rev.colomb.biote.v16n2.47241
http://dx.doi.org/10.15446/rev.colomb.biote.v16n2.47241
ARTÍCULO DE INVESTIGACIÓN
Efecto del filtrado crudo de Purpureocillium sp. (Cepa UdeA0106), sobre la eclosión de huevos y movilidad de juveniles de Meloidogyne incognita-javanica
Effect of the raw filtrate of Purpureocillium sp. (UdeA0106 strain) on the eclosion of eggs and the motility of Meloidogyne incognitajavanica juveniles
Nadya Lorena Cardona Bustos1, Harold Pavas2, Erika Pamela Fernández3
1 M.Sc., Ph.D. Instituto de Biología, Universidad de Antioquia, Calle 67# 53-108. Grupo BIOMA, nadya.cardona@udea.edu.co (Autor de correspondencia)
2 Biólogo, Universidad de Antioquia. bachue@gmail.com
3 Microbióloga Industrial. Instituto de Biología, Instituto de Biología, Universidad de Antioquia, Grupo BIOMA, eripafer@gmail.com
Recibido: octubre 10 de 2013 Aprobado: octubre 17 de 2014
Resumen
Meloidogyne incognita-javanica representa una limitación de los cultivos agrícolas y es necesario buscar alternativas para su manejo. El presente trabajo tuvo como objetivo evaluar el efecto in vitro del filtrado crudo de Purpureocillium sp. (Cepa UdeA0106) sobre laeclosión de huevos y los estadios juveniles de Meloidogyne spp. Adicionalmente, se evaluaron los medios: caldo extracto de malta (CEM), caldo extracto de levadura (CEL) y caldo papa glucosa (CPG), escogiéndose aquel que no ejerciera daño sobre la morfología de los huevos y permitiera la eclosión de los estadios juveniles. El hongo se multiplicó durante 7 días y fue filtrado. Para establecer su efecto sobre los huevos y estadios J2 de Meloidogyne spp., se probaron concentraciones del filtrado al 100 %, 90 %, 70 %, 50 %, 25 % y 10 %; comparándolas con un control compuesto de estadios J2 en agua destilada estéril (ADE) y CPG. Las variables a evaluar fueron el porcentaje de eclosión e inmovilidad en los J2. La unidad experimental fue la caja de Petri, cada una con 200 huevos/J2, con 5 réplicas de cada tratamiento. Se utilizó un diseño experimental completamente aleatorizado con ANOVA (P = 0,05) y análisis de comparación múltiple de Tukey. Se encontraron diferencias significativas entre todos los tratamientos (P < 0,05) pero el tratamiento correspondiente al filtrado puro (100 %) logró mantener el porcentaje más bajo de eclosión y mayor porcentaje de inmovilidad de los J2 (96,8 %). Las concentraciones al 90 % y 70 % igualmente lograron efectos en los J2, con porcentajes altos de inmovilidad.
Palabras clave: Meloidogyne incognita-javanica, Purpureocillium sp., control biológico de nematodos, Metabolitos fúngicos.
Abstract
Meloidogyne incognita-javanica represents an important threat to the agricultural crops, and it is necessary to seek alternatives for its control. The aim of this research it was to evaluate a crude filtrate from the strain Purpureocillium sp. UdeA0106 in order to establish the in vitro effect on the egg hatching and the immobility of juvenile stages of Meloidogyne spp. The mediums evaluated were malt extract broth (MEB), yeast extract broth (YEB), and potato dextrose broth (PDB), after which it was chosen the one that didn't produce any damages on nematode eggs and allowed the emergence of the larval stages. The fungus was multiplied for 7 days, and then it was filtrated. To evaluate its effect on the eggs and the J2 of Meloidogyne spp., filtrate concentrations were made at 100 %, 90 %, 70 %, 50 %, 25 % and 10 %, contrasting them with a control composed of the J2 stages in sterile distilled water and PDB. The variables evaluated were the percentage of altered eggs and the immobility observed in J2 stages. The experimental unit was the Petri dish, each one containing 200 eggs /J2. Each treatment was replicated 5 times. It was used a completely randomized design, and an ANOVA was performed (P = 0,05) as well as a multiple comparison test (Tukey). Significant differences were found between all treatments (P < 0,05), although the most effective in inhibiting both egg hatching and J2 mobility (96,8 %) were the full strength filtering (100 %). The dilutions at 90 % and 70 %, were able to produce effects with high percentages in the immobility.
Key words: Meloidogyne incognita-javanica, Purpureocillium sp., Biological control of nematodes, Fungus metabolites
Introducción
Los nematodos formadores de agallas del género Meloidogyne spp., son de gran importancia económica; representan un limitante en la agricultura ya que se estima que son responsables de más del 90 % de todos los daños causados por fitopatógenos en todo el mundo (Castagnone-Sereno, 2002).
Para minimizar el nivel de daño causado por estos organismos, existen varias estrategias que pueden ser empleadas, de acuerdo con las condiciones climáticas, estado del cultivo, la especie de nematodo y su nivel de densidad poblacional (Kaṩkavalci et al., 2009). Sin embargo, algunas de las prácticas más extendidas corresponden al uso de productos químicos, que conllevan a problemas medioambientales y de resistencia. Por otra parte, se encuentra el uso de variedades tolerantes o resistentes, las cuales no siempre están disponibles para todos los tipos de cultivos comerciales, o no cumplen con las exigencias de los consumidores.
Debido a lo anterior, desde hace varios años se han buscado otras alternativas, tales como el uso de hongos biorreguladores, que deben ser utilizados dentro de programas de manejo integrado de plagas y enfermedades (MIPE). Actualmente, hay en el mercado diferentes bioformulados que utilizan algunas de sus estructuras, y se están desarrollando productos con actividad tóxica o propiedades enzimáticas derivados de hongos, que pueden afectar la viabilidad de fitopatógenos y son prometedoras fuentes de innovación en nuevos productos orgánicos para su manejo integrado (Hashem y Abo-Elyousr, 2011; Regaieg et al., 2010; Al abed, 2008).
Existen diferentes grupos de hongos que se están implementando para biocontrol, dentro de los cuales se encuentra Purpureocillium sp. que ha sido recientemente descrito (Luansga et al., 2011). El hongo Purpureocillium sp., cepa UdeA0106, se ha venido trabajando en el grupo BIOMA (Biocontrol y Microbiología ambiental) desde hace algunos años y ha mostrado ser un buen biocontrolador de Sinfílidos (Salazar, 2013; Gallego, 2012; Durán, 2012) y nematodos del género Meloidogyne spp. De acuerdo con varios estudios, realizados en el grupo BIOMA (Cardona y Montoya, 2013; Sánchez, 2013), se ha observado como posteriormente a 24 - 48 horas de la interacción hongo-nematodo, éstos presentan alteraciones visibles en los diferentes estadios, sin que se presente aún micosis sobre éstos, lo que podría sugerir la presencia de metabolitos difusibles en el medio.
Aun cuando existen algunos estudios relacionados con la expresión genética en interacción hongo-nematodo (Cardona et al., 2008), es necesario continuar con los estudios sobre la producción de metabolitos presentes en el medio de crecimiento con el fin de contar con información que pueda conllevar en un futuro a procesos biotecnológicos para la producción de bioformulados. En este sentido, se realizó este trabajo de investigación que tuvo como objetivo, determinar el efecto in vitro del filtrado crudo de medio de cultivo la cepa UdeA0106 sobre la eclosión de huevos y la inmovilidad de los J2 del complejo Meloidogyne incognita-javanica.
Materiales y métodos
Los ensayos fueron realizados en el Laboratorio de Control Microbiológico del grupo BIOMA de la Universidad de Antioquia, y la cepa utilizada corresponde a Purpureocillium spp., cepa UdeA0106, aislada en los suelos de la finca Vegas de la Clara, propiedad de la Universidad de Antioquia, (Municipio de Gómez Plata-Antioquia), dentro de prácticas académicas. Los nematodos del género Meloidogyne spp. fueron obtenidos a partir de plántulas de tomate, variedad Santa Clara, susceptibles a nematodos, multiplicados en condiciones de invernadero en suelo previamente esterilizado. Los nematodos, fueron identificados morfológicamente de acuerdo con el método de los patrones perineales (Perry et al., 2010).
Los ensayos realizados correspondieron a la selección del mejor medio de cultivo para la realización de las pruebas de patogenicidad de los filtrados crudos, sobre los estadios de Meloidogyne spp., la obtención del filtrado crudo de la cepa UdeA0106 para la realización de las pruebas de patogenicidad y la determinación del efecto del filtrado de la cepa UdeA0106 sobre los huevos y J2 de Meloidogyne spp.
Debido a que la cepa estaba almacenada en nevera en medio de cultivo sintético, fue preciso realizar su reactivación. Colonias del hongo con dos semanas de crecimiento en medio PDA acidificado (Papa Dextrosa Agar, Merck®), se pusieron en contacto con huevos de Meloidogyne spp., hasta la observación de huevos que presentaran evidencia de crecimiento micelial en su interior. Estos, fueron traspasados a medio de cultivo PDA acidificado, en donde se pudieron obtener colonias características de la cepa UdeA0106 (Cardona, 2007).
Selección del medio de cultivo para la realización de las pruebas de patogenicidad de los filtrados crudos, sobre los estadios de Meloidogyne spp.
Con el objetivo de establecer el efecto de los medios sobre estadios del nematodo, y buscar aquel que no ejerciera daño alguno sobre la morfología y permitiera la eclosión de los huevos larvarios, fueron evaluados diferentes medios de cultivo. Los tratamientos evaluados correspondieron a los medios de cultivo:caldo extracto de malta (20 g/L, Oxoid®) (CEM), caldo extracto de levadura (20 g/L, Oxoid®) (CEL) y caldo papa glucosa (200 g/L papa, 20 g/L Glucosa) (CPG). Estos fueron envasados en erlenmeyers de 250 ml con 100 ml de medio líquido y esterilizados durante 15 min a 121°C y 15 psi. Posterior a su enfriamiento, se dispensaron huevos de Meloidogyne spp., los cuales se mantuvieron entre 18 – 25 oC, durante 2, 4 y 6 días. La variable a evaluar fue el porcentaje de eclosión de los huevos y se utilizó un control, los huevos del nematodo, dispensados en agua destilada estéril (ADE), incubados bajo las mismas condiciones que los tratamientos. Se consideró como el mejor medio de cultivo, aquel en donde el número de huevos eclosionados fue igual o menor que el control, permitiendo corroborar con ello, que el medio no intervenía con el desarrollo del nematodo.
Diseño experimental y Análisis estadístico
La unidad experimental fue la caja de Petri, con 5 réplicas, cada una con 100 huevos de Meloidogyne spp. Se realizaron ANOVAS a un nivel de significancia del 5 % y para determinar cuál sería el mejor tratamiento, se utilizó la prueba de comparación múltiple de Tukey por medio del programa SPSS Statistic versión 19 y las gráficas se realizaron con el programa SigmaPlot (versión 11.0).
Evaluación del efecto del filtrado de la cepa UdeA0106 sobre los huevos de Meloidogyne spp.
Con el objetivo de establecer el efecto del filtrado crudo de la cepa UdeA0106, a partir de las raíces de plantas de tomate infestadas previamente, se obtuvieron masas de huevos. Para ello, tales raíces fueron cortadas en trozos pequeños y dispensadas en frascos que contenían 200 mL NaOCl al 1 % las cuales fueron sometidas a agitación durante 3 min, para posteriormente realizar lavados con abundante ADE. A continuación los huevos fueron obtenidos por tamizaje diferencial y finalmente en un tamiz de 500 mesh. Con el fin de remover el exceso de hipoclorito, se les hicieron cuatro enjuagues con (ADE), para posteriormente ser lavados con una solución de Oxitetraciclina® al 0,1 % por 10 min. Porúltimo, con el fin de remover el antibiótico presente, se hicieron 5 lavados sucesivos con ADE para posteriormente ser utilizados en el bioensayo (Giraldo et al., 1997; Liu et al., 2008; Meyer et al., 2004; Regaieg et al., 2010).
Para obtener el filtrado crudo de la cepa UdeA0106 usado en ésta prueba, el hongo fue cultivado durante 7 días en el medio escogido, en agitación constante (150 rpm), a temperatura ambiente (18-25 °C). Con el fin de obtener una solución sin ninguna traza de la biomasa del hongo, posterior al tiempo de incubación, se realizó una doble filtración inicial, la cual incluyó el uso de una gasa estéril y un papel de f i l tro Whatman No.1. El producto obtenido, se centrifugó a 5200 rpm por 15 min y se filtró utilizando una bomba de vacío, con un filtro miliporo (0,2 μm). Posteriormente, con el fin de eliminar posibles restos de esporas o micelio, el filtrado fue centrifugado a 13000 rpm por 20 min. Por último, el sobrenadante obtenido, atravesó un filtro de fibra de vidrio (47 mm de poro) y con este material, se procedió a realizar los experimentos (Al abed, 2008; Liu et al., 2008; Regaieg et al., 2010; Yang et al., 2010).
Con el fin de obtener la solución de trabajo para la prueba de patogenicidad, se ajustó la concentración de nematodos entre 150 a 200 huevos/ml, los cuales fueron depositados en cajas de Petri estériles (Cardona y Leguizamón, 1994). A éstas, se les adicionaron los tratamientos a evaluar, consistentes en las diferentes concentraciones del filtrado (100 %, 90 %, 70 %, 50 %, 25 % y 10 %), las cuales fueron incubadas durante el tiempo del ensayo a temperatura ambiente (18-25 oC), bajo condiciones del laboratorio. Para la evaluación de los huevos, los controles, consistieron en el medio escogido estéril (CPG), y ADE, sin la adición de los filtrados del hongo. Las evaluaciones se realizaron bajo microscopio invertido en 20 y 40X y las variables a evaluar correspondieron al porcentaje de eclosión de los huevos, a los 2, 4 y 6 días de exposición y adicionalmente se hicieron registros cualitativos de cambios en la morfología de los huevos. Aquellos huevos con alteraciones morfológicas, fueron fotografiados utilizando para ello un microscopio invertido de luz marca Zeiss®, en objetivos de 40 y 100X.
Evaluación del filtrado de la cepa UdeA0106 en la actividad de los estadios J2 de Meloidogyne spp.
Para establecer el efecto del filtrado crudo de la cepa UdeA0106, se realizó extracción de J2 de Meloidogyne spp. a partir de muestras de suelo y raíces de las plántulas de tomate por el método del tamiz-papel facial (Coyne et al., 2007). Las muestras se colocaron en bandejas con un tamiz y una hoja de papel facial, y se le adicionó 300 ml de agua, para posteriormente recoger su filtrado en beackers a las 24 y 48 h, para concentrar los J2. Posteriormente, con el fin de limpiar de residuos vegetales la suspensión, se pasó por un juego de tamices de malla No. 16, 32, 60 y 150 Adicionalmente, se utilizaron juveniles, procedentes de la eclosión de huevos, en cajas de Petri estériles, incubadas a temperatura ambiente de 3 a 5 días. Los J2 obtenidos fueron concentrados por medio de tamices y utilizando un frasco lavador con agua corriente, fueron colectados en un beaker La concentración de nematodos se ajustó entre 150 a 200 J2/ml, los cuales fueron depositados en cajas de Petri estériles (Cardona y Leguizamón, 1994). A éstas, se les adicionaron los tratamientos a evaluar, consistentes en las diferentes concentraciones del filtrado (100 %, 90 %, 70 %, 50 %, 25 % y 10 %), las cuales fueron mantenidas durante el tiempo del ensayo a temperatura ambiente (25-28 oC), bajo condiciones del laboratorio. La variable a evaluar fue la proporción de inmovilidad de los J2 a las 24, 48 y 72 horas y adicionalmente, se hicieron registros cualitativos de cambios en la morfología de los J2, relacionados con presencia de vacuolas en el interior y deformidad corporal.
Diseño experimental y análisis estadístico del filtrado sobre huevos y J2 de Meloidogyne spp.
La unidad experimental, fue la caja de Petri, con 5 réplicas por tratamiento, cada una con 150-200 huevos o J2. En el estudio se utilizó un diseño experimental completamente al azar, con un intervalo de confianza del 95 % (P = 0,05) y se realizó un análisis de varianza (ANOVA) con medidas repetidas en el tiempo y se realizaron pruebas de comparación múltiple con el estadístico de prueba Tukey para determinar el mejor tratamiento. Para el análisis estadístico se utilizó el programa SPSS Statistic versión 19 y las gráficas se realizaron con el programa SigmaPlot (versión 11.0).
Para cada una de las pruebas de patogenicidad, fue necesario hacer transformaciones (log) a los datos, para que se ajustaran a los requerimientos de los supuestos de normalidad, homogeneidad y el supuesto de esfericidad exigidos por el modelo estadístico.
Resultados
Selección del mejor medio de cultivo para la realización de las pruebas de patogenicidad
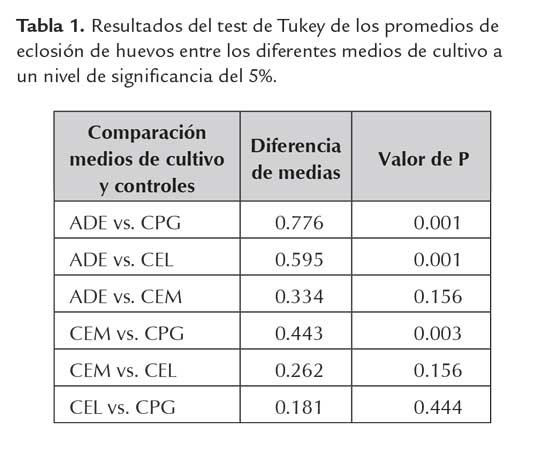
Los resultados de la evaluación de los medios, para establecer su efecto sobre estadios del nematodo, mostraron diferencias significativas en la eclosión de huevos en los medios CEL y CPG con respecto a su control (P < 0,05) (tabla 1). En CEM, se observó una eclosión mayor que en los demás medios evaluados y no se presentaron diferencias significativas comparadas con el control. Por otra parte, a pesar de que en los medios CEL y CPG, no presentaron diferencias entre sus medias (tabla 1), se seleccionó el CPG para cultivo de la cepa UdeA0106, debido a su bajo costo, comparado con los otros medios evaluados. Con este medio escogido, se realizaron las evaluaciones, cuyos resultados se muestran en párrafos posteriores.
Efecto del filtrado de la cepa UdeA0106 sobre la eclosión de huevos de Meloidogyne spp.
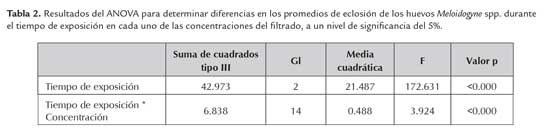
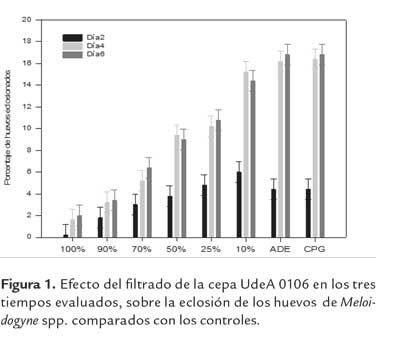
Los tiempos de evaluación mostraron inhibición de la eclosión diferencial de Meloidogyne spp. el medio CPG estéril, en comparación con los controles (P < 0,000) en la eclosión de los huevos de Meloidogyne spp. (tabla 2). Así mismo, los resultados muestran diferencias en la interacción tiempo x concentración, evidenciando la relación existente entre estas dos variables (figura 1).
A partir del primer tiempo de evaluación, se observó como las concentraciones de los filtrados, mostraron inhibición de la eclosión, comparados con los controles. La concentración del 100 % al día 2, presentó una eclosión del 2 %, mientras que el de la concentración del 90 %, fue del 3,4 % Por otra parte, en el cuarto y sexto día de exposición, los controles aumentaron el porcentaje de eclosión a un 16.8%, mientras que los porcentajes de eclosión a partir de la concentración del 25 %, estuvieron por debajo del 10 %. Los valores menores, se alcanzaron en las concentraciones del filtrado al 100 %.
Durante todo el tiempo del experimento, las mejores concentraciones del filtrado fueron el 70, 90 y el 100 %, quienes presentaron los menores porcentajes de eclosión de los huevos, comparados con el control. A pesar de que todos los tratamientos mostraron disminución en el porcentaje de eclosión, los resultados sugieren que el tratamiento con filtrado puro de la cepa UdeA0106 (100 %), fue el más efectivo, ya que logró mantener el porcentaje más bajo de eclosión.
Los resultados anteriores, indican que la cepa UdeA0106, podría estar produciendo ciertas sustancias que inhibirían la eclosión de los huevos del complejo Meloidogyne spp., aspecto que debe ser estudiado en posteriores investigaciones.
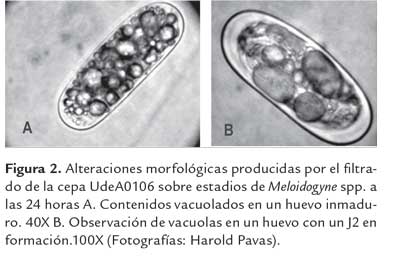
Por otra parte, aun cuando no se cuantificó el número de huevos morfológicamente anormales, se observó que para los tratamientos con el filtrado al 100%, 90%, 70% una gran proporción presentaban huevos con vacuolas en su interior y con deterioro de la pared, desde las 24 horas (figura 2).
Efecto del filtrado de la cepa UdeA0106 sobre la inmovilidad de estadios J2 de Meloidogyne spp.
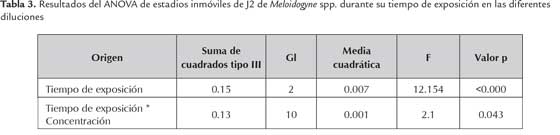
La inmovilidad de los estadios J2 de Meloidogyne spp. mostró diferencias significativas para los tiempos de evaluación y en la interacción tiempo x concentración del filtrado (tabla 3).
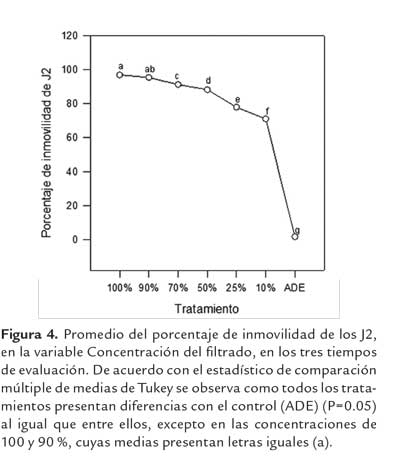
Posterior a las 72 horas de incubación del hongo con los J2, se logró mayores valores de inmovilidad en comparación con el control de ADE (figura 3). Los tratamientos con una mejor respuesta fueron el filtrado puro (100%) y las diluciones al 90% y 70% con porcentajes de inmovilidad del 96,8 %, 94,8% y 90,4 % respectivamente. Se encontró diferencias significativas, entre todos los tratamientos evaluados (P<0,05). El control con ADE registró un 3% de inmovilidad a las 24 horas, y 0 % a las 48 y 72 horas en los estadios J2 de Meloidogyne spp. De acuerdo con el estadístico de Tukey, todos los tratamientos mostraron diferencias con el control, considerándose como los mejores, aquellos que tuvieron los mayores porcentajes de inmovilidad como los presentados por las concentraciones del 100 y el 90 %, en todos los tiempos evaluados (figura 4)
Discusión
La actividad de filtrados de hongos nematófagos contra especies de nematodos fitoparásitos ha sido reportada en años anteriores (Cayrol et al., 1989; Mayer et al., 1999; Kerry, 2000) y los compuestos derivados de estos hongos con propiedades tóxicas y/o enzimáticas, se han registrado como una fuente promisoria de nuevas sustancias para el manejo de nematodos parásitos de plantas (Regaieg et al., 2010).
La existencia de efectos adversos de los filtrados de hongos sobre la eclosión de huevos y la mortalidad de nematodos parásitos de plantas han sido reportados por varios estudios (Cayrol et al.., 1989; Mukhtar y Pervaz, 2003; Regaieg et al., 2010; Yang et al., 2010; Ayatollahy y Fatemy, 2010), y se ha demostrado como varios hongos como Aspergillus sp, Penicillium sp, Paecilomyces sp., Talaromyces sp., Curvularia sp., Beauveria sp., Verticillium sp., Gymnoascus sp.) entre otros, producen toxinas y antibióticos así como sustancias que aún no han sido identificadas (Al abed 2008.; Liu et al., 2008, 2009; Cardona et al., 2008; Ayatollahy y Fatemy, 2010).
Es importante señalar como el hongo en estudio, tuvo la capacidad de afectar los dos estadios evaluados mientras que, existen algunos registros de hongos en los cuales, se ha observado que solo tienen la capacidad de inhibir uno de los estadios de los nematodos. En este sentido, Shinya et al., (2008) demostraron como aislados de Lecanicillium lecanii mostraron una alta actividad nematicida contra los huevos Heterodera glycines, en donde se observó inhibición de la embriogénesis en el huevo (huevos fertilizados pero sin desarrollo de juveniles) y en los huevos maduros (con formación de J2), este hongo evitó la eclosión; sin embargo no tuvo la capacidad de afectar la movilidad de los juveniles. Los resultados obtenidos por la cepa evaluada, con respecto a la capacidad de afectar J2 y huevos, concuerdan con el efecto del filtrado de Metacordyceps chlamydosporia sobre huevos y J2 de Meloidogyne incognita- javanica, en donde las diferentes diluciones del filtrado, ejercieron acción sobre estos (Mukhtar y Pervaz 2003; Perry et al., 2010). De otra forma, Regaieg et al. (2010) observaron que los filtrados de V. leptobactrum tenían un efecto sobre la movilidad de los J2 de M. incógnita en las concentraciones de 10 y 50%, e inhibían la incubación de huevos después de 7 días de exposición con la dilución de 50%. Los mismos autores, realizaron estudios de microscopia electrónica de barrido, demostrando alteraciones e inviabilidad en los huevos que fueron expuestos al tratamiento.
Adicionalmente, en el caso de Metacordyceps chlamydosporia, se encontró la producción de la toxina Verticilina A, B y C y se observó como las concentraciones de 80 y 100% inhibían la incubación de los huevos de M. javanica, y que el porcentaje de inhibición aumentaba proporcionalmente con el tiempo de exposición a filtrados crudos. De igual manera se encontró que a mayor concentración, se incrementaba la tasa de mortalidad de los J2 y que está a su vez era directamente proporcional al tiempo de exposición (Mukhtar y Pervaz, 2003). Los resultados del presente estudio, indican la presencia de igual forma de productos que son exudados hacia el medio, que no han sido identificados aún, lo cual hace necesario continuar los estudios en este sentido, con la cepa UdeA0106.
A pesar de que para este estudio no se determinó la naturaleza química de los compuestos del filtrado de la cepa UdeA0106 que pudieron tener un efecto sobre la inhibición en el porcentaje de eclosión, la malformación de los huevos y en la inmovilidad de los estadios J2 de Meloidogyne incognita-javanica, existen investigaciones previas realizadas con otra cepa de este mismo hongo (Codificada como Cenicafé 9501). Esta cepa, producía enzimas hidrolíticas extracelulares como quitinasas, una serín proteasa y lipasas (Villa, 2006; Cardona et al., 2007, 2008), que son expresadas en procesos complejos que conllevan a la penetración y degradación de la cutícula del nematodo hospedero y su digestión celular, lo cual podría dar origen a las alteraciones morfológicas observadas. En los estudio de Cardona et al. (2008) se determinaron algunos genes candidatos que se expresaban en la interacción directa hongo- nematodo, pero se desconocía la probabilidad de que, metabolitos producidos directamente en el medio, sin ejercer el estímulo de la interacción, tuvieran capacidades nematicidas.
Con relación a lo anterior, desde hace varios años, Bonants et al. (1995) reportaron el efecto deletéreo del filtrado de un cultivo de Purpureocillium lilacinum sobre huevos de Meloidogyne hapla, sugiriendo que la causa de este efecto, se debe a una proteasa extracelular que actúa sobre huevos; sin embargo, no afectó a los J2. Este resultado, también fue registrado por el efecto del filtrado de Lecanicillium lecanii sobre huevos de Heterodera glycines (Shinya et al. 2008) Metacordyceps chlamydosporia o Purpureocillium lilacinum que han sido encontrados como hongos parásitos de huevos y productores de toxinas y enzimas contra nematodos fitoparásitos (Kiewnick y Sikora, 2006).
Se ha descrito, que la forma en que afecta la producción de toxinas por parte de estos hongos nematófagos, ocurre por diferentes vías; Cayrol et al. (1989) sugiere que algunas toxinas producidas por hongos poseen por ejemplo un mecanismo de acción sobre los receptores neurotrópicos de los nematodos. Adicionalmente, se ha encontrado que un número de hongos nematófagos, conocidos por su actividad proteolítica y quitinolítica, causan serias alteraciones a la estructura cuticular de los huevos, cambios en la permeabilidad de la pared de éstos o producen perforaciones en la cutícula de los embriones. Lo anterior, es producido por enzimas y metabolitos tóxicos, que a su vez pueden causar desordenes fisiológicos (Mukhtar y Pervaz, 2003). Debido a los registros existentes, sería importante estudiar, si este tipo de metabolitos producidos en el medio por la Cepa UdeA0106, los cuales son producidos sin estimulo por parte del nematodo, eventualmente podría estar explicando la formación de vacuolas al interior de los huevos de Meloidogyne spp.
Conclusiones
Los resultados obtenidos por esta investigación demuestran como diferentes concentraciones del filtrado del cultivo de la cepa UdeA0106, obtenidas en el medio CPG, afectaron el desarrollo y eclosión de los huevos, así como la movilidad de los J2 de Meloidogyne spp. De acuerdo con estos resultados, es necesario continuar con las investigaciones relacionadas con el uso de filtrados o metabolitos de los hongos biocontroladores de nematodos, ya que en un futuro, ésta podría constituirse en una alternativa en la producción de bioformulados en nuestro medio.
Referencias bibliográficas
1. Al, abed A. M. 2008. In vitro Studies on Nematode Interactions with their Antagonistic Fung in the Rhizosphere of Various Plants. Faculty of Forest and Environmental Sciences, Albert Ludwigs Universität. Freiburg im Breisgau, Germany. 227 pp. [ Links ]
2. Ayatollahy, E.; Fatemy, S. 2010. In vitro assessment of pathogenicity and culture filtrates of fungi against Heterodera schachtii. Applied Entomology and Phytopathology. 77(2): 15-17. [ Links ]
3. Bonants, P. J.; Fitters, P.F.; Thijs, H. den Belder E.; Waalwijk, C.; Henfling, J.W.1995. A basic serine protease from Paecilomyces lilacinus with biological activity against Meloidogyne hapla eggs. Microbiology. 141 (Pt 4): 775-84. [ Links ]
4. Cardona, N.L.; Leguizamón, J. 1994. Aislamiento y Patogenicidad de hongos y bacterias al nematodo del nudo radical del café Meloidogyne incognita-javanica Goeldi. Revista Fitopatología Colombiana. 21(1): 39-52. [ Links ]
5. Cardona, N.L. 2007. Caracterización molecular de la cepa "Cenicafé 9501", y anotación de genes involucrados en la interacción con huevos de Meloidogyne incognita-javanica provenientes de zona cafetera. Tesis para optar al título de PhD. en Ciencias Agrarias, Universidad Nacional de Colombia, Sede Bogotá. 177 p. [ Links ]
6. Cardona, N. L.; Betancur, J. F.; Rivera, L.F.; Gaitán, A. 2008. Identification of pathogenic candidate's genes in the interaction of the CENICAFE 9501 strain with the root knot nematode Meloidogyne incognita-javanica. Revista Facultad Nacional de Agronomía. 61 (2): 4527-4541. ISSN 0304-2847. [ Links ]
7. Cardona, H.V.; Montoya, T.G.J. 2013. Evaluación de la patogenicidad del bioformulado de esporas de Purpureocillium spp. (Cepa UdeA 0109) sobre poblaciones de Meloidogyne spp. en plantas de tomate (Solanum lycopersicum) bajo condiciones de invernadero. Trabajo de pregrado para optar por el título de Biólogo. Medellín (Colombia). Grupo BIOMA. Universidad de Antioquia. 52 p. [ Links ]
8. Castagnone-Sereno, P. 2002. Genetic variability in parthenogenetic root-knot nematodes, Meloidogyne incognita-javanica, and their ability to overcome plant resistance genes.Nematology. 4: 605-608. [ Links ]
9. Cayrol, J. C.; Djian, C.; Pijarowski, L. 1989. Study of nematocidal properties of the culture filtrate of the nematophagus fungus Paecilomyces lilacinus. Revue Nématol. 12 (4): 331-336. [ Links ]
10. Coyne, D.L.; Nicol, J.M.; Claudius-Cole, B. 2007. Practical plant nematology: a field and laboratory guide. SP-IPM Secretariat, International Institute of Tropical Agriculture (IITA), Cotonou, Benin. ISBN 978-131-294-7. 82 p. [ Links ]
11. Durán, B. 2012. Evaluación de la patogenicidad de la cepa UdeA0106 sobre poblaciones de Sinfilidos, en condiciones de invernadero. Trabajo de grado como requisito parcial para optar por el título de Biólogo. Instituto de Biología, Universidad de Antioquia.44p. [ Links ]
12. Gallego, J. M. 2012. Compatibilidad del hongo entomopatógeno Cepa UdeA0106 con biocontroladores y productos fitosanitarios utilizados en cultivos de crisantemo. Tesis para optar al título de Magister en Biología. Universidad de Antioquia. 122 pp. [ Links ]
13. Giraldo, M. A.; Leguizamon, J.; Chaves, B. 1997. Evaluación de Paecilomyces lilacinus (Thom.) Samson para el control de Meloidogyne incognita-javanica Goeldi. en almacigos de café (Coffea arabica L.) variedad caturra. Revista de Fitopatología Colombiana. 21(2): 104-117. [ Links ]
14. Hashem, M.; Abo-Elyousr, K. 2011 Management of the root-knot nematode Meloidogyne incognita on tomato with combinations of different biocontrol organisms. Crop Protection. 30: 285-292. [ Links ]
15. Kerry, B. R. 2000. Rhizosphere interactions and the exploitation of microbial agents for the biological control of plant-parasitic nematodes. Annual Review of Phytopathology. 38: 423-441. [ Links ]
16. Kakavalci, G.; Tüzel, Y.; Dura, O.; Öztekin, G.B. 2009. Effects of alternative control methods against Meloidogyne incognita in organic tomato production. Ekoloji. 18: 23 - 31. [ Links ]
17. Kiewnick, S.; Sikora, R. A. 2006. Evaluation of Paecilomyces lilacinus strain 251 for the biological control of the northern rootknot nematode Meloidogyne hapla Chitwood. Nematology. 8: 69-78. [ Links ]
18. Liu, T.; Wang, L.; Duan, Y. X.; Wuang, X. 2008. Nematicidal activities of culture filtrate of Beauveria bassiana againts Meloidogyne hapla. World Journal of Microbiology and Biotechnology. 24: 113-118. [ Links ]
19. Liu, Y. J.; Zhai, C.Y.; Liu, Y.; Zhang, K. Q. 2009. Nematicidal Activity of Paecilomyces spp. and isolation a Novel Active Compound. The Journal of Microbiology. 47 (3): 248 - 252. [ Links ]
20. Luansga, J.J.; Houbraken, J.; Van, DorrnT.; Hong, S.B.; Borman, A.M.; Hygel-Jones, N.L.; Samson R.A. 2011. Purpureocillium, a new genus for the medically important Paecilomyces lilacinus. FEMS Microbiol Lett. 321: 141-149. [ Links ]
21. Mayer, A.; Kilian, M.; Hoster, B.; Sterner, O.; Anke, H. 1999. In-vitro and in-vivo nematicidal activities of the cyclic dodecapeptide omphalotin A. Pesticide Science. 55: 27-30. [ Links ]
22. Meyer, S.L.F.; Huettel, R.N.; Liu, X.Z.; Humber, R.A.; Juba, J.; Nitao, J.K. 2004. Activity of fungal culture filtrates against soybean cyst nematode and root-knot nematode egg hatch and juvenile motility. Nematology. 6: 23-32. [ Links ]
23. Mukhtar, T.; Pervaz, I. 2003. In vitro Evaluation of Ovicidal and Larvicidal Effects of Culture Filtrate of Verticillium chlamydosporiumAgainst Meloidogyne javanica. International Journal of Agriculture & Biology. 5 (4): 576-579. [ Links ]
24. Perry, R.N.; Moens, M.; Starr, J. L. 2010. Root-Knot Nematode. MPG Books group. CABI UK. ISBN 978-1-84593-492-7. 488 p. [ Links ]
25. Regaieg, H.; Ciancio, A.; Horrigue, N.; Grasso, G.; Rosso, L. 2010. Effects of culture filtrates from the nematophagous fungus Verticillium leptobactrum on viability of the root-knot nematode Meloidogyne incognita. World Journal Microbiology and Biotechnology. 26: 2285-2289. DOI 10.1007/s11274010-0397-4. [ Links ]
26. Salazar, D. 2013. Desarrollo de Métodos in vitro e Invernadero para el Control de Scutigerella sp. con la Cepa del Hongo Udea0106 en Cultivos de Flores del Oriente Antioqueño. Tesis de grado como requisito parcial para obtener el título de Doctor en Biología. Instituto de Biología, Universidad de Antioquia.160 p. [ Links ]
27. Sánchez, J. Y. 2013. Estudio de viabilidad de las estructuras del hongo Purpureocillum sp. Cepa UdeA0109 formulado en un ingrediente inerte bajo diferentes condiciones de tiempo y temperatura. Trabajo de grado para optar por el título de Biólogo. Universidad de Antioquia. Facultad de Ciencias Exactas y Naturales. Seccional oriente - Carmen de Viboral. Grupo BIOMA. Universidad de Antioquia. 35 p. [ Links ]
28. Shinya, R.; Aiuchi, D.; Kushida, A.; Tani, M.; Kuramochi, K.; Koike, M. 2008. Effects of fungal culture filtrates of Verticillium lecanii (Lecanicillium spp.) hybrid strains on Heterodera glycines eggs and juveniles. Journal of Invertebrate Pathology. 97: 291-297. [ Links ]
29. Villa, C. 2006. Estudios in vitro sobre la patogenicidad de cultIvos monospóricos del Hyphomycete sp. (Cenicafé 9501) sobre huevos de Meloidogyne incógnita-javánica provenientes de café. Trabajo de grado para optar por el título de Biólogo. Instituto de Biología. Universidad de Antioquia. 51 p. [ Links ]
30. Yang, Z.S.; Li, G.H.; Zhao, P.J.; Zheng, X.; Luo, S.L.; Niu, X.M.; Zhang, K.Q. 2010. Nematicidal activity of Trichoderma spp. and isolation of an active compound. World Journal of Microbiology and Biotechnology. DOI 10.1007/s11274-010-0410-y. [ Links ]