Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.2 Bogotá jul./dez. 2014
https://doi.org/10.15446/rev.colomb.biote.v16n2.47244
http://dx.doi.org/10.15446/rev.colomb.biote.v16n2.47244
ARTÍCULO DE INVESTIGACIÓN
Efecto de la temperatura de almacenamiento sobre la viabilidad de bacterias simbióticas fijadoras de nitrógeno utilizadas en la elaboración de inoculantes biológicos para arveja (Pisum sativum) y soya (Glycine max)
Effect of storage temperature on the viability of symbiotic nitrogen fixing bacteria used in the preparation of biological inoculants for crop pea (Pisum sativum) and soybean (Glycine max)
Lina M. Moreno Conn1, Adrián Pérez2, Margarita Ramírez3, Marcela Franco4
1 Microbióloga Agrícola y Veterinaria MSc. Corporación Colombiana de Investigación Agropecuaria Corpoica C.l La Libertad. Km 19 vía Puerto López, Villavicencio-Meta. lmoreno@corpoica.org.co.
2 Ingeniero de Producción Biotecnológica MSc. Corporación Colombiana de Investigación Agropecuaria Corpoica C.l Tibaitatá. Km 14 vía Mosquera, Cundinamarca. urleyadrian@gmail.com.
3 Ingeniero agrónomo PhD. Corporación Colombiana de Investigación Agropecuaria Corpoica C.l Tibaitatá. Km 14 vía Mosquera, Cundina-marca. mmramirez@corpoica.org.co.
4 Microbióloga. PhD. Pontificia Universidad Javeriana. Departamento de Microbiologia. Bogotá-Cundinamarca. franco@javeriana.edu.co.
Recibido: noviembre 25 de 2013 Aprobado: octubre 17 de 2014
Resumen
El nitrógeno es un elemento requerido en grandes cantidades por los cultivos, sin embargo, en el suelo es uno de los elementos más limitantes ya que se encuentra en formas poco disponibles para las plantas y debe ser incorporado a través de la fertilización química o por medio de la fijación biológica llevada a cabo por microorganismos. Las bacterias simbióticas fijadoras de nitrógeno han sido ampliamente utilizadas para la elaboración de inoculantes, constituyéndose en una alternativa viable para mejorar el rendimiento de los cultivos a través de un mejor suministro de este elemento. Estos inoculantes para que puedan ser comercializados deben cumplir con ciertos requisitos de calidad que garanticen el buen funcionamiento del producto. En este estudio se evalúo la viabilidad de las cepas ICA L9 e ICA J96 en inoculantes almacenados a temperaturas de 4±2, 18±3 y 28±2 °C durante 180 días y la actividad biológica en plantas de arveja y soya. Las cepas utilizadas pertenecen al Banco de Germoplasma de Microorganismos de Corpoica; para los ensayos biológicos se emplearon semillas de arveja variedad "Santa Isabel" y soya variedad "Corpoica Superior 6". Al evaluar la viabilidad de los inoculantes almacenados a 4±2 °C, 18±3 °C y 28±2 °C, se evidenció que la temperatura no afectó la supervivencia y la concentración de rizobios después de 180 días de almacenamiento permitiendo observar un número de unidades formadoras de colonias por gramo superior a 108, valor que garantiza la calidad del inoculante. En cuanto a la actividad biológica, se observó que las cepas inoculadas fueron infectivas y efectivas para la fijación biológica del nitrógeno, comparado con los testigos absolutos.
Palabras clave: Nitrógeno, inoculantes, Banco de Germoplasma, arveja, soya.
Abstract
Nitrogen is an element required in large amounts by most crops, however, in soil is one of the most limiting and located in ways not available to the plant and must be incorporated through chemical fertilization or by biological fixation conducted by microorganisms. Fixing symbiotic bacteria nitrogen has been widely used for the production of inoculants, becoming a viable alternative to improve crop yields through a better supply of this element. These inoculants to be marketed must meet certain requirements quality to ensure the smooth operation of the product. This study assessed the viability of the strains ICA L9 and ICA J96 inoculants stored at temperatures 4±2, 18±3 y 28±2°C for 180 days and the biological activity in pea and soybean plants. The strains used belong to the collection of work Germplasm Bank CORPOICA Microorganisms; for biological assays were used pea seeds variety "Santa Isabel" and soybean variety "Superior Corpoica 6". In assessing the viability of inoculants stored at 4±2°C, 18±3°C y 28±2°C, evidenced that the temperature did not affect the survival and the concentration of rhizobia after 180 days of storage allowing to observe a number of colony forming units per gram than 10s, value that guarantees the quality of the inoculant. Concerning the biological activity, it was observed that the strains were inoculated infective and effective biological nitrogen fixation, absolute compared to controls.
Key words: Nitrogen, inoculants, Germplasm Bank, pea, soybean
Introducción
El nitrógeno (N) es un elemento importante en el desarrollo de todos los organismos ya que hace parte estructural de aminoácidos, ácidos nucleicos, proteínas y componentes celulares; sin embargo, en el suelo es uno de los nutrientes más limitantes ya que se encuentra en formas poco disponibles y solo puede ser utilizado por un grupo de microorganismos altamente especializados, donde se incluyen las bacterias fijadoras de nitrógeno o diazótrofas de vida libre y simbióticas que se asocian con diferentes especies vegetales, especialmente las leguminosas (Racca, 2004). Esta asociación biológica es de gran importancia para la agricultura ya que contribuye a aumentar la fertilidad de los suelos a través de la fijación de nitrógeno y se estima que con la simbiosis establecida entre los rizobios y las leguminosas se puede fijar de 24 hasta más de 584 kg de nitrógeno/ha abasteciendo en algunos casos hasta el 90 % de las necesidades de las plantas (Ferrera y Alarcón, 2007; Lindström et al., 2010).
En la simbiosis rizobio-leguminosas, los dos organismos establecen una cooperación metabólica; por un lado las bacterias reducen el nitrógeno atmosférico (N2) por acción del complejo enzimático nitrogenasa a amonio (NH4), el cual es exportado al tejido vegetal para su asimilación en proteínas y otros compuestos nitrogenados complejos. Por otra parte, durante la fotosíntesis, las plantas reducen el CO2 en azúcares que son transportados a la raíz donde son aprovechados por los bacteroides que se encuentran dentro del nódulo, como fuente de energía para proveer ATP al proceso de fijación biológica del nitrógeno (FBN). Esta asociación es de gran importancia para la agricultura y los ecosistemas naturales ya que conlleva a un aumento significativo del nitrógeno disponible para las plantas, siendo la manera directa de incorporar el nitrógeno atmosférico al suelo. De igual forma pueden promover la toma de otros nutrientes como el fósforo, producir fitohormonas, vitaminas y sustancias antibacterianas capaces de mitigar el ataque por patógenos (Ernst, 2004) contribuyendo a disminuir la aplicación de insumos químicos y/o fertilizantes nitrogenados que han alterado significativamente los constituyentes del suelo y el equilibrio ecológico, modificando especialmente las actividades metabólicas de las diferentes poblaciones microbianas del agroecosistema (Reyes et al., 2008).
En los últimos años, las bacterias simbióticas fijadoras de nitrógeno perteneciente a la familia de las Rhizobiaceae han sido ampliamente utilizadas para la elaboración de inoculantes biológicos para cultivos de leguminosas como la arveja y la soya, constituyéndose en una alternativa viable para mejorar la nutrición y el rendimiento de los cultivos mediante una fijación biológica más eficiente del N2, con niveles que oscilan entre el 60 y 90 % de FBN para ser utilizado por las plantas, favoreciendo el desarrollo de una agricultura ecológicamente sostenible y reduciendo costos de producción (Alfonso et al., 2005).
En Colombia, la arveja es la segunda leguminosa de mayor importancia después del frijol por ser el motor de la economía de pequeños productores, con una producción calculada de 80000 toneladas de vaina para consumo fresco y 1200 toneladas de arveja seca para semilla cultivadas principalmente en los departamentos de Cundinamarca, Boyacá, Nariño, Tolima y Huila (Fenalce, 2010). Los mayores limitantes en la producción de este cultivo se ven reflejados en el incremento de costos de producción ya que esta leguminosa requiere altas dosis de fertilizantes que suplan las necesidades nutricionales de las plantas, debido a la baja productividad de los suelos en que se establecen generalmente estos cultivos; dichos suelos se caracterizan principalmente por bajos contenidos de nitrógeno disponible, baja mineralización de la materia orgánica y altas tasas de pérdida de nitrógeno por lixiviación o volatilización.
Para el caso de la soya, este cultivo ocupa el octavo lugar en superficie cosechada; el principal productor es el departamento del Meta con una participación en la producción nacional del 68,7 % y un área sembrada de aproximadamente 61000 ha con un rendimiento que oscila entre 2,5 y 3 ton/ha destinadas para la producción de aceite, harina de soya y grano para su uso en la alimentación humana o materia prima para la obtención de albúminas concentradas, convirtiéndose en una alternativa nutricional por su alto contenido de proteína de excelente calidad (Fenalce, 2010; Gutiérrez & Forero, 2007). La soya requiere de nutrientes durante su ciclo de desarrollo, entre ellos el nitrógeno, potasio, calcio, fósforo y azufre, indispensables para obtener altas producciones y buena calidad del grano, considerándose como uno de los cultivos que más extraen nutrientes en comparación con otras especies transitorias (Guerrero, 1993). Cerca del 50 % del nitrógeno total necesario para las plantas de soya es absorbido en la etapa de floración y llenado de vainas; sin embargo, la exigencia de nitrógeno diaria de esta leguminosa es dependiente del índice de crecimiento y la etapa del desarrollo. Las principales fuentes de nitrógeno para este cultivo provienen del suelo cuando no establece asociación simbiótica y del N2 atmosférico obtenido mediante el proceso de FBN cuando es inoculado con bacterias simbióticas pertenecientes a la familia de las Rhizobiaceae (George & Singleton, 1992). En la Altillanura Colombiana, la inoculación de las semillas de soya con bacterias simbióticas fijadoras de nitrógeno como Bradyrhizobium japonicum es una práctica que se ha implementado en los últimos años y ha conllevado a disminuir hasta en un 80 % a 90 % la fertilización nitrogenada.
En el país, la producción de inoculantes biológicos ha venido abarcando un amplio mercado dentro del sector agropecuario nacional; actualmente existen alrededor de 71 empresas registradas y avaladas por el ICA destinadas a la producción de inoculantes con base en microorganismos promotores de crecimiento vegetal dentro de los cuales se incluyen las bacterias simbióticas fijadoras de nitrógeno (Zambrano, 2008). El uso de estos insumos en cultivos de interés como es el caso de la arveja y soya se ha venido incrementando acorde a las demandas generadas por los productores en su afán por reducir costos de producción. El ICA como entidad responsable de garantizar la calidad de los insumos agrícolas expidió en la resolución 0698 del 2011 que los inoculantes para ser comercializados deben cumplir con rigurosos estándares de calidad microbiológica que garantice el buen funcionamiento del producto y que permitan al agricultor utilizarlos en un determinado período de tiempo. El manejo inadecuado de los productos tanto en la etapa de escalamiento, preparación y almacenamiento puede traer como consecuencia una baja viabilidad y efectividad de los inoculantes (Reyes et al., 2008; Munévar & Ramírez,1990).
Teniendo en cuenta lo anterior, el presente estudio tuvo como objetivo evaluar el efecto de las temperaturas de almacenamiento sobre la viabilidad y actividad biológica de las cepas ICA L9 e ICA J96 (Rhizobium leguminosarun bv. viceae y Bradyrhizobium japonicum) utilizadas en la elaboración de inoculantes sólidos con base en turba para el cultivo de arveja y soya, durante
180 días.
Materiales y métodos Material biológico
Las cepas ICA L9 e ICA J96 utilizadas para la elaboración de los inoculantes hacen parte del Banco de Germoplasma de Microorganismos del Centro de Investigación de Corpoica. La cepa ICA L9 se aisló a partir de raíces noduladas de Pisum sativum. La cepa ICA J96 fue aislada a partir de raíces noduladas de Glycine max; este aislamiento es utilizado para la elaboración de inoculantes biológicos para el cultivo de soya por Corpoica. Para los ensayos de actividad biológica bajo condiciones controladas en invernadero, se utilizaron semillas de arveja variedad "Santa Isabel" y soya variedad "Superior 6". La variedad de arveja "Santa Isabel" es la más cultivada en Colombia con un rendimiento promedio entre 4000 a 4500 tn/ha, se adapta a altitudes entre 2200 y 3000 msnm. Por otra parte, la variedad de soya "Superior 6" es un material desarrollado por Corpoica en el centro de investigaciones La Libertad ubicado en Villavicencio-Meta, como alternativa genética para la Orinoquia colombiana con adaptación a suelos de vega del Piedemonte llanero y suelos mejorados de la Altillanura, a altitudes entre 150 y 1200 msnm (Corpoica, 2006). Las semillas de arveja y soya se desinfectaron previamente sumergiéndolas en etanol al 85% por 20 seg, luego se pasaron a hi-poclorito de sodio al 2 % por dos min y finalmente se enjuagaron con suficiente agua destilada con el objeto de eliminar el exceso de las soluciones desinfectantes.
Preparación del pre-inóculo
Cada una de las cepas almacenadas a 4 °C fueron reactivadas en 500 ml de medio levadura-manitol (LM); la cepa ICA L9 se llevó a incubación por 24 a 48 h teniendo en cuenta que es una bacteria de crecimiento rápido. Para el caso de la cepa ICA J96 por ser una bacteria de crecimiento lento, se dejó en incubación hasta las 72 h a una temperatura de 28±2 °C y 120 rpm. Una vez que se observó la turbidez del medio de cultivo, como indicio del crecimiento de los microorganismos, se procedió a inocular cada cepa en 3000 ml de medio LM e incubar por 24-48-72 h a 28±2 °C y agitación orbital a 120 rpm. Posteriormente se realizó un control de calidad a cada inóculo líquido para verificar la pureza, mediante la técnica de diluciones seriadas utilizando solución salina al 0,85 % y siembra en superficie sobre el medio levadura-manitol-agar (LMA) suplementado con Rojo Congo. Los resultados de los conteos se expresaron en unidades logarítmicas (UL).
Elaboración de los inoculantes
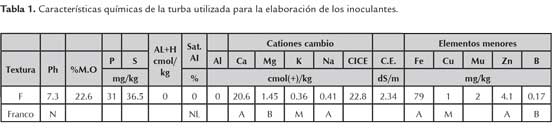
Se tomaron 35 ml de la cepa ICA L9, en fase exponencial con una concentración de 8x108 UFC de rizobios/ ml, y se inyectaron en 62,5 g de turba proveniente del departamento de Antioquia, previamente esterilizada a 120 °C y 15 lb de presión por tres días con intervalos de 24 h; este mismo procedimiento se realizó con la cepa ICA J96. La turba utilizada se caracterizó por presentar porcentajes altos de materia orgánica, según el análisis químico (tabla 1). De cada cepa se inocularon 90 bolsas y se tomaron como controles negativos las bolsas impregnadas con el medio de cultivo LM estéril sin microorganismos, para un total de tres tratamientos por cada temperatura evaluada (T1: inoculantes elaborados con la cepa ICA L9, T2: inoculantes elaborados con la cepa ICA J96, T3: control negativo). Los inoculantes se llevaron a incubación durante 24-48 h a 28±2 °C; posteriormente se almacenaron a tres temperaturas (4±2, 18±3 y 28±2 °C) por un periodo de seis meses (180 días); para las evaluaciones se tomaron 4 bolsas de cada tratamiento por cada temperatura a las cuales se les realizó el control de calidad para verificar la pureza y viabilidad de las cepas. La primera evaluación se realizó 5 días después de la inoculación sobre el soporte turba, a partir de este momento se evaluó la pureza y viabilidad, teniendo en cuenta 4 tiempos: T1: 15 días después de la incubación, T2: 60 días después de la inoculación, T3: 120 días después de la inoculación, T4: 180 días después de la inoculación. La pureza de los inoculantes se determinó mediante el conteo del número de unidades formadoras de colonias por gramo (UFC/g) utilizando el método de recuento en placa de diluciones en base diez en medio LMA y características microscópicas de las cepas, teniendo en cuenta los protocolos establecidos en el manual de procedimientos técnicos para el control de calidad de inoculantes de Corpoica (Corpoica, 2007) y el manualBergey (2005).
Los datos se analizaron por medio de estadística descriptiva y por comparación entre medias utilizando la prueba de Duncan (p<0,05) con un nivel de confianza del 95 % empleando el programa SAS versión 8.3.1.
Actividad biológica
Para evaluar la actividad biológica de la cepa ICA L9 (R. leguminosarum bv. viceae), se establecieron ensayos en invernadero con semillas de arveja variedad "Santa Isabel" inoculadas con el producto; para el caso de la soya variedad "Superior 6" se inocularon con la cepa ICA J96 (8. japonicum) previamente desinfectadas. La cantidad de inóculo utilizado para cada ensayo fue de 5 g/kg mezclado con una solución de sacarosa al 10 % para permitir la impregnación de la semilla con el inoculante (Corpoica, 2007). Los ensayos se establecieron de forma independiente bajo condiciones de invernadero con una temperatura promedio entre 10,9 y 32,9 °C y una humedad relativa entre 50 y 70%; los tratamientos evaluados se muestran en la tabla 2.
Se realizaron muestreos destructivos de las plantas de arveja y soya cada dos meses después de la siembra e inoculación y se evaluaron variables dependientes como altura de planta, peso seco foliar y radical, número y color de los nódulos.
El diseño estadístico empleado para los ensayos fue el de bloques completos al azar con cinco repeticiones por tratamiento. Se aplicó un análisis de varianza y una prueba de comparación múltiple con la prueba de Duncan (p<0,05) con un nivel de confianza del 95 % empleando el programa SAS versión 8.3.1, para la determinación de diferencias entre los tratamientos evaluados.
Reducción de acetileno para la determinación de la actividad de la nitrogenasa
La actividad del complejo enzimático nitrogenasa evaluado en las cepas ICA L9 e ICA J96 se determinó en las raíces noduladas de las plantas de arveja y soya inmediatamente después del muestreo, utilizando la técnica de reducción de acetileno en un cromatógrafo de gases marca Perkin-Elmer 3920B, con detector de llama FID, columna empacada Poropack R (malla 80/100) de 200 cm de longitud y 0,2 cm de sección e inyector manual (Corpoica, 2007).
Resultados y discusión
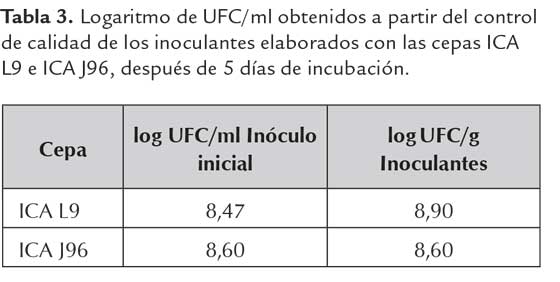
Al realizar el control de calidad de los inoculantes después de 5 días de incubación se observó que la cepa ICA L9 se multiplicó en el soporte turba aumentando el número de células en 0,43 unidades logarítmicas (UL), mientras que la cepa ICA J96 no tuvo un aumento en el número de células bacterianas (tabla 3); este resultado se pudo deber al cambio drástico medioambiental al que son sometidas las cepas y está relacionado con el tiempo de adaptación y multiplicación ya que la cepa ICA J96 es un microorganismo de crecimiento lento con una fase exponencial entre 22 a 50 h, la capacidad de adaptación al soporte y utilización de los diferentes sustratos, generando en algunos casos la disminución de la biomasa celular.
Efecto de las temperaturas de almacenamiento sobre la viabilidad de las cepas
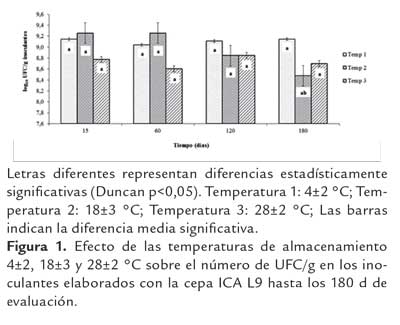
Al evaluar el efecto de las temperaturas 4±2, 18±3 y 28±2 sobre la viabilidad de la cepa ICA L9 en los inoculantes se observó que la concentración celular se mantuvo en 108 hasta los 180 días de almacenamiento, no evidenciándose diferencias estadísticamente significativas según la prueba de Duncan (p<0,05) en el número de rizobios presentes en los inoculantes (figura 1). Con este resultado se puede justificar que aun que no hubo un efecto significativo de la temperatura sobre la viabilidad de la cepa, si se observó claramente un incremento en la concentración inicial pasando de 8,90 UL/g a 9,14 UL al almacenar el inoculante a temperatura de 4±2 °C; este incremento en la concentración celular puede estar relacionado con el contenido de materia orgánica y los nutrientes encontrados en la turba utilizada como soporte, que permitieron el desarrollo y multiplicación de las bacterias presentes en el inoculante. Después de 60 días de almacenamiento, estos nutrientes pudieron agotarse paulatinamente a través del tiempo, especialmente el manitol utilizado por los rizobios como fuente de carbono, disminuyendo así la concentración celular del microorganismo evaluado.
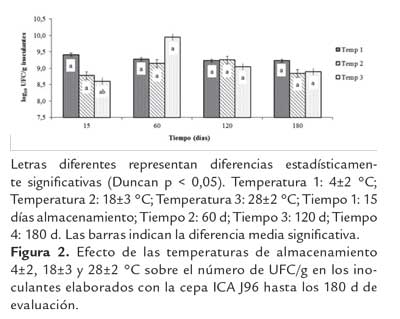
Letras diferentes representan diferencias estadísticamente significativas (Duncan p < 0,05). Temperatura 1: 4±2 °C; Temperatura 2: 18±3 °C; Temperatura 3: 28±2 °C; Tiempo 1: 15 días almacenamiento; Tiempo 2: 60 d; Tiempo 3: 120 d; Tiempo 4: 180 d. Las barras indican la diferencia media significativa. Figura 2. Efecto de las temperaturas de almacenamiento 4±2, 18±3 y 28±2 °C sobre el número de UFC/g en los inoculantes elaborados con la cepa ICA J96 hasta los 180 d de evaluación.
En los inoculantes elaborados con la cepa ICA J96 almacenados a 4±2, 18±3 y 28±2 °C se observó que desde los 120 hasta los 180 días de evaluación el número de unidades formadoras de colonias se mantuvo en 9,23 UL/g de inoculante, no encontrándose diferencias estadísticamente significativas entre las temperaturas evaluadas (figura 2).
Con estos resultados obtenidos sobre los inoculantes elaborados con bacterias simbióticas fijadoras de nitrógeno, se puede observar que las temperaturas de almacenamiento no tuvieron un efecto marcado sobre la población bacteriana ya que hasta el final de la evaluación (180 días) se mantuvo el número de UFC/g de inoculante, con una concentración de 108 lo cual hace que sea apto para su uso. Los inoculantes elaborados con turba estéril deben contener un mínimo de 1 x 108 células viables de rizobios (Rhizobium sp. y/o Bradyrhizobium sp.) por gramo de inoculante en fábrica hasta el término de su vida útil. Sin embargo, este requerimiento varía de acuerdo a las legislaciones vigentes para cada país (Rossi, 2005). En Colombia, el Instituto Colombiano Agropecuario (ICA) en la resolución 0698 del 2011 exige que los inoculantes elaborados con base en bacterias fijadoras de nitrógeno contengan una concentración mínima de 1x108 UFC/g de inoculante, para su comercialización.
La temperatura óptima para el crecimiento de los rizobios en medios de cultivo e inoculantes sólidos puede variar entre cepas y especies, con valores entre 27 °C y 39 °C. Las temperaturas máximas en las cuales pueden crecer estos microorganismos se encuentran en el rango de 35-39 °C, sin embargo, se ha observado aumentos en la proliferación celular de los rizobios hasta los 42 °C. Esta característica es importante ya que cepas utilizadas para los inoculantes, adaptadas a altas temperaturas de almacenamiento pueden sobrevivir bajo las condiciones de suelos tropicales, las cuales oscilan entre 27 y 50 °C (Abdulland & Alfalih, 2002). Kremer y Peterson (1983) evaluaron diferentes soportes para la preparación de inoculantes entre ellos turba, carbón vegetal, bentonita y aceite vegetal, encontrando que la turba y el aceite vegetal puede mantener un alto número de rizobios (> 108) almacenados a temperatura entre 30 y 60 °C después de 6 meses; para el caso del aceite vegetal, observaron que la alta supervivencia y viabilidad de los rizobios se debe a que este soporte puede proteger a las células bacterianas contra el calor y condiciones de sequía por el uso de altas temperaturas de almacenamiento.
Estrada et al., (2009) evaluaron diferentes temperaturas para el almacenamiento de inoculantes con base en bacterias diazotróficas, entre ellas Azospirillum brasilense, Azospirillum amazonense, Herbaspirillum seropedicae y Rhizobium tropici (SP245) encontrando que los inoculantes elaborados con base en H. seropedicae y R. tropici (SP245) almacenados a 4 °C mantuvieron la concentración celular por encima de 108 UFC/g de inoculante durante los 150 días de evaluación comparado con las otras bacterias evaluadas. Este resultado es similar al obtenido con los inoculantes elaborados con las cepas ICA L9 e ICA J96 almacenados a 4 °C, donde a los 180 días de almacenamiento, aún mantuvieron una concentración de 108 UFC/g de inoculante.
Temprano et al., (2002) encontraron que inoculantes elaborados con Rhizobium sp. almacenados a 25±3 °C, presentaron un incremento inicial en el número de células viables a las dos semanas de almacenamiento; luego éste se redujo durante las ocho semanas siguientes a una concentración por debajo de 108 UFC/g de inoculante. En este trabajo de investigación, los inoculantes sólidos elaborados con base en Rhizobium sp. almacenados a 28±2 °C presentaron 108 UFC/g durante 180 días. Con este resultado se puede inferir que los inoculantes son aptos para su comercialización ya que se conservan durante 180 días con un número de UFC/g en 108. Según Kuykendall et al., (2005) la temperatura óptima para el crecimiento y multiplicación de rizobios es entre 25 y 30 °C.
Tittabutr et al., (2007) encontraron que cepas de crecimiento lento pueden sobrevivir más tiempo (> 6 meses) almacenadas en inoculantes sólidos con base en turba, e incluso en inoculantes líquidos, comparadas con cepas de crecimiento rápido; sin embargo, la eficiencia de los rizobios puede disminuir con el tiempo de almacenamiento. Por otro lado, largos períodos de almacenamiento (> 1 año) pueden traer cambios fisiológicos en las células bacterianas, reducción en la viabilidad y tasa de multiplicación, interferir en la síntesis de proteínas, ADN, ARN, disminución del vigor celular por la pérdida de genes dispensables ex planta posiblemente ligados a plásmidos portadores de genes simbióticos y aumentar el tiempo de nodulación en las raíces de las leguminosas, disminuyendo la eficiencia de los rizobios en los inoculantes (León et al., 1986).
A mayor temperatura de almacenamiento de los inoculantes, se acelera los procesos biológicos, específicamente la respiración de los microorganismos dentro del empaque, agotando en menor tiempo el sustrato y disminuyendo la cantidad de carbono disponible (Pérez & Torralba, 1997 citado por Jiménez, 2007). Sin embargo, este efecto no es visible en esta investigación debido a que el material utilizado como soporte es turba la cual se caracterizó por un alto contenido de materia orgánica (22,6 %), lo cual pudo proveer de nutrientes a las bacterias en su etapa de multiplicación permitiendo una mayor sobrevivencia en condiciones de déficit hídrico y temperaturas elevadas (Hungría et al., 2005).
Albareda et al., (2008) evaluaron diferentes sustratos para la preparación de inoculantes con base en Sinorhizobium freddi SMH12 (Ensifer) y B. japonicum USDA110, observando que el compost de corcho, perlita y la turba son soportes eficaces ya que permitieron la supervivencia de altas poblaciones de rizobios con concentraciones de 1010 UFC/g de inoculantes y se mantuvo sin cambios por un periodo de 90 y 120 días de incubación a temperatura de 25 °C. Al final del tiempo de almacenamiento, el número de células viables para las cepas SMH12 y USDA110 fue superior a 109 y 5x108 UFC/g respectivamente en los inoculantes elaborados con turba. Aunque la turba es un recurso natural sujeto a procesos de degradación natural y humano, ha sido el sustrato más ampliamente utilizado en la elaboración de inoculantes ya que presenta ventajas como estabilizar el número de bacterias dentro del producto, protegerlas durante el período de almacenamiento y factores adversos del suelo como altas temperaturas, deshidratación y proveer mejor adhesión a la semilla en el momento de la inoculación (Drevon, 2009).
Actividad biológica de los inoculantes evaluada sobre variables agronómicas en plantas de arveja
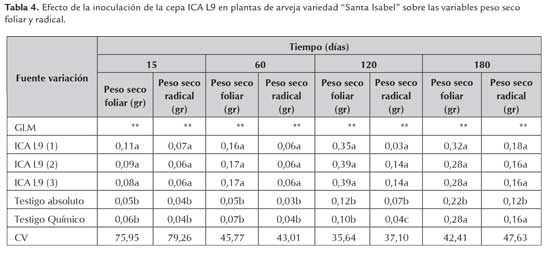
Para la variable peso seco foliar y radical de las plantas inoculadas con la cepa ICA L9 no se observaron diferencias estadísticamente significativas según la prueba de comparación múltiple de Duncan (p<0,05) entre los inoculantes almacenados a 4±2 °C, 18±3 °C y 28±2 °C a los 15, 60, 120 y 180 d. El testigo químico y el testigo absoluto presentaron los menores valores de peso seco foliar y radical con respecto a los tratamientos inoculados (tabla 4). El testigo químico mostró un valor menor para la variable de peso seco radical de 0,04 g con respecto al testigo absoluto de 0,07 g en los ensayos de evaluación de 120 días de almacenamiento de los productos. Las plantas de arveja inoculadas con los productos almacenados durante 180 días a diferentes temperaturas no presentaron diferencias significativas para las variables de peso seco de la parte aérea y radical con respecto al testigo químico.
Este resultado muestra la necesidad de incluir el nitrógeno como elemento esencial en la nutrición de las plantas; en los ensayos de inoculación se observó que el N pudo ser tomado por la FBN a través de la asociación con los rizobios o el nitrógeno contenido dentro de la fertilización. Para el caso de las plantas asociadas a rizobios o en simbiosis, la sustitución del nitrógeno puede ser hasta en un 80-90 % lo cual disminuiría la aplicación de fertilizantes nitrogenados que aporten este elemento. Lo anterior se confirma con los menores valores obtenidos para esta variable, obtenidos con el testigo absoluto.
El peso seco de la parte aérea y radical es un parámetro útil para determinar la influencia de la inoculación de la cepa ICA L9 sobre la producción de materia verde en las plantas de arveja, teniendo en cuenta que la disponibilidad de nitrógeno procedente de la fijación biológica se inicia aproximadamente 20 días después de la siembra, lo cual ha generado una controversia entre diferentes investigadores y asistentes técnicos, ya que algunos consideran necesario adicionar una pequeña cantidad de N mineral (30kg/ha) para estimular el crecimiento inicial de las plántulas, favorecer el establecimiento de las cepas en el cultivo y estimular la formación de los nódulos en la raíz (Silvestre 1983 citado por Mora, 1995). Sin embargo, en este trabajo de investigación, no se adicionó nitrógeno en ninguno de los ensayos evaluados con las semillas inoculadas a través del tiempo, razón por la cual se puede pensar que la asociación entre los rizobios y la leguminosa se presentó de forma natural con la formación de nódulos en las raíces de arveja estimulada quizá por el nitrógeno presente en el soporte o por el contenido dentro de la semilla, necesario en la etapa de crecimiento y desarrollo de las plantas.
Por otra parte, las plantas inoculadas con rizobios tienden a tener mayor capacidad fotosintética expresada en el área foliar con respecto a las plantas no inoculadas. Peñaranda (2004) evaluó plantas de arveja variedad "Santa Isabel" inoculadas con la cepa ICA L9, encontrando un mayor peso de la parte aérea de las plantas inoculadas con respecto al testigo químico y absoluto, 99 días después de la siembra del cultivo. Esta característica se vio reflejada en una mayor capacidad productiva por el cultivo, generando plantas con mayor tasa absoluta de crecimiento e índice de área foliar aumentando la biomasa vegetal.
Ramírez et al., (2007) realizaron ensayos de eficacia con la cepa ICA L9 de Rhizobium inoculada sobre arveja (Pisum sativum) bajo condiciones de campo, donde observaron que la inoculación mostró un beneficio en el desarrollo y crecimiento de las plantas, viéndose reflejado este efecto en el peso fresco y seco de la parte foliar con valores de 328,56 y 37,26 g al compararlos con el testigo absoluto con valores de 273,15 y 30,24 g respectivamente, observándose una mayor acumulación de biomasa en los tratamientos inoculados con la cepa ICA L9, en la época de cosecha.
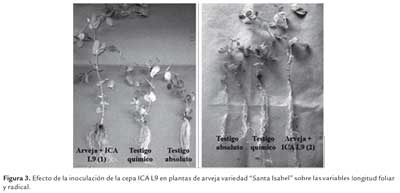
Para las variables de longitud foliar, radical y número de nódulos se pudo observar que no hay diferencias significativas según la prueba de Duncan (p<0,05) entre los inoculantes almacenados a 4±2°C, 18±3 °C y 28±2 °C durante 15, 60 y 180 d; sin embargo, visualmente es evidente las diferencias entre las plantas inoculadas con respecto al testigo químico y el testigo absoluto (figura 3). Las plantas inoculadas con la cepa ICA L9 independientemente de las temperaturas de almacenamiento del producto, fueron las más vigorosas, mostrando una longitud foliar y radical mayor comparadas con los testigos. Este resultado muestra el beneficio proporcionado a las plantas con la inoculación, y surge como una alternativa viable para disminuir el uso de fertilización química nitrogenada con una reducción en los costos de producción (Alfonso et al., 2005). Es evidente que el nitrógeno es un elemento esencial para el crecimiento y desarrollo de las plantas, este efecto se vio claramente en las plantas no inoculadas (testigo absoluto) donde la no aplicación del mismo produjo un efecto negativo sobre las variables evaluadas.
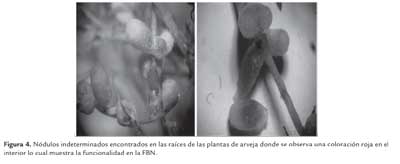
En cuanto a las estructuras nodulares encontradas en las raíces de las plantas de arveja inoculadas con la cepa ICA L9, se observó la formación de nódulos indeterminados que generalmente se forman en leguminosas de zona templada como Lupinus sp, Vicia sp, Pisum sp o Medicago; estos nódulos se caracterizan por presentar una forma alargada con un meristemo nodular que es persistente y un cordón de infección ancho; Una característica importante que sirve para diferenciar los nódulos indeterminados de los determinados es que estos estimulan la producción de polímeros de reserva de poli (3-hidroxibutirato (PHB) los cuales juegan un papel importante en el metabolismo celular de la bacterias interviniendo en el proceso de infección, nodulación y fijación de nitrógeno (Trainer et al., 2006). Cuando se está dando la FBN por los bacteroides dentro del nódulo, estos toman una coloración roja dada por la proteína leghemoglobina encargada de mantener los niveles de oxígeno dentro de la estructura; en este momento se determina que los rizobios son efectivos llevando a cabo este proceso biológico (figura 4).
Se determinó el índice de efectividad de la inoculación (IEI) expresado en porcentaje de los productos almacenados a las tres temperaturas durante los primeros 15 días, teniendo en cuenta la expresión propuesta por Beck et al., 1993 citado por León et al., (2002):
IEI = (msi - msni)/(mscn - mscsin) x 100
Donde msi es la materia seca del tratamiento inoculado, msni: materia seca del tratamiento control no inoculado, mscn: materia seca del control con nitrógeno y mscsin: materia seca control no inoculado, sin nitrógeno; y se clasifica así:
• Inefectivo = Menos del 50% de la materia seca del control con nitrógeno (C/N)
• Parcialmente efectivo = 50-75% de la materia seca del control con nitrógeno (C/N)
• Efectivo = 75-100% de la materia seca del control con nitrógeno (C/N)
Según el IEI, los inoculantes almacenados a temperatura de 4±2 °C, fueron los más efectivos con un porcentaje del 90 % comparado con los almacenados a 18±3 °C y 28±2 °C con valores de 60 y 50 % respectivamente. Este resultado puede estar relacionado con la disminución de las actividades metabólicas de los microorganismos en el inoculante ya que cuando se encuentran almacenados en nevera entran en estado de latencia, esto se refleja con la disminución en el consumo de nutrientes encontrados en el soporte, tolerando así varios periodos de almacenamiento; cuando son inoculados en el suelo, activan su maquinaria enzimática para llevar a cabo las diferentes funciones como la FBN. Por otro lado, los microorganismos que se encuentran almacenados a temperaturas más altas dentro del producto, pueden llegar a utilizar los nutrientes encontrados en el soporte, para llevar a cabo sus funciones metabólicas de acuerdo a sus requerimientos, pasando por la etapa de adaptación, exponencial, latencia y decline dentro del mismo sustrato. Es posible que cuando se inocularon estos productos en las leguminosas, el número de rizobios haya disminuido por efecto de la temperatura y humedad en el invernadero durante el tiempo de evaluación y esto conllevó a que el proceso de nodulación haya sido menos eficiente y así mismo, la fijación biológica de nitrógeno; lo cual se pudo ver reflejado en una menor producción de biomasa fresca en las plantas inoculadas.
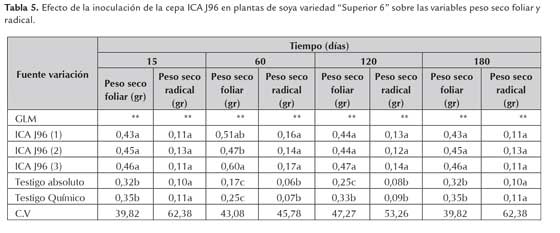
Actividad biológica de los inoculantes evaluada sobre variables agronómicas en plantas de soya
Para evaluar la actividad biológica de los inoculantes elaborados con la cepa ICA J96 en plantas de soya se tuvo en cuenta variables agronómicas como el peso seco foliar y radical; según el análisis de varianza realizado para el peso seco foliar, no se observaron diferencias estadísticamente significativas entre las plantas de soya inoculadas con los productos almacenados a diferentes temperaturas durante 15, 60, 120 y 180 días. Para la variable de peso seco radical, se pudo observar que los inoculantes utilizados en soya almacenados durante 15 y 180 días a diferentes temperaturas, no presentaron diferencias significativas con respecto al testigo químico y absoluto (tabla 5). Este resultado puede estar relacionado con la dinámica de crecimiento y establecimiento de los rizobios en el soporte después de 15 días de elaborados los productos y la disminución en el número de células viables después de 180 días de almacenamiento.
Mannasila et al., (2007) evaluaron el efecto de cepas de B. japonicum y B. elkanii sobre el crecimiento en plantas de soya (Glycine max) y fríjol mongo (Vigna radiata), encontrando que hay una relación directa entre el efecto de la inoculación sobre la materia seca de las plantas, número y peso fresco de nódulos, con respecto a los testigos sin inocular donde los valores son menores; estos resultados son similares al obtenido en este trabajo de investigación ya que demuestra claramente el efecto positivo que tienen las plantas de soya inoculadas en la producción de materia seca, sin haber un efecto directo en las temperaturas de almacenamiento de los productos; lo cual indica que sí hubo una asociación de los rizobios con las plantas y adquisición de nitrógeno mediante la fijación biológica.
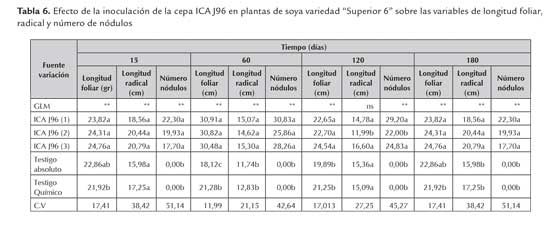
Para las variables longitud foliar, radical y número de nódulos se pudo observar que no hay diferencias estadísticamente significativas en las plantas inoculadas con los productos almacenados durante 15, 60 y 180 días a diferentes temperaturas (tabla 6); pero sí es evidente un efecto negativo en el testigo químico y absoluto en cuanto al desarrollo radical de las plantas (figura 5). En el caso de la longitud radical, se observó que las plantas inoculadas con los productos almacenados a 18±3 °C durante 120 días, mostraron una menor longitud con 11,99 cm, comparados con los productos almacenados a 4±2 °C y 28±2 °C con valores de 14,78 cm y 16,60 cm, observándose también diferencias estadísticamente significativas con respecto al testigo químico y absoluto con valores de 15,09 cm y 15,36 cm respectivamente, siendo el tratamiento inoculado el que presentó menores valores de longitud radical evaluado en este tiempo.
En las raíces de soya se evidenciaron nódulos determinados, los cuales se encuentran generalmente en leguminosas tropicales como Glycine sp, Arachis sp, Phaseolus sp, Vigna sp, Lotus sp; son nódulos temporales de estructura globular, el meristemo de crecimiento está ubicado de forma radial y una vez ha alcanzado su máximo desarrollo deja de crecer; carecen de meristemo indeterminado y el tejido central contiene tanto células infectadas como no infectadas encontrándose en el mismo estado de desarrollo (figura 6). Las células no infectadas están especializadas en el transporte de ureidos procedentes del nitrógeno fijado (Vasse et al., 1990).
Actividad del complejo enzimático nitrogenasa a partir de raíces de arveja noduladas
Según los resultados obtenidos en la prueba de reducción de acetileno para la cepa ICA L9, se observó que la mayor actividad de la enzima nitrogenasa se evidenció en las plantas inoculadas con los productos almacenados a 28±2 °C con un valor de 3,22 |jmol/ ml C2H4 h-1/planta, seguido de las plantas inoculadas con los productos almacenados a 4±2 °C y 18±3 °C, con valores de 2,45 y 2,28 |mol/ml C2H4 h-1/planta respectivamente. Para el caso de los testigos químicos y absolutos, no se observó la actividad de esta enzima indispensable para la FBN.
Ayala (2005) evalúo el efecto de 8 cepas de Rhizobium sp. sobre la actividad específica del complejo nitrogenasa en plantas de maní variedad Red Starr a los 40 días de edad; encontrando que 2 cepas (VII-VII) aisladas a partir de Arachis hypogaea y Centrosema pubescens, presentaron la mayor actividad de la enzima con valores de 12,83 y 13,84 |jmo(/m( C2H4 h-1/ planta respectivamente; el valor menor obtenido en la evaluación de la nitrogenasa fue de 4,36 iJimol/ml C2H4 h-1/planta, sin embargo, se vio un efecto positivo de la fijación biológica de nitrógeno sobre la producción de biomasa en las plantas evaluadas.
Jiménez en el año 2007 evaluó la actividad de la enzima nitrogenasa en árboles de Enterolobium cyclocarpum, Samanea saman, Pterocarpus indicus, Clitoria farchildiana y Flemingia macrophylla sembrados en suelos con poblaciones nativas de rizobios, observando que los árboles que presentaron la mayor actividad de la enzima fueron los de Clitoria farchildiana y Flemingia macrophylla con valores de 3,23 y 3,97 |mol/ml C2H4 h-1/ planta, respectivamente. Estos valores son similares a los obtenidos para la cepa ICA L9 donde el valor mayor observado fue de 3,22 |mol/ml C2H4 h-1/planta.
Para el caso de las plantas inoculadas con la cepa ICA J96 se pudo observar que la mayor actividad se evidenció en las plantas inoculadas con los productos almacenados a 4±2 °C con valor de 0,633 |mol/ml C2H4 h-1/planta, seguido de las plantas inoculadas con los productos almacenados a 28±2 °C y 18±3 °C con valores de 0,518 y 0,476 |mol/ml C2H4 h-1/planta, respectivamente.
Estos resultados son similares a los obtenidos por Rey et al., (2005) quienes evaluaron la actividad de la enzima nitrogenasa en cepas nativas aisladas e inoculadas en Leucaena leucocephala y una cepa de referencia perteneciente al Banco de Germoplasma de Corpoica codificada como C50, encontrando que el mayor valor lo reportó la cepa nativa C-202 con 0,90 |mol/ml C2H4 h-1/ planta, seguido de la cepa control C-50 con 0,82 |mol/ml C2H4 h-1/planta. Este resultado muestra la efectividad de la cepa ICA J96 inoculada en las plantas de soya.
Conclusiones
Las cepas ICA L9 e ICA J96 sobreviven en los inoculantes con base en turba en un rango de temperatura entre 4±2 °C a 28±2 °C, manteniendo la concentración superior o igual a 108 UFC/g de inoculante, nivel requerido para su comercialización hasta 6 meses después de la elaboración; esto sugiere que los productos no requieran cadena de frío para su almacenamiento. Este trabajo se puede implementar con inoculantes líquidos elaborados con base en bacterias simbióticas fijadoras de nitrógeno para determinar la vida útil del producto teniendo en cuenta la temperatura óptima para el almacenamiento.
No se evidenció un efecto negativo de las temperaturas de almacenamiento de los inoculantes sobre la actividad biológica de las cepas ICA L9 e ICA J96 y el establecimiento de la simbiosis con plantas de arveja y soya; la asociación de los rizobios se evidenció a los 30 días después de la inoculación mediante la formación de nódulos en las raíces de las plantas.
Las cepas ICA L9 e ICA J96 utilizadas en la elaboración de los inoculantes sólidos con base en turba mostraron ser infectivas y efectivas para la FBN, esto se evidenció con el incremento significativo de la biomasa foliar y radical de plantas de arveja y soya comparado con los testigos absolutos.
Referencias bibliográficas
1. Abdulland, M.; Al-falih, K. 2002. Factors affecting the efficiency of symbiotic nitrogen fixation by Rhizobium. Pakistan Journal of Biological Science. 5 (11): 1277-1279. [ Links ]
2. Albareda, M.; Rodríguez-Navarro, D.; Camacho, M.; Temprano, J. 2008. Alternatives to peat as a carrier for rhizobia inoculants: Solid and liquid formulations. Soil Biology & Biochemistry. 40:2771-2779. [ Links ]
3. Alfonso, E.; Leyva, A.; Hernández, A. 2005. Microorganismos benéficos como biofertilizantes eficientes para el cultivo de tomate (Lycopersicom esculetum, Mill). Revista Colombiana de Biotecnología. 2 (2):47-54. [ Links ]
4. Ayala, L. 2005. Estudio de algunos aspectos de la fijación biológica de nitrógeno por el maní (Arachis hypoagea): Evaluación bioquímica de la fijación y factores relacionados en la asociación Maní-Rhizobium sp. Agronomía tropical. 27 (4): 427-449. [ Links ]
5. Bergey Manual of Systematic Bacteriology. 2005. 2da Edición, Release 5.0. (En línea) http://www.dx.doi.org./10.1007/ber-geysoutline200310.2005 (Consultado: 7 de Febrero de 2009). [ Links ]
6. Drevon, M. 2009. Manual técnico de la fijación biológica del nitrógeno, Leguminosa/Rhizobium. Organización de las naciones unidas para la agricultura y la alimentación. Roma 1-5p. (En línea) (Consultado: 25 Marzo 2011). [ Links ]
7. Ernst, O. 2004. Leguminosas como cultivo de cobertura. Informaciones agronómicas del Cono Sur. 2: 1-9. [ Links ]
8. Estrada, A.; Bonilla, R.; Baldani, V. 2009. Efecto de diferentes temperaturas de almacenamiento sobre la calidad de bioinoculantes turbosos. Corpoica Revista Ciencia y Tecnología Agropecuaria. 10(2): 205-213. [ Links ]
9. Fenalce. 2010. El cultivo de la arveja, historia e importancia. (En línea) fenalce.org/arch_public/soya94.pdf (Consultado: 21 de Mayo del 2014). [ Links ]
10. Ferrera, R.; Alarcón, A. 2007. Microbiología agrícola. Primera edición. Editorial Trillas, México D.F. 225-236 p. [ Links ]
11. George, T.; Singleton, P. 1992. Nitrogen Assimilation Traits and Dinitrogen Fixation in Soybean and Common Bean. Agronomy lournal. 84 (6): 62-67. [ Links ]
12. Guerrero, R. 1993. Fertilización de cultivos de clima cálido. En: Revista Monómeros Colombo Venezolano S.A. Barranquilla, Atlántico, 276 p. [ Links ]
13. Gutiérrez, E.; Forero, M. 2007. Soya (Glycine max) Alternativa para los sistemas de producción de la Orinoquía Colombiana. Plan estratégico de investigación y desarrollo tecnológico de soya. Boletín informativo, Villavicencio, Meta. 24 p. [ Links ]
14. Hungría, M.; Loureiro, M.; Mendes, I.; Campo, R.; Graham, H. 2005. Inoculant preparation, production and application. Nitrogen fixation in agriculture, forestry, ecology and the environmental. 223-253. [ Links ]
15. Jiménez, M. 2007. Fijación biológica de nitrógeno por leguminosas arbóreas para la sombra de café en Puerto Rico. Tesis Maestría. Universidad de Puerto Rico. Facultad de Ciencias en Agronomía. 103p. [ Links ]
16. Kremer, R.; Peterson H. 1983. Effects of Carrier and Temperature on Survival of Rhizobium spp. in Legume Inocula: Development of an Improved Type of Inoculant. Applied and Environmental Microbiology. 45 (6): 1790-1794. [ Links ]
17. Kuykendall, D.; Young, J.; Martinez, E.; Kerr, A.; Sawada, H. 2005. Rhizobium. Frank 1889, 338. En Bergey Manual of Systematic Bacteriology. Editorial Springer US Vol. II 2da Edition. [ Links ]
18. León, E.; Acuña, O.; Ramírez, C. 1986. Evaluación de la reproducción y sobrevivencia de bacterias del género Rhizobium en suelo de turba de la zona de medio queso, Los chiles, Costa Rica. Agronomía Costarricense. 10 (1/2): 33-41. [ Links ]
19. León, O.; Silva, P.; Acevedo, P. 2002. Respuesta a la inoculación de Rhizobium en dos especies de Lupinus (Lupinus álbum L y Lupinus angustifolius L.). Universidad de Chile. Facultad de ciencias agronómicas. [ Links ]
20. Lindström, K.; Murwira, M.; Willems, A.; Altier, N. 2010. The biodiversity of beneficial microbe-host mutualism: the case of rhizobia. Research in Microbiology. 161 (6) 453-463. [ Links ]
21. Manassila, M.; Nuntagij, A.; Kotepong, S.; Boonkerd, N.; Teaumroong, N. 2007. Characterization and monitoring of selected rhizobial strains isolated from tree legumes in Thailand. African Journal of Biotechnology. 6 (12):1393-1402. [ Links ]
22. Manual de procedimientos técnicos para el control de calidad de inoculantes. Corpoica, 2007. Documento interno, Laboratorio Microbiología de suelos. [ Links ]
23. Munévar, F.; Ramírez, M. 1990. Uso correcto de inoculantes para soya. Plegable divulgativo N° 223. Bogotá - Colombia. [ Links ]
24. Peñaranda, A. 2004. Evaluación de las interacciones Rhizobium y Micorrizas Arbusculares en el cultivo de la Arveja (Pisum sativum var. arvense). Tesis de Pregrado. Universidad Francisco de Paula Santander. Facultad de ciencias agrarias y del ambiente. [ Links ]
25. Racca, W.; Collino, D. 2004. Bases fisiológicas para el manejo de la fijación biológica del nitrógeno en soya. IFFIVE- INTA. Córdoba. [ Links ]
26. Ramírez, M.; Valbuena, I.; Arguelles, J. 2007. Ensayo de Eficacia de la cepa ICA L9 de Rhizobium leguminosarum en Arveja. Centro de Investigación Corpoica - Tibaitatá. Bogotá, Colombia. 23 p. [ Links ]
27. Rey, A.; Chamorro, D.; Ramírez, M. 2005. Efecto de la doble inoculación de rizobios y micorrizas en la producción y calidad del forraje de Leucaena leucocephala. Corpoica Revista Ciencia y Tecnología. 6 (2): 52-59. [ Links ]
28. Reyes, I.; Álvarez, L.; Hind, E.; Alexis, V. 2008. Selección y Evaluación de Rhizobacterias promotoras del crecimiento en pimentón y maíz. Revista Bioagro. 20(1):37-48. [ Links ]
29. Rossi, A. 2005. Producción y control de calidad de inoculantes. Programa y resúmenes: I Taller latinoamericano sobre normatividad y control de calidad de inoculantes para la agricultura. Centro de pesquisas Gonzalo Moniz-Brasil. [ Links ]
30. Temprano, J.; Albareda, M.; Camacho, M.; Daza, A. 2002. Survival of several Rhizobium/Bradyrhizobium strains on different inoculant formulations and inoculated seeds. Int. Microbiol. 5: 81-86. [ Links ]
31. Trainer, M.; Trevor, C. 2006. The role of PHB metabolism in the simbiosis of rhizobia with legumes. Appl Microbiol Biotechnol. 3 (7): 377 - 386. [ Links ]
32. Variedad de soya Corpoica superior 6. 2006. Plegable divulgativo. Corpoica C.I La Libertad. [ Links ]
33. Zambrano, C.; Riaño, P. 2008. Rentabilidad de las empresas productoras de bioinsumos registradas ante el ICA. IICA. Bogotá, 25p. [ Links ]