Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Biotecnología
versión impresa ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.2 Bogotá jul./dic. 2014
https://doi.org/10.15446/rev.colomb.biote.v16n2.40131
http://dx.doi.org/10.15446/rev.colomb.biote.v16n2.40131
ARTÍCULO DE INVESTIGACIÓN
Organogénesis y embriogénesis en Curcuma longa L. a partir de capas delgadas de células, segmentos y bases de hoja
Curcuma longa L. embryogenesis and organogenesis from thin cell layers, leaf segments and bases of leaf
Zulma Isabel Monsalve Fonnegra1, Aura Inés Urrea Trujillo1, Alejandra Canal Morales2
1 Ph.D en Biotecnología, Investigadora grupo AgroBiotecnología y docente Instituto de Biología, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, calle 67 Nº 53-108 oficina 7-104, A.A. 1226 Medellín, Colombia. zmonsalve@gmail.com, zulma.monsalve@udea.edu.co
2 Estudiante Maestría en Biología, Universidad de Antioquia.
Recibido: febrero 15 de 2014 Aprobado: octubre 22 de 2014
Resumen
A pesar de sus propiedades farmacológicas, alimenticias e industriales y su gran potencial de mercado, Curcuma longa L. no ha sido comercializada en la medida en que se esperaría. La dificultad de propagación de la especie, que se da exclusivamente por vía vegetativa al ser un triploide estéril, aunada a las exigencias ambientales de su cultivo y su alta susceptibilidad al ataque de distintos patógenos han sido las causas por las cuales no se ha dado un aprovechamiento acorde a las propiedades y potenciales de la planta. Como estrategia para la obtención de gran cantidad de germoplasma con características fitosanitarias óptimas, se han implementado diferentes técnicas de cultivo in vitro, incluyendo la formación de microrrizomas y la micropropagación de plantas. Sin embargo, aún no se dispone de métodos eficientes para la inducción de procesos de organogénesis y embriogénesis somática. En el presente estudio se reporta el efecto de diferentes reguladores de crecimiento vegetal y sus combinaciones sobre segmentos de hojas, bases de hoja y capas delgadas de células (thin cell layers - TCL) de Curcuma longa L. para la inducción de callos y embriones. Los tejidos evaluados mostraron una respuesta diferencial de acuerdo con sus características y los reguladores de crecimiento vegetal adicionados. En las bases de hoja y TCLs se obtuvo particularmente una respuesta embriogénica. De otro lado, fue posible inducir morfogénesis caulinar y radicular simultáneamente en todos los tejidos evaluados. Las plantas regeneradas a partir de las bases de hoja fueron mucho mas vigorosas que las de los otros tejidos.
Palabras clave: micropropagación, embriogénesis, organogénesis, reguladores de crecimiento vegetal.
Abstract
In spite of its pharmacological, nutritional and industrial properties and its great potential market, Curcuma longa L. has not been commercialized to the extent that would be expected. The difficulty of propagation of the species, which is provided exclusively by vegetative to be a sterile triploid, coupled with the environmental requirements of the crop and its high susceptibility to attack by different pathogens, have been the causes for which has not been given a use according to the properties and potential of the plant. As a strategy for obtaining large numbers of germplasm with optimal phytosanitary characteristics, different techniques have been implemented in vitro culture, including the formation of microrrizomas and micropropagation of plants. However, not yet available efficient methods for somatic embryogenesis and organogenesis induction processes. In this study, we report the effect of different plant growth regulators and their combinations on the leaf segments, leaf bases and thin cells layers (TCL) of Curcuma longa L. for the callus and embryos induction. The evaluated tissues showed a differential response, according to its characteristics and the plant growth regulators added. Embryogenic response was particularly obtained in leaf bases and TCL. On the other hand, it was possible to induce cauline and root morphogenesis simultaneously in all evaluated tissue. Regenerated plants from leaf bases were more vigorous than the others tissues.
Keywords: micropropagation, embryogenesis, organogenesis, plant growth regulators.
Introducción
Curcuma longa L., (Zingiberacea) es una de las especies de mayor importancia en aplicaciones cosméticas, alimentarias (como conservante y condimento), ornamentales y medicinales incluyendo su uso como anticancerígeno, antidiabético, antiinflamatorio, inmunomodulador, antioxidante, antiparasitario y en la prevención y tratamiento del Alzheimer y la fibrosis cística, entre otras (Abd-Elraheim et al., 2013; Alvis et al., 2012; Tehranipour y Erfani, 2012; Jaggi Lal, 2012; Jantan et al., 2012; Ji et al., 2012; ; Panditrao y Nayak, 2012; Zhou et al., 2011; Jurenka, 2009). Tiene un gran potencial de mercado e impacto económico, con una demanda mundial creciente y una pequeña oferta, siendo los principales productores y exportadores India, China, Indonesia, Bangladesh y Tailandia (Kumar et al., 2010). La India cuenta con un cultivo de 150,000 hectáreas, lo que representa un 93,7% de la producción mundial, de los cuales el 92% es empleado en consumo doméstico y solo el 8% restante es exportado (Velayudhan et al., 2012).
Los rizomas son la principal fuente de curcuminoides (curcumina, demetoxicurcumina y bisdemetoxicurcumina), en los cuales llegan a representar más del 3 % de su peso seco (Xiaoqiang y Gang, 2006). Estos pigmentos polifenólicos le confieren el color amarillo brillante característico a este órgano de almacenamiento, y junto con algunos sesquiterpenos y otros diarilheptanoides, han sido postulados como responsables de gran parte de la actividad biológica de la especie. Uno de los grandes problemas en la comercialización masiva de estas plantas, es su dificultad en la propagación. En las zingiberáceas, los rizomas son generalmente usados como propágulos, ya que la propagación por semillas es muy complicada debido a que tienen un periodo de dormancia superior a los 12 meses (Bejoy et al., 2012). En el caso particular de Cúrcuma, la propagación es llevada a cabo exclusivamente por esta vía asexual, dado que es una especie triploide (2n = 3x = 63) básicamente estéril. Adicional a esto, las condiciones para su cultivo tales como la altitud (1300 a 1800 msnm), el requerimiento de agua (1000 mm mínimo), la elevada temperatura y el suelo rico en materia orgánica, limitan de manera considerable la producción masiva (Urrea et al., 2011).
Otro de los problemas asociados al cultivo es su alta susceptibilidad a bacterias como Pseudomonas solanacearum y Fusarium oxysporum, además de nematodos como Meloidogyne incognita (Dohroo, 1989) y Oomicetes como Phythium sp., patógenos que son diseminados a través de los rizomas (Xiaoqiang y Gang, 2006), representando un gran problema para la conservación y almacenamiento de este germoplasma.
Por lo anterior, las técnicas de cultivo in vitro han sido consideradas como la mejor alternativa para la obtención de gran cantidad de plantas de estas especies con las características fitosanitarias y de estabilidad genética óptimas para su comercialización.
En Cúrcuma, se han empleado técnicas de cultivo de tejidos con diferentes fines, particularmente en la propagación vía morfogénesis e inducción de microrrizomas (Singh et al., 2011; Cousins y Adelberg, 2008; Tyagi et al., 2004; Mrudul et al., 2001; Salvi et al., 2001; Dekkers et al., 1991; Balachandran et al., 1990; Nadgauda et al., 1978). Por ejemplo, se han micropropagado plantas de C. zedoaria, C. aromatica (Anisuzzaman et al., 2008; Yasuda et al., 1987), C. amada (Prakash et al., 2004; Barthakur y Bordoloi, 1992), C. angustifolia (Shukla et al., 2007), C. aeruginosa, C. caesia (Balachandran et al., 1990) y C. longa (Rahman et al., 2004), entre otras.
En Curcuma longa L., específicamente, se ha logrado la formación de 4,7 brotes/explante en el medio MS suplementado con 3,0 mg/L de 6-benziladenina (BA) (Nayak y Kumar, 2006). Posteriormente, Urrea et al. (2011) empleando BAP a 2,0 mg/L logró incrementar este número a 11, 0 brotes/explante. Considerando que el tipo y cantidad de metabolitos sintetizados por la planta varía según las condiciones de cultivo, también se ha comparado el perfil metabólico de plantas de Curcuma longa propagadas por métodos convencionales y por cultivo de tejidos sin encontrar diferencias significativas entre ellas (Xiaoqiang y Gang, 2006).
Sin embargo, en Cúrcuma a la fecha son pocos los trabajos realizados para el establecimiento de métodos eficientes para la inducción de procesos de organogénesis, embriogénesis y regeneración de plantas completas a partir de diferentes explantes, entre ellos segmentos de hojas, bases de hoja y capas delgadas de células (TCL, por sus siglas en ingles).
En el presente estudio se describen los resultados obtenidos con diferentes reguladores de crecimiento vegetal y su combinación en varias concentraciones en la inducción procesos de organogénesis y embriogénesis a partir de distintos tipos de tejidos de Curcuma longa L.
Materiales y métodos
Material vegetal
Rizomas de Curcuma longa L. fueron usados como explantes para la obtención de plantas completas. Los rizomas con brotes fueron individualizados y cultivados bajo condiciones de vivero, usando una mezcla tierra arena (2:1) previamente esterilizada y fertilizando con sales MS (Murashige y Skoog, 1962) a la mitad de la concentración de su fórmula cada 30 días. Plantas con un tamaño entre 10 y 15 cm se escindieron desde la base del rizoma, posteriormente fueron desinfectadas según lo descrito por Urrea et al. (2011). Propagación in vitro
Después de la desinfección del material, se procedió a sembrar los explantes en medio basal MS suplementado con 6-benzil aminopurina (BAP 2,0 mg/L), sacarosa (30,0 g/L) y gelrite (1,8 g/L), ajustando el pH a 5,7 antes de esterilizar en autoclave a 121 °C a 20 lb de presión por 15 mi. Las condiciones de incubación fueron mantenidas, según Urrea et al. (2011), a una temperatura de 24 ± 2 °C con fotoperiodo de 16h luz (28-35 μmol m-2 s-1) y 8h oscuridad, logrando después de 90 días una adecuada micropropagación del material con características morfológicas óptimas para los ensayos posteriores.
Formación de callos y embriones
Los ensayos fueron llevados a cabo sobre distintos tipos de tejido vegetal: base de hoja, hoja y thin cell layers (TCL) obtenidos a partir de plantas micropropagadas como se describió anteriormente.
Para las bases de hoja se tomó el segmento basal incluyendo el meristemo apical de aproximadamente 0,5 cm2. Los segmentos de hoja de aproximadamente 0,5 cm2 fueron tomados a partir de hojas jóvenes. Las TLC fueron obtenidas a partir de pseudotallo de la parte basal incluyendo el meristemo apical con un tamaño aproximado de 0,2 cm2.
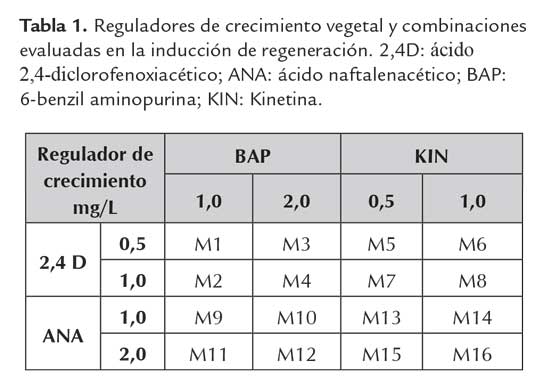
Para establecer el tratamiento más adecuado para inducir la regeneración, se evalúo el efecto de algunos reguladores del crecimiento (auxinas: ácido 2,4-diclorofenoxiacético (2,4 D) y ácido naftalenacético (ANA); citokininas: BAP y Kinetina (KIN)) en distintas concentraciones y combinaciones, adicionándolos al medio de cultivo basal MS suplementado con sacarosa (30,0 g/L) y gelrite (1,8 g/L), como se describe en la tabla 1. En cada caso se incluyeron los respectivos controles sin adición de reguladores de crecimiento. Los cultivos se mantuvieron a una temperatura de 24 ± 2 °C bajo condiciones de oscuridad constante por un periodo de 30 días. El tamaño de muestra fue de 12 explantes por tratamiento distribuidos en cajas de Petri con 4 explantes por caja y 3 repeticiones. Como indicadores de respuesta se evaluaron la formación y tipo de callo (granular, nodular, fibroso o embriogénico), formación de brotes y formación de raíces.
Análisis estadísticos
Los datos obtenidos se procesaron estadísticamente mediante análisis de varianza simple (ANOVA). La determinación de grupos homogéneos y significativamente diferentes se llevó a cabo mediante la prueba de Rangos Múltiples y Kruskal-Wallis con un nivel de confianza del 95 %, usando el programa Statgraphics 5 plus.
Resultados y discusión
Formación de callos y embriones somáticos.
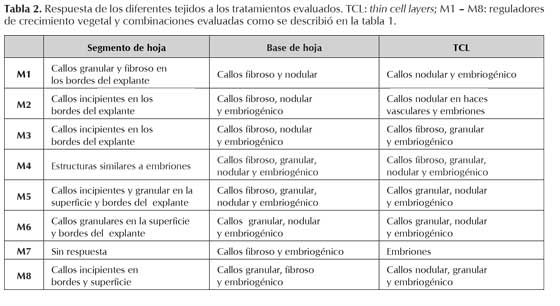
Cuando se evaluó el efecto de los reguladores de crecimiento en diferentes explantes se encontró una marcada diferencia en la respuesta de los segmentos de hoja con respecto a las bases de hoja y las TCL. En los segmentos de hoja se obtuvo una incipiente formación de callo, ubicado en general en los bordes y la superficie del tejido y principalmente con características de callo fibroso y granular en los tratamientos M1 a M8 (tabla 2).
A diferencia de esto, con los mismos tratamientos, en las TCL y las bases de hoja predominó la formación de callo granular, nodular y embriogénico (tabla 2).
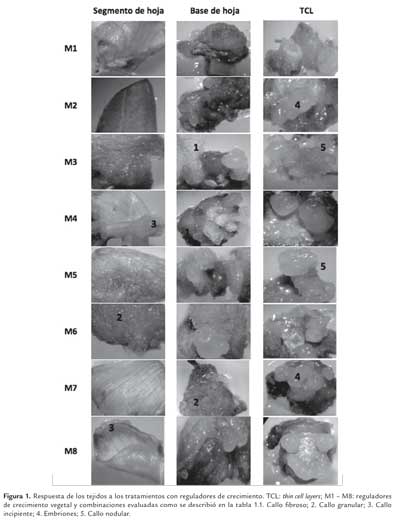
Con la combinación BAP 1,0 mg/L y 2,4 D a 0,5 mg/L (M1) solamente se encontró callo embriogénico en las TCL, en los demás tejidos se favoreció la formación de callo granular, nodular y fibroso (figura 1). A diferencia de esto, la misma combinación de reguladores de crecimiento pero en mayor concentración (BAP 2,0 mg/L y 2,4 D a 1,0 mg/L; M4) permitió la formación de callo embriogénico en los tres tipos de explante (figura 1).
Los tratamientos M2, M3, M5, M6, M7 y M8 en segmento de hoja condujeron a la formación de todos los tipos de callo excepto el embriogénico; en tanto que, con los mismos medios, pero en TCL y bases de hoja, este fue el tipo de callo que predominó (figura 1).
Considerando las características fisiológicas de los tres tipos de tejidos evaluados, no es sorprendente la diferencia encontrada en la respuesta a los tratamientos con los reguladores de crecimiento entre los segmentos de hoja y los demás explantes. Los segmentos de hoja presentan un mayor grado de diferenciación en comparación con las bases de hoja y las TCL. Estas últimas son muy similares entre ellas y presentan, en general, un estado metabólico más activo caracterizado por una rápida proliferación celular dado que provienen de tejido en desarrollo. Esto podría explicar que en los segmentos de hoja la respuesta fuera menos contundente en la formación de callos que la obtenida en los explantes menos diferenciados.
En las bases de hoja y las TCL se registró la formación de todos los tipos de callo, un reflejo de la gran capacidad de estos tejidos para sufrir des-diferenciación y/o re-diferenciación ante el tratamiento con reguladores del crecimiento vegetal, máxime si se tiene en cuenta que estos son explantes ricos en elementos vasculares, caracterizados por su gran sensibilidad a estímulos ocasionados por señales reguladoras (Teixeira, 2003). La respuesta obtenida en la combinación de 2,4 D y BAP o con KIN fue indistinta, sugiriendo que el efecto obtenido es debido a las características de los tejidos más que al tipo de citoquinina evaluada.
La combinación entre 2,4 D y BAP también ha mostrado buenos resultados en la inducción de embriones somáticos en otras especies de la familia Zingiberacea. Por ejemplo, en Curcuma amada, Soundar-Raju et al. (2013) lograron la formación de callos embriogénicos a partir de segmentos de hoja mediante el cultivo en medio MS suplementado con 2,4 D a 2,0 mg/L y BAP 0,5 mg/L.
Por otro lado, en Curcuma attenuatta, los porcentajes más altos (33,3 %) en la inducción de callos fue obtenida mediante el cultivo en medio suplementado con 2,4 D a 3,0 mg/L y KIN 0,5 mg/L (Kou et al., 2013) partiendo de anteras como explante; no obstante, las características de los callos descritas no corresponden a las de un callo embriogénico. A diferencia de esto, en el presente reporte, esta combinación de reguladores favoreció la inducción de callo embriogénico, sin embargo no se debe perder de vista que se partió de explantes muy diferentes, por la tanto es de esperar que la respuesta sea diferente, muy probablemente como consecuencia de la carga hormonal endógenay las potencialidad del tejido mismo.
Cabe resaltar que la obtención de callos embriogénicos lograda en este estudio representa un aporte muy significativo para la obtención de regenerantes, como paso indispensable en los programas de mejoramiento mediante técnicas biotecnológicas en esta especie.
Regeneración vía organogénesis
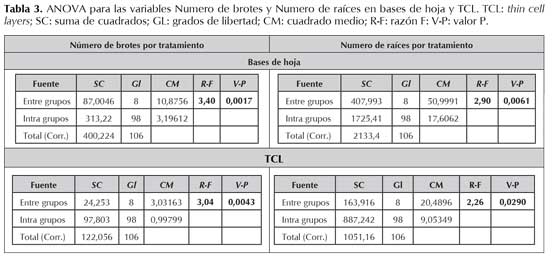
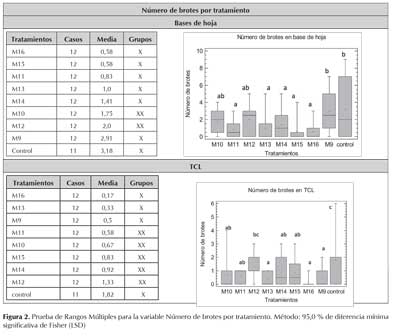
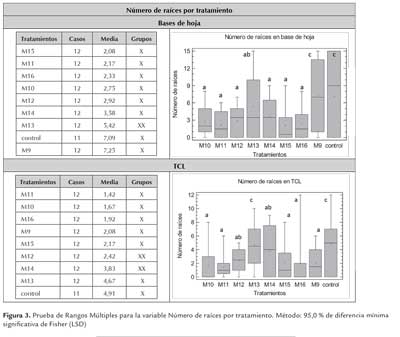
El análisis de varianza permitió comparar el efecto de nueve de los tratamientos evaluados (M9 a M16 y control), tanto en base de hoja como en TCL, considerando el número de brotes y raíces como indicadores del efecto.
Con respecto al número de brotes, la razón-F fue de 3,40274 para las bases de hoja y de 3,03774 para las TCLs, demostrando que existe una diferencia estadísticamente significativa entre la media de este indicador según los tratamientos evaluados (tabla 3). Para el indicador número de raíces, usando las bases de hoja como explante la razón-F fue de 2,89665, y de 2,26317 en TCL, demostrando nuevamente diferencia estadísticamente significativa entre los tratamientos M9 a M16 (tabla 3). En todos los casos se obtuvo un valor-P menor que 0,05 a un nivel de confianza del 95,0 %.
Ahora bien, con la prueba de Rangos Múltiples se logró identificar dos grupos homogéneos cuando se emplearon bases de hoja como explante. Uno conformado por los tratamientos M11, M13, M14, M15 y M16, y el otro con el control y el tratamiento M9, indicando que existen diferencias estadísticamente significativas entre ellos, con un nivel del 95,0 % de confianza (figura 2). Los mejores resultados en cuanto a número de brotes fue obtenido cuando el explante se cultivó en el medio MS exento de reguladores de crecimiento (3,1 brotes en promedio) y cuando fue suplementado con 1,0 mg/L de ANA y la misma concentración de BAP (2,9 brotes en promedio). Estos resultados fueron corroborados mediante la comparación de medianas con la prueba de Kruskal-Wallis, obteniendo un valor-P de 0,0104335 con un nivel del 95,0 % de confianza.
Cuando se emplearon TCL como explante se identificaron tres grupos homogéneos. El primero conformado por los tratamientos M16, M13 y M9, el segundo entre M11, M10, M15 y M14, y el tercero con el tratamiento control y el M12 (figura 2). Para este explante el mayor número promedio de brotes fue obtenido cuando se cultivo en el medio MS sin reguladores de crecimiento (1,8 brotes en promedio) y cuando fue suplementado con ANA y BAP ambos a 2,0 mg/L (1,3 brotes en promedio). La comparación de medianas con la prueba de Kruskal-Wallis, permitió verificar estas diferencias con un valor-P de 0,0112683 a un nivel de confianza del 95,0 %.
Para el indicador número de raíces, empleando las bases de hoja, se identificaron dos grupos homogéneos. El primero conformado por los tratamientos M15, M11, M16, M10, M12 y M14, y el segundo con el control y M9; en el último caso con un número promedio de raíces de 7,1 y 7,25, respectivamente (figura 3). En el caso de las TCL se separaron dos grupos, el primero compuesto por los tratamientos M11, M10, M16, M9, M15, M12 y M14 y el segundo por M12, M14 y M13 y el control; el mayor número promedio de raíces fue obtenido empleando el medio MS sin reguladores de crecimiento (4,9 raíces; figura 4) y cuando fue suplementado con ANA a 1,0 mg/L y KIN a 0,5 mg/L (4,6 raíces en promedio) (figura 3).
Sin embargo para este indicador, con las bases de hoja el valor-P fue de 0,207962 y de 0,0682319 en TCL, demostrando que para ambos explantes no hay diferencia estadísticamente significativa entre los tratamientos evaluados con un nivel del 95,0 % de confianza. En las bases de hoja, tanto la inducción de brotes como de raíces, tuvo la mejor respuesta en el medio conteniendo ANA a 1,0 mg/L y BAP a 1,0 mg/L y en el control exento de reguladores de crecimiento. Es de resaltar que la inducción lograda en morfogénesis, tanto caulinar como radicular, empleando los mismos tratamientos tiene una gran implicación en la regeneración de esta especie, ya que permite obtener plantas completas en un solo paso. Más aún, considerando que no hubo diferencia estadísticamente significativa entre el medio M9 y el control, y dado el impacto que pueden desencadenar los tratamientos con fitohormonas, es de elección el empleo del medio sin suplementos (medio basal MS).
A diferencia de lo reportado en este estudio, la respuesta organogénica o morfogénica se ha logrado mediante el cultivo con diferentes reguladores de crecimiento. En Zingiber officinale Rosc., con segmentos de rizoma se obtuvieron múltiples brotes empleando BAP (5,0 mg/L) y ANA (0,5 mg/L), los cuales fueron luego elongados con BAP (3,0 mg/L) y ANA (0,5 mg/L) (Sarhyagowri y Seran, 2011). En el caso Cúrcuma soloensis (Zhanga et al., 2011) fue necesario un tratamiento combinado de BA (1,0 mg/L) y ANA (0,1 mg/L) para lograr la iniciación de los brotes (elongación sin formación de brotes laterales).
Kou et al. (2013), en Cúrcuma attenuatta, solo lograron la formación de brotes y raíces mediante el tratamiento combinado de BA 2,0 mg/L, ANA 0,5 mg/L y TDZ 0,3 mg/L en callos obtenidos a partir de anteras tratadas con 2,4 D 3,0 mg/L y KIN 0,5 mg/L. En otros géneros de la familia Zingiberacea, también se ha reportado la regeneración indirecta empleando diferentes concentraciones y combinaciones hormonales. Por ejemplo, en Cornukaempferia aurantiflora, Saensouk (2011) se obtuvo callos a partir de explantes foliares mediante el tratamiento con 2,4 D a 2,0 mg/L, y se logró la regeneración de plantas cultivándolos en medio MS suplementado con 2,4 D a 0,1 mg/L y BA a 5,0 mg/L.
Específicamente en Cúrcuma longa, se han empleado bases de hoja como explante para la formación de callos granulares mediante tratamientos con BA 0,5 mg/L y ANA a 5,0 mg/L; BA 0,5 mg/L y Dicamba (ácido 2-metoxi-3,6 diclorobenzoico) a 2,0 mg/L; y BA 0,5 mg/L y Picloram (ácido 4-amino-3,5,6-trichloropyridine- 2-carboxilico) a 2,0 mg/L. Para la obtención de brotes a partir de estos callos, fue necesario el tratamiento combinado con BA 5,0 mg/L y TIBA (ácido 2,3,5 triiodobenzoico) a 0,1 mg/L o BA 5,0 mg/L y 2,4 D a 0,1 mg/L, resaltando que con este último tratamiento no fue posible la organogénesis a partir de los callos inducidos con ANA (Salvi et al., 2001).
En la inducción de brotes se encontró una respuesta diferencial según el explante, TCL y base de hoja. Aunque en ambos casos la mejor respuesta fue obtenida con el tratamiento control y el medio conteniendo ANA y BAP, llama la atención que en TCL se requiera una mayor concentración de ambos reguladores (2,0 mg/L de cada uno) aún manteniéndose la proporción entre ellos (1:1). Sin embargo, en este tejido siempre se obtuvo una menor cantidad de brotes con respecto a las bases de hoja, es probable que este comportamiento sea un reflejo de la concentración hormonal endógena y sensibilidad propias del tejido.
Las características fisiológicas y morfológicas de las TCL permiten suponer que la respuesta de este tejido al tratamiento hormonal se presentaría a una menor concentración, sin embargo, en los resultados obtenidos se evidencio lo contrario. No obstante, el mayor número de brotes se encontró en el medio basal, dejando abierta la posibilidad que se esté presentando un detrimento en la respuesta por el tratamiento hormonal mismo, sin embargo con las condiciones evaluadas no es posible afirmar o refutar esta hipótesis.
Conclusiones
Mediante la evaluación del efecto de reguladores de crecimiento vegetal, en distintas concentraciones y combinaciones, sobre segmentos de hojas, bases de hoja y TCL fue posible inducir la formación de callo embriogénico y obtener plantas completas de Curcumalonga vía organogénesis.
Se encontró una respuesta diferencial de los tejidos evaluados ante los distintos tratamientos con reguladores de crecimiento, muy probablemente como un reflejo de las características fisiológicas y metabólicas de los explantes. Con el medio conteniendo BAP 1,0 mg/L y 2,4 D a 0,5 mg/L se logró la formación de callo embriogénico exclusivamente en TCL; a diferencia de ello, con el medio conteniendo BAP 2,0 mg/L y 2,4 D a 1,0 mg/L fue posible inducir la formación de callo con características embriogénicas de manera independiente del tipo de explante.
Se indujo simultáneamente la organogénesis caulinar y radicular, con mejores resultados en vigor cuando se usaron bases de hoja. En este tejido se obtuvo el mayor número de brotes tanto cuando el medio fue adicionado con 1,0 mg/L de ANA y BAP, como cuando se mantiene exento de reguladores de crecimiento.
Agradecimientos
Agradecemos al soporte financiero del proyecto "Transformación genética transitoria, propagación y regeneración in vitro de plantas de Curcuma longa L", financiado por el CODI, Vicerrectoría de Investigación, Universidad de Antioquia.
Referencias bibliográficas
1. Abd-Elraheim, A.E.; Mohi El-din, M.M.; Ali Salman, M.M. and Abdel- Rahman, R.A. 2013. Patho-physiological studies on the reverse effect of Curcumin (Curcuma longa, Zingiberaceae), and Ursofalk (Ursodeoxycholic acid) against the toxicity of carbon tetrachloride on albino rats. American Journal of Research Communication. ISSN: 2325-4076. [ Links ]
2. Alvis, A.; Arrazola, G. y Martínez, W. 2012. Evaluación de la Actividad y el Potencial Antioxidante de Extractos Hidro-Alcohólicos de Cúrcuma (Cúrcuma longa). Información Tecnológica. 23 (2): 11-18. [ Links ]
3. Anisuzzaman, M.; Sharmin, S.; Mondal, S.; Sultana, R.; Khalekuzzaman, M.; Alam, I. and Alam, M. 2008. In vitro microrhizome induction in Cúrcuma zedoaria (Christm.) Roscoea conservation prioritized medical plant. Journal of Biological Sciences. 8: 1216-1220. [ Links ]
4. Balachandran, S.; Bhat, S. and Chandel, K. 1990. In vitro clonal multiplication of turmeric (Curcuma spp.) and ginger (Zingiber officinale Rosc.). Plant Cell Report. 8: 521-524. [ Links ]
5. Barthakur, M. and Bordoloi, D. 1992. Micropropagation of Curcuma amada (Roxb.). Spices Aromatic Crops. 1: 154-156. [ Links ]
6. Bejoy, M.; Dam, M.; Anish, N.; Nair, A.; Radhika, B. and Manesh, K. 2012. Micropropagation of an Indian Ginger (Cúrcuma vamana Sabu and Mangaly): A wild relative of Turmeric. Biotechnology. 11 (6): 333-338. [ Links ]
7. Cousins, M. and Adelberg, J. 2008. Short-term and long-term time course studies of turmeric (Curcuma longa L.) microrhizome development in vitro. Plant Cell, Tissue and Organ Culture. 93: 283-293. [ Links ]
8. Dekkers, A.; Rao, A; and Goh CJ. 1991. In vitro storage of multiple shoot cultures of gingers at ambient temperatures of 24-29 ºC. Scientia Horticulturae. 47: 157-167. [ Links ]
9. Dohroo, N. 1989. Seed transmission of pre-emergence rot and yellows in ginger. Plant Disease Research 4:73-74. [ Links ]
10. Jaggi, Lal. 2012. Turmeric, Curcumin and Our Life: A Review. Bulletin of Environment, Pharmacology and Life Sciences. 1 (7): 11 - 17. [ Links ]
11. Jantan, I.; Chany Saputri, F.; Naeem Qaisar, M. and Buang, F. 2012. Correlation between Chemical Composition of Cúrcuma domestica and Cúrcuma xanthorrhiza and Their Antioxidant Effect on Human Low-Density Lipoprotein Oxidation. Hindawi Publishing Corporation Evidence-Based Complementary and Alternative Medicine. [ Links ]
12. Ji H., Kim; Subash C., Gupta; Byoungduck, Park; Vivek R., Yadav and Bharat B. Aggarwal. 2012. Turmeric (Curcuma longa) inhibits inflammatory nuclear factor (NF)-jB and NF-jB regulated gene products and induces death receptors leading to suppressed proliferation, induced chemosensitization, and suppressed osteoclastogenesis. Molecular Nutrition & Food Research. 56: 454–465. [ Links ]
13. Jurenka, J.S. 2009. Anti-inflammatory Properties of Curcumin, a Major Constituent of Curcuma longa: A Review of Preclinical and Clinical Research. Alternative Medicine Review. 14: 2. [ Links ]
14. Kou, Y.; Guohua, M.; Teixeira da Silva, J. and Liu, N. 2013. Callus induction and shoot organogenesis from anther cultures of Curcuma attenuata Wall. Plant Cell Tissue and Organ Culture. 112: 1–7. [ Links ]
15. Kumar Joshi, R.; Kuanar, A.; Mohanty, S.; Subudhi, E. and Nayak, S. 2010. Mining and characterization of EST derived microsatellites in Curcuma longa L. Bioinformation. 5 (3): 128-131. [ Links ]
16. Mrudul V., Shirgurkar, C.K. John and Rajani S. Nadgauda. 2001. Factors affecting in vitro microrhizome production in turmeric. Plant Cell, Tissue and Organ Culture. 64: 5-11. [ Links ]
17. Murashige, T. and Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant. 15:437–497. [ Links ]
18. Nadgauda, R.; Mascarenhas, A.; Hendre, R. and Jagannathan, V. 1978. Rapid multiplication of turmeric (Curcuma longa Linn.) plants by tissue culture. Indian Journal of Experimental Biology. 16: 120-122. [ Links ]
19. Nayak, S. and Kumar Naik, P. 2006. Factors effecting in vitro microrhizome formation and growth in Curcuma longa L. and improved field performance of micropropagated plants. Science Asia. 32: 31-37. [ Links ]
20. Panditrao, Palve; Y. and Nayak, P.L. 2012. Curcumin: A wonder anticancer drug. International Journal of Pharmaceutical and Biomedical Research. 3 (2): 60-69. [ Links ]
21. Prakash, S.; Elongomathavan, R.; Seshadri, S.; Kathiaravan, K. and Ignacimuthu, S. 2004. Efficient regeneration of Curcuma anada Roxb. plantles from hhizome and leaf sheathexplants. Plant Cell, Tissue Organ Culture. 78: 159-165. [ Links ]
22. Rahman, M.; Amin, M.; Jahan, H. and Ahmed, R. 2004. In vitro regeneration of plantlets of Curcuma longa Linn. A valuable spice plant in Bangladesh. Asian Journal of Plant Sciences. 3: 306-309. [ Links ]
23. Saensouk, P. 2011. Callus induction and plant regeneration from leaf explant of Cornukaempferia aurantiflora mood & larsen. Pakistan Journal of Botany. 43 (5): 2415-2418. [ Links ]
24. Salvi, N.; George, L. and Eapen, S. 2001. Plant regeneration from leaf base callus of turmeric and random amplified polymorphic DNA analysis of regenerated plants. Plant Cell, Tissue and Organ Culture. 66: 113-119. [ Links ]
25.Sarhyagowri, S. and Seran, T. 2011. In vitro plant regeneration of Ginger (Zingiber officinale Rosc.) with enphasis on initial culture establishment. International Journal of Medicinal and Aromatic Plants. 1 (3): 195-202. [ Links ]
26. Shukla, S.; Shukla, S.; Koche, V. and Mishra, S. 2007. In vitro propagation of tikhur (Curcuma angustifolia Roxb.): a starch yielding plant. Indian Journal of Biotechnology. 6: 274-276. [ Links ]
27. Singh, S.; Kuanar, A.; Mohanty, S.; Subudhi, E. and Nayak, S. 2011. Evaluation of phytomecinal yield potential and molecular profiling of micropropagated and conventionally grown turmeric (Curcuma longa L.). Plant Cell, Tissue and Organ Culture. 104 (2): 263-269. [ Links ]
28. Soundar-Raju, C.; Kathiravan, K.; Aslam, A. and Shajahan, A. 2013. An efficient regeneration system via somatic embryogenesis in mango ginger (Curcuma amada Roxb.). Plant Cell, Tissue and Organ Culture. 112 (3): 387-393. [ Links ]
29. Tehranipour, M.; and Erfani, M. 2012. The effect oF Cúrcuma longa alcoholic extract on cell regeneration (neurons and neuroglias) after sciatic nerve injury in diabetic rats. Pharmacologia. 3 (8): 2999-305. [ Links ]
30. Teixeira, J. 2003. Thin Cell Layer technology in ornamental plant micropropagation and biotechnology. African Journal of Biotechnology. 2 (12): 683-691. [ Links ]
31. Tyagi, R.; Yusuf, A.; Dua, P. and Agrawal, A. 2004. In vitro plant regeneration and genotype conservation of eight wild species of Curcuma. Biologia Plantarum. 48 (1): 129-132. [ Links ]
32. Urrea, A.; Canal-Morales, A. y Monsalve-Fonnegra, Z. 2011. Micropropagación e inducción de órganos de almacenamiento en Curcuma longa L. Actualidades Biológicas. 33 (94): 5-15. [ Links ]
33. (94): 5-15.33. Velayudhan, K.; Dikshit, N. and Abdul, M. 2012. Ethnobotany of turmeric (Cúrcuma longa L.). Indian Journal of Traditional Knowledge. 11 (4): 607-614. [ Links ]
34. Xiaoqiang, M.; and Gang, D. 2006. Metabolic Profiling of Turmeric (Curcuma longa L.) Plants Derived from in Vitro Micropropagation and Conventional Greenhouse Cultivation. Journal of Agricultural and Food Chemistry. 54 (25): 9573–9583. [ Links ]
35. Yasuda, K.; Tsuda, T.; Shimazu, H. and Sugaya, A. 1987. Multiplication of Cúrcuma species by tissue culture. Plant Med. 54: 75-78. [ Links ]
36. Zhanga, S.; Liua, N.; Shenga, A.; Mab, G.; and Wub, G. 2011. Direct and callus-mediated regeneration of Curcuma soloensis Valeton (Zingiberaceae) and ex vitro performance of regenerated plants. Scientia Horticulturae. 130: 899–905. [ Links ] [ Links ]