Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.2 Bogotá July/Dec. 2014
https://doi.org/10.15446/rev.colomb.biote.v16n2.47247
http://dx.doi.org/10.15446/rev.colomb.biote.v16n2.47247
ARTÍCULO DE INVESTIGACIÓN
Análisis genómico del resistoma de la cepa de Acinetobacter baumannii ABIBUN 107m multi-resistente y persistente en hospitales colombianos
Genomic analysis of the resistome of the strain of Acinetobacter baumannii ABIBUN 107m multi-resistant and persistent in colombian hospitals
Ma. Teresa Reguero1, Vanessa Flores1, Laura Patricia Uribe1, Elsa Beatriz González1, José Ramón Mantilla1, Emilia María Valenzuela de Silva1, Laurent Falquet2, Emiliano Barreto-Hernández1
1 Instituto de Biotecnología. Universidad Nacional de Colombia-Sede Bogotá. mtregueror@unal.edu.co, ebarretoh@unal.edu.co.
2 University of Fribourg and Swiss Institute of Bioinformatics, Switzerland. laurent.falquet@unifr.ch.
Recibido: febrero 19 de 2014 Aprobado: octubre 10 de 2014
Resumen
Acinetobacter baumannii es una bacteria, causante de infecciones asociadas a la atención en salud como neumonía, septicemia, meningitis e infecciones urinarias entre otras. Se caracteriza por su capacidad para desarrollar y acumular rápidamente una gran variedad de mecanismos de resistencia a antibióticos. En esta investigación se realizó el análisis genómico de una cepa de A. baumannii ABIBUN 107m que forma parte de un clon persistente en hospitales colombianos, resistente a los antibióticos carbapenémicos (imipenem y meropenem), antibióticos de elección en el tratamiento infecciones causadas por este microorganismo. El genoma de esta bacteria fue secuenciado utilizando técnicas de alto rendimiento, ensamblado y anotado, obteniéndose un genoma constituido por 3954000 pb con 56 contigs; consta de 4256 genes con un tamaño promedio de 912 pb; 3796 CDS de los cuales por anotación 2884 se asignaron a COG; 57 tRNA y un porcentaje de GC de 38,74%. A. baumannii ABIBUN 107m es resistente a β-lactámicos, aminoglicósidos, quinolonas, tetraciclina, sulfonamida y colistina. En su genoma se localizaron genes asociados con el perfil de resistencia ya que presenta serin β-lactamasas (blaADC-38, blaOXA-64, blaOXA-23, blaampC-like, blaamp(H)-like), metalo β-lactamasa_B; proteínas de unión a penicilina de elevada masa molecular, secuencias de inserción tipo ISAba1; mutaciones en los genes de DNA girasa y topoisomerasa IV subunidad A (gyrA y parC); enzimas modificadoras de aminoglicósidos (aphA-like, aad -like); cloranfenicol aciltransferasa (cat) y dehidropteroato sintasa (sul-1). Se identificaron genes pertenecientes a cinco familias de sistemas de eflujo (RND, MATE, MSF, ATP, SMR).
Palabras clave: Acinetobacter baumannnii MDR, resistoma, Colombia
Abstract
Acinetobacter baumannii is a bacterium causing health care associated infections such as pneumonia, septicemia, meningitis and urinary infections amongst others. It has great capacity to quickly develop and gather a big variety of drug resistance mechanisms. In this research, the genome of strain A. baumannii ABIBUN 107m was analyzed wich forms part of a persistent clon in Colombian hospitals and it's also resistant to carbapenems (imipenem and meropenem), which are the election antibiotics for treatment of infections caused by this microorganism. The genome was sequenced using high performance technology, assembled and annotated. As a result, we obtained a 3954000 bp genome, with 56 contigs; 4256 genes with average size of 912 bp; 3796 CDS; 2884 were assigned to COG; 57 tRNA and GC percentage of 38,74%. The A. baumannii strain ABIBUN 107m, is resistant to the following antibiotic groups: β-lactams, aminoglycosides, quinolones, tetracycline, sulfonamide and colistin. Genes associated with this resistance profile were found in A. baumannii ABIBUN 107m genome serino β-lactamases (blaADC-38, blaOXA-64, blaOXA-23, blaampC-like, blaamp(H)-like), metallo β-lactamase_B; High Molecular Mass penicillin binding proteins, ISAba1 type insertion sequences, mutations of DNA gyrase and topoisomerase IV subunit A (gyrA and parC); aminoglycoside modifying enzymes (aphA-like, aadA-like); choramphenicol acyltransferase (cat) and dehydropteroate synthase (sul-1). Genes belonging to five different efflux systems were identified (RND, MATE, MSF, ATP, SMR).
Key words: Acinetobacter baumannnii MDR, resistome, Colombia
Introducción
Según un reporte de los Centros de Control y Prevención de Enfermedades (CDC) al menos 2 millones de personas en ese país desarrollan al año infecciones bacterianas graves, que son resistentes a uno o más tipos de antibióticos y alrededor de 23000 mueren por esa causa (Steenhuysen, 2013). Durante las últimas décadas, se han hecho grandes esfuerzos para combatir a las bacterias multi-resistentes causantes de infecciones asociadas a la atención en salud (IAAS). Dentro de estos microorganismos multi-resistentes, de difícil erradicación, se destacan algunas especies del género Acinetobacter (Giske et al., 2008; Garnacho-Montero & Amaya-Villar, 2010). Estas bacterias son patógenos oportunistas y han surgido como uno de los agentes causantes de IAAS, principalmente en pacientes de unidades de cuidado intensivo-UCIs (Enoch et al., 2008; Munoz-Price & Weinstein, 2008). Acinetobacter presenta, entre sus características, la habilidad para adquirir genes de resistencia a antibióticos por su competencia natural para la transformación genética, y la capacidad para sobrevivir sobre superficies abióticas. Estas características lo han convertido en una amenaza para las instituciones de salud, con reportes de bacterias pan-resistentes que dejan muy pocas opciones terapéuticas disponibles (Park et al., 2009; Turton et al., 2010; Hart et al., 2010). Durante los últimos cinco años se ha reportado un aumento en la resistencia a la mayoría de los antibióticos de uso clínico, haciendo más difícil el tratamiento de las infecciones por cepas multi-resistentes de A. baumannii causantes de brotes, en UCIs. (Ramírez-Sandoval et al., 2013; Kempf & Rolain, 2012; Magiorakos et al., 2012; Poirel et al., 2011; Boucher et al., 2009; Cantón & Ruiz-Garbajosa, 2013; Vila & Pachón, 2008; Pérez et al., 2007; Hernández-Torres et al., 2010).
En Latinoamérica, los acinetobacter son una de las principales bacterias causantes de IAAS con elevada resistencia a los antibióticos. En un estudio ya publicado, Gales y cols. (2012) evaluaron la frecuencia y resistencia de patógenos Gram negativos, aislados de diversos países de Latinoamérica adscritos al programa SENTRY, durante 2008-2010 y caracterizaron molecularmente las cepas productoras de carbapenemasas. Acinetobacter spp. fue uno de los 10 patógenos mas prevalentes como causa de bacteremias, neumonía e infecciones de piel y tejidos blandos en pacientes hospitalizados. En otro estudio Opazo y cols. (2012) se informa que en Suramérica, particularmente en Chile, A. baumannii ha incrementado su resistencia a carbapenémicos debido a la presencia de carbapenemasas del tipo OXA.
Los estudios encaminados a establecer las bases moleculares de su resistencia se realizan utilizando técnicas de secuenciación de última generación de genomas bacterianos de algunas cepas, con la finalidad de comprender la biología, diversidad y determinantes de virulencia. (Medini et al., 2005; Falush, 2009; Tettelin et al., 2005). En la actualidad se encuentran registrados, en el National Center for Biotechnology Information (NCBI), 292 proyectos de secuenciación de genomas de A. baumannii, de los cuales 16 corresponden a genomas completos e incluyen 26 plásmidos; 233 tienen resultados parciales (contigs o scaffolds); 44 secuencias sin ensamblar y 696 proyectos de secuenciación sin datos (NCBI, 2014).
A. baumannii tiene la habilidad de acumular una gran variedad de mecanismos de resistencia, tanto por mutaciones como por la adquisición de elementos genéticos, plásmidos, integrones, transposones o aun islas de resistencia (Roca et al., 2012). En particular, los mecanismos de resistencia a antibióticos β-lactámicos se atribuyen a la presencia de β-lactamasas, cambios en la afinidad de las proteínas de unión a penicilinas (PBPs), alteraciones en la estructura y expresión de porinas que reducen la permeabilidad de antibióticos y-o sistemas de eflujo que disminuyen la concentración del antibiótico en el espacio periplásmico (Zhu et al., 2010).
En cuanto a sistemas de eflujo presentes en A. baumannii multi-resistente, Coyne y cols. (2011) indican que la familia RND es el sistema más prevalente en estos aislamientos y que, adicionalmente, se presenta una sobreexpresión de AdeABC, además de mutaciones en los genes adeRS, que codifican para un sistema regulador de dos componentes, siendo este uno de los mecanismos que más contribuye a la multi-resistencia en A. baumannii. Los sistemas RND tienen un amplio rango de sustratos, particularmente AdeABC y AdeIJK expulsan antibióticos; AdeIJK es intrínseco a esta especie y es el responsable, al menos en parte, de la resistencia natural que presenta Acinetbacter. (Coyne et al., 2010; Rajamohan et al., 2010; Magnet et al., 2001; Damier-Piolle et al., 2008).
En Colombia, estudios preliminares han mostrado que A. baumannii es la especie del genero aislada con mayor frecuencia (Saavedra et al., 2008; Hernández et al., 2011). Estudios preliminares sobre las bases moleculares de la resistencia han detectado genes codificantes de resistencia a cefalosporinas, carbapenémicos, quinolonas, aminoglicósidos, tetraciclinas y la participación de mecanismos de eflujo en los fenotipos de multi-resistencia observados en estos aislamientos (Villegas& Hartstein, 2003).
Se presenta, en este trabajo, el análisis del repertorio de genes de resistencia que conforman el resistoma (Wright, 2007) de A. baumannii ABIBUN 107m, aislado de hospitales colombianos. La cepa ABIBUN 107m, se seleccionó como representativa de un clon asociado a un brote epidémico, obtenido inicialmente en 2005 y posteriormente en el 2009, procedente de diferentes hospitales de 3er nivel de la ciudad de Bogotá, Colombia (Saavedra et al., 2008). La tipificación de las cepas pertenecientes al clon, incluida la cepa ABIBUN 107m, fue realizada por el grupo de Epidemiología Molecular (Hernández et al., 2011).
Materiales y métodos
Características del aislamiento
A. baumannii ABIBUN 107m se obtuvo de un hemocultivo que procedía de un paciente con IAAS, en un hospital de tercer nivel de la ciudad de Bogotá. El mismo clon fue encontrado previamente en otro hospital diferente en 2005 (Saavedra et al., 2008).
Perfil de resistencia en el aislamiento de A. baumannii ABIBUN 107m
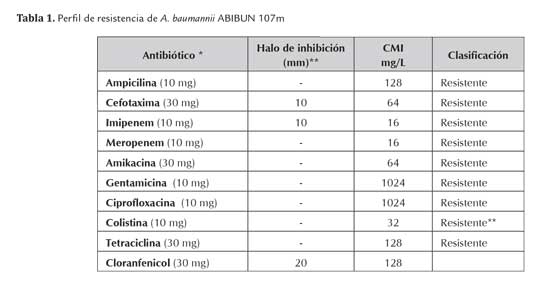
La evaluación del perfil de resistencia de A. baumannii ABIBUN 107m se realizó por el método de difusión en disco y mediante la determinación de la concentración mínima inhibitoria (CMI), según las recomendaciones y criterios de interpretación del CLSI, 2012 (excepto para colistina). Los resultados obtenidos se consignan en la tabla 1.
* Entre paréntesis aparece la cantidad de antibiótico cargado en el sensidisco
** No se presenta halo de inhibición
Obtención del DNA
A. baumannii ABIBUN 107m se cultivo en placas de agar Luria Bertani (LB) y se incubó a 37 °C toda la noche. Cinco colonias fueron inoculadas en 15 mL de caldo Luria Bertani en un matraz, y se en un agitador mecánico giratorio (150 rpm) a 37 °C, hasta obtener una densidad óptica entre 0,8 a 1 (λ 600 nm). La obtención del DNA se realizó disponiendo todo el cultivo en un tubo Falcon y centrifugando a 3500 xg por 2 minutos a 4 °C. Se eliminó el sobrenadante y el pellet obtenido se resuspendió en 1,5 mL de solución salina (hipertónica). Esta suspensión se colocó en un tubo de microcentrífuga de 1.5 mL, se centrifugó a 5345 xg por 2 minutos a 4°C y se descartó el sobrenadante. El pellet se resuspendió en 500 μL de buffer TE estéril y se centrifugó a temperatura ambiente (15 °C) por 5 min a 4000 xg. Después de obtener el pellet, se procedió a realizar la lisis celular, siguiendo las indicaciones del fabricante del QIAamp DNA Mini Kit®. La purificación del DNA se realizó utilizando una columna del kit Quiagen® siguiendo las instrucciones consignadas en el manual del fabricante. La cuantificación se hizo por fluorometría utilizando el fluorómetro Qubit de Invitrogen mediante el Kit Quant iT dsDNA y por el Nano-drop utilizando el sistema de Thermo Scientific NanoDrop 2000®.
Secuenciación, ensamblaje y anotación del genoma de A. baumannii ABIBUN 107m
El DNA obtenido fue secuenciado inicialmente con el secuenciador de alto rendimiento Illumina HiSeq 2000 sobre librerías paired-end y adicionalmente con el secuenciador Roche 454 GS FLX sobre librerías matepair de 7,5 kb. Una vez obtenidos los reads se sometieron a control de calidad con los programas FASTQC (Babraham Institute, 2013) y fastx_toolkit (Pearson etal., 1997). Para el ensamblaje de novo de los reads obtenidos por Illumina, se utilizó el programa Velvet (1.2.10) y el scaffolding, se realizó alineando los contigs previamente ensamblados en el programa Velvet con los reads obtenidos por Roche 454, utilizando el programa Newbler 2.7 (Roche Diagnostics Corporation ©). Estos alineamientos fueron visualizados utilizando el programa IGV 2.3 (Thorvaldsdóttir et al., 2012) .
El genoma ensamblado fue anotado automáticamente utilizando el NCBI Procariotic Genome Annotation Pipeline (PGAAP) (Angiuoli et al., 2008) y el servidor NMPDR RAST 4.0 (Aziz et al., 2008) y posteriormente se hizo la verificación de la anotación, en forma manual, utilizando el programa Artemis 16 (Rutherford et al., 2000).
Identificación y ubicación de los genes de resistencia en el genoma de A. baumannii 107m
• Genes que codifican para sistemas enzimáticos asociados con resistencia
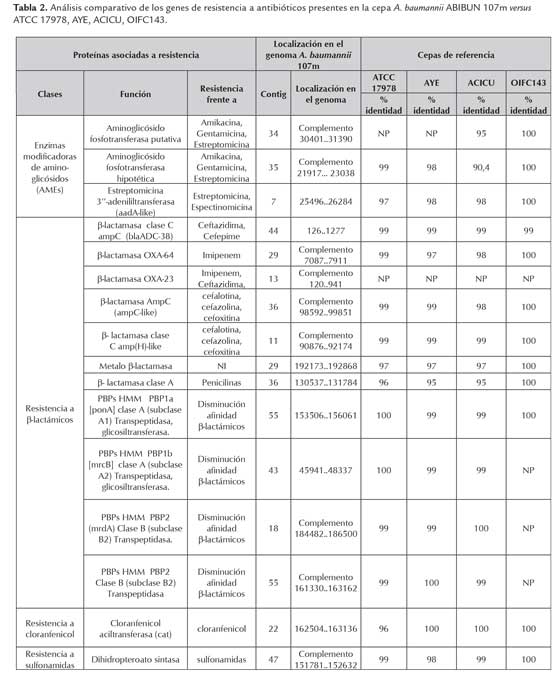
La identificación de los genes de resistencia se realizó a partir de la anotación del genoma. Las proteínas codificadas por los genes de resistencia encontrados, fueron comparadas con las secuencias de las proteínas correspondientes, presentes en cepas de referencia (A. baumannii ATCC17978; AYE; ACICU y OIFC143) obtenidas de la base de datos de proteínas del NCBI, mediante alineamiento global, utilizando el programa Needle - EMBOSS 6.5.7 (Rice et al., 2000), con el fin de evaluar el porcentaje de identidad y el tamaño de las proteínas. En la tabla 2 se consignan los resultados obtenidos.
• Genes que codifican para sistemas no enzimáticos asociados con resistencia Mutación de genes
Con el propósito de evidenciar las mutaciones que presentan los genes gyrA y parC se realizó un alineamiento global usando el programa Needle - EMBOSS 6.5.7 (Rice et al., 2000) de cada una de las secuencias de las proteínas codificadas por estos genes en el genoma en estudio, con sus correspondientes proteínas gyrA (GI:NC010400) y parC (GI:EU886740) no mutadas, obtenida de la base de datos de proteínas del NCBI. Resultados no mostrados.
Sistemas de eflujo
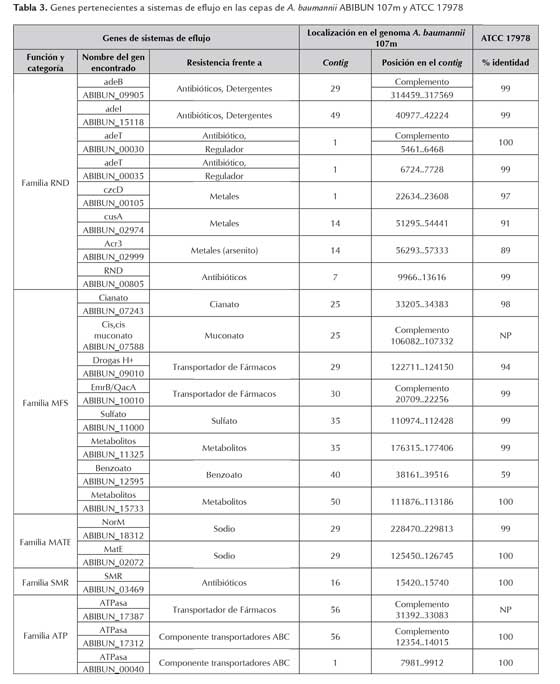
Para localizar los genes que codifican para proteínas que forman parte de los sistemas de eflujo el genoma de A. baumannii ABIBUN 107m, se realizó el mismo para sistema enzimáticos asociados con resistencia. En este caso, sin embargo, se utilizó como cepa de referencia A. baumannii ATCC17978. Los resultados obtenidos se muestran en la tabla 3.
Resultados y Discusión
Acinetobacter baumannii uno de los microorganismos más frecuentemente asociados con IAAS y presentauna resistencia varios tipos de antibióticos. La caracterización del perfil de resistencia optimiza, de ser realizada en forma rápida, la terapia antibiótica óptima para cada paciente (Turton et al., 2010; Perez et al., 2007), y su conocimiento permite, además, la selección de tratamientos empíricos racionales antes de su generación.
ABIBUN 107m es resistente a antibióticos β-lactámicos (ampicilina, cefotaxima, imipenem y meropenem), aminoglicósidos (amikacina y gentamicina), fluoroquinolonas (ciprofloxacina), lipopéptidos (colistina) y tetraciclina. Si bien no está definido un punto de corte para cloranfenicol, la CMI de este fármaco es claramente elevada. Dada la resistencia a más de tres familias de antibióticos este microorganismo es clasificado como multi-resistente. Tabla 1.
La secuenciación de alto rendimiento y el ensamblaje del genoma de Acinetobacter baumannii ABIBUN 107m dieron como resultado 56 contigs que pudieron ser organizados en un super-scaffold constituido por 3,954,000 bp con una porcentaje de GC de 38,74%, que consta de 3.796 CDS (Coding Sequence), dentro de los que hay 57 tRNA y 3.735 genes predichos con un tamaño promedio de 912 pb, de los cuales por anotación 2.884 se asignaron a COGs (Clusters of Orthologous Groups of proteins, database), lo cual es coherente con los datos reportados para este género (Farrugia et al., 2013). La cepa de este estudio tiene un plásmido (p1ABIBUN) de 8731 pb (ID:HG380023 de la base de datos GENOME del EBI) que es idéntico al plásmido p1 ABTCDC0715 de cinetobacter baumannii TCDC0715 (número de acceso CP 002523.1). Una característica a resaltar del plásmido p1ABIBUN es que no contiene genes de resistencia. Este proyecto de secuenciación del genoma completo fue depositado en el DDBJ/EMBL/GenBank bajo el siguiente número de acceso: A. baumannii ABIBUN 107m (CBSG00000000).
Los tres principales mecanismos que generalmente determinan la resistencia de A. baumannii a aminoglicósidos, disminución de la concentración intracelular del antibiótico (presencia de genes que codifican para sistemas de eflujo adeABC-RND), alteraciones en los sitios de unión al ribosoma 16s RNA por la adquisición del gen armA y la producción de enzimas modificadoras de aminoglicósidos (AMEs) (Zhu et al., 2010). La resistencia que presenta A. baumannii ABIBUN 107m a aminoglicósidos (gentamicina y amikacina) se puede atribuir a la presencia de dos genes que codifican para enzimas modificadoras de aminoglicósidos aminoglicósido fosfotransferasas y al gen aadA-like que codifica para una nucleotidil transferasa, específicamente la estreptomicina 3"-adenilil transferasa. La presencia de los genes que codifican para estas enzimas, permite postular que la resistencia de la cepa a aminoglicósidos estaría determinada por estos genes, lo cual es consistente con lo reportado en la literatura (Zhu etal., 2013).
Las proteínas(asociadas a resistencia) que pudieron ser anotadas en este genoma, están muy conservadas en A. baumannnii, particularmente con las de la cepa A. baumannii OIFC143. Sin embargo, se encuentran diferencias en las β-lactamasas OXA-23 que no se encuentra en los genomas utilizados como referencia, pero que es conservada (100 %) frente a otras cepas de A. baumannii como es el caso de A. baumannii MDRZJ06 y A. baumannii TCDC-AB0715, entre otras.
El perfil de resistencia a los antibióticos β-lactámicos se puede explicar por la presencia de los siguientes genes: un gen que codifica para una β-lactamasa clase A ; metalo β-lactamasa (MBL) dependiente de Zn; blaampC- like y blaamp(H)-like que codifican para β-lactamasas clase C (cefalosporinasas) y los genes blaOXA-23 y blaOXA-64 que codifican para enzimas de la clase D. Estos resultados están acordes con lo publicado para otras cepas de A. baumannii, en las que se evidencia que la resistencia a carbapenémicos está asociada con la producción de β-lactamasas de la clase D (carbapenemasas OXA) y blaOXA-23 (Mugnier et al., 2010; Corvec et al., 2007; Jeon et al., 2005; Heritier et al., 2005; Pournaras et al., 2006; Bonomo & Szabo, 2006; Hernández -Torres et al., 2010]. En la cepa ABIBUN 107m se encontraron β-lactamasas pertenecientes a 3 tres (A, C y D) de los cuatro grupos existentes.El gen blaOXA-23 ,presente en nuestra cepa, se encuentra en el contig ABISeq_013 y, corriente arriba (contig ABISeq_012) en la posición complementaria 41191- 41737), se localizó una secuencia que codifica para una transposasa de la familia ISAba1 (utilizando ISFinder). La presencia de esta secuencia sugiere la sobreexpresión de la β-lactamasa por las secuencias promotoras, de acuerdo con lo reportado en la literatura (Lin et al., 2010; Héritier et al., 2006; Mugnier et al., 2009). El gen blaOXA-23 , que en otras especies de Acinetobacter puede estar localizado en el cromosoma o en plásmidos, en el genoma de A. baumannii ABIBUN 107m se encuentra exclusivamente en el cromosoma (Mugnier et al., 2010; Zarrilli et al., 2013).
Si bien los antibióticos carbapénemicos constituyen los fármacos de elección para el tratamiento de infecciones causadas por Acinetobacter baumannii, es este uso el responsable de la resistencia encontrada en los clones capaces de generar hoy brotes en las UCIs, con el consiguiente riesgo de fracaso terapéutico. (Zúñiga et al., 2010; Carlet et al., 2011; Lee et al., 2011).
La presencia de 4 genes que codifican para Proteínas de Unión a Penicilina (PBPs) de elevada masa molecular, dos de la clase A, PBP1a [ponA] y PBP1b [mrcB]), que presentan actividad como transpeptidasas y glicosiltransferasas, y dos de la clase B PBP2 [pbpA] y PBP tipo2 que son transpeptidasas, que son blanco de los antibióticos β-lactámicos podrían incrementar la resistencia a este tipo de fármacos debido una disminución de la afinidad como ha sido reportado (Papp-Wallace et al., 2012 ).
El comportamiento frente a cloranfenicol podría ser explicado, al menos en parte, por la presencia del gen cat que codifica para una cloranfenicol aciltransferasa: por otra parte, la resistencia a sulfonamidas se explica por la presencia del gen sul-1 que codifica para una dehidropteroato sintasa.
La resistencia a fluoroquinolonas (ciprofloxacina) parece originado por las mutaciones encontradas en las proteínas GyrA y ParC. En la secuencia de la proteína GyrA se encontró una mutación del aminoácido en la posición 82 (leucina por serina); la misma mutación se encontró en la proteína ParC pero en la posición 84, una modificación ubicada en el bolsillo de unión de esta proteína a la quinolona (quinolone-binding pocket- QBP) lo que podría generar una disminución de la actividad del antibiótico, como se ha reportado para A. baumannii y otros microorganismos. (Vila et al., 1995; Vila et al., 1997; Li et al., 2014).
Pudimos identificar la presencia y organización genética de las cinco sistemas de eflujo (RND, MATE, MSF, ATP, SMR) asociados con el perfil de resistencia que presenta este aislamiento, acorde con lo reportado en 2011, por Coyne y cols. El análisis genómico evidenció la presencia de un tipo de la familia RND -AdeABC- lo cual contribuye a la multi-resistencia, ya que los principales sustratos de este sistema son: ciprofloxacina, tetraciclina y colistina. Estos sistemas también pueden remover los antibióticos β-lactámicos, aminoglicósidos, cloranfenicol y tigeciclina (Chau et al., 2004; Munoz-Price & Weinstein, 2008; Adams et al., 2009; Iacono et al., 2008; Smith et al., 2007; Vallenet et al., 2008; Wieczorek et al., 2008). El operón AdeABC (Acinetobacter drug efflux) es el principal sistema RND en A. baumannii y codifica para AdeA MFP, transportador multifármacos que se encuentra presente en la cepa ABIBUN 107m (Marchand et al., 2004; Ruzin et al., 2007). En el genoma estudiado se identificó AdeIJK que es intrínseco a esta especie y se le asigna la resistencia intrínseca que presenta este género. (Coyne et al., 2010; Rajamohan et al., 2010; Magnet et al., 2001; Damier-Piolle et al., 2008).
Los genes anotados en el genoma tienen una alta correlación con el perfil fenotípico que presenta la cepa en estudio. También se encontró que esta cepa, a diferencia de otras cepas estudiadas, tiene codificados en su genoma todos los genes asociados con resistencia aunque no se encontró evidencia de que formen parte de islas de resistencia.
Conclusiones
La cepa de A. baumannii ABIBUN 107m presenta resistencia a varios tipos de antibióticos tales como: β-lactámicos (ampicilina, cefotaxima, imipenem y meropenem); aminoglicósidos (amikacina y gentamicina); fluoroquinolonas (ciprofloxacina); lipopéptidos (colis tina); tetraciclina y trimetoprim-sulfametoxazol, por lo cual se puede clasificar como multi-resistente.
El genoma de esta bacteria fue secuenciado utilizando técnicas de alto rendimiento, ensamblado y anotado, obteniéndose un genoma constituido por 3954000 bp con 56 contigs; consta de 4256 genes con un tamaño promedio de 912 pb; 3796 CDS de los cuales por anotación 2884 se asignaron a COG; 57 tRNA y un porcentaje de GC de 38,74%. Adicionalmente se secuenció el plásmido p1ABIBUN de 8731 pb, el cual no presenta genes de resistencia que puedan contribuir a la resistencia que presenta la cepa ABIBUN 107m.
En el genoma de A. baumannii ABIBUN 107m se localizaron genes asociados con el perfil de resistencia que presenta: enzimas modificadoras de aminoglicósidos (aphA-like, aadA-like); β-lactamasas (blaADC-38, blaOXA-64, blaOXA-23, blaampC-like, blaamp(H)-like), β-lactamasa clase A ; metalo β-lactamasa (MBL) dependiente de Zn; secuencia de inserción tipo ISAba1; mutaciones en las proteínas GyrA (serina por leucina) en la posición 82 y la misma mutación en la posición 84 en la proteína parC codificadas por los genes de la DNA girasa y topoisomerasa IV subunidad A (gyrA y parC); la resistencia a cloranfenicol se podría explicar, parcialmente, por la presencia del gen cat que codifica para la cloranfenicol aciltransferasa y la resistencia a sulfonamidas por el gen sul-1 que codifica para una dehidropteroato sintasa. Adicionalmente se identificaron 4 PBPs de elevada masa molecular que coadyuvarían a disminuir la afinidad de los antibióticos β-lactámicos con su blanco. Se localizaron, en A. baumannii ABIBUN 107m, genes asociados a cinco sistemas de eflujo (RND, MATE, MSF, ATP, SMR). Particularmente el sistema RND, presenta un amplio rango de sustratos. AdeABC y AdeIJK expulsan antibióticos y AdeIJK es intrínseco a esta especie y es el responsable de la resistencia natural que presenta Acinetobacter. La presencia de estos sistemas ayudarían a la disminución de la concentración de los antibióticos especialmente de los β-lactámicos pero también de fluoroquinolonas, cloranfenicol, colistina y tetraciclinas.
Nuestro análisis sobre los genes que conforman el resistoma de A. baumannii ABIBUN 107m, son una referencia en la identificación de los mecanismos moleculares asociados con la resistencia a antibióticos sin embargo, es importante indicar que no se encontró evidencia de que genes se encuentren formando parte de islas de resistencia (datos no reportados) y que la resistencia sería el resultado de una combinación de mecanismos.
Agradecimientos
Esta investigación fue financiada por Colciencias (Código 1101 5192 9105; Contrato 300-2010). Los autores agradecen la colaboración y apoyo del Instituto de Biotecnología de la Universidad Nacional de Colombia - Sede Bogotá; Instituto Suizo de Bioinformática; National Center for Biotechnology Information; Centro de Nacional de Biotecnología de España y a la red Freebit del CyTED.
Referencias bibliográficas
1. Adams, MD.; Nickel, GC.; Bajaksouzian, S.; Lavender, H.; Murthy, AR.; Jacobs, MR.; Bonomo, RA. 2009. Resistance to colistin in Acinetobacter baumannii associated with mutations in the PmrAB two-component system. Antimicrobial Agents Chemotherapy. 53(9): 3628- 3634. [ Links ]
2. Angiuoli, SV.; Gussman, A.; Klimke, W.; Cochrane, G.; Field, D.; Garrity, GM.; Kodira, CD.; Kyrpides, N.; Madupu, R.; Markowitz, V.; Tatusova, T.; Thomson, N.; White, O. 2008. Toward an online repository of Standard Operating Procedures (SOPs) for (meta)genomic annotation. OMICS. 12(2): 137-141. [ Links ]
3. Aziz, RK.; Bartels, D.; Best, AA.; DeJongh, M.; Disz, T.; Edwards, RA.; Formsma, K.; Gerdes, S.; Glass, EM.; Kubal, M.; Meyer, F.; Olen, GJ.; Olson, R.; Osterman, AL.; Overbeek, RA.; McNeil, LK.; Paarmann, D.; Paczian, T.; Parrello, B.; Pusch, GD.; Reich, C.; Stevens, R.; Vassieva, O.; Vonstein, V.; Wilke, A.; Zagnitko, O. 2008. The RAST Server: rapid annotations using subsystems technology. BMC Genomics. 9:75 doi:10.1186/1471-2164-9-75. [ Links ]
4. Babraham Institute. 2013. Babraham Bioinformatics -FastQC A Quality Control tool for High Throughput Sequence Data. http://www.bioinformatics.babraham.ac.uk/projects/fastqc/ Fecha de consulta:13/04/2013. [ Links ]
5. Bonomo, RA.; Szabo, D. 2006. Mechanisms of multidrug resistance in Acinetobacter species and Pseudomonas aeruginosa. Clinical Infectious Diseases. 43(2): 49-56. [ Links ]
6. Boucher, HW.; Talbot, GH.; Bradley, JS.; Edwards, JE.; Rice, LB.; Scheld, M.; Spellberg, B.; Bartlett, J. 2009. Bad Bugs, No Drugs: No ESKAPE! An Update from the Infectious Diseases Society of America. Clinical Infectious Diseases. 48(1): 1-12. [ Links ]
7. Cantón, R.; Ruiz-Garbajosa, P. 2013. Acinetobacter baumannii: Do they still deserve our attention? Enfermedades Infecciosas y Microbiología Clínica. 31(1): 1-3. [ Links ]
8. Carlet, J.; Collignon, P.; Goldman, D.; Goossens, H.; Gyssens, IC.; Harbarth, S.; Jarlier, V.; Levy, SB.; N'Doye, B.; Pittet, D.; Ritchmann, R.; Seto, WH.; van der Meer, JWM.; Voss, A. 2011. Society's failure to protect a precious resource: antibiotics. The Lancet. 378(9788): 369- 371. [ Links ]
9. Chau, SL.; Chu, YW.; Houang, ET. 2004. Novel resistance-nodulation-cell division efflux system AdeDE in Acinetobacter genomic DNA group 3. Antimicrobial Agents Chemotherapy. 48(10):4054-4055. [ Links ]
10. CLSI. Clinical and Laboratory Standards Institute. 2012. Performance Standards for Antimicrobial Susceptibility Testing. Twenty-Second Informational Supplement document M100-S22, x 33(1): 184 p. Wayne, PA. [ Links ]
11. Corvec, S.; Poirel, L.; Naas, T.; Drugeon, H.; Nordmann, P. 2007. Genetics and expression of the carbapenem-hydrolyzing oxacillinase gene blaOXA-23 in Acinetobacter baumannii.Antimicrobial Agents Chemotherapy. 51(4): 1530-1533. [ Links ]
12. Coyne, S.; Rosenfeld, N.; Lambert, T.; Courvalin, P.; Périchon, B. 2010. Overexpression of resistance-nodulation-cell division pump AdeFGH confers multidrug resistance in Acinetobacter baumannii. Antimicrobial Agents Chemotherapy. 54(10): 4389- 4393. [ Links ]
13. Coyne, S.; Courvalin, P.; Périchon, B. 2011. Efflux-Mediated Antibiotic Resistance in Acinetobacter spp. Antimicrobial Agents Chemotherapy. 55(3): 947-953. [ Links ]
14. Damier-Piolle, L.; Magnet, S.; Bremont, S.; Lambert, T.; Courvalin, P. 2008. AdeIJK, a resistance-nodulation-cell division pump effluxing multiple antibiotics in Acinetobacter baumannii. Antimicrobial Agents Chemotherapy. 52(2): 557-562. [ Links ]
15. Enoch, DA.; Summers, C.; Brown, NM.; Moore, L.; Burnstein, RM.; Thaxter, R.; Enoch, LM.; Matta, B.; Sule O. 2008. Investigation and management of an outbreak of multidrug-carbapenemresistant Acinetobacter baumannii in Cambridge, UK. Journal of Hospital Infection. 70(2): 109-118. [ Links ]
16. Falush, D. 2009. Towards the use of Genomics to study Microevolutionary Change in Bacteria. PLoS Genetics. 5(10): e1000627. [ Links ]
17. Farrugia, DN.; Elbourne, LDH.; Hassan, KA.; Eijkelkamp, BA.; Tetu, SG.; Brown, MH.; Shah, BS.; Peleg, AY.; Mabbutt, BC.; Paulsen, IT. 2013. The Complete Genome and Phenome of a Community- Acquired Acinetobacter baumannii. PLoS ONE. 8(3): e58628. [ Links ]
18. Gales, AC.; Castanheira, M.; Jones, RN.; Sader, HS. 2012. Antimicrobial resistance among Gram-negative bacilli isolated from Latin America: results from SENTRY Antimicrobial Surveillance Program (Latin America, 2008-2010). Diagnostic Microbiology Infectious Disease. 73(4): 354-360. [ Links ]
19. Garnacho-Montero, J.; Amaya-Villar, R. 2010. Multiresistant Acinetobacter baumannii infections: Epidemiology and management. Current Opinion in Infectious Diseases. 23(4): 332-339. [ Links ]
20. Giske, CG.; Monnet, DL.; Cars, O.; Carmeli, Y. on behalf of ReAct- Action on Antibiotic Resistance. 2008. Clinical and Economic Impact of Common Multidrug-Resistant Gram-Negative Bacilli. Antimicrobial Agents Chemotherapy. 52(3): 813-821. [ Links ]
21. Hart, M.; Espinosa, F.; Halley, MC.; Martínez, ML.; Montes de Oca, Z. 2010. Resistencia a antibióticos en cepas de Acinetobacter baumannii aisladas de enero a marzo del 2010 en el Hospital Clinicoquirúrgico "Hermanos Ameijeiras". Revista Cubana de Medicina. 49(3): 218-227. [ Links ]
22. Héritier, C.; Poirel, L.; Lambert, T.; Nordmann, P. 2005. Contribution of acquired carbapenem-hydrolyzing oxacillinases to carbapenem resistance in Acinetobacter baumannii. Antimicrobial Agents Chemotherapy. 49(8): 3198-3202. [ Links ]
23. Héritier, C.; Poirel, L.; Nordmann, P. 2006. Cephalosporinase overexpression resulting from insertion of ISAba1 in Acinetobacter baumannii. Clinical Microbiology and Infection. 12(2): 123-30. [ Links ]
24. Hernández, A.; Valenzuela, EM.; Pulido, IY.; Reguero, MT.; Restrepo, S.; Gualtero, S.; Santofimio, D.; Ramírez, M.; Quintero, E.; Mantilla; JR. 2011. The genomic identification of Acinetobacterbaumannii clinical isolates by RFLP- PCR analysis of 16S-23S rRNA gene spacer region. Revista Colombiana de Biotecnología. 13(1): 110-114. [ Links ]
25. Hernández-Torres, A.; García-Vázquez, AE.; Yagüe, G.; Gómez Gómez, J. 2010. Acinetobacter baumannii multirresistente: situación clínica actual y nuevas perspectivas. Revista Española de Quimioterapia. 23(1):12-19. [ Links ]
26. Iacono, M.; Villa, L.; Fortini, D.; Bordoni, R.; Imperi, F.; Bonnal, RJ.; Sicheritz-Ponten, T.; De Bellis, G.; Visca, P.; Cassone, A.; Carattoli, A. 2008. Whole genome pyrosequencing of an Epidemic Multidrug-Resistant Acinetobacter baumannii strain Belonging to the European clone II group. Antimicrobial Agents Chemotherapy. 52(7): 2616-2625. [ Links ] [ Links ]
28. Kempf, M.; Rolain, JM. 2012. Emergence of resistance to carbapenems in Acinetobacter baumannii in Europe: clinical impact and therapeutic options. International Journal of AntimicrobialAgents. 39(2): 105-114. [ Links ]
29. Lee, Y.; Bae, IK.; Kim, J.; Jeong, SH.; Lee, K. 2011. Dissemination of ceftazidime-resistant Acinetobacter baumannii clonal complex 92 in Korea. Journal of Applied Microbiology. 112(6):1207-1211. [ Links ]
30. Li, J.; Gao, X.; Luo, T.; Wu, J.; Sun, G.; Liu, Q.; Jiang, Y.; Zhang, Y.; Mei, J.; Gao, Q. 2014. Association of gyrA/B mutations and resistance levels to fluoroquinolones in clinical isolates of Mycobacterium tuberculosis. Emerging Microbes and Infections. 3:e19; doi:10.1038/emi.2014.21. [ Links ]
31. Lin, YC.; Hsia, K-C.; Chen, Y-C.; Sheng, W-H.; Chang, SC.; Liao, M-H.; Li, S-Y. 2010. Genetic Basis of Multidrug Resistance in Acinetobacter Clinical Isolates in Taiwan. Antimicrobial Agents Chemotherapy. 54(5): 2078-2084. [ Links ]
32. Magiorakos, AP.; Srinivasan, A.; Carey, RB.; Carmelim, Y.; Falagas, ME.; Giske, CG.; Harbarth, S.; Hindler, JF.; Kahlmeter, G.; Olsson-Liljequist, B.; Paterson, DL.; Rice, LB.; Stelling, J.; Struelens, MJ.; Vatopoulos, A.; Weber, JT.; Monnet, DL. 2012. Multidrug resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clinical Microbiology and Infection. 18(3): 268-281. [ Links ]
33. Magnet, S.; Courvalin, P.; Lambert, T. 2001. Resistance-nodulationcell division-type efflux pump involved in aminoglycoside resistance in Acinetobacter baumannii strain BM4454. AntimicrobialAgents Chemotherapy. 45(12): 3375- 3380. [ Links ]
34. Marchand, I.; Damier-Piolle, L.; Courvalin, P.; Lambert, T. 2004. Expression of the RND-type efflux pump AdeABC in Acinetobacter baumannii is regulated by the AdeRS two-component system. Antimicrobial Agents Chemotherapy. 48(9): 3298-3304. [ Links ]
35. Medini, D.; Donati, C.; Tettelin, H. 2005. The microbial pan-genome.Current Opinion in Genetics & Development. 15(6): 589-594. [ Links ]
36. Mugnier, PD.; Poirel, L.; Naas, T.; Nordmann, P. 2009. Functional Analysis of Insertion Sequence IS Aba1, Responsible for Genomic Plasticity of Acinetobacter baumannii. Journal of Bacteriology. 191(7): 2414-2418. [ Links ]
37. Mugnier, PD.; Poirel, L.; Naas, T.; Nordmann, P. 2010. Worldwide dissemination of the blaOXA-23 carbapenemase gene of Acinetobacter baumannii. Emerging Infectious Diseases. 16(1): 340. [ Links ]
38. Muñoz-Price, LS; & Weinstein, RA. 2008. Acinetobacter Infection. New England Journal of Medicine. 358(12): 1271-1281. [ Links ]
39. NCBI. 2014. Database resources of the National Center for Biotechnology Information. Nucleic Acids Research, 42: D7-D17. Published online 19 November 2013. doi:10.1093/nar/gkt1146. [ Links ]
40. Opazo, A.; Domínguez, M.; Bello, H.; Amyes, SGB.; González- Rocha, G. 2012. OXA-type carbapenemases in Acinetobacter baumannii in South America. Journal of Infection DevelopingCountries. 6(4): 311-316. [ Links ]
41. Park, YK.; Ran-Peck, K.; Cheong, HS.; Chung, DR.; Song, JH.; Ko KS. 2009. Extreme drug resistance in Acinetobacter baumannii infections in intensive care units, South Korea. Emerging Infectious Diseases. 15(8): 1325-1327. [ Links ]
42. Papp-Wallace, KM.; Senkfor B.; Gatta J.; Chai W.; Taracila MA.; Shanmu- gasundaram, V.; Han, S.; Zaniewski, RP.; Lacey, BM.; Tomaras, AP.; Skalweit, MJ.; Harris, ME.; Rice, LB.; Buynak, JD.; Bonomo, RA. 2012. Early insights into the interactions of different β -lactam antibiotics and β -lactamase inhibitors against soluble forms of Acinetobacter baumannii PBP1a and Acinetobacter sp. PBP3. Antimicrobial. Agents and Chemotherapy. 56(11): 5687-5692. [ Links ]
43. Pearson, WR.; Wood, T.; Zhang, Z.; Miller, W. 1997. Comparison of DNA sequences with protein sequences. Genomics. 46(1): 24-36. [ Links ]
44. Perez, F.; Hujer, AM.; Hujer, KM.; Decker, BK.; Rather, PN.; Bonomo, RA. 2007. Global Challenge of Multidrug Resistant Acinetobacter baumannii. Antimicrobial Agents Chemotherapy. 51(10): 3471-3484. [ Links ]
45. Poirel, L.; Bonnin, RA.; Nordmann, P. 2011. Genetic basis of antibiotic resistance in pathogenic Acinetobacter species. International Union of Biochemistry and Molecular Biology IUBMB Life. 63(12): 1061-1067. [ Links ]
46. Pournaras, S.; Markogiannakis, A.; Ikonomidis, A.; Kondyli, L.; Bethimouti, K.; Maniatis, AN.; Legakis, NJ.; Tsakris, A. 2006. Outbreak of multiple clones of imipenem-resistant Acinetobacterbaumannii isolates expressing OXA-58 carbapenemase in an intensive care unit. Antimicrobial Agents Chemotherapy. 57(3): 557-561. [ Links ]
47. Rajamohan, G.; Srinivasan, VB.; Wondwossen, A.; Gebreyes, WA. 2010. Molecular and functional characterization of a novel efflux pump, AmvA, mediating antimicrobial and disinfectant resistance in Acinetobacter baumannii. Journal of Antimicrobial Chemotherapy. 65(9): 1919-1925. [ Links ]
48. Ramírez-Sandoval, ML.; Aranza-Aguilar, JL.; Varela, MA.; García-González, A.; Vélez-Castro, G., Salcedo-Romero, R.; Fajardo Luz, MM.; Cruz-Sánchez, M.; Moreno-Pérez, FJ. 2013. Brote de infección nosocomial de vías respiratorias bajas por Acinetobacter baumannii en un servicio de Medicina Interna de un hospital general de la Ciudad de México. Medicina Interna de México. 29(3): 250-256. [ Links ]
49. Rice, P.; Longden, I.; Bleasby, A. 2000. EMBOSS: The European Molecular Biology Open Software Suite. Trends in Genetics. 16(6): 276-277. [ Links ]
50. Roca, I.; Espinal, P.; Vila-Farrés, X.; Vila, J. 2012. The Acinetobacter baumannii oxymoron: comensal hospital dweller turned pandrug-resistance menace. Frontiers in Microbiology. 23(3): 148. doi: 10.3389/fmicb.2012.00148. [ Links ]
51. Rutherford, K.; Parkhill, J.; Crook, J.; Horsnell, T.; Rice, P.; Rajandream, MA.; Barrell, B. 2000. Artemis: sequence visualization and annotation. Bioinformatics. 16(10): 944-945. [ Links ]
52. Ruzin, A.; Keeney, D.; Bradford, PA. 2007. AdeABC multidrug efflux pump is associated with decreased susceptibility to tigecycline in Acinetobacter calcoaceticus-Acinetobacter baumanniicomplex. Journal of Antimicrobial Chemotherapy. 59(5): 1001-1004. [ Links ]
53. Saavedra, SY.; Nuñez, JC.; Pulido, IY.; González, EB.; Valenzuela, EM.; Reguero, MT.; Mantilla, JR. 2008. Characterization of carbapenem- resistant Acinetobacter calcoaceticus--A. baumannii complex isolates in a third-level hospital in Bogotá, Colombia. International Journal of Antimicrobial Agents. 31(4): 389-391. [ Links ]
54. Smith, MG.; Gianoulis, TA.; Pukatzki, S.; Mekalanos, JJ.; Ornston, LN.; Gerstein, M.; Snyder, M. 2007. New insights into Acinetobacter baumannii pathogenesis revealed by high-density pyrosequencing and transposon mutagenesis. Genes & Development. 21: 601-614. [ Links ]
55. Steenhuysen, J. 2013. Bacterias resistentes a fármacos son una amenaza urgente: informe EEUU. MedlinePlus. http://www.nlm.nih.gov/medlineplus/spanish/news/fullstory_140737.html. Fecha de consulta 22 de octubre 2013. [ Links ]
56. Tettelin, H.; Masignani, V.; Cieslewiczm, MJ.; Donati, C.; Medini, D.; Ward, NL.; Angiuoli, SV.; Crabtree, J.; Jones, AL.; Durkin, AS.; Deboy, RT.; Davidsen, TM.; Fraser, CM. 2005. Genome analysis of multiple pathogenic isolates of Streptococcus agalactiae: Implications for the microbial "pan-genome". Proceedings of the National Academy of Sciences. 102(39): 13950-13955. [ Links ]
57. Thorvaldsdóttir, H.; Robinson, JT.; Mesirov, JP. 2012. Integrative Genomics Viewer (IGV): high-performance genomics data visualization and exploration. Briefings in Bioinformatics. 14(2): 178-92. [ Links ]
58. Turton, JF.; Shah, J.; Ozongwu, C.; Pike, R. 2010. Incidence of Acinetobacter species other than A. baumannii among clinical isolates of Acinetobacter: Evidence for Emerging species. Journal ofClinical Microbiology. 48(4): 1445-1449. [ Links ]
59. Vallenet, D.; Nordmann, P.; Barbe, V.; Poirel, L.; Mangenot, S.; Bataille, E.; Dossat, C.; Gas, S. 2008. Comparative analysis of Acinetobacters: three genomes for three lifestyles. PLoS ONE3(3):e1805. [ Links ]
60. Vila, J.; Ruiz, J.; Goñi, P.; Marcos, A.; Jiménez de Anta, T. 1995. Mutation in the gyrA Gene of Quinolone-Resistant Clinical Isolates of Acinetobacter baumannii. Antimicrobial Agents and Chemotherapy. 39(5): 1201-1203. [ Links ]
61. Vila, J.; Ruiz, J.; Goñi, P.; Marcos, A.; Jiménez de Anta, T. 1997. Quinolone- resistance mutations in the topoisomerase IV parC gene of Acinetobacter baumannii. Journal of Antimicrobial Agents and Chemotherapy. 39: 757-762. [ Links ]
62. Vila, J.; Pachón, J. 2008. Therapeutic options for Acinetobacter baumannii infections. Expert Opinion on Pharmacotherapy. 9(4): 587-599. [ Links ]
63. Villegas, MV.; Hartstein, AI. 2003. Acinetobacter outbreaks, 1977- 2000. Infection Control and Hospital Epidemiology. 24(4): 284- 295. [ Links ]
64. Wieczorek, P.; Sacha, P.; Hauschild, T.; Zórawski, M.; Krawczyk, M.; Tryniszewska, E. 2008. Multidrug resistant Acinetobacter baumannii the role of AdeABC (RND family) efflux pump in resistance to antibiotics. Folia Histochemica et Cytobiologica. 46(3): 257-267. doi: 10.2478/v10042-008-0056-x. [ Links ]
65. Wright, GD. 2007. The antibiotic resistome: the nexus of chemical and genetic diversity. Nature Reviews Microbiology. 5: 175-186. [ Links ]
66. Zarrilli, R.; Pournaras S.; Giannouli M.; Tsakris A. 2013. Global evolution of multidrug-resistant Acinetobacter baumannii clonal lineages.International Journal Antimicrobial Agents. 41(1): 11-19. [ Links ]
67. Zhu, H-Y.; Wang, Y.; Zhu, Y-V.; Xu, D-x; Zhang, H-Y. 2010. Detection Rate and Drug Resistance Rate of Acinetobacter baumanii during 2005- 2009. Chinese Journal of Nosocomiology. 23: 3778-3780. [ Links ]
68. Zhu, L.; Yan, Z.; Zhang, Z.; Zhou, Q.; Zhou, J.; Wakeland, EK.; Fang, X.; Xuan, Z.; Shen, D.; Li, Q-Z. 2013. Complete Genome Analysis of Three Acinetobacter baumannii Clinical Isolates in China for Insight into the Diversification of Drug Resistance Elements. PLoS ONE. 8(6): e66584. [ Links ]
69. Zuñiga, AE.; Chávez, M.; Gómez, RF.; Cabrera, CE.; Corral, RE.; López, B. 2010. Relación entre virulencia y resistencia antimicrobiana en Acinetobacter baumannii. Nova. Publicación Científica en Ciencias Biomédicas. 8(14): 148- 162. [ Links ]