Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.2 Bogotá jul./dez. 2014
https://doi.org/10.15446/rev.colomb.biote.v16n2.41077
http://dx.doi.org/10.15446/rev.colomb.biote.v16n2.41077
ARTÍCULO DE INVESTIGACIÓN
Efecto de rizobacterias promotoras de crecimiento vegetal solubilizadoras de fosfato en Lactuca sativa cultivar White Boston
Effect of plant growth promoting rhizobacteria phosate solubilizing Lactuca sativa cultivar White Boston
Diana Beatriz Sánchez López, Ana María García Hoyos, Felipe Andrés Romero Perdomo,Ruth Rebeca Bonilla Buitrago
Corporacion Colombiana de Investigacion Agropecuaria, Km 14 via Mosquera, Cundinamarca-Colombia. Centro de Biotecnologia y Bioindustria, Laboratorio Microbiologia de Suelos. Telephone +57(1) 4227300 Ext. 1409. Autor para correspondencia: dbsanchez@corpoica.org.co
Recibido: febrero 16 de 2014 Aprobado: octubre 16 de 2014
Resumen
En las últimas décadas, la agricultura colombiana se ha visto afectada por la reducción de la productividad en las zonas hortícolas, el incremento de los costos de producción y la dependencia del uso de productos químicos, produciendo un daño irreversible al medio ambiente y la calidad de vida de productores y consumidores. El objetivo de investigación fue evaluar el efecto de rizobacterias promotoras del crecimiento vegetal del género Pseudomonas sp. sobre Lactuca sativa cultivar White Boston como solubilizadoras de roca fosfórica. El estudio se realizó en el Centro de Investigación Tibaitatá (Corpoica) ubicado en Mosquera (Cundinamarca-Colombia). Los resultados demostraron que las cepas tienen la capacidad intrínseca para solubilizar fuentes de fósforo de baja solubilidad como la roca fosfórica. La aplicación de inoculantes con base en las cepas: Pseudomonas fluorescens FR1, Pseudomonas sp., UVLO27 y Pseudomonas sp. LEAV18 arrojaron los mejores resultados. Las cepas Pseudomonas sp. FR2, UVLO27 y K35, tienen la capacidad de producir índoles y sideróforos. El experimento en invernadero evidenció que las cepas Pseudomonas fluorescens FR1, Pseudomonas sp. FR2 y UVLO27 incrementaron de manera significativa (P<0.05) la biomasa y el desarrollo de las plantas. El uso de rocas fosfóricas representa una alternativa económica y ecológica viable, en sistemas de agricultura sostenible.
Palabras clave: Pseudomonas sp., biofertilizantes, roca fosfórica, fósforo, índoles totales.
Abstract
In the last decades, Colombian agriculture has been affected by the reduction in productivity in horticultural areas, increase in production costs and the dependence of chemical products usage, causing and irreversible damage to environment and producers and consumers life quality. The aim of this research was to evaluate the effect of plant growth promoting rhizobacteria of the genus Pseudomonas sp. under Lactuca sativa cultivar White Boston as phosphate rock solubilizing bacteria. The study took place in the Research Centre Tibaitatá-Corpoica, located in Mosquera (Cundinamarca-Colombia). Results demonstrated that the strains have an intrinsic capacity to solubilize low solubility phosphorus sources as phosphate rock. Inoculants application based on: Pseudomonas fluorescensFR1, Pseudomonas sp., UVLO27 and Pseudomonas sp. LEAV18 strains displayed the best results. The strains Pseudomonas sp. FR2, UVLO27 and K35, are capable of producing indoles and siderophores. The green house experiment showd that strain Pseudomonas fluorescens FR1, Pseudomonas sp. FR2 of phosphate rocks represents a viable economic and ecological alternative in sustainable agriculture systems.
Key words: Pseudomonas sp., biofertilizer, phosphate rock, phosphorus, total indole.
Introducción
El incremento de los costos de producción y la dependencia del uso de agroquímicos han ocasionado un daño irreversible al medio ambiente, a los agricultores y a los consumidores (Elkoca et al., 2010). De acuerdo a Pinzon et al. (1993), estos sistemas de fertilización, llevan a la no sostenibilidad a través del tiempo; un claro ejemplo de esta situación se ha observado durante el proceso de producción del cultivo de Lactuca sativa cultivar White Boston. Esta hortaliza de hoja es considerada como la más importante a nivel nacional, contando con un área aproximada de siembra de 3.500 hectáreas con un valor de producción de $245 millones (Pinzon et al., 1993).
En cuanto a los requerimientos nutricionales del cultivo, el fósforo (P) es uno de los macronutrientes más importantes para el desarrollo del mismo (Yadav, Dadarwal, 1997). Lo anterior ha generado una problemática por la forma indiscriminada que se aplica al cultivo y su rápida inmovilización por la reacción con iones calcio, hierro o aluminio, dejando de estar disponible para la planta (Alkhader et al., 2013; Omar 1997). Algunos microorganismos juegan un papel muy importante en los ciclos biogeoquímicos. Mejoran la disponibilidad de P para las plantas por mineralización de P orgánico mediante fosfatasas en el suelo y la solubilización de fosfatos minerales a través de ácidos orgánicos (Toro et al., 2013; (Makoi et al., 2010; Rodríguez y Fraga, 1999). De esta forma el fósforo queda disponible en el suelo y finalmente es absorbido por las plantas y utilizado para su desarrollo (Maseko y Dakora, 2013). Debido al papel que juegan en la colonización de la rizósfera y en la promoción de crecimiento, éstas bacterias se ha denominado Rizobacterias Promotoras De Crecimiento Vegetal (PGPR por sus siglas en ingles) (Hayat et al., 2010; Kang et al., 2011). Entre ellas se encuentran los géneros Pseudomonas, Azospirillum, Burkholderia, Bacillus, Enterobacter, Rhizobium, Erwinia, Alcaligenes, Arthrobacter, Acinetobacter y Flavobacterium entre otros.
La aplicación de P y la inoculación bacteriana afecta el rendimiento de la soya a través de la utilización de este mejorando su efectividad (Khan et al., 2011). Flores-Félix et al. (2013) reportaron que Rhizobium leguminosarum (PEPV16) tiene la capacidad de promover el crecimiento de las plantas aumentado su biomasa seca de parte aérea y raíces en Lactuca sativa y Daucuscarota L.; además esta cepa aumentó la absorción del fósforo en la parte comestible de las dos especies y en la microscopia con focal mostró la capacidad de colonizar las raíces de dos cultivos hortícolas. Sin embargo, pocos estudios se han realizado en torno al uso de PGPR, específicamente bacterias solubilizadoras de fosfato (BSF), eficientes que hacen disponibles el fósforo del suelo aplicado en fertilizante de síntesis química en el cultivo Lactuca sativa. El objetivo de ésta investigación fue evaluar el efecto de rizobacterias promotoras del crecimiento vegetal del género Pseudomonas como solubilizadoras de fosfato sobre la producción de Lactuca sativa cultivar White Boston, utilizando como fuente fosfórica la roca fosfórica de Pesca (30% de P2O5), de muy baja solubilidad, como alternativa para la reducción de costos económicos y ecológicos en cultivos de interés económico.
Materiales y métodos
Condiciones experimentales
Área de estudio. El estudio se realizó en 2013, en el Centro de Investigación Tibaitatá (Corpoica) ubicado en Mosquera (Cundinamarca - Colombia) a una altura de 2543 msnm; localizado geográficamente a 4°41" 43" de latitud norte y 74°12" 30" de latitud oeste.
Material vegetal. Se utilizó para evaluación a nivel de invernadero Lactuca sativa cultivar White Boston.
Microorganismos. Las cepas Pseudomonas fluorescens FR1, Pseudomonas sp.FR2, UVLO27, LEAV18, K35 y UVLO25 fueron provistas por el banco de microorganismos de trabajo del laboratorio de microbiología de suelo, Corpoica. Estas cepas fueron reactivadas en medio de cultivo King-B (King et al., 1954).
Roca fosfórica (RF). Se utilizó roca fosfórica originaria de Pesca-Boyacá (Colombia) con la siguiente composición: 30% P2O5, 40% Ca, 12% Si, 0.1% Mg, 40 ppm Mn, 30 ppm Cu, 10 ppm Mo, 300 ppm Zn y un 3% de humedad.
Caracterización de las cepas
Evaluación cuantitativa de la solubilización de roca fosfórica. La determinación cuantitativa de la solubilización de roca fosfórica se realizó en medio de cultivo líquido SRSM-PR con un tiempo de incubación de 5 d a 30±2 °C a 150 rpm. Los sobrenadantes a partir del cultivo se centrifugaron a 10000 rpm durante 10 min. El fosfato soluble en el sobrenadante fue estimado por el método del azul de fosfomolibdato (Fiske y Subbarow 1925).
Síntesis de sideróforos. Se realizó una suspensión bacteriana de cada una de las cepas en estudio en NaCl 0.85 % a un OD600= 0.500. Se tomaron alícuotas de 10 μL de la suspensión, y se sembraron por triplicado sobre una placa de petri con agar CAS a razón de una microgota por caja, por triplicado. Las placas fueron incubadas durante 5 días a 30±2 °C (Schwyn y Neilands, 1987).
Producción de índoles totales. Los compuestos indólicos se determinaron mediante el ensayo colorimétrico descrito por (Glickman y Dessaux, 1995) empleando el medio de cultivo K-lactato suplementado con triptófano a 100 mg/L. Los cultivos se incubaron durante 72 h a 150 rpm en oscuridad. La lectura se realizó utilizando el reactivo de Salkowsky (FeCl3 7H2O 12g/L en H2SO4 7.9M) en una relación 1:1 con la suspensión bacteriana, dejándose reaccionar durante 30 min en la oscuridad. La lectura se realizó a una absorbancia de 540 nm.
Evaluación de las cepas en Lactuca sativa cultivar White Boston en condiciones de invernadero
Evaluación del efecto de los microorganismos en plantas de Lactuca sativa cultivar White Boston bajo
condiciones de invernadero. Las semillas fueron desinfectadas con hipoclorito de sodio 5% y etanol 70% (1:1) durante 5 min, seguido de varios enjuagues con agua destilada estéril. Luego fueron pregerminadas en turba no estéril por tres semanas. Se utilizó un suelo sin esterilizar de pH=5.50, textura franco limoso, 12,23% MO; 2,7 P (mg*kg-1); 0,72 K; 1,20 Mg; 2,32 Ca (Cmol*kg-1). Las plántulas se colocaron en materas con capacidad de 4 kg y se inoculó directamente el suelo de cada planta con 5 mL de la suspensión bacteriana correspondiente, a una concentración celular
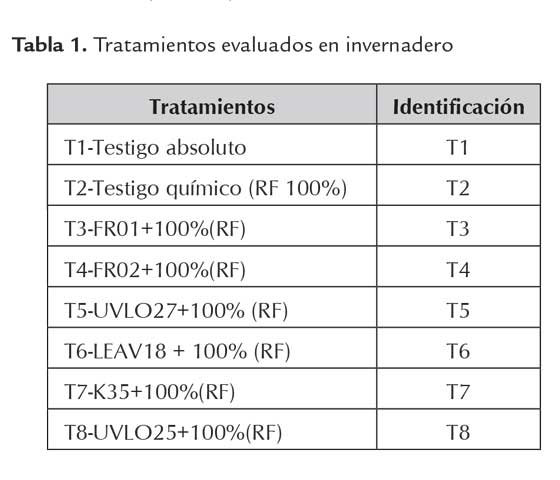
de 1x108 UFC.mL-1 en medio King-B (King et al., 1954). El experimento se mantuvo bajo condiciones de invernadero por un período de dos meses. El diseño experimental empleado fue completamente al azar con tres repeticiones por tratamiento. Se evaluaron ocho tratamientos (tabla 1).
Las variables evaluadas de respuesta vegetal fueron: Longitud de la parte área (cm), longitud radical (cm), masa seca de la parte aérea (g), masa seca de la raíz (g), masa fresca de la parte área (g), masa fresca de raíz (g), área foliar (cm2) y fósforo foliar (%). Se realizaron dos muestreos destructivos, uno al mes de establecido el ensayo y el otro al finalizar el período de evaluación. El área foliar se determinó con tres hojas por plantas seleccionadas aleatoriamente por cada repetición. Estas hojas fueron luego escaneadas, obteniéndose el área foliar mediante la utilización de un medidor de área foliar CI-202 Portable Leaf Area Meter (Bio-Science).
Análisis estadístico
Los datos fueron sometidos a una evaluación estadística empleando un análisis de varianza (ANOVA) y la prueba HSD de Tukey con un 95% de confianza.
Resultados y discusión
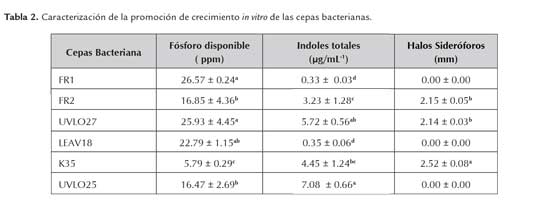
Evaluación cuantitativa de la solubilización de roca fosfórica. Las cepas Pseudomonas fluorescens FR1 (26.57 ppm), Pseudomonas sp. UVLO27 (25.93 ppm) y LEAV18 (22.79 ppm) presentaron los mejores resultados (p≤0.05) (tabla 2). Sánchez et al. (2012), reportaron valores superiores de solubilización de fósforo para la cepa P. putida de 144.0 ppm, y sugieren también que la capacidad de solubilización está directamente relacionada con la solubilidad de la roca empleada y con el fósforo disponible liberado. Babana et al. (2013) cuantificaron concentraciones de 90.0 ppm de fósforo por Pseudomonas sp. BR2 aislada de cultivos de trigo. Entre los géneros más estudiados como solubilizadores de fosfatos se encuentra el género Pseudomonas sp. (Rodríguez y Fraga, 1999). La actividad de este tipo de bacterias no sólo contribuye en la solubilización de fosfatos, sino también intervienen directamente en el incremento de la capacidad de crecimiento de las especies vegetales en las que son inoculadas (Alarcón y Ferrera-Cerrato, 2012). Como ejemplo de estas bacterias benéficas, se tiene P. aurantiaca (Rosas et al., 2009), Pseudomonas fluorescens (Vikram, 2007), las cuales tienen la capacidad de solubilizar fosfatos a partir de fuentes inorgánicas insolubles (Alarcón y Ferrera-Cerrato, 2012).
Producción de AIA y Producción de sideróforos. Al evaluar la producción de compuestos indólicos de las cepas en estudio, los mejores resultados fueron obtenidos a partir de las cepas Pseudomonas sp. UVLO25 (7.08 µg/mL), UVLO27 (5.72 µg/mL) y K 35(4.45 µg/ mL) (p≤0.05) (tabla 2). Varios estudios han reportado que la producción in vitro de AIA y otras hormonas fisiológicamente activas derivadas del L- triptófano, son una característica de las PGPR. (Merzaeva y Shirokikn, 2010; Sánchez et al., 2012). El ácido indol-3-acético (AIA) es producido por varios microorganismos del suelo, el cual se conoce como estimulante de la elongación, la división y la diferenciación celular (Khan et al., 2009; González-Mendoza, et al., 2013). Bajo condiciones naturales del suelo, es posible que estos microorganismos sinteticen mayor cantidad de AIA en comparación con cultivos puros en condiciones de laboratorio, posiblemente por efectos sinérgicos con otros microorganismos e interacciones con la materia orgánica del suelo (Sánchez et al., 2005).
La síntesis de sideróforos, se evidenció en las cepas Pseudomonas sp. FR2 (2.15 mm), Pseudomonas sp.UVLO27 (2.14 mm) y Pseudomonas sp. K35 (2.52 mm) (tabla 2.). De acuerdo con Kloepper et al. (1980) y Farías et al. (1990), estos metabolitos tienen la capacidad de secuestrar el hierro del ambiente rizosférico, impidiendo que esté disponible para los patógenos. Así, las bacterias del género Pseudomonas que sinteticen sideróforos, tienen ventajas en el suelo, al comportándose como controladores de enfermedades. Estudios realizados por Parani y Saha (2012) demostraron que la capacidad de producción de sideróforos es llevada a cabo por especies del género Pseudomonas sp. como P. trivalis BIHB 745 y P. fluorescens 1773/K.
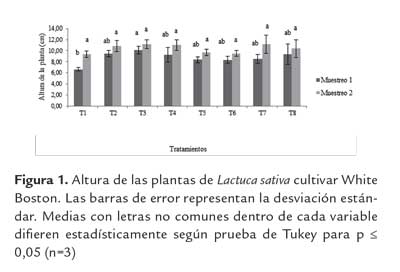
Respuesta vegetal: Altura de las plantas y Longitud de la raíz. Los resultados con relación a la altura de planta mostraron que hubo diferencias significativas (p≤ 0.05) en el primer mes de muestreo respecto al testigo químico. El tratamiento T3 superó este parámetro en un 107 % (figura 1). En el segundo mes de muestreo no se presentaron diferencias significativas (p≤ 0.05) entre los tratamientos (figura 1). De acuerdo con lo anterior, es importante tener en cuenta que algunas condiciones abióticas pueden afectar la eficiencia de estos microorganismos, por ejemplo la influencia de las temperaturas o los tipos de suelos y condiciones bióticas como las respuestas sinérgicas antagónicas (Bhattacharyya y Jha, 2012) o el estado fenológico de la planta a la cual están asociados (Piromyou et al., 2011).
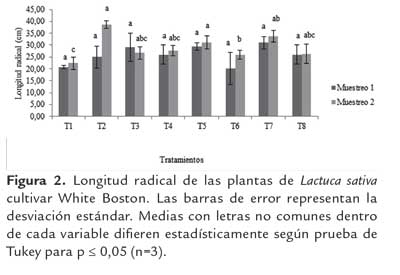
En cuanto a la longitud de la raíz no se encontraron diferencias significativas (p≤ 0.05) en el primer mes de muestreo respecto al testigo químico. A pesar de esto, los tratamientos T7 y T5 mostraron un aumento respecto al testigo químico de 124 % y 117 % respectivamente.
En el segundo muestreo no se encontraron diferencias significativas (p≤ 0.05) respecto al T2, pero se presentó un incremento del el tratamiento T5 con un 99 %. La inoculación con bacterias podría mejorar el desarrollo de la planta a través de la producción de los reguladores de crecimiento por los microorganismos en la interface de raíces, estimulando el desarrollo radicular permitiendo una mejor absorción de agua y nutrientes del suelo (Cassán et al., 2011). Existen varios mecanismos por los cuales se puede estimular el crecimiento de las plantas, entre los que se pueden destacar la producción de reguladores de crecimiento, fijación de nitrógeno y la supresión de enfermedades causadas por microorganismos (Egamberdiyeva, 2007; Porcel et al., 2013). Las cepas de Pseudomonas sp. aumentaron la longitud de la raíz y elongación en Lactuca sativa (Glick et al., 1997). Someya et al. (2008), reportaron promoción de crecimiento en esta planta cuando se utilizó como inoculante bacteriano P. fluorescens LRB3W, lo que corrobora su capacidad de crecimiento vegetal y por tanto un alto potencial como biofertilizante.
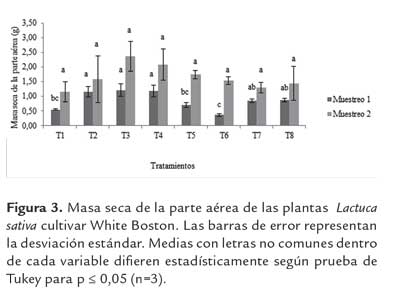
Masa seca de la plantas. En el primer mes de muestreo, en la variable masa aérea los tratamientos T3 y T4 presentaron un aumento en la biomasa aérea respecto al testigo químico; sin embargo, no fue estadísticamente significativo (p≤ 0.05) (figura 2) En el segundo mes de muestreo los tratamientos T3 y T4 presentaron un aumento significativo (p≤ 0.05) de 105 % y 102 % respecto a T2 (figura 3).
Con relación a la masa seca radicular en el primer y segundo mes de muestreo los tratamientos con mayores valores, T3 y T4 no presentaron diferencias significativas (p≤ 0.05) en comparación con el T2; aunque mostraron un aumento de masa seca en un 150 %, 131 %, 103 % y 115 % respectivamente (figura 4).
El aumento de masa seca, mediado por bacterias, es comúnmente reportado como una respuesta a la inoculación, lo que permite un mejor acceso de los nutrientes del suelo a la planta (Sharan y Nehra, 2011). Por otra parte, la capacidad de absorción de las raíces promovida por rizobacterias se basa en la posible conversión de los exudados radiculares en sustancias promotoras de crecimiento vegetal como auxinas y citoquininas (Cassán et al., 2014). En diversos estudios, se ha encontrado que las bacterias del género Pseudomonas sp. poseen la propiedad de producir estas sustancias, cuya principal ventaja es inducir la iniciación radicular e incrementar la formación de raíces y pelos radiculares (Diyansah et al., 2014).
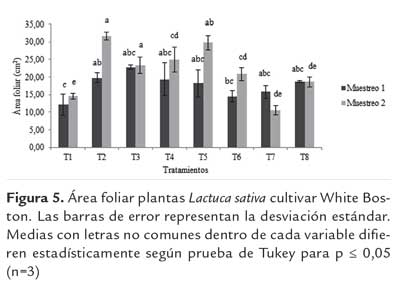
Área foliar. En el primer mes, el tratamiento T3 presentó diferencias significativas (p≤ 0.05) en comparación con el T2 con un incremento del 115 %. En el segundo mes de muestreo no se presentaron diferencias significativas respecto al T2. De acuerdo con Sharan y Nehra (2011), la inoculación con PGPR en estadios tempranos de desarrollo mejora la producción de biomasa a través de efectos directos en el crecimiento de la raíz y de la plántula. La inoculación de plantas ornamentales, arboles maderables, vegetales y cultivos agrícolas con PGPR puede resultar en múltiples efectos en la fase temprana de crecimiento, como en la potencialización de la emergencia del vástago, salud, vigor, altura y peso de la planta. De igual forma en esta fase temprana el contenido de nutrientes y clorofila aumenta.
Lo anteriormente expuesto explica el porqué no hubo diferencias significativas en el segundo muestreo, donde las plantas ya pasan su fase inicial con incrementos posiblemente por el efecto de los microorganismos. Sin embargo, todos los tratamientos presentaron diferencias significativas con el T1, evidenciándose un aumento en la respuesta con los tratamientos T4 y T5 en un 204 % y 171 % espectivamente. Teniendo en cuenta que el aumento en área foliar es un indicador de incremento en la tasa de actividad fotosintética en las plantas debido a aumentos en los niveles de contenido de carbono (Taiz y Zeiger, 2010), la cepa FR1 representa una alternativa para posible uso en la promoción de crecimiento en el cultivo de Lactuca sativa cultivar White Boston, dada la importancia de esta variable agronómica en la calidad del producto. En diferentes estudios, se ha determinado el efecto positivo de bacterias del género Pseudomonas sp. en Lactuca sativa sobre la promoción de crecimiento de esta especie(Someya et al., 2008; Kohler, 2006).
Es importante resaltar que la selección de rizobacterias promotoras de crecimiento es bastante crítica debido a que la respuesta de la planta es muy variable dependiendo de la cepa bacteriana, genotipo de la planta y condiciones del experimento en invernadero (Khalid et al., 2009).
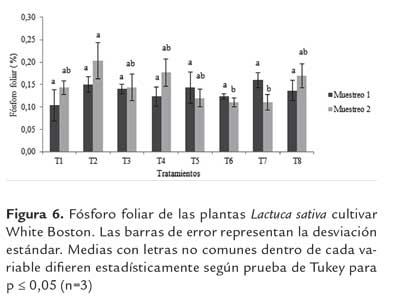
Fósforo Foliar. Los resultados del porcentaje de fósforo foliar no revelan diferencias significativas (p≤ 0.05) en comparación con el T2. Sin embargo, el tratamiento T7 presentó un incremento de 106% respecto al T2 y de 154 % con respecto al testigo absoluto con el primer mes de muestreo. En el segundo mes de muestreo los tratamientos no presentaron diferencias significativas (p≤ 0.05) respecto al T2; por el contrario, al T4 y T8 presentaron diferencias significativas respecto al T1 de 123 % y 118 % respectivamente. A partir del análisis realizado, se obtuvieron valores de fósforo en tejido foliar entre 0,10 y 0,16% en el primer muestreo y en el segundo muestreo 0,11y 0,20% (figura 5). De acuerdo con Jones et al. (1991), estos valores son considerados bajos. Es importante resaltar que la roca fosfórica es de muy baja solubilización, lo que trae como consecuencia una liberación más lenta (Xiao et al., 2012) y esto puede inferir un efecto residual para los cultivos.
En los resultados obtenidos, se evidencian diferencias de tipo numérico entre el primer y segundo muestreo. Con base en lo anterior, sería adecuado evaluar la solubilización de esta fuente en un tiempo mayor o en una siembra posterior.(figura 6)
Conclusión
Las cepas Pseudomonas fluorescens FR1, Pseudomonas sp. UVLO27 y Pseudomonas sp. LEAV18 tiene la capacidad de producir índoles, sideróforos y además solubilizar P de fuentes muy poco solubles como la roca fosfórica y estimuló el crecimiento en las plantas de Lactuca sativa cultivar White Boston.
Sin embargo, la absorción de nutrientes, favorecido por este género de bacterias, no es el único factor que afecta el crecimiento y desarrollo de las plantas, factores ambientales como la luz, temperatura y humedad son importantes sobre la respuesta, por ende en esta investigación se mantuvieron condiciones controladas, lo que no indica que hayan sido las condiciones ideales y óptimas durante todo el tiempo del estudio. Se recomienda realizar análisis de fósforo en suelo una vez terminado el período de evaluación de crecimiento y así poder relacionar estos valores con el contenido de fósforo foliar y conocer la dinámica de solubilización de este elemento en el tiempo. Igualmente repetir experimento con los mismos microorganismos en el mismo suelo con la misma especie.
Agradecimientos
Ministerio de Agricultura y Desarrollo Rural Colombiano - Laboratorio de Microbiología de Suelos -CORPOICA.
Referencias bibliográficas
1. Alarcón, A; Ferrera-Cerrato, R. 2012. Biofertilizantes: Importancia y utilización en la agricultura. Revista Mexicana de Ciencias Agrícolas. 26 (2): 191-203. [ Links ]
2. Alkhader, A.; Rayyan, A; Rusan, M. 2013. The effect of phosphorus fertilizers on the growth and quality of lettuce (Lactuca sativa L.) under greenhouse and field conditions. Journal of Food, Agriculture & Environment. 11 (2): 777-783. [ Links ]
3. Babana, A.; Dicko, A.; Maïga, K; Traoré, D. 2013. Characterization of rock phosphate-solubilizing microorganisms isolated from wheat (Triticum aestivum L.) rhizosphere in Mali. Journal of Microbiology and Microbial Research. 1(1):1-6. [ Links ]
4. Bhattacharyya, P; Jha, D. 2012. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture. World J. Microbiol. Biotechnol. 28: 1327-1350. [ Links ]
5. Cassán, F.; Perrig, D.; Sgroy, V; Luna, V. 2011. Chapter 7. Basic and Technological Aspects of Phytohormone production by Microorganisms: Azospirrillum sp. as a Model of Plant Growth Promoting Rhizobacteria. En: Maheshwari, D (ed). Bacteria in Agrobiology: Plant Nutrient Management. 141-182. [ Links ]
6. Cassán, F.; Vanderleyden, J.; Spaepen, S. 2014. Physiological and agronomical aspects of phytohormone production by model plant-growth-promoting rhizobacteria (PGPR) belonging to the genus Azospirillum. Journal of Plant Growth Regulation. 33(2): 440-459. [ Links ]
7. Diyansah, B.; Aini, L; Hadiastono, T. 2014. The effect of PGPR (Plant Growth Promoting Rhizobacteria) Pseudomonas fluorescens and Bacillus subtilis On Leaf Mustard Plant (Brassica juncea L.) Infected by TuMV (Turnip Mosaic Virus). Journal of Tropical Plant Protection. 1(1): 30-38. [ Links ]
8. Egamberdiyeva, D. 2007. The effect of plant growth promoting bacteria on growth and nutrient uptake of maize in two different soils. Applied Soil Ecology. 36(2): 184-189. [ Links ]
9. Elkoca, E.; Turan, M; Donmez, M. 2010. Effects of single, dual and triple inoculations with Bacillus subtilis, Bacillus megaterium and Rhizobiumleguminosa rumbv. phaseoli on nodulation, nutrient uptake, yield andyield parameters of common bean (Phaseolus vulgaris L. cv. 'Elkoca-05'). Journal of Plant Nutrition. 33 (14) : 2104-2119. [ Links ]
10. Farías, R.; Soriano, E; Cervantes, C. 1990. Los sideróforos microbianos y su influencia en el desarrollo vegetal. Revista Latinoamericana de Microbiología. 56: 662-676. [ Links ]
11. Fiske, C; Subbarow, Y. 1925. The colorimetric determination of phosphorus. Journal of Biological Chemistry. 66:375-400. [ Links ]
12. Flores-Félix, J.; Menéndez, E.; Rivera, L.; Marcos-García, M.; Martínez Hidalgo, P.; Mateos, P.; Martínez-Molina, E.; Velázquez, M.; García- Fraile, P; Rivas, R. 2013. Use of Rhizobium leguminosarum as a potential biofertilizer for Lactuca sativa and Daucuscarota crops. Journal of Plant Nutrition and Soil Science. 176(6): 876-882. [ Links ]
13. Glick, B.; Changping, L; Sibdas, G. 1997. Dumbroff, E. Early development of canola seedlings in the presence of the plant growth promoting rhizobacteria Pseudomonas putida GR12-2. Soil Biology and Biochemistry. 29:1233-1239. [ Links ]
14. Glickman, E; Dessaux, Y. 1995. A Critical examination of the specificity of the salkowsky reagent for indolic compounds produced by phytopathogenic bacteria. Applied and Environmental Microbiology. 61(2): 793-796. [ Links ]
15. González-Mendoza, V.; Zurita-Silva, A.; Sánchez-Calderón, L.; Sánchez- Sandoval, M. E.; Oropeza-Aburto, A.; Gutiérrez-Alanís, D; Herrera-Estrella, L. 2013. APSR1 a novel gene required for meristem maintenance, is negatively regulated by low phosphate availability. Plant Science. 205: 2-12. [ Links ]
16. Hayat, R.; Ali, S.; Amara, U.; Khalid, R.; Ahmed, I. 2010. Soil beneficial bacteria and their role in plant growth promotion: a review. Annals of Microbiology. 60(4):579-598. [ Links ]
17. Jones, J; Wolf, B; Mills, H. 1991. Plant Analysis Handbook: a practical sampling, preparation, analysis, and interpretation guide. Georgia: Micro-Macro Publishing, p. 213. [ Links ]
18. Khalid, A.; Arshad, M.; Shaharoona, B.; Mahmoood, T. 2009. Plant Growth Promoting Rhizobacteria and Sustainable Agriculture En: Khan, M; Zaidi, A; Musarrat, J. Microbial Strategies for Crop Improvement. E-book: Springer Berlin Heidelberg. p. 371. [ Links ]
19. Khan, A.L.; Hamayun, M.; Khan, S.A.; Shinwari, Z.K.; Kamaran, M.; Kang, S.M.; Kim, J.G.; Lee, I.J. 2011. Pure culture of Metarhizium anisopliae LHL07 reporgrams soybean to higher growth and mitigates salt stress. World J. Microb. Biotech. 28(4): 1483-94. [ Links ]
20. Khan, M; Zaidi, A; Wani, P; Ahemad, M; Oves, M. 2009. Functional diversity among plant growth-promoting rhizobacteria: Current Status. En: Khan, M; Zaidi, A; Musarrat, J. Microbial Strategies for Crop Improvement. E-book: Springer Berlin Heidelberg. pp.105-132. [ Links ]
21. King, E.; Ward, M; Raney, D. 1954.Two simple media for the demonstration of pyocyanin and fluoresce J. Lab. Clin. Med. 44: 301. [ Links ]
22. Kloepper, J.; Leong, J.;Teintze, M; Schroth, M. 1980. Enhanced plant growth by siderophores produced by plant growth-promoting rhizobacteria. Nature. 286: 885-886. [ Links ]
23. Kohler, J.; Caravaca, F.; Carrasco, L; Roldán, A. 2006. Contribution of Pseudomonas mendocina and Glomusintraradices to aggregate stabilization and promotion of biological fertility in rhizosphere soil of lettuce plants under field conditions. Soil Use and Management. 22: 298-304. [ Links ]
24. Makoi, J. H.; Chimphango, S. B; Dakora, F. D. 2010. Elevated levels of acid and alkaline phosphatase activity in roots and rhizosphere of cowpea (Vigna unguiculata L. Walp.) genotypes grown in mixed culture and at different densities with sorghum (Sorghum bicolor L.). Crop and Pasture Science. 61(4): 279-286. [ Links ]
25. Maseko, S. T; Dakora, F. 2013. Plant Enzymes, root exudates, cluster roots and mycorrhizal symbiosis are the driver of P nutrition in native legumes growing in P deficient soil of the Cape Fynbos in South Africa. Journal of Agricultural Science and Technology. (3):331-340. [ Links ]
26. Merzaeva, O; Shirokikn, I. 2010. The production of auxins bytheendophytic Bacteria of winterrye. Applied Biochemistry and Microbiology. 46:44-40. [ Links ]
27. Omar, S.A. 1997. The role of rock-phosphate-solubilizing fungi and vesicular–arbusular-mycorrhiza (VAM) in growth of wheat plants fertilized with rock phosphate. World Journal of Microbiology and Biotechnology.14 (2): 211-218. [ Links ]
28. Parani, K.; Saha, B. 2012. Prospects of Using Phosphate Solubilizing Pseudomonas as Bio Fertilizer. European Journal of Biological Sciences. 4(2): 40-44. [ Links ]
29. Pinzon, H.; Laverde, H; Clavijo, J. 1993. Producción de semilla de Lechuga en Colombia. Agronomía Colombiana. 2: 105-113. [ Links ]
30. Piromyou, P.; Buranabanyat, B.; Tantasawat, P.; Tittabutr, P.; Boonkerd, N.; Teaumroong, N. 2011. Effect of plant growth promoting rhizobacteria (PGPR) inoculation on microbial community structure in rhizosphere of forage corn cultivated in Thailand. European Journal of Soil Biology. 47: 44-54. [ Links ]
31. Porcel, R.; Zamarreño, Á.; García-Mina, J; Aroca, R. 2014. Involvement of plant endogenous ABA in Bacillus megaterium PGPR activity in tomato plants. BMC plantbiology 14 (1): 36. [ Links ]
32. Rodríguez, H; Fraga, R.1999. Phosphate solubilizing bacteria and their role in plant growth promotion. Biotechnology advances. 17(4): 319-339. [ Links ]
33. Rosas, S.; Avanzini, G.; Carlier, E.; Pasluosta, C.; Pastor, N; Rovera, M. 2009. Root colonization and growth promotion of wheat and maize by Pseudomonas aurantiaca SR1. Soil Biology andBiochemistry. 41(9): 1802-1806. [ Links ]
34. Saharan, B; Nehra, V. 2011. Plant Growth Promoting Rhizobacteria: A critical Review. Life Sciences and Medicine Research. 2011:1-30. Disponible online: http://astonjournals.com/lsmr. [ Links ]
35. Sánchez, D.; Gómez, R.; Garrido, M; Bonilla, R. 2012. Inoculación con bacterias promotoras de crecimiento vegetal en tomate bajo condiciones de invernadero. Revista Mexicana de Cienciasgrícolas. 3 (7):1401-1415. [ Links ]
36. Sánchez, J; Valencia, H; Valero, N. 2005. Producción de ácido indola cético por microorganismos solubilizadores de fosfatos presentes en la rizósfera de Espeletia grandiflora y Calamagrostiseffusa del páramo El Granizo. En: Bonilla, M. Estrategias adaptativas de plantas del páramo y del bosque alto andino en la cordillera Oriental de Colombia. Unibiblos. 11: p.177-193. [ Links ]
37. Schwyn, B; Neilands, J. 1987. Universal chemicalassaysforthedetection and determination of siderophores. Analytical Biochemistry. 160:47-56. [ Links ]
38. Someya, N.; Tsuchiya, K.; Sugisawa, S.; Noguchi, M; Yoshida, T. 2008. Growth Promotion of Lettuce (Lactuca sativa L.) by a Rhizobacterium Pseudomonas fluorscens Strain LRB3W1 under Iron-Limiting Condition. Environmental Control in Biology. 46(2):139-146. [ Links ]
39. Taiz, L; Zeiger, E. Plant Physiology. 2010. Edition 5º. (USA): Sinauer Associates, Inc. Publishers. p. 782. [ Links ]
40. Toro, M.; Blones, J; Hernández Valencia, I. 2013. Dinámica del fósforo y actividad biológica en las micorrizósferas de dos ecosistemas adyacentes con vegetación y suelos contrastantes. ActaBiológica Venezuélica. 21(2): 21-28. [ Links ]
41. Vikram, A. 2007.Efficacy of phosphate solubilizing bacteria isolated from vertisols on growth and yield parameters of sorghum. Research Journal of Microbiology.2: 550-559. [ Links ]
42. Xiao, C.; Chi, R.; Pan, X.; Liu, F; He, J. 2012. Rock phosphate solubilization by four yeast strains. Annals of Microbiology. 63(1): 173-178. [ Links ]
43. Yadav, K; Dadarwal, K. 1997. Biotechnological approaches in soil microorganisms for sustainable crop production. India: Jodhpur. Scientific publishers. pp. 293-308. [ Links ]