Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.2 Bogotá jul./dez. 2014
https://doi.org/10.15446/rev.colomb.biote.v16n2.47240
http://dx.doi.org/10.15446/rev.colomb.biote.v16n2.47240
ARTÍCULO CORTO
Establecimiento in vitro de dos especies nativas de Costa Rica: Terminalia amazonia (Amarillón) y Vochysia allenii (Botarrama Blanco)
In vitro establishment of two species native to Costa Rica: Terminalia amazonia (Amarillón) and Vochysia allenii (Botarrama Blanco)
Hine Gómez, Ana1; Rojas Vargas, Alejandra2; Daquinta Gradaille, Marcos3
1 Master en Ciencias Agricolas y Recursos Naturales. Instituto de Investigacion y Servicios Forestales (INISEFOR), Universidad Nacional (UNA). CP 86-3000. Costa Rica. Tel.: 25624606, ana.hine.gomez@una.cr.
2 Master en Ciencias Agricolas y Recursos Naturales. Instituto de Investigacion y Servicios Forestales (INISEFOR), Universidad Nacional (UNA). CP 86-3000. Costa Rica. Tel.: 25624606, alejandra.rojas.vargas@una.cr.
3Doctor en Ciencias Agricolas. Centro de Bioplantas, Universidad de Ciego de Avila, Carretera a Moron km. 9. CP 69450. Cuba. Tel.: 2713313.
Recibido: febrero 18 de 2014 Aprobado: octubre 17 de 2014
Resumen
El objetivo de esta investigación fue lograr el establecimiento in vitro de la especie Terminalia amazonia y Vochysia allenii debido a la dificultad de propagarlas sexual y asexualmente con técnicas convencionales. Se logró establecer segmentos nodales de ambas especies en condiciones in vitro empleando el HgCl2 0,1 % con un tiempo de exposición de 5 minutos. El mejor medio de cultivo para nudos fue el WPM 100 % de sales para T.amazonia y para V. allenii fue el WPM 50 % de sales. Después de 28 días de cultivo se obtuvo un 42 % de nudos establecidos para T. amazonia y 10% para V. allenii. En ambas especies se evaluó el efecto sobre la brotación de cinco concentraciones de 6-bencilaminopurina (6-BAP) (0,0; 2.22, 4.44, 6.66, 8.88 μM L-1) y cinco de tidiazuron (TDZ) (0,0; 0.22, 0.45, 0.68, 0.90 μM L-1). Se obtuvó en promedio un brote por explante en los cinco tratamientos de BAP y TDZ utilizados.
Palabra clave: cultivo in vitro, nudos, 6-bencilaminopurina, tidiazuron.
Abstract
The objective of this research was to achieve the in vitro establishment of the species Terminalia amazonia and Vochysia allenii due to the difficulty propagate sexually and asexually with conventional techniques. It was possible to establish the nodal segments of both species in in vitro conditions using 0.1 % HgCl2 with an exposure time of 5 minutes. The best nodal culture medium was 100 % WPM salts in T. amazonia and V. allenii was WPM 50% salts. After 28 days of culture 42 % of nodal segments to T. amazonia and V. allenii 10% was obtained. In both species, the effect on sprouting of five concentrations of 6-benzylaminopurine (6-BAP) (0.0, 2.22, 4.44, 6.66, 8.88 μM L-1) and five thidiazuron (TDZ) (0.0, 0.22, 0.45, 0.68, 0.90 μM L-1) was evaluated. Outbreak was scored on average per explant in the five treatments of BAP and TDZ used.
Key word: in vitro culture, nodal segments, 6-benzylaminopurine, thidiazuron.
Introducción
El amarillón, Terminalia amazonia, es un árbol grande de 25 a 45 m de altura, ampliamente distribuido en el bosque lluvioso y altamente valorado por su madera de alta calidad, su crecimiento es moderado convirtiéndolo en candidato para plantar desde altitudes bajas hasta medianas. Su madera dura y durable, es cotizada en los mercados nacionales e internacionales. Por su alta fortaleza y acabado atractivo tiene diversos usos en construcción general (armadura de techos y pisos), mueblería y construcción externa, incluyendo en durmientes para ferrocarriles y puentes. Se recomienda para mangos de herramientas, encofrados, puentes, pilotes, tarimas, pisos industriales, chapa, parquet, barriles, puertas y tablilla (OFI y CATIE, 2003; Zamora et al., 2003).
Por otra parte, el árbol de botarrama blanco, Vochysia allenii, es un árbol de buen tamaño de 30 a 35 m de altura y 98-120 cm de DAP (diámetro a la altura de pecho). Su madera puede usarse en la construcción interna y carpintería general, postes de cercas, formaletas, molduras, cornisas y rodapié, cajas de diversos tamaños, fósforos, palillos y enchapes. Esta madera tiene características excelentes para la producción de pulpa para papel (Quesada et al., 1997; Flores y Obando, 2003).
Como respuesta a la dificultad de propagar sexual y asexualmente con técnicas convencionales el amarillón y la existencia de pocos individuos de botarrama, se plantea la propagación in vitro como una alternativa de multiplicación de estos materiales. En general, la técnica busca mejorar los sistemas de producción de las especies, producir material sano y seleccionado durante todo el año, útil para el establecimiento de plantaciones clonales de las especies seleccionadas; sin olvidar que se contribuye a la conservación genética de las mismas (Daquinta et al., 2000; Agramonte et al., 2001; Estopá, 2005).
Por otra parte, existen pocos trabajos de cultivo de tejidos en estas especies. Para el género Terminalia, Ramesh et al., (2005) lograron el establecimiento exitoso de segmentos nodales de Terminalia bellirica; Pandey et al., (2006) lograron el establecimiento de nudos de Terminalia arjuna y Méndez y Abdelnour (2014) lograron el establecimiento in vitro de segmentos nodales. Para botarrama blanco no existen trabajos de establecimiento in vitro de segmentos nodales. Por lo anterior, se realizó este trabajo con el objetivo de lograr el establecimiento in vitro de amarillón y botarrama blanco para generar otro método de propagación vegetativa.
Materiales y métodos
Establecimiento in vitro de nudos de T. amazonia y V. allenii provenientes de plantas cultivadas en condiciones de invernadero
La investigación se realizó en el Laboratorio de Cultivo de Tejidos Forestales del Instituto de Investigación y Servicios Forestales (INISEFOR) de la Universidad Nacional, (UNA), Costa Rica. El material experimental fue donado por la Fundación para el desarrollo de la Cordillera Volcánica Central (FUNDECOR). Una vez colectadas las plantas, se trasladaron a condiciones de invernadero (temperatura promedio 27 °C, humedad relativa 60 %) para ser decapitadas y podadas mensualmente, eliminándose la yema apical con el fin iniciar el rebrote de las yemas axilares (rejuvenecimiento). Finalmente, las plantas se trataron semanalmente con una mezcla de 2 g/l de Agimicina y 2 g/l Benlate y 50 mg l -1 de 6-bencilaminopurina (6-BAP) por un periodo de cuatro semanas (figura 1).
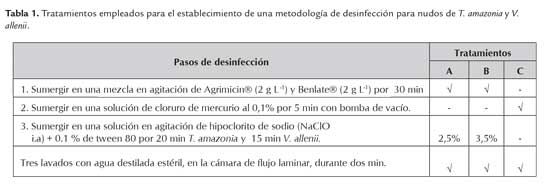
El material experimental de ambas especies a introducir en condiciones in vitro, consistió de nudos tomados de brotes axilares de plántulas mantenidas en condiciones de invernadero (figura 1). Para la desinfección del material, se colectaron los nudos en el invernadero y se trasladaron al laboratorio en una solución de 0,5 g/l de cisteína. Posteriormente, se mantuvieron durante 1 h bajo el flujo de agua constante, seguido se sumergieron en una solución de agua y jabón líquido Antibacterial Bactex (Punto Rojo S.A) al 1 % por 10 min en agitación y se lavaron con ayuda de un cepillo suave para eliminar los contaminantes adheridos superficialmente, luego se enjuagaron con abundante agua. Posteriormente, se evaluaron tres metodologías de desinfección para la introducción in vitro de nudos de ambas especies tabla 1. Los explantes de T. amazonia se cultivaron en el medio de cultivo Murashige y Skoog (MS) (1962) y el Lloyd y McCown, (WPM) (1980). Para el caso de V. allenii se cultivaron los explantes en WPM 100 % y 50 % de fuerza iónica y el MS 50 % de fuerza iónica. Todos los medios de cultivo se complementaron con 3 % de sacarosa, y se solidificaron con 2,7 g L-1 de PhytagelTM (Sigma, St. Louis, MO, USA); el pH del medio se ajustó a 5,7 antes de la esterilización en autoclave (21 °C, 15 lb. presión, 25 min).
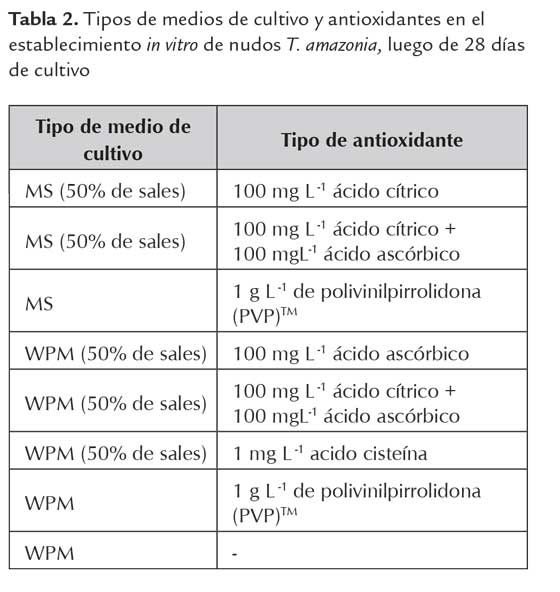
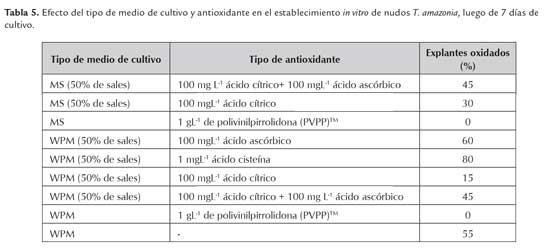
Debido a la oxidación del medio de cultivo que presentaron los nudos de T. amazonia al ser desinfectados e introducidos en condiciones in vitro, se realizó una prueba con diferentes medios de cultivo y antioxidantes con el fin de eliminar la necrosis de los explantes. Los tratamientos empleados se detallan en el tabla 2. Para este ensayo los explantes fueron desinfectados empleando la metodología C (tabla 1).
Inducción de brotes en segmentos nodales de T. amazonia y Vochysia allenii
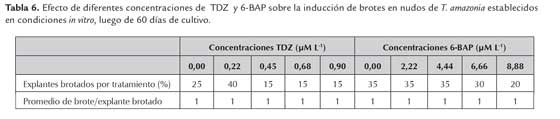
Para los ensayos de multiplicación in vitro, se emplearon nudos de T. amazonia, inmaduros y etiolados durante 30 días en condiciones de invernadero y nudos de V. allenii, inmaduros sin etiolar. Los nudos de ambas especies fueron desinfectados empleando la metodología C, que incluía el uso de 0,1 % de HgCl2. Como unidad experimental se consideró un nudo de 2 cm de longitud cultivado en un tubo de ensayo (150 mm x 25 mm) con 10 ml de medio de cultivo WPM 100 % de fuerza iónica para el caso de T. amazonia y 50 % de fuerza iónica para V. allenii, complementados con 3 % de sacarosa, 1 ml L-1 de Plant Preservative Mixture (PPM)TM (Plant Cell Technology, Washington DC, USA), 1 g L-1 de PVPPTM (Sigma, St. Louis, MO, USA), 0,5 g L-1 de caseína hidrolizada y solidificados con 2,7 g L-1 de PhytagelTM). El pH de los medios se ajustó a 5,7 antes de la esterilización en autoclave (21 °C, 15 lb. presión, durante 25 min). Se estudiaron cinco concentraciones de 6-bencilaminopurina (6-BAP) (Sigma, St. Louis, MO, USA): (0,00; 2.22; 4.44; 6.66; 8.88 μM L-1) y cinco de tidiazuron (TDZ) (Sigma, St. Louis, MO, USA): (0.00; 0.22; 0.45; 0.68; 0.90 μM L-1).
Procesamiento estadístico de los datos
Cada tratamiento consistió de 20 nudos introducidos en condiciones in vitro; como unidad experimental se consideró un nudo de 2 cm de longitud cultivado en un tubo de ensayo (150 mm x 25 mm) con 10 ml de medio de cultivo. Las variables evaluadas fueron las siguientes: porcentaje de nudos contaminados, porcentaje de explantes necrosados y número promedio de brotes por explante desinfectado. El ensayo se evaluó semanalmente durante un mes. En cada uno de los ensayos se utilizó un diseño completamente al azar con 20 nudos por tratamiento. El procesamiento de la información se realizó empleando el programa estadístico Infostat (Di Rienzo et al., 2009).
Resultados y discusión
Establecimiento in vitro de nudos de T. amazonia y V. allenii
En Terminalia amazonia para la variable explantes libres de contaminación no se logró determinar diferencia entre los tratamientos de desinfección aplicados. El tratamiento con HgCl2 0,1 % con un tiempo de exposición de 5 min resultó ser el mejor, debido a que no se presentaron explantes necrosados (0 %) y el porcentaje de explantes sobrevivientes fue alto (76 %). Por su parte, los tratamientos A y B presentaron 100 % de explantes necrosados y no sobrevivió ningún explante. Sin embargo, el material no presentó valores de contaminación importantes, en el tratamiento A se presentó un 73 % de explantes libres de contaminación y en el tratamiento B un 79 %. Además, se debe mencionar que se observó oxidación de los medios de cultivo en todos los explantes desinfectados tanto con NaClO como con HgCl2. Por este motivo, se necrosó gran parte del material introducido. Se definió el trata Por otro lado, en el caso de V. allenii solo se observó explantes limpios en la desinfección con HgCl2; (47,5 %), de los cuales solo el 10 % sobrevivieron y no se observó oxidación del medio de cultivo. Sin embargo, en esta especie se observó gran pérdida de material por necrosis de los explantes en todos los tratamientos de desinfección y por la presencia de una bacteria persistente. De acuerdo con Smith (2000) y Alvarado (1998), es frecuente que el material vegetal tenga microorganismos endógenos. En algunos casos estos microorganismos se pueden expresar porque la desinfección es un estrés para el vegetal o quedaron latentes y almacenados en el interior de las células, espacios intercelulares o haces conductores.
Por otra parte, el cloruro de mercurio aunque ha tenido sus detractores, es un desinfestante muy empleado en especies donde los hipocloritos no han tenido éxito. Por ejemplo, Daquinta et al., (2007) lograron el establecimiento de Bambú con HgCl2 0,2 % con un tiempo de exposición de 10 min. Además, Abdelnour y Muñoz (2005), obtuvieron un 40 % de yemas limpias al desinfectar con HgCl2 0,5 % durante 10 min, yemas de estacas de (Tectona grandis) provenientes de plantas de campo.
Pandey et al., (2006) lograron el establecimiento de nudos de Terminalia arjuna provenientes de brotes juveniles de árboles de 35 años de edad, aplicando durante 3 min una solución de 0,05 % de HgCl2. Además, Ramesh et al., (2005) lograron el establecimiento exitoso de segmentos nodales de plántulas de 3 meses de edad de Terminalia bellirica, provenientes de semillas germinadas en condiciones de invernadero empleando 0,1 % de HgCl2 por 5 min. Lo que demuestra que el HgCl2 es utilizado exitosamente como desinfectante para el establecimiento de explantes de diferentes especies del género Terminalia. Sin embargo, Abdelnour y Muñoz (2005), observaron que en yemas de Tectona grandis provenientes de estacas de campo, desinfectadas con cloruro de mercurio en concentraciones de 1,5 % y 1,0 % se obtienen porcentajes de contaminación del 3 % y 5 % respectivamente, pero estas son incapaces de brotar. Cuando se utilizó este desinfectante en concentraciones de 0,5 % durante 10 min, se observó un mayor porcentaje de explantes contaminados (58 %), pero el 40 % del total de material sometido a desinfección logró el establecimiento aséptico y la brotación de las yemas. Lo anterior, evidencia que aún cuando en muchas especies el HgCl2 sea el único agente desinfectante que permita la desinfección de los explantes, el tejido vegetal puede dañarse a su exposición, afectando significativamente los porcentajes de sobrevivencia.
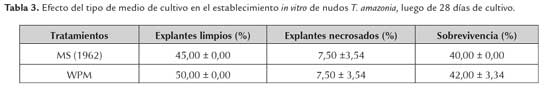
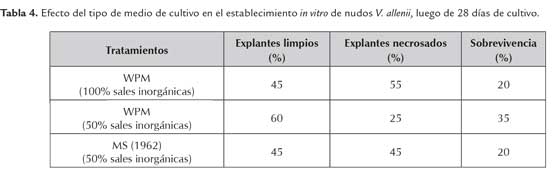
Con respecto al comportamiento de los nudos de ambas especies, establecidos en los medios de cultivo MS y WPM 100 % y 50 % de sales, en el caso de T. amazonia, se obtuvo entre el 40 – 42 % de explantes vivos (tabla 3) en ambos medios de cultivo. Sin embargo, los mayores valores se obtienen en el medio de cultivo WPM, siendo el mejor para continuar con la investigación. Al analizar los datos de V. allenii se observó mayor porcentaje de sobrevivencia (35 %) en el medio WPM al 50 % de sales inorgánicas (tabla 4). Ambos medios de cultivo se han empleado indistintamente para el establecimiento de diversas especies leñosas, de acuerdo a sus exigencias nutricionales (George et al., 2008).
Los resultados presentados en la tabla 5, muestran que el PVPP fue el antioxidante con mejor efecto contra la oxidación del medio de cultivo y la necrosis de los nudos de T. amazonia; resultado que coincide con el de Méndez y Abdelnour (2014) en T. amazonia (figura 2). Además, George et al., (2008) mencionan que el PVPP es una poliamida que absorbe los fenoles a través de uniones hidrógeno, previniendo su oxidación y polimerización. No se observó oxidación de los explantes durante los primeros 7 días de cultivo tanto en el medio MS (1962) como en el WPM. Por lo que se incluye dentro de los compuestos complementarios del WPM a emplear en la etapa de multiplicación. Azofeifa (2009), define la oxidación u oscurecimiento del tejido in vitro como la oxidación de radicales libres de diferentes compuestos celulares, así, como la oxidación de los compuestos fenólicos catalizados por la enzima polifenol oxidasa (PPO), para producir quinonas, las cuales son muy reactivas, generando daño e incluso la muerte celular.
Inducción de brotes en segmentos nodales de T. amazonia y V. allenii
Comportamiento similar en cuanto al número promedio de brotes por explantes, se obsevó al emplear 6-BAP y TDZ en T. amazonia (tabla 6). Obteniéndose un brote por explante en todas las concentraciones evaluadas (figura 3A). Según George et al., (2008), ambas citocininas se han empleado en el establecimiento de diferentes especies leñosas, siendo su respuesta similar a la obtenida en el presente trabajo en T. amazonia. En la figura 3B, se presenta la respuesta de un nudo de T. amazonia, en presencia de 4,44 μM L-1 de 6-BAP, como se puede notar se alcanza un buen desarrollo tanto del brote como de las hojas en el medio de cultivo WPM. Este resultado concuerda con lo mencionado por Méndez y Abdelnour (2014), donde el 6-BAP actúa como una citocinina que promueve la proliferación de brotes por explante en concentraciones relativamente bajas. Pandey et al., (2006) y Pijut et al., (2012), lograron propagar Terminalia arjuna a partir de segmentos nodales de un árbol maduro. Para lo cual emplearon en medio de cultivo MS a la mitad de sus sales orgánicas y complementado con BAP 4,44 μM y 0.53 μM de ácido naftalenacético (ANA). Por otra parte Ramesh et al. (2005) y Pijut et al., (2012), lograron inducir la brotación de Terminalia bellirica a partir de explantes nodales cultivados en medio de cultivo MS complementado con 13,3 μM 6-BAP, seguido de subcultivo en un medio que contenía 4,4 de μM 6-BAP. Por su parte, Méndez y Abdelnour (2014) lograron en T. amazonia generar brotes con una concentración alta de 6-BAP (30 mg/l) y Ravi et al., (2014) también lograron inducir brotación de yemas con 1,5 mg/l de 6-BAP.
Por su parte, al utilizar el TDZ en T. amazonia se presentó un resultado similar al estudiado por Pandey et al., (2006), los cuales determinaron que el TDZ en algunas especies forestales puede presentar niveles bajos de inducción de yemas.
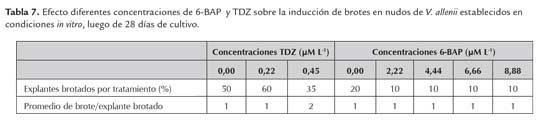
En la tabla 7 se presenta el efecto de 6-BAP y TDZ sobre la brotación de nudos de V. allenii. Se obtuvo en promedio de 1 a 2 brotes por explante, resultado muy similar al presentado en T. amazonia. De acuerdo con la (figura 4 A) las yemas nuevas presentaron un mejor desarrollo en el medio de cultivo complementado con 6-BAP. Este resultado pudo deberse según George (2008), a que el TDZ es un regulador del crecimiento que induce una brotación múltiple y en consecuente los brotes adventicios no pueden elongarse lo suficiente. Por su parte, el 6-BAP sí induce la elongación y desarrollo del brote que prolifera. Como ya se mencionó, la inducción de yemas presentó un resultado muy similar en ambas especies y evidencia lo mencionado por George et al. (2008), en cuanto a que la respuesta de estos reguladores de crecimiento es similar al inducir brotes en especies leñosas. Finalmente, no se reportan trabajos anteriores de micropropagación en V. allenii, pero queda claro con este ensayo que la especie responde a los reguladores de crecimiento. Lo anterior, indica que su multiplicación podría darse empleando el cultivo de tejidos como una herramienta para tal fin, pero se debe trabajar otras técnicas hasta obtener un protocolo de multiplicación in vitro de la especie.
Conclusiones
En ambas especies se logró el establecimiento in vitro utilizando el HgCl2 como agente desinfectante. Se concluye que el WPM 100 % de fuerza iónica es el mejor medio de cultivo para el desarrollo de T. amazonia; mientras que para V. allenii el mejor medio de cultivo es WPM 50 % de fuerza iónica. Además, se logró la inducción de brotes a partir de segmentos nodales. Sin embargo, los datos obtenidos en ambas especies sugieren que la multiplicación partir de segmentos nodales resulta en baja frecuencia de brotación de los nudos. Lo anterior, las clasifica como especies altamente recalcitrantes o difíciles de establecer en condiciones in vitro. Es importante destacar que sí es posible su establecimiento en condiciones in vitro y que se deben estudiar otras metodologías de multiplicación que permitan la propagación del material ya establecido.
Referencias bibliográficas
1. Abdelnour, A.; Muñoz, A. 2005. Micropropagación de teca (Tectona grandis L.f). Kurú: Revista Forestal (Costa Rica). 2(5): 1- 11. [ Links ]
2. Agramonte, D.; Delgado, L.; Trocones, A.; Pérez, M.; Ramírez, D.; Gutiérrez, O. 2001. Micropropagación del Eucalyptus grandis (Hill ex Maiden) a partir de segmentos nodales. Biotecnologíavegetal. 1(2): 109-114. [ Links ]
3. Alvarado, Y. 1998. Contaminación microbiana en el cultivo in vitro de plantas. Propagación y mejora genética de plantas por biotecnología. Santa Clara: Instituto de Biotecnología de Plantas, Cuba. p 81-104. [ Links ]
4. Azofeifa, A. 2009. Problemas de oxidación en explantes cultivados in vitro. Agronomía mesoamericana. 20(1): 153-175. [ Links ]
5. Daquinta, M.; Gregori, A.; Cid, M.; Lezcano, L.; Sagarra F. 2007. Formación de callos e inducción de brotes a partir de tejido intercalar de ramas de plantas adultas de Guadua angustifolia Kunth. Biotecnología Vegetal. 7(2): 119–122. [ Links ]
6. Daquinta, M.; Ramos, L.; Lezcano, L.; Rodríguez, R.; Escalona, M. 2000. Algunos elementos en la propagación de la teca. Biotecnología vegetal. 1: 39-44. [ Links ]
7. Di Rienzo, JA; Casanoves, F; Balzarini, MG; González, L; Tablada, M; Robledo, C. 2009. Infostat versión 2009. Grupo Infostat. FCA, Universidad Nacional de Córdoba. Argentina. [ Links ]
8. Estopá, BM. 2005. El cultivo in vitro en la reproducción vegetativa de plantas de vivero. Viveros Revista Extra. Pp. 50-56. [ Links ]
9. Flores, E.; Obando, G. 2003. Árboles del trópico húmedo: importancia socioeconómica. Editorial Tecnológica de Costa Rica. Cartago. 920 p. [ Links ]
10. George EF.; Hall MA.; De Klerk, G. 2008. Plant Propagation by Tissue Culture. 3ra Ed. Springer, The Netherlands. 501 p. [ Links ]
11. Lloyd, G; McCown, B. 1980. Commercially-feasible micropropagation of mountain laurel, Kalmia latifolia, by use of shoot-tip culture. Int Plant Prop Soc. Proc. 30: 421- 427. [ Links ]
12. Méndez, D.; Abdelnour, A. 2014. Establecimiento in vitro de Terminalia amazonia (Gmel.) Excell. Revista Forestal Mesoamericana Kurú (Costa Rica). 11(27): 7-21. [ Links ]
13. Murashige, T. and Skoog, F .1962. A revised medium for rapid growth and bioessays with tobacco tissue culture. Physiologia Plantarum. 15: 473-497. [ Links ]
14. OFI (Oxford Forestry Institute) y CATIE (Centro Agronómico Tropical de Investigación y Enseñanza). 2003. Árboles de Centroamérica: un manual para extensionistas.UK. 1 disco compacto. 1079p. [ Links ]
15. Pandey, S.; Singh, M.; Jaiswal, U.; Jaiswal, V. 2006. Shoot initiation and multiplication from a mature tree of Terminalia arjuna roxb. In Vitro Cell. Dev. Biol. Plant. 42: 389–393. [ Links ]
16. Pijut, PM.; Beasley, RR.; Lawson, SS.; Palla, KJ.; Stevens, ME.; Wang, Y. 2012. In vitro propagation of tropical hardwood tree species -A Review (2001-2011). Propagation of Ornamental Plants. 12(1): 25-51 [ Links ]
17. Quesada, F.; Jiménez, Q.; Zamora, N.A.; Aguilar, R.; González, J. 1997. Árboles de la Península de Osa. Heredia, CR, INBio. [ Links ]
18. Ramesh, M.; Pavan, U.; Venugopal, K.; Sadanandam, A. 2005. Micropropagation of Terminalia bellirica Roxb. A sericulture and medicinal. In Vitro Cell Dev Biol Plant. 41: 320–323. [ Links ]
19. Ravi, M.; Ramanjaneyulu, P; Rao, A. 2014. Micropropagation of Terminalia arjuna Roxb. from nursery plant material. International Journal of Emerging Trends in Science and Technology. 01(07): 997–1004. [ Links ]
20. Smith, R. 2000. Plant Tissue Culture. Techniques and Experiments. 2 da Edición. San Diego, USA. Academic Press. p 231. [ Links ]
21. Zamora, N.; Jiménez, Q.; Poveda, l.; Aragón, C. Árboles de Costa Rica. Heredia, INBIO, Costa Rica. 2003. [ Links ]